>У позвоночных положение непарных органов асиметрично относительно лево-правостронней ( left-right (LR)) оси тела. Каждая структура располагается неслучайно по отношению к средней линии и ее положение обозначается как situs solitus,например, у человека положение сердца, желудка и селезенки сдивнуто влево . Аберантное развитие LR оси может приводить к рандомизации положения отдельных органов ( randomization of individual organ position (situs ambiguus)) или к зеркальному обратному положению всех латерализованных структур (situs inversus). Ранее был картирован локус для situs abnormalities у человека , HTX1, в Xq26.2 путем анализа сцепленя в одной семье (LR1) и путем определения делеций у неродственных мужчин с situs ambiguus (Family LR2).Из этой области клонирован ZIC3, ген, кодирующий предполагаемый фактор транскрипции с цинковыми пальчиками. Идентифицированы 1 мутация сдвига рамки считывания, 2 missense и 2 nonsense мутации. в семейных и спорадических случаях situs ambiguus. Аллель со сдвигом рамки считывания ассоциирован также с situs inversus у некоторых гетерозиготных женщин . Это указывает на то, что ZIC3 функционирует на ранних стадиях формирования LR-оси Gebbia et al 1997). Рандомизация направления образования сердечной петли отмечается и у мутантных мышей no turning (nt)
Ген мыши nodal и его гомолог у кур и Xenopus является одним из первых асимметрично экспрессирующихся вдоль лево-правосторонней оси до формирования асимметрии органов. Нарушения паттерна экспрессии мышиного nodal and куринного гомолога cNR 1 связаны с дефектами развития лево-правосторонней асимметрии и образования сердечной петли.
У эмбрионов мыши асимметричная левосторонняя экспрессия nodal обнаруживается в левой латеральной мезодерме на ранней сомитной стадии, предшествующей образованию сердечной петли. Нарушение паттерна экспрессии nodal обнаружено у мышей с мутациями, нарушающими cardiac situs. Так, мыши, гомозиготные по inv имеют аномальный паттерн nodal, от правостороннего ассоциирующего с situs inversus (Lowe et al 1996; Collignon et al 1996) до рострального укорочения ( rostral truncation) ассоциирующего со случайным или ambiguous cardiac looping ( Collignon et al 1996) . Мыши, гомозиготные по iv мутации имеют случайную лево-правостороннюю ориентацию и изменчивый паттерн экспрессии nodal (Lowe et al 1996).Нормальный паттерн экспрессии Xenopus гомолога nodal Xnr 1 сходен с таковым у эмбрионов кур и мышей, с асмметричной экспрессией в левой латеральной мезодерме во время стадии хвостовой почки.
Показано, что нормальный паттерн экспрессии Xnr 1 у Xenopus варьирует и что его экспрессия нарушается воздействиями, которые нарушают право-левостороннее развитие . Показатель аномальной экспрессии Xnr 1 коррелирует с долей cardiac reversal.Более того структуры дорсальной средней линии, включая хорду, и/или гипохорд и нейральную донную пластинку, регулируют Xnr 1 до спецификации лево-правосторонней ориентации сердца путем репрессии экспрессии Xnr 1 в правой латеральной пластинке мезодермы во время закрытия нервной трубки (Lohr et al., 1997). Экстирпация клеток дорсальной средней линии на стадии 15 нарушает экспрессию Xnr 1 .Xnr 1 при этом экспрессируется эктопически в правой латеральной пластине мезодермы , так что экспрессия Xnr 1 становится билатеральной . Только экстирпация на ст 15 вызывает билатаральную экспрессию и рандомизированную кардиальную асимметрию. Следовательно, негативные регуляторные сигналы воспринимаются Xnr 1 правой, но не левой латеральной пластинкой мезодермы . Эмбриологические и генетические экспреименты на Xenopus и zebrafish указывают на то, что клетки дорсальной средней линии необходимы для нормальной лево-правосторонней ориентации сердца ( Danos and Yost 1996 ). Клетки средней линии регулируют как асимметричную экспрессию Xnr 1 так и ориентацию сердца между стадиями 15 и 20. Латеральная мезодерма располагается между дорсальной и вентральной средней линией и может использоваться intermediary для проведения сигналов между клетками противоположных сторон эмбриона. Предполагается, что сигналы идут от средней линии через соматические ткани к латеральным пластинкам, специфицируя экспрессию Xnr 1. Специфицированная ассимметрия Xnr 1 может затем передавать прямо или косвенно сигнал примордию сердца для спецификации лево-правосторонней его ориентации.
Ген Shh обнаруживает асимметричную левостороннюю экспрессию и может затрагивать situs эмбрионального поворота и кишки, в дополнение к сердцу. Аномальная двусторонняя экспрессия Shh не приводит к левостороннему изомерзму (с двух сторон симметричный эмбрион, имеющий две левых стороны) ни к фенотипу полного situs inversus . Аномальная экспрессия Shh на правой стороне узелка ведет к двусторонней экспрессии гена nodal и дает heterotaxia-подобное состояние, где различные аспекты laterality определены независимо. Положение сердца изменеяется при эктопической экспрессии Shh и активина. Однако, наиболее нижестоящий ген, идентифицированный в L\R пути, nodal, был функционально не связан с laterality сердца . Эктопическая (правосторонняя) экспрессия nodal способна затронуть положение сердце , это подтверждается тем, что randomization сердца laterality, наблюдаемая при Shh и activin эктопической экспрессии, была результатом изменений в экспресии nodal, и что nodal, вероятно, регулирует положение сердце эндогенно. Первым определяющим асимметричным сигналом в лево-правстороннем пути формирования паттерна является Shh, который у эмбрионов кур первоначально экспрессируется по всему узелку Гензена, но становится ограниченным левой стороной на стадии 4 (+). Очевидно, что ограничение Shh expression может быть результатом репрессии вышестоящим activin-подобным фактором, потому что эктопический activin белок способен подавлять экспрессию Shh на левой стороне узла, также как и стимулировать ectopic expression обычно правостороннего маркера, активинового рецептора cAct-RIIa. Член этого семейства, Activin betaB, действительно экспрессируется асимметрично, только на правой> стороне узла Гензена, в соответствующее время для этого, чтобы быть эндогенным асимметричным активиновым сигналом. Применение follistatin-нагруженных бусинок устраняет ассиметрию в экспрессии Shh, что согласуется с подавлением экспрессии эндогенного члена activin-BMP суперсемейства. Итак, Activin betaB функционирует в эмбрионе цыпленка, чтобы обеспечить Shh асимметрию ( Levin et al., 1997 ). Влияние гена активна подтверждается также асимметричной экспрессией рецептора активина cAct-RIIA у эмбрионов кур и характерными нарушениями у нулевых мутантов мыши по рецептору активина IIB(Act-RIIB).Итак, асимметричная экспрессия активина справа от узла обусловливает репрессию справа Shh, в результате чего его экспрессия ограничивается левой стороной(стадия 4 у эмбрионов кур). В это же время происходит услиение экспрессии слева от полоски непосредственно за узлом гена HNF3β (транскрипционного фактора,родственного гену forkhead дрозофилы).Роль его неясна, предполагается, что он участвует в поддержании экспресии Shh слева от узла.
В сердце эмбрионов с отсутствием гомеобоксного гена Nkx2-5, которое не формирует петлю сердечной трубки,левосторонняя экспрессия гена eHand устраняется. Однако экспрессия не меняется в сердце Sc1-/- ,где форомирование петли слабое из-з гематопоэтической недостаточности и было правосторонним в сердце inv/inv эмбрионов с situs inversus. По-видимому, экспресия еHand усиливается в производных пула для левой половины сердца как один из ответов на индуктивный сигнал от L/R аксиальной системы, и что eHand контролирует внутренне присущий морфогенетический путь ,существенный для образования петли. Одни из аспектов ответа на L/R информацию находится под Nkx2-5 homeobox контролем ( Biben C, Harvey 1997 ).
Имеются также данные, указывающие на то, что лево-правостронняя асимметрия контролируется также с помощью пути передачи сигналов Wnt (Xwnt-8, beta-catenin, or Siamois )у эмбрионов ксенопус ( Nascone et al., 1997 ) и белков внеклеточного матрикса.
Молекула, названная флектином flectin (flectere, in L., to bend or to loop), обнаруживает билатерально асимметричную локализацию в ранней сердце-формирующей мезодерме и продолжает экспрессироваться асимметрично четко организованным способом в кардиальном геле во время образования петли сердечной трубкой. Это большая молекуля внеклеточного матрикса идентифицирована с использованием моноклональных антител F-22 . Флектин обнаруживает определенный протстранственно-временной паттерн экспрессии внеклеточного матрикса во время развития сердца птиц. Асимметричная экспрессия флектина обнаруживается на стадии 7+/8- (примерно 24 ч развития около стадии 3-х сомитов). Она преимущественно экспрессируется в левой прекардиальной мезодерме. Между стадиями 12 и 14 флектин продолжает экспрессироваться асимметрично в миокарде и локализуется на высоком уровне на базальной стороне миокарда и в кардиальном геле, распространяясь до поверхности эндокардиальных клеток. В той же самой плоскости петлеобразующей части сердца она дифференциально организована в кардиальном геле на конвексной ( convex)стороне и на наружной области петли . Редуцированная экспрессия видима спереди и сзади вдоль сердечной трубки . Инициальная асимметрия сохраняется во всем тубулярном сердце. На стадии 22 (Embryonic Day 3.5), интенсивность иммунолокализации флектина существенно снижается с Л-П асимметрией менее выраженной или отсутсвущей . Флексин экспрессируется снова на 10 день в сердце эмборионов. Экспрессия флексина модулируется ретиноидами. У витамин-А- дефицитных эмбрионов перепела экспрессия флексина в сердце снижена и дизорганизована , как и другие компоненты ВКМ, представляющие кардиальный гель ( Tsuda et al., 1996 ).
Так, показано, что левое и правое прекардиальные поля отличаются по своей чувствительности к ретиноевой кислоте. Воздействие ретиноевой кислоты на правое прекардиальное поле во время гаструляции рандомизирует процесс формирования сердечной петли, воздействие на левое прекардиальное поле обусловливает situs inversus , но только при высоких концентрациях. Идентифицированы два белка внеклетчоного матрикса, сердце-специфический лектин-ассоциированный матричный белок-1 (hLAMP1) и сходный с фибриллином белок, распознаваемый с помощью антител JB3, которые распределяются асимметрично в прекардиальных полях на стадии головного отростка . У нормальных эмбрионов экспрессия JB3 усиливается в правом прекардиальном поле , а экспрессия hLAMP-1 в левом. Воздействие ретиноевой кислоты нарушает экспрессию этих белков по способу, согласующемуся с последующей латеральностью сердца : воздействие ретиноевой кислоты, которое рандомизирует направление сердечной петли ( equalized) или делает обратным лево/правостороннее распределние JB3 и hLAMP-1 до слияния сердечных трубок . Существование асимметрично экспрессирующихся белков ВКМ в прекардиальных областях указывает на то, что взаимодействия между кардиоцитами и их окружающей средой могут участовать в детерминации heart laterality determination и образовании петли сердца (looping) ( Smith et al., 1997 ) |
Дорсо-вентральная и передне-задняя оси, а следовательно, и билатеральная симметрия выявляются во время гаструляции. Морфологически обнаружимая асимметрия
обнаруживается в позднем эмбриогенезе после образования петли сердечной трубки и киши
[1] [2]. Образование кародиальной петли высоко
законсервировано у позвоночных [3]. Обнаружены асимметрично экспрессирующиеся
гены у эмбрионов кур [4],
более 30 мутантных генов, затрагивающих лево-правостороннее
развитие, открыто у позвоновных (reviewed in [5•]).Результаты пересадок ткани указывают
на то, что лево-правосторонняя ориентация
специфицируется задолго до образования
петель. Ключевые гены, которые функционируют позже, такие как pitx2 и cSNR1,являются транскрипционными факторами,
экспрессирующимися в left-right органных
клонах.
FGF—fibroblast growth factor;
ft— fused toes;
inv— inversion of embryonic turning;
iv— inversus viscerum;
LRC—left–right coordinator;
LRD—left–right dynein;
Shh—Sonic hedgehog;
TGF-β—transforming growth factor-β
литература
Danos MC, Yost HJ:
Linkage of cardiac left-right asymmetry and dorsal-anterior development in Xenopus.
Development
1995,
121:
1467–1474.
Yost HJ:
Vertebrate left-right development.
Cell
1995,
82:
689–692.
Burggren WW:
Cardiac design in lower vertebrates: what can phylogeny reveal about ontogeny?
Experientia
1988,
44:
919–930.
Levin M, Johnson RL, Stern CD, Kuehn M, Tabin C:
A molecular pathway determining left-right asymmetry in chick embryogenesis.
Cell
1995,
82:
803–814.
•
Ramsdell AF, Yost HJ:
Molecular mechanisms of vertebrate left-right development.
Trends Genet
1998,
14:
459–465.
Collignon J, Varlet I, Robertson EJ:
Relationship between asymmetric nodal expression and the direction of embryonic turning.
Nature
1996,
381:
155–158.
Lowe LA, Supp DM, Sampath K, Yokoyama T, Wright CVE, Potter SS, Overbeek P, Kuehn MR:
Conserved left-right asymmetry of nodal expression and alterations in murine situs inversus.
Nature
1996,
381:
158–161.
Lohr JL, Danos MC, Yost HJ:
Left-right asymmetry of a nodal-related gene is regulated by dorsoanterior midline structures during Xenopus development.
Development
1997,
124:
1465–1472.
•
Sampath K, Rubinstein AL, Cheng AM, Liang JO, Fekany K, Solnica-Krezel L, Korzh V, Halpern ME, Wright CV:
Induction of the zebrafish ventral brain and floorplate requires cyclops/nodal signalling.
Nature
1998,
395:
185–189.
•
Rebagliati MR, Toyama R, Fricke C, Haffter P, Dawid IB:
Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry.
Dev Biol
1998,
199:
261–272.
Heymer J, Kuehn M, Ruther U:
The expression pattern of nodal and lefty in the mouse mutant Ft suggests a function in the establishment of handedness.
Mech Dev
1997,
66:
5–11.
Melloy PG, Ewart JL, Cohen MF, Desmond ME, Kuehn MR, Lo CW:
No turning, a mouse mutation causing left-right and axial patterning defects.
Dev Biol
1998,
193:
77–89.
Supp DM, Witte DP, Potter SS, Brueckner M:
Mutation of an axonemal dynein affects left-right asymmetry in inversus viscerum mice.
Nature
1997,
389:
963–966.
•
Mochizuki T, Saijoh Y, Tsuchiya K, Shirayoshi Y, Takai S, Taya C, Yonekawa H, Yamada K, Nihei H, Nakatsuji N et al.:
Cloning of inv, a gene that controls left/right asymmetry and kidney development.
Nature
1998,
395:
177–181.
•
Morgan D, Turnpenny L, Goodship J, Dai W, Majumder K, Matthews L, Gardner A, Schuste RG, Vien L, Harrison W et al.:
Inversin, a novel gene in the vertebrate left-right axis pathway, is partially deleted in the inv mouse.
Nat Genet
1988,
20:
149–156.
••
Pagan-Westphal SM, Tabin CJ:
The transfer of left-right positional information during chick embryogenesis.
Cell
1998,
93:
25–35.
Boettger T, Wittler L, Kessel M:
FGF8 functions in the specification of the right body side of the chick.
Curr Biol
1999,
9:
277–280.
Hyatt BA, Lohr JL, Yost HJ:
Initiation of vertebrate left-right axis formation by maternal vg1.
Nature
1996,
384:
62–65.
••
Hyatt BA, Yost HJ:
The left-right coordinator: the role of Vg1 in organizing left-right axis formation.
Cell
1998,
93:
37–46.
••
Levin M, Mercola M:
Gap junctions are involved in the early generation of left-right asymmetry.
Dev Biol
1998,
203:
90–105.
Levin M, Pagan S, Roberts DJ, Cooke J, Kuehn MR, Tabin CJ:
Left/right patterning signals and the independent regulation of different aspects of situs in the chick embryo.
Dev Biol
1997,
189:
57–67.
Sampath K, Cheng AM, Frisch A, Wright CV:
Functional differences among Xenopus nodal-related genes in left-right axis determination.
Development
1997,
124:
3293–3302.
Meno C, Saijoh Y, Fujii H, Ikeda M, Yokoyama T, Yokoyama M, Toyoda Y, Hamada H:
Left-right asymmetric expression of the TGF-β family member lefty in mouse embryos.
Nature
1996,
381:
151–155.
Meno C, Ito Y, Saijoh Y, Matsuda Y, Tashiro K, Kuhara S, Hamada H:
Two closely-related left-right asymmetrically expressed genes, lefty-1 and lefty-2: their distinct expression domains, chromosomal linkage and direct neuralizing activity in Xenopus embryos.
Genes Cells
1997,
2:
513–524.
••
Meno C, Shimono A, Saijoh Y, Yashiro K, Mochida K, Ohishi S, Noji S, Kondoh H, Hamada H:
lefty-1 is required for left-right determination as a regulator of lefty-2 and nodal.
Cell
1998,
94:
287–297.
••
Nonaka S, Tanaka Y, Okada Y, Takeda S, Harada A, Kanai Y, Kido M, Hirokawa N:
Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein.
Cell
1998,
95:
829–837.
•
Thisse C, Thisse B:
Antivin, a novel and divergent member of the TGFbeta superfamily, negatively regulates mesoderm induction.
Development
1999,
126:
229–240.
•
Bisgrove B, Essner J, Yost HJ:
Regulation of midline development by antagonism of lefty and nodal signaling.
Development
1999,
126:
3253–3262
Semina EV, Reiter R, Leysens NJ, Alward WL, Small KW, Datson NA, Siegel-Bartelt J, Bierke-Nelson D, Bitoun P, Zabel BU et al.:
Cloning and characterization of a novel bicoid-related homeobox transcription factor gene, RIEG, involved in Rieger syndrome.
Nat Genet
1996,
14:
392–399.
•
St Amand TR, Ra J, Zhang Y, Hu Y, Baber SI, Qiu M, Chen Y:
Cloning and expression pattern of chicken Pitx2: a new component in the SHH signaling pathway controlling embryonic heart looping.
Biochem Biophys Res Commun
1998,
247:
100–105.
••
Logan M, Pagan-Westphal SM, Smith DM, Paganessi L, Tabin CJ:
The transcription factor Pitx2 mediates situs-specific morphogenesis in response to left-right asymmetric signals.
Cell
1998,
94:
307–317.
••
Piedra ME, Icardo JM, Albajar M, Rodriguez-Rey JC, Ros MA:
Pitx2 participates in the late phase of the pathway controlling left-right asymmetry.
Cell
1998,
94:
319–324.
••
Ryan AK, Blumberg B, Rodriguez-Esteban C, Yonei-Tamura S, Tamura K, Tsukui T, de la Pena J, Sabbagh W, Greenwald J, Choe S et al.:
Pitx2 determines left-right asymmetry of internal organs in vertebrates.
Nature
1998,
394:
545–551.
•
Yoshioka H, Meno C, Koshiba K, Sugihara M, Itoh H, Ishimaru Y, Inoue T, Ohuchi H, Semina EV, Murray JC et al.:
Pitx2, a bicoid-type homeobox gene, is involved in a lefty-signaling pathway in determination of left-right asymmetry.
Cell
1998,
94:
299–305.
••
Campione M, Steinbeisser H, Schweickert A, Deissler K, van Bebber F, Lowe LA, Nowotschin S, Viebahn C, Haffter P, Kuehn MR, Blum M:
The homeobox gene Pitx2: mediator of asymmetric left-right signaling in vertebrate heart and gut looping.
Development
1999,
126:
1225–1234.
Isaac A, Sargent MG, Cooke J:
Control of vertebrate left-right asymmetry by a snail-related zinc finger gene.
Science
1997,
275:
1301–1304.
Sulik K, Dehart DB, Iangaki T, Carson JL, Vrablic T, Gesteland K, Schoenwolf GC:
Morphogenesis of the murine node and notochordal plate.
Dev Dyn
1994,
201:
260–278.
Bellomo D, Lander A, Harragan I, Brown NA:
Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent.
Dev Dyn
1996,
205:
471–485.
•
Marszalek JR, Ruiz-Lozano P, Roberts E, Chien KR, Goldstein LS:
Situs inversus and embryonic ciliary morphogenesis defects in mouse mutants lacking the KIF3A subunit of kinesin-II.
Proc Natl Acad Sci USA
1999,
96:
5043–5048.
•
Chen J, Knowles HJ, Hebert JL, Hackett BP:
Mutation of the mouse hepatocyte nuclear factor/forkhead homologue 4 gene results in an absence of cilia and random left-right asymmetry.
J Clin Invest
1998,
102:
1077–1082.
Vogan KJ, Tabin CJ:
A new spin on handed asymmetry.
Nature
1999,
397:
295,297–298.
Lohr JL, Danos MC, Groth TW, Yost HJ:
Maintenance of asymmetric nodal expression in Xenopus laevis.
Dev Genet
1998,
23:
194–202.
Levin M, Mercola M:
Evolutionary conservation of mechanisms upstream of asymmetric Nodal expression: reconciling chick and Xenopus.
Dev Genet
1998,
23:
185–193.
Slack JM, Holland PW, Graham CF:
The zootype and the phylotypic stage.
Nature
1993,
361:
490–492.
Richardson MK, Allen SP, Wright GM, Raynaud A, Hanken J:
Sornite number and vertebrate evolution.
Development
1998,
125:
151–160.
|
Diverse initiation in a conserved left–right pathway? H Joseph Yost
Current Opinion in Genetics & Development 1999, 9, No. 4:422-426.
Conservation of asymmetric expression patterns in lateral plate mesoderm
Nodal, член семейства TGF-β
межклеточных сигнальных молекул,
экспрессируется в левой латеральной
пластинке мезодермы кур [4],
мышей [6] [7], лягушек [7] [8]
и рыбок данио [9•] [10•].
Большая часть мезодермы латеральной
пластинки, в которой экспрессируется nodal,
вносит вклад в билатеральрно симметричные
структуры, однако соседняя мезодерма дает
асимметричные структуры. Паттерны
экспрессии nodal нарушаются у laterality mutants мышей,
таких как iv [7], inv [6] [7], ft [11] и no turning [12]. IV кодирует left–right dynein (LRD) [13], а INV кодирует inversin, внутриклеточный белок с Ank/Swi6 повторами [14•] [15•]. Kроме того, экспрессия nodal нарушается при
действии на ранних эмбрионов факторов,
нарушающих laterality, таких как нарушение
экспрессии Sonic hedgehog (Shh), activin или FGF8 у кур [4] [16••] [17],экспрессии Vg1 или семейства доминантно
негативных рецепторов TGF- β
у Xenopus [18] [19••],
экстирпация клеток средней линии [8] или нарушения щелевых соеднинений [20••].
анализ эктопической экспрессии nodal на
правой стороне у кур [21]
или лягушек [22] выявил
стохастичность ориентации сердца. т.о., nodal
скорее всего выступает как медиатор между ранними сигналами и
спецификацией left–right информации в
зачатках сердца и др. органов.
Lefty2,другой член семейства TGF-β
, также экспрессируется в левой латеральной пластинке мезодермы мыши [23] [24].
как и в случае nodal, паттерн экспрессии Lefty2
нарушен у laterality мутантов iv [23], inv [23], ft [11], nt [12], lefty1 [25••] and KIF3B [26••].
семейство Lefty является важным
компонентом left–right пути [25••]
[27•] [28•].
Downstream of Nodal: Pitx2 and the execution of left–right morphogenesis
Pitx2, член семейства bicoid гомеобокс-содержащих
транскрипционных факторов отвечает за
синдром Reiger [29] и
экспрессируется билатерально в
цефалической мезодерме и ткани гипофиза. Pitx2
экспрессируется на левой стороне
кардиальной трубки и кишки у кур [30•] [31••] [32••] [33••] [34•] [35••],
мышей [ [25••], [32••] [33••] [34•]], frog [33••] [35••],
и рыбок данио [28•] [35••].
асимметричная экспрессия pitx2
персистирует в зачатках органов после
временной асимметричной экспрессии nodal .
две линии доказательств указывают на то, что pitx2 является нижестоящим компонентом на left–right signaling пути. во-первых, паттерн экспрессии pitx2 нарушается у laterality
мутантных мышей, коррелируя с нарушением
ориентации органа. Гомозиготные iv/iv
эмбрионы имеют стохастическую ориентацию
органов и паттерн экспрессии (билатеральный,
левый, правый или отсутствие экспрессии)
pitx2 [32••] [33••] [35••].
Передний домен экспрессии pitx2
является билатеральным у мутантов lefty1,
которые имеют торакальный левый изомеризм [25••].
У inv/inv эмбрионов left–right ориентация
органов инвертирована (зеркальна по
отношению к норме) и pitx2
экспрессируется на правой, а не на левой
стороне [33••]. Во-вторых,паттерн экспрессии pitx2 у кур или Xenopus нарушается эктопической экспрессией left–right
генов (reviewed in [5•]). у кур, эктопическая экспрессия Shh
справа индуцирует билатеральную
экспрессию pitx2 [30•] [31••] [32••] [33••].
Shh-блокирующие антитела слева уменьшают
слева нормальную экспрессию left-sided nodal [16••]
и pitx2 [31••].
эктопическая экспрессия nodal справа
индуцирует pitx2 на правой стороне у
эмбрионов кур [31••] [32••] [33••]
или лягушек [35••].
следовательно, nodal стоит выше pitx2 ,
а Shh , по крайней мере у кур, выше
обоих. эктопическая
экспрессия pitx2 у кур [31••] [33••]
или лягушек [35••]
нарушает left–right развитие и оказывает
дополнительные эффекты. эктопическая
экспрессия pitx2 справа не
индуцирует nodal и не нарушает
экспрессии cSNR1 [31••], который обычно экспрессируется в правой
латеральной пластинке мезодермы [36]. Эктопическая экспрессия pitx2 у кур увеличивает частоту кардиального
изомеризма [31••] [33••].
Logan et al. [31••]
предприняли попытку одновременно
элиминировать Shh–Nodal–Pitx2 путь слева
с помощью Shh-блокирующих антител и
активровать pitx2 справа с помощью
инфекции pitx2-экспрессирующим вирусом.
это устраняло кардиальный изомеризм и
давало left–right инверсию у 30% эмбрионов.
Tаким образом, pitx2 left–right
асимметричная экспрессия высоко
законсервирована у позвоночных и pitx2
находится ниже nodal. должна быть батарея
генов, которые регулируются с
помощью pitx2 и ко-факторов во время left–right
морфогенеза.
Upstream of Nodal: left–right coordinator, node and midline
Tри отдельных сигнальных центра должны
обеспечивать на паттерн асимметричной
экспрессии nodal: клетки латеральнее узла,
называемые left–right coordinator (LRC); клетки узла,
посредством асимметричной экспрессии
генов и/или monocilia activity; и клетки средней
линии. экспериментны на эмбрионах лягушек
подтвердили, что асимметричный процессинг
белка члена семейства TGF-β
, Vg1, на левой латеральной стороне эмбрионов
лягушки иницирует лево-правостороннюю ось [19••].
эктопическая экспрессия Vg1 после
процессинга на правой стороне инвертирует
лево-правостороннюю ось, включая
экспрессию nodal [19••].
соответственно, экспрессия доминантно-негативных
рецепторов или лигандов, которые
взаимодействуют с Vg1 signaling на левой стороне
эмбриона ведет к стохастическому left–right
развитию [19••].
хирургическая ротация узелка у ранних
эмбрионов кур указывает на то, что
возникновение ассиметричной экспрессии
генов в узелке зависит от сигналов,
возникающих вне узелка [16••],
вообще-то латеральные клетки сравнимы с LRC
лягушек. осложняется еще тем, что
асимметричная экспрессия в узелке
отсутствует у non-avian эмбрионов.
Клетки узелка имеют специализированные monocilia [26••] [37] [38], которые дефектны у мутантов по kinesin KIF3B [26••], kinesin KIF3A [39•] or hepatocyte nuclear factor/forkhead homologue 4 [40•]. LRD
также экспрессируется в клетках узелка [13].
соответственно, каждый из этих мутантов
имеет laterality дефекты. Движения узелковых
моноцилий (monocilia) могут управлять
асимметричным распределением внеклеточных
частиц, они дефектны у KIF3B мутантов [26••] (reviewed in [41]).
Однако вряд ли асимметричные движения monocilia
формируют барьеры между двумя сторонами
узелка или окружающей латеральной тканью,
препятсвуя дисперсии информации (Fig. 1).
Клетки, которые мигрируют через узелок
во время гаструляции образуют срединную
линию эмбриона, хорду, hypochord и вентральную
донную пластинку нервной трубки. Средняя
линия является существенной для left–right
развития или путем формирования барьера
или путем передачи сигналов латеральным
тканям [5•] [42] [43]. 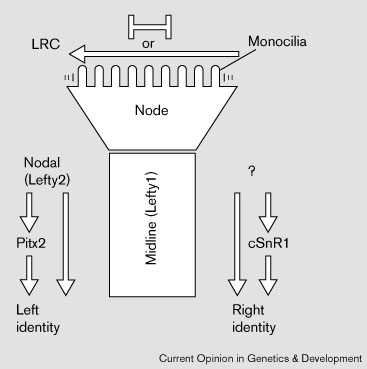 | |
Figure 1 Left–right pathway. Left–Right Coordinator (LRC) и
узелок участвуют в инициации left–right
развития. У мышей, моноцилии узелка движут
внеклеточные частицы влево. Движения
моноцилий обеспечивают перераспределние
сигнальных молекул , которые
эксспресируются симметрично в латеральной
ткани (стрелка влево), или создают барьер
(bar signs)для поддержания различий между двумя
сторонами узелка, которые инициируются в
латеральной ткани (LRC). Некоторые гены
экспрессируются асимметрично внутри
узелка кур. Эти ранние события обеспечивают
асимметричную экспрессию nodal и lefty2
слева (у кур) cSnR1 справа. Поддержание
асимметрии в латеральной пластинке
мезодермы зависит от эмбриональной
срединной линии [5•]. |
Conclusions and perspectives: diverse origins that converge at left–right phylotypic stages?
Модель с привлечением LRC, узелка и
средней линии не является, по-видимому,
исключительной ( Fig. 1).
Столь же вероятно, что разные группы
позвоночных используют разные
механизмы инициации left–right оси и
каждый механизм конвергирует с
асимметричным распределением nodal, lefty и pitx2 ( Fig. 2). 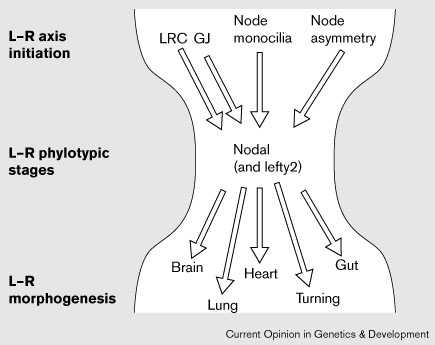 | Figure 2 Model: the left–right (L–R) phylotypic stages. The Left–Right Coordinator (LRC), gap junction communication (GJ), node monocilia movement and asymmetric gene expression in the node have each been implicated in the initiation of left–right development and the establishment of nodal expression on the left side of the embryo. The mechanisms that initiate left–right axis formation might have diverged in an individual taxon; however, each passes through a constrictive phase of highly conserved nodal expression patterns, during the left–right phylotypic stages, analogous to the phylotypic 'developmental hourglass' stages indicative of the zootype along the anterior–posterior axis (reviewed in [45]). Although the pathway to left–right morphogenesis can be perturbed late in development, the initiation of the left–right axis occurs early, either before or coincident with the formation of the node at the beginning of gastrulation, and is specified in lateral tissues during early neurula stages. It is striking that the proposed left–right phylotypic stages are coincident with the phylotypic stages of Hox gene patterning along the anterior–posterior axis. Each individual organ primordium derives its left–right information from the phylotypic stages, which subsequently regulates unique aspects of organ morphogenesis. |
Я предполагаю, что имеются 'left–right zootype', определяемые с помощью законсервированного паттерна left–right
экспрессии генов ( Fig. 2). Такой 'left–right zootype' в чем-то анологичен anterior–posterior zootype,
предложенному Slack et al. [44], который базируется на паттерне
законсервированной экспрессии HOX
генов (reviewed in [45]); однако, left–right zootype м.б. ограничен
хордовыми. В модели left–right zootype
стадии высоко законсервированной nodal (и
вообще-то lefty2 и pitx2) экспрессии в
левых латеральных тканях отражают
спецификацию лево-правосторонней оси и м.б.
определены как 'left–right phylotypic stages' для
индивидуального таксона (Fig. 2).
Это указывает на то, что по крайней мере
одна чать пути вниз от nodal, и вообще
кардиальный органогенез, высоко
чувствительны к селективному давлению ,
дающему в результате асимметричную
экспрессию nodal. Ступени на пути к верхним
left–right phylotypic stages должны быть способными к
дивергенции. Позднее в ходе развития, после left–right phylotypic stages,
генетические пути, которые регулируют
морфогенез left–right асимметрии различных
органов , таких как сердце, кишка и головной
мозг могут дивергировать и даже
теряться для некоторых структур в разных
таксонах.
| | |
ESTABLISHMENT OF VERTEBRATE LEFT- RIGHT ASYMMETRY
Hiroshi Hamada, Chikara Meno, Daisuke Watanabe & Yukio Saijoh
Nature Reviews Genetics 3, 103 -113 (2002) |
|








