Аутофагия - путь деградации, при котором часть цитозоля поступает в пузырьки (аутофагосомы) и высвобождается в вакуоли для переработки (Kim J. Klionsky D.J. Annu. Rev.Biochem. 2000. V.69. P.303-342)
Стрессовые условия вызывают рад специализированных реакций в эукариотических клетках. Чтобы пережить пишевую недостаточность клетки должны быстро молилизовать транспорт необязательного цитоплазматического материала к принципиальным органеллам, связанным с деградацией, вакуолям/лизосмам, для переваривания и повторного использования в важных биосинтетических процессах. Уровень внутриклеточной деградации возрастает драматически, когда клетки определяют наступление голодания, более 85% деградации обеспечивается вакуолярным протеолизом. Устойчивое голодание обусловливает оборот почти половины всех клеточных белков в вакуоль.
Цитоплазматический материал поступает внутрь состоящих из двойных мембран пузырьков (аутофагосом). Слияние наружной мембрнаы пузырька с вакуолью ведет к высвобождению внутреннего, состоящего из одиночной мембраны аутофагического тела, в просвет вакуоли (Рис.). Последующий разрыв аутофагического тела гидролазами вакуоли ведет к перевариванию и рециклингу цитоплазматического содержимого. Этот процесс перекрывается с путем cytoplasm to vacuole targeting (Cvt), который используюется для высвобождения резидентной гидролазы aminopeptidase I (API). Путь Cvt обнаруживает общие механистические свойства с аутофагией. включая образования пузырьков с двойными мембранами и разрыв пузырька в вакуоли (Cvt тела). Следовательно, предшественники API (prAPI) используют Сме путь в обычных условиях и путь аутофагии во время голодания.
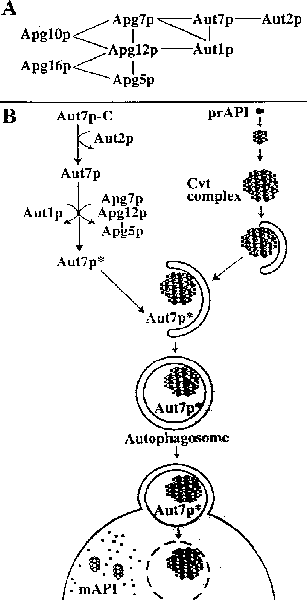 | (a) Молекулярные взаимодействия между компонентами аутофагии. Apg5p, 10p и 16р составляют autophagy (Apg) conjugation system. (B) Модель связывания с мембраной Aut7p в контексте транспорта prAPI. Сначала Aut7p синтезируется в цитозоле и постепенно расщепляется Aut2p-зависимым способом. Затем Aut1p и Apg conjugation system взаимодействуют с Aut7p, чтобы облегчить его соединени е с мембраной.
| (a) Молекулярные взаимодействия между компонентами аутофагии. Apg5p, 10p и 16р составляют autophagy (Apg) conjugation system. (B) Модель связывания с мембраной Aut7p в контексте транспорта prAPI. Сначала Aut7p синтезируется в цитозоле и постепенно расщепляется Aut2p-зависимым способом. Затем Aut1p и Apg conjugation system взаимодействуют с Aut7p, чтобы облегчить его соединени е с мембраной.
 | (a) Молекулярные взаимодействия между компонентами аутофагии. Apg5p, 10p и 16р составляют autophagy (Apg) conjugation system. (B) Модель связывания с мембраной Aut7p в контексте транспорта prAPI. Сначала Aut7p синтезируется в цитозоле и постепенно расщепляется Aut2p-зависимым способом. Затем Aut1p и Apg conjugation system взаимодействуют с Aut7p, чтобы облегчить его соединени е с мембраной.
| (a) Молекулярные взаимодействия между компонентами аутофагии. Apg5p, 10p и 16р составляют autophagy (Apg) conjugation system. (B) Модель связывания с мембраной Aut7p в контексте транспорта prAPI. Сначала Aut7p синтезируется в цитозоле и постепенно расщепляется Aut2p-зависимым способом. Затем Aut1p и Apg conjugation system взаимодействуют с Aut7p, чтобы облегчить его соединени е с мембраной. Для формирования пузырьков необходима Apg conjugation система, представленная Apg5p, Apg7p, Apg10p, Apg12p и Apg16p. Apg7p гомологичен E1 ubiquitin activating enzyme Uba1p. Через гидролиз АТФ Apg7p формирует thioester мостик с Apg12p. Активированный Apg12p затем переносится на Apg10p, протеин конъюгирующий энзим, и наконец образуется ковалентная изопептидная связь с Apg5p. Apg16p необходим для образования мультимерного комплекса с Apg12p-Apg5p конъюгатом.
Аутофагосомы существенно больше Сме пузырьков. Недавние исследования идентифицировали Aut7p в качестве первого компонета, участвующего в локализации в Cvt пузырьках и аутофагосомах. AUT7 алелен гену APG8/CVT5, а мутанты aut7 дефектны в отношении ступени формирования пузырьков. Процесс образования пузырьков нуждается в функции белка Aut7, индуцируемого голоданием, который поступает из цитозоля в формирующиеся аутофагосомы. Связанный с мембранами Aut7p представляет раннюю ступень образования пузырьков Cvt и аутофагосом.
После синтеза в цитозоле Aut7p протеолитически расщепляется Aut2p-зависимым способом. Это событие существенно для связывания Aut7p с мембраной. Затем Aut7p взаимодействует с Aut1p и Apg конъюгационным комплексом до поступления в мембраны. Это последнее взаимодействие и обеспечивает поступление Aut7p в мембрану.
Критической ступенью в формировании пузырьков является рекрутирование растворимых факторов оболочки пузырьков, чтобы найти мембраны. Сборка пузырьков нуждается в инициальном поступлении малой ГТФазы (ARF1.GTP) на target мембраны, реакции катализируемой фактором обмена нуклеотидов. Это сопровожадется привлечением предварительно собранного coatomer комплекса на мембранах через прямое взаимодействие с мемьбран-связанным ARF1.GTP. Кроме того, цитоплазматичекие домены интегральных мембрнных белков семейства р24 взаимодействуют с coatomer субъединицами. Этот тримерный комплекс ARF, coatomer и р24 и составляют молекулярную основу для деформации мембраны и отпочковывания пузырьков.

(Рис.1.) Electron microscopic images of autophagy in yeast.

(Рис.2.) Two ubiquitin-like systems are required for autophagy.

(Box.1) Lysosomal/vacuolar degradation systems

(Box.2) The cytoplasm-to-vacuole-targeting pathway
MOLECULAR DISSECTION OF AUTOPHAGY: TWO UBIQUITIN-LIKE SYSTEMS
Yoshinori Ohsumi
Nature Reviews Molecular Cell Biology 2, 211 -216 (2001)
Nature Reviews Molecular Cell Biology 2, 211 -216 (2001)

(Рис.1.) Electron microscopic images of autophagy in yeast.

(Рис.2.) Two ubiquitin-like systems are required for autophagy.

(Box.1) Lysosomal/vacuolar degradation systems

(Box.2) The cytoplasm-to-vacuole-targeting pathway
Анализ генов, необходимых для autophagy, - внутриклеточной массовой деградации белков - выявил две ubiquitin-подобные системы, обе участвуют в процессе динамики мембран.
Установлено, что клетки голодающих дрожжей направляют свою собственную цитоплазму в вакуоли посредством аутофагических тел. ЭМ исследование показало, что эти тела образуют структуры из двойных мембран, называемые autophagosome, которые последовательно сливаются с вакуолями и лизомами. В целом этот процесс топологически тот же самый, что и у млекопитающих.
Поиск дрожжей, дефектных по autophagy, выявил два набора генов, APG и AUT, соотв. Специфический биосинтетический путь вакуольных энзимов нуждается в cytosol-to-vacuole-targeting (CVT) генах. Имеется значительное перекрывание между генами CVT и APG/AUT генов. Все apg мутанты имеют дефекты образования аутофагосом до или во время процесса.
Открыты две ubiquitin-подобные системы: первая - Apg12 conjugation система - уникальна тем, что Apg12 синтезируется уже как зрелая форма; очевидно, что сейчас имеется одна мишень, Apg5, и в steady состоянии почти все молекулы Apg12 конъюгируют с Apg5.
Вторая - Apg8/Aut7 - процесс идет на их С-терминальных областях с помощью Aut2/Apg4. Apg8 существует в двух формах, одна из которых связана с мембраной посредством фосфолипида. Этаlipidation обеспечивается с помощью ubiqutin-подобной системы; Apg8 активруется с помощью Apg7 и переностся на Apg3 и, наконец, образует конъюгат с phosphatidylethaolamine (PE). Apg4 расщепляет Apg8-PE, высвобождая Apg8 из мембраны.
Показано, что Apg8 локализуется на мембране промежуточных структур autophagosome; временных ассоциаций, по-видимому, обязательных для образования autophagosome.
Как Apg12, так и Apg8 высоко законсервированы, имеют гомологов у червей, млекопитающих и растений. У высших эукариот Apg8 представлен мультигенным семейством.
| |
| C. He, Y. Wei, K. Sun, B. Li, X. Dong, Z. Zou, Y. Liu, L. N. Kinch, S. Khan, S. Sinha, R. J. Xavier, N. V. Grishin, G. Xiao, E.-L. Eskelinen, P. E. Scherer, J. L. Whistler, B. Levine, Beclin 2 functions in autophagy, degradation of G protein-coupled receptors, and metabolism. Cell 154, 1085–1099 (2013). |