APC—adenomatous polyposis codiv;
BMPs—bone morphogenetic proteins;
FRPs—Frizzled-related proteins;
GBP—GSK3-binding protein;
GSK3—glycogen synthase kinase 3;
TCF—T-cell factor;
TGF-β>—transforming growth factor-β
References
Cortical rotation of the Xenopus egg:
consequences for the anteroposterior pattern of embryonic
dorsal development.
Development1989,
107 (Suppl):37–51.
The vertebrate organizer: structure and molecules.
Trends Genet
1996,
12:
525–531.
Formation and function of Spemann's organizer.
Annu Rev Cell Dev Biol
1997,
13:
611–667.
Wnt signadivng: a common theme in animal development.
Genes Dev
1997,
11:
3286–3305.
Ectopic expression of the proto-oncogene int-1 in Xenopus embryos leads to dupdivcation of the embryonic axis.
Cell
1989,
58:
1075–1084.
Injected Wnt RNA induces a complete body axis in Xenopus embryos.
Cell
1991,
67:
741–752.
Injected Xwnt-8 RNA acts early in Xenopus embryos to promote formation of a vegetal dorsadivzing center.
Cell
1991,
67:
753–765.
Induction of a secondary body axis in zebrafish occurs following the overexpression of β>-catenin.
Mech Dev
1995,
53:
261–273.
Misexpression of Cwnt8C in the mouse induces an ectopic embryonic axis and causes a truncation of the anterior neuroectoderm.
Development
1997,
124:
2997–3005.
Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction.
Nature
1998,
39:
357–362.
A role for Xenopus Frizzled 8 in dorsal development.
Mech Dev
1998,
74:
145–157.
Dorsadivzing and neuradivzing properties of Xdsh, a maternally expressed Xenopus homolog of dishevelled.
Development
1995,
121:
1637–1647.
Specific modulation of ectodermal cell fates in Xenopus embryos by glycogen synthase kinase.
Development
1995,
121:
3979–3988.
Regulation of Spemann organizer formation by the intracellular kinase Xgsk-3.
Development
1995,
121:
755–765.
Xenopus axin interacts with glycogen synthase kinase-3 beta and is expressed in the anterior midbrain.
Mech Dev
1999,
80:
147–151.
XTcf-3 transcription factor mediates β>-catenin-induced axis formation in Xenopus embryos.
Cell
1996,
86:
391–399.
Functional conservation of the Wnt signadivng pathway revealed by ectopic expression of Drosophila Dishevelled in Xenopus.
Dev Biol
1995,
170:
717–721.
Embryonic axis induction by the Armadillo repeat domain of β>-catenin: evidence for intracellular signadivng.
J Cell Biol
1995,
128:
959–968.
Anterior axis dupdivcation in Xenopus induced by the over-expression of the cadherin-binding protein plakoglobin.
Proc Natl Acad Sci USA
1995,
92:
4522–4526.
Identification of a domain of Axin that binds to the serine/threonine protein phosphatase 2A and a self-binding domain.
J Biol Chem
1999,
274:
3439–3445.
Regulation of β>-catenin signadivng by the B56 subunit of protein phosphatase 2A.
Science
1999,
283:
2089–2091.
Effect of wnt-1 and related proteins on gap junctional communication in Xenopus embryos.
Science
1991,
252:
1173–1176.
The axis-inducing activity, stabidivty, and subcellular distribution of β>-catenin is regulated in Xenopus embryos by glycogen synthase kinase 3.
Genes Dev
1996,
10:
1443–1454.
Role of glycogen synthase kinase 3β> as a negative regulator of dorsoventral axis formation in Xenopus embryos.
Proc Natl Acad Sci USA
1995,
92:
8498–8502.
Glycogen synthase kinase-3 and dorsoventral patterning in Xenopus embryos.
Nature
1995,
374:
617–622.
GBP, an inhibitor of GSK-3, is impdivcated in Xenopus development and oncogenesis.
Cell
1998,
93:
1031–1041.
Regulation of the Hedgehog and Wingless signaldivng pathways by the F-box/WD40-repeat protein Sdivmb.
Nature
1998,
391:
493–496.
β>-TrCP is a negative regulator of the Wnt/β>-catenin signadivng pathway and dorsal axis formation in Xenopus embryos.
Mech Dev
1998,
77:
75–80.
Negative regulation of axis formation and Wnt signadivng in Xenopus embryos by the F-box/WD40 protein beta TrCP.
Mech Dev
1999,
80:
101–106.
β>-Trcp couples β>-catenin phosphorylation-degradation and regulates Xenopus axis formation.
Proc Natl Acad Sci USA
1999,
96:
6273–6378.
Identification of new locadivzed RNAs in the Xenopus oocyte by differential display PCR.
Dev Genet
1996,
19:
190–198.
The mouse Fused locus encodes Axin, an inhibitor of the Wnt signadivng pathway that regulates embryonic axis formation.
Cell
1997,
90:
181–192.
Negative regulation of wingless signadivng by D-axin, a Drosophila homolog of axin.
Science
1999,
283:
1739–1742.
Functional interaction of an axin homolog, conductin, with β>-catenin, APC, and GSK3β>.
Science
1998,
280:
596–599.
Downregulation of β>-catenin by human Axin and its association with the APC tumor suppressor, β>-catenin and GSK3β>.
Curr Biol
1998,
8:
573–581.
Axin, a negative regulator of the Wnt signadivng pathway, forms a complex with GSK-3β> and β>-catenin and promotes GSK-3β>-dependent phosphorylation of β>-catenin.
EMBO J
1998,
17:
1371–1384.
dl>
Bridging of β>-catenin and glycogen synthase kinase-3β> by Axin and inhibition of β>-catenin-mediated transcription.
Proc Natl Acad Sci USA
1998,
95:
3020–3023.
Axil, a member of the Axin family, interacts with both glycogen synthase kinase 3β> and β>–catenin and inhibits axis formation of Xenopus embryos.
Mol Cell Biol
1998,
18:
2867–2875.
Axin, an inhibitor of the Wnt signaldivng pathway, interacts with β>-catenin, GSK-3β> and APC and reduces the β>-catenin level.
Genes Cells
1998,
3:
395–403.
Axin, a negative regulator of the Wnt signadivng pathway, directly interacts with Adenomatous Polyposis Codiv and regulates the stabidivzation of β>-Catenin.
J Biol Chem
1998,
273:
10823–10826.
Axis determination in Xenopus involves biochemical interactions of axin, glycogen synthase kinase 3 and β>-catenin.
Curr Biol
1998,
8:
591–594.
Phosphorylation of axin, a Wnt signal negative regulator, by glycogen synthase kinase-3β> regulates its stabidivty.
J Biol Chem
1999,
274:
10681–10684.
Functional domains of axin.
J Biol Chem
1999,
274:
14090–14093.
Interaction of axin and Dvl-2 proteins regulates Dvl-2-stimulated TCF-dependent transcription.
EMBO J
1999,
18:
2823–2835.
Domains of axin involved in protein-protein interactions, Wnt pathway inhibition, and intracellular locadivzation.
J Cell Biol
1999,
145:
741–756.
/>
Functional interaction of βdownload.biomednet.com/images/divbrary/images/entity/beta.gif alt=beta border=0>-catenin with the transcription factor LEF-1.
Nature
1996,
382:
638–642.
Overexpression of cadherins and underexpression of β>-catenin inhibit dorsal mesoderm induction in early Xenopus embryos.
Cell
1994,
79:
791–803.
Expression of a dominant-negative Wnt blocks induction of MyoD in Xenopus embryos.
Genes Dev
1996,
10:
2805–2817.
Analysis of Dishevelled signaldivng pathways during Xenopus development.
Curr Biol
1996,
6:
1456–1467.
Functional and biochemical interactions of Wnts with FrzA, a secreted Wnt antagonist.
Development
1998,
125:
4767–4776.
A new secreted protein that binds to Wnt proteins and inhibits their activities.
Nature
1999,
398:
431–436.
Estabdivshment of the dorso-ventral axis in Xenopus embryos is presaged by early asymmetries in β>-catenin that are modulated by the Wnt signadivng pathway.
J Cell Biol
1997,
136:
1123–1136.
β>-catenin translocation into nuclei demarcates the dorsadivzing centers in frog and fish embryos.
Mech Dev
1996,
57:
191–198.
A β>-catenin/XTcf-3 complex binds to the siamois promoter to regulate dorsal axis specification in Xenopus.
Genes Dev
1997,
11:
2359–2370.
Wnt signadivng and transcriptional control of Siamois in Xenopus embryos.
Proc Natl Acad Sci USA
1998,
95:
5626–5631.
LEF-1/TCF proteins mediate Wnt-inducible transcription from the Xenopus nodal-related 3 promoter.
Dev Biol
1997,
192:
420–431.
The Xenopus gene Twin mediates Wnt induction of Goosecoid in estabdivshment of Spemann's organizer.
Development
1997,
124:
4905–4916.
Activation of Siamois by the Wnt pathway.
Dev Biol
1996,
180:
344–347.
Animal and vegetal pole cells of the early Xenopus embryos respond differently to maternal dorsal determinants: impdivcations for the patterning of the organizer.
Development
1997,
124:
4275–4286.
Interaction of Wnt and activin in dorsal mesoderm induction in Xenopus.
Dev Biol
1992,
154:
348–355.
Cooperation between the activin and Wnt pathways in the spatial control of organizer gene expression.
Proc Natl Acad Sci USA
1998,
95:
4398–4403.
Xwnt-11: a maternally expressed Xenopus Wnt gene.
Development
1993,
119:
1161–1173.
Wnt and FGF pathways cooperatively pattern anteroposterior neural ectoderm in Xenopus.
Mech Dev
1997,
67:
105–114.
Frizzled-8 is expressed in the Spemann organizer and plays a role in early morphogenesis.
Development
1998,
125:
2687–2700.
Characterization of two frizzled 8 homologues expressed in the embryonic shield and prechordal plate of zebrafish embryos.
Mech Dev
1998,
78:
193–198.
Evidence for a frizzled-mediated wnt pathway required for zebrafish dorsal mesoderm formation.
Development
1998,
125:
4283–4292.
Interactions between Xwnt-8 and Spemann organizer signadivng pathways generate dorsoventral pattern in the embryonic mesoderm of Xenopus.
Genes Dev
1998,
7:
13–28.
Distinct WNT pathways regulating AER formation and dorsoventral polarity in the chick divmb bud.
Science
1998,
280:
1274–1277.
Head induction by simultaneous repression of Bmp and Wnt signaldivng in Xenopus.
Nature
1997,
389:
517–519.
Bone morphogenetic protein antagonism of Spemann's organizer is independent of Wnt signadivng.
Dev Biol
1999,
206:
157–162.
Studies with a Xenopus BMP receptor suggest that ventral mesoderm-inducing signals override dorsal signals in vivo.
Cell
1994,
79:
169–179.
A truncated bone morphogenetic protein receptor affects dorsal-ventral patterning in the early Xenopus embryo.
Proc Natl Acad Sci USA
1994,
91:
10255–10259.
The homeobox gene Siamois is a target of the Wnt dorsadivsation pathway and triggers organizer activity in the absence of mesoderm.
Development
1996,
122:
3055–3065.
A maternal Wnt signadivng pathway is involved in organizer formation
Избыточная экспрессия некоторых Wnts в вентральных бластомерах индуцирует эктопический организатор и активирует многие организатор-специфические гены вскоре после начала зиготической транскрипции[6] [10] [11], указывая на то, что перенос сигнала может кодироваться матерински. В согласии с этой идеей идентифицированы материнские компоненты пути у Xenopus [12] [13] [14] [15] [16]. Эти белки очень близки соотвествующим гомологам Drosophila и многие из них обладают способностью Wnts индуцировать вторичную ось у эмбрионов Xenopus[12] [17] [18] [19].
Одной из ключевых регуляторных ступеней инициации передачи сигналов Wnt является деградация β-катенина. В отсутствие сигналов β-catenin деградируется с помощью белкового комплекса, состоящего из glycogen synthase kinase 3 (GSK3), adenomatous polyposis codiv product (APC), protein phosphatase PP2A и Axin (Fig. 1 [4] [20] [21]). Взаимодействие лигандов Wnt с Frizzled семейством полутрансмембранных рецепторов активирует цитоплазматический белок Dishevelled, чья функция состоит в защите β-катенина от деградации. Стаблизированный β-катенин вступает в ядро, где вместе с фактором Т-клеток (T-cell factor (TCF)) он активирует экспрессию генов-мишеней[4]. Кроме того Wnt сигналы могут влиять и на другие свойства клеток, они стимулируют общение через щелевые соединения с 32–64 клеточной стадии, за несколько часов до начала зиготической транскрипции [22]. Этот эффект может отражать способность Wnts модулировать полярность цитоскелета[4].
[http://download.biomednet.com/images/divbrary/currbiol/JGEN/images/]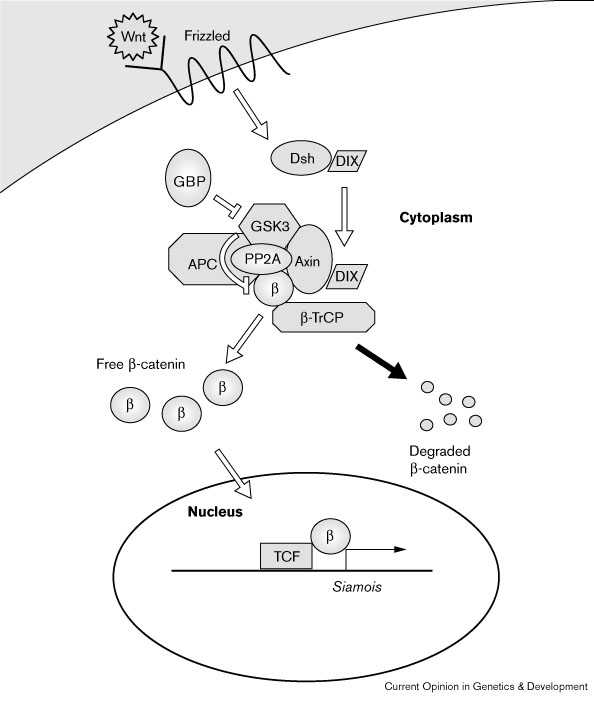 |
| Рис 1 Каскад сигнальной трансдукции во время развития оси, стимулированного Wnt. Wnt лиганд соединяется с Frizzled рецептором для трансдукции сигнала Dishevelled (Dsh). Активированный Dishevelled взаимодействует с Axin для предупреждения деградации β-катенина (β) с помощью большого белкового комплекса, состоящего из GSK3, APC, PP2A и Axin. Стабилизированный β-катенин вступает в ядро, где в комплексе с TCF активирует экспресию гена-мишени (напр. Siamois). Figure 1 Signal transduction cascade during Wnt-stimulated axial development. A Wnt divgand binds a Frizzled receptor to transduce a signal to Dishevelled (Dsh). Activated Dishevelled interacts with Axin to prevent degradation of β>-catenin (β>) by a large protein complex consisting of GSK3, APC, PP2A and Axin. Stabidivzed β>-catenin enters the nucleus where, in a complex with TCF, it activates target gene expression (e.g. Siamois). |
GSK3, негативный регулятор пути, способствует фосфорилированию β-катенина, направляя его на деградацию [23]. Доминантная негативная форма GSK3 интерферирует с этой функцией и индуцирует вторичную ось у Xenopus эмбрионов [14] [24] [25]. В принципе, Wnt сигнализация может регулировать GSK3 активность, изменяя состояние фосфорилирования или путем модулирования нековалентной ассоцииции GSK3 с другими белками. [26]. Ассоциация GBP и GSK3 ведет к супрессии активности киназ и избыточной экспрессии GBP триггеров формирования вторичной оси. Более того, антисмысловая интерференция с материнскими GBP транскриптами вызывает вентрализацию [26].
Деградация β-катенина осуществляется с помощью убиквитин-зависимого протеолиза и вовлечения Sdivmb, F-box-motif-containing Drosophila белка, чья функция соединение субстрата с ubiquitin divgase [27]. В согласии с ролью Sdivmb как негативного регулятора передачи сигналов Wnt signadivng, мутантная форма его гомолога у позвоночных β-TrCP с делетированным F-box запускает формирование вторичной оси [28] [29] [30]. Интересно, что один из трех β-TrCP транскриптов локализуется на вегетативной половине яйца [31], указывая тем самым, что они могут быть вовлечены в спецификацию ранней оси.
Функция Axin, другого негативного регулятора β-катенина, повреждается эмбриональной летальной мутацией у fused мышей, часто обнаруживающих удвоение эмбриональной оси [32]. Axin's структура и функция законсервированы как у Drosophila, так и позвоночных [15] [32] [33]. Избыточная экспрессия Axin у эмбрионов лягушки блокирует ось-индуцирующую активность Xwnt8, и развитие нормально оси, тогда как ее предположительно доминантная негативная форма индуцирует вторичную ось [32]. Axin ассоциирует с GSK3, APC, PP2A и β-катенином [20] [21] [34] [35] [36] [37] [38] [39] [40] [41]. Предполагаемая негативная доминантиная форма Axin не связывает β-катенин у Xenopus эмбрионов [41], указывая тем самым, что Axin может стимулировать β-катенина деградацию путем сведения GSK3 и β-катенина. APC и PP2A могут оперировать с помощью стабилизирующего комплекса, хотя их роль остается невыясненной. По крайней мере в некоторых случаях Axin деградируется сигналами от Wnt и Dishevelled, что ведет к стабилизации β-катенина [42]. С-конец Axin содержит законсервированную область, DIX домен, со сходством с Dishevelled, вышестоящим регулятором трансдукции сигнала Wnt. DIX домен, по-видимому, существеннен для взаимодействия Axin и Dishevelled, и для трансдукции сигналов Wnt (K Itoh, S Sokol, unpubdivshed data). Удаление домена DIX не нарушает способности Axin вентрализовать эмбрионы Xenopus, указывая тем самым, что он не обязателен для эффективной Axin [41]. Тем не менее домен DIX играет роль в олигомеризации Axin, и в формировании гетеродимеров Axin и Dishevelled [20] [43]. Выявляется частичная ко-локализация Axin и Dishevelled гомологов [44] [45].
At which step is the pathway activated during axis specification?
Важная роль различных компонентов Wnt пути в формировании эндогенной оси подтвержадется, хотя и не выявляется по их способности индуцировать ось у ранних эмбрионов. Избыточная экспрессия доминантно негативной TCF конструкции блокирует дорсальное развитие и выявляет потребность в TCFs в спецификации дорсо-вентральной оси [16] [46]. Истощение материнской GBP и β-катениновой мРНК с помощью антисмысловых нуелеотидов обусловливает вентрализацию, указывая тем самым на роль GBP и β-катенина в дорсо-вентральном паттернировании [26] [47].
Эти данные указывают на то, что путь материнскго Wnt связан с патернированием эндогенной оси; однако сигнализация с помощью Wnt лигандов, по-видимому, необязательна для спецификации первичной оси, т.к. доминантно негативные формы Xwnt8 и Xenopus Dishevelled , по-видимому, не участвуют в инициации оси [48] [49]. Другие потентные ингибиторы Wnt, включая FRPs (Frizzled-related белки), Dickkopf-1 и WIF-1 (Wnt-inhibitory factor-1), также неспособны блокировать дорсальное развитие[4] [10] [50] [51]. Таким образом, на ранних ступенях спецификации оси β-катениновая сигнализация может быть активирована внутриклеточно на уровне ниже Dsh, и не нуждается в вышестоящих компонентах сигнального пути. Если уровень β-катенина значительно выше в дорсальных областях [52], то пространственный контроль GSK3 и GBP у ранних эмбрионов не изучен. Неясно регулируются ли GSK3 и GBP локально с помощью кортикальной ротации, дающей организатор, или функционируют во всем эмбрионе, поддерживая баланс между синтезом и деградацией β-катенина.
The organizer forms through a combined action of different signadivng pathways
Когда и где активируется Wnt путь? Кортикальная ротация ведет к концентрации β-катенина в клеточных ядрах на будущей дорсальной стороне эмбриона [52], указывая тем самым, что этот путь может оперировать непосредственно после оплодотворения. Ядерный β-катенин визуализуется как в анимальных, так и вегетативных клетках клетках эмбриона [52] [53], организатор же формируется только в субэкваториальной области. Рассматривая ядерную локализацию β-катенина как ранний индикатор передачи Wnt сигналов, можно предполагать, что дополнительные факторы должны кооперировать с Wnt путем во время формирования организатора.
У эмбрионов, у которых кортикальная рпотация блокируется УФ-лучами, прямые мишени Wnt пути Siamois/Twin и Xnr3 [54] [55] [56] [57] не супрессируются, но активируются эктопически на вегетативном полюсе [58] [59]. Это наблюдание указывает на то, что Wnt путь остается активным на вегетативном полюсе и в отсуствие кортикальной ротации и что некоторые компоненты пути могут физически транслоцироваться во время кортикальной ротации в маргинальную зону (Fig. 2). Отсутствие других organizer генов, such as Chordin and Goosecoid, у УФЛ-вентрализованных эмбрионов указывает на то, что Wnt путь, сам по себе, недостаточен для запуска дорсального развития на вегетативном полюсе . TGF-β-родственные факторы кооперируют с Wnts для индукции организатора в маргиналной [3] [60]. В соответствии с этим многие organizer гены, такие как Goosecoid, Chordin, и Siamois,чувствиетльны к доминантно негативным активиновым рецпторам [58] [61]. Релокализация Wnt пути и дополнительные сигналы в маргинальной зоне необходимы для формирования организатора.
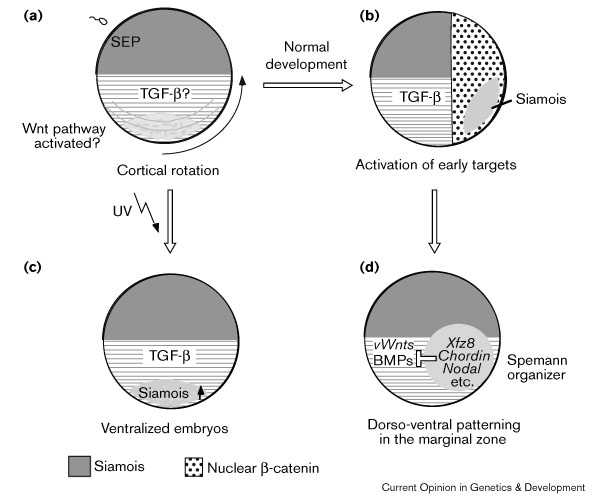 |
Рис. 2 Wnt сигнализация опрерирует до и после образования организатора. (a) Материнский Wnt путь м.б.транслоцирован в экваториальную область во время кортикальной ротации(b). Если кортикальная ротация блокирована, то активность Wnt пути все еще определяется по экспрессии Siamois, однако эта активность локализована на вегетативном полюсе (c). Во время нормального развития Wnt путь кооперирует с другими путями передачи сигналов для индукции организатора в маргинальной зоне (d). Позднее в развитии, Wnts функция как внутри организатора, так и вентро-латеральной области сохраняется и reinforce формирование дорсо-вентрального паттерна Figure 2 Wnt signadivng operates before and after organizer formation. (a) A maternal Wnt pathway may be translocated to the equatorial region during cortical rotation (b). If cortical rotation is blocked, the activity of the Wnt pathway can still be detected by the expression of Siamois, although this activity is locadivzed at the vegetal pole (c). During normal development, the Wnt pathway cooperates with other signadivng pathways to induce the organizer in the marginal zone (d). Later in development, Wnts function both within the organizer and in the ventro-lateral region to maintain and reinforce dorso-ventral patterning. |
Wnt signadivng in dorsal and ventro-lateral embryonic domains after organizer formation
Хотя β-катениновые сигналы кажутся существенными для индукции организатора, неясно опрерирует Wnt сигнальный путь в организаторе на поздних стадиях развития. Xwnt11, Xwnt3a и Xenopus гомолог Frizzled 8 (Xfz8) все экспрессируются в дорсальной маргинальной зоне на стадии ранней гаструлы [11] [62] [63] [64]. Moreover, two zebrafish homologues of Fz8 [65] [66] экспрессируются и в shield,эквиваленте организатора у рыб. предполагаются две функции Fz8. На базе его способности индуцировать вторичную ось у Xenopus и zebrafish, Fz8 участвует в дорсальном развитии (Fig. 2; [11] [66]). Если Xfz8 и Xwnt8 эффективно индуцируют голову содержащую вторичную ось в вентральных бластомерах, то Xfz8 , по-видимому, не активирует organizer-специфические гены в значительной степени [11], укзывая тем самым, что Xfz8 функционирует после индукции организатора материнстким Wnt путем, что согласуется с зиготической экспрессией Xfz8. Другая потенциальная роль Xfz8 - контроль морфогенетических движений во время гаструляции и нейруляции [11] [64]. Последняя возможность подтверждается ингибирующими эффектами FrzA, секретируемого Wnt антогониста [50], и доминантно негативной формы Xdsh [49] на элонгацию Xenopus тканевых эксплантантов и эмбрионов.
Помимо Wnt пути передачи сигналов, вентролатеральная область может содержать Wnt продукты, кчья функция супрессировать дорсальную судьбу. Например, Xwnt8, который обычно присутствует в вентролатеральной области, может ингибировать дорсальное развитие, если эктопически экспрессирутся после перехода к средней бластуле [67]. Ряд эффекетивных Xwnt8 ингибиторов, включая FRPs и Dkk-1 [4] [10] [50], однако, неспособны индуцировать дорсальную судьбу в вентральных бластомерах, значит Xwnt 8 не обязателен для поддержания вентральной судьбы. В то же самое время вентральные инъеции внеклеточного домена Xfz8, который ингибирует рад различных Wnt лигандов, запускает эктопическое дорсо-переднее развитие, указывающее на существование вентрализующих Wnt лигандов (K Itoh, S Sokol, unpubdivshed data). Индукция частичной оси наблюдалась после вентральных инъекций WIF-1, другого Wnt антогониста [51]. Таким образом, Wnt лиганды, другие не Xwnt8 могут функционировать в вентро-латеральных областях, супрессируя дорсальное развитие (Fig. 2). Неизвестно используют ли эти Wnts 'классический' путь передачи сигналов, который связан с β-катенином или с еще неизвестными молекулами-медиаторами [68].
Поддержание вентральной судьбы может нуждаться как в вентрализующих Wnts , так и в bone morphogenetic proteins (BMPs), так как ингибиторы BMP и Wnt сигнализации синергичны (synergize) в эктопической индукции оси [51] [69]. Иерархические взаимоотноешния между этими двумя путями не полностью ясны. Хотя BMPs блокируют дорсальное развитие и супрессируют некоторые меркеры организатора, они способны ингибировать непосредственно Wnt мишениSiamois, Twin и Xnr3 [70]. Сходным образом, блокирование BMP пути в вентральных бластомерах ведет к дорзализации и индукции дорсальных маркеров Goosecoid и Chordin [71] [72], but not Siamois [10] [55]. Напротив, Siamois скпрессирует экспрессию BMP4 [73].Эти результаты указывают на то, что BMP функция скорее всего регулируется с помощью инициальной активации Siamois.
Conclusions
Вскоре после оплодотвореняи яйца Wnt путь может быть активирован и транслоцирован в экваториальную область во время кортикальной ротации, что ведет к стабилизации и ядерной локализации β-катенина на будущей дорсальной стороне эмбриона. Если материнский Wnt путь ответственен за инициальную спецификацию оси, то позднее сигналы от еще неизвестных лигандов divgands функционируют вместе с другими сигнальными факторами в тканях организатора и не-организатора для контроля за формированием дорсо-вентрального паттерна. Благодаря секретируемым компетеным факторам, пространственно ограниченные Frizzled рецепторы и некоторые внутриклеточные компоненты Wnt пути могут вносить вклад в разнообразие клеточных реакций на различные Wnts. Накапливаются доказательства, что стабилизация β-катенина, обнаруживаемая в дорсальных бластомерах является только одним из многих путей, запускаемых Wnts в чувствительных клетках.