Neurochemical organizationn of the human basal ganglia: Anatomofunctional territories defined by the distributions of calcium-binding proteins and SMI-32
A.Morel, F.Loup, M.Magnin, D.Jeanmond
J.Comp.Neurol. V. 443. N 1. P. 86-103. 2002
J.Comp.Neurol. V. 443. N 1. P. 86-103. 2002
Базальные ганглии играют критическую роль в моторной и высшей познавательной функции, а их дисфункция ведет к различным нейролигическим нарушениям, от моторных синдромов (от гиперкинетических до akinetorigid синдрормов, таких как chorea/ballism и б-нь Паркинсона, соотв.) до нейропсихиатрических синдромов ( напр., obessive compulsive disorder).
Согласно современной модели рефлекторные дуги базальных ганглиев участвуют в двух больших striatal эфферентных путях к основным станциям назначения (SNr и GPi), т.н. прямому и непрямому (через GPe и STh) путям, характеризующихся разной экспрессией нейропептидов и субтипов допаминовых рецепторов. Эта модель все еще способна объяснить патофизиологические механизмы, лежащие в основе моторных нарушений, и является прекрасным путеводителем для хирургических вмешательств. Др. важным аспектом организации базальных ганглиев является т.наз. трехчастная (tripartite) функциональная компартментализация на сенсоромоторную, ассоциативную и лимбическую территории, базирующаяся на частичной сегрегации кортикальных импульсов к striatum и поддерживаемая до некоторой степени благодаря рефлекторным дугам базальные ганглии-thalamocortex. В striatum и pallidum ? которые выглядят относительно гомогенными, это подразделение м.б. выявлено нейрохимически, в частности с помощью кальций-связывающих белков (СаВР). Их специфическое распределение в отношении стриосомальных участков и матричной компартментализации striatum помогает идентификации их функциональных территорий и м.б. частично связано с их организацией входа/выхода. У человека базальные ганглии чрезвычайно сложны и гетерогенны по своей организации, особенно в ростральных и вентральных регионах striatum? ассоциированных с лимбической системой.
Изучали нейрохимическую компартментализацию базальных ганглиев человека с помощью распределения СаВР и SMI-32.
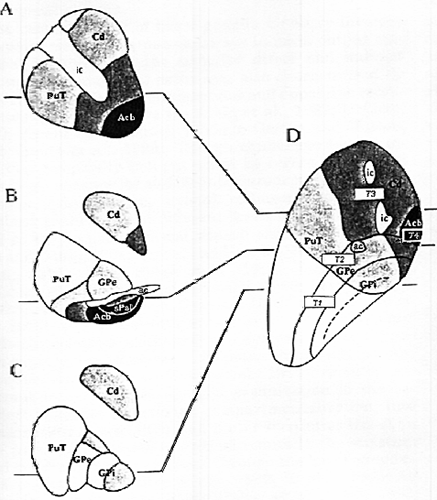
Diagramm of striatal and pallidal anatomofunctional territories in frontal (A-C) and horizontal (D) sections of human basal ganglia. The four different territiries (labeled T1-T4 in D) are represented by different gray areas, from light gray in T1 (sensoriomotor) to dark gray (limbic) territory. Abbreviations: ac - anterior commissure, Acb - accumbens nucleus, Cd - caudate nucleus, GPi,e - globus pallidus, internal and external, ic - internal capsule, PuT - putamen, sPal - subpallidal area.
Striatal compartmentalization: gradients and patch/martix organization
Striatum, особенно у человека, часто рассматривается как состоящий из двух функциональных подразделений, вентрального стриатум, ассоциированного с лимбической системой, и дорсального стриатум. В данном исследовании они были подразделены (территории Т1-Т4), как и pallidum, на функциональные территории (Рис.9 А-С).
Diagramm of striatal and pallidal anatomofunctional territories in frontal (A-C) and horizontal (D) sections of human basal ganglia. The four different territiries (labeled T1-T4 in D) are represented by different gray areas, from light gray in T1 (sensoriomotor) to dark gray (limbic) territory. Abbreviations: ac - anterior commissure, Acb - accumbens nucleus, Cd - caudate nucleus, GPi,e - globus pallidus, internal and external, ic - internal capsule, PuT - putamen, sPal - subpallidal area.
Striatal территории характеризуются повышенной matriceal PV- и SMI-32-иммунореактивностью и представляя все, кроме ростровентрального putamen (T1), соответствуют тем территориям, которые получают доминантные входящие импульсы от соматосенсорного и моторного кортекса (сенсоримоторная территория). Сходный паттерн повышенной PV-иммунореактивности описан ранее в striatum человека и обезьян, хотя у последних вентральная часть посткомиссурального putamen (PuT), соседнего с Cd, имеет более низкую PV-иммунореактивность, но более высокую СВ-иммунореактивность, и с помощью своих кортикальных соединений включаются в ассоцииативные территории. Этот дорсовентральный градиент, который обнаруживается и в талямических проекциях от centre median-parafascicular complex (CM-Pf) менее очевиден в посткомиссуральном PuT человека и м.б. связан с большей прерывистостьтю между PuT и хвостом caudate nucleus (Cd) на этом уровне по сравнению с обезьянами.
Прогрессивное снижение PV- и SMI-32-иммунореактивности нейтропилов и напротив увеличение СВ-иммунорреактивности в ростровентральной части PuT, вместе с интенсивной СВ-иммунореактивностью в большей части Cd, ограничивает второй striatal компартмент (Т2), который соответствует ассоциативной территории. Градированные изменения, наблюдаемые вдоль рострокаудальной и дорсовентральной оси PuT, такж как и дорсолатеральная часть переднего Cd, м.б. скоррелированы с градиентами corticostriatal паттернов иннервации из множественных областей из соматосенсорнорго и моторного кортекса, хотя и в варьирующей степени взаимопроникновений и перекрываний между массиванми проекций. Сходная частичная сегрегация описана и для талямический проекций с определенным предоминированием проекций от СМ (сутеку median nucleus) и вентролатеральных (VL) ядер в сенсориомоторные и из Pf и вентрально передних (VA) ядер в ассоциативные стриатальные территории. Получены и прямые доказательства конвергенции кортикальных и талямических проекций в данной территории striatum и частичная сегрегация этих проекций в сенсомоторную и ассоциативную территории.
Повышенна СВ-иммунореактивность в ростральном и вентралльном striatum, ее появление разграничивает две терриротии (Т3 и Т4), соответствующие paralimbic и limbic территориям. Они представляют ростровентральные части Cd и PuT, лучше всего характеризуемые комплементраностью высокой CR-иммунореактивности в или около участков с низкой СВ-иммунореактивностью в тесной близи с низким содержанием AChE striosomes, и acumbens nucleus (Acb), характеризующегося более сложными и менее комплементарными паттернами меркеров. Во всей области отсутствует заметная PV-иммунореактивность, но паттерн SMI-иммунореактивности вызывает дальнейшее подразделение между вентральыми частями Cd/PuT и Acb путем перехода от средне выраженной экспрессии в первых и слабаой экспрессией во втором. Паралимбические и лимбические территории совпадают с т. наз. вентральным striatum. Граница между вентральным Cd/PuT и Acb выявлена и др. авторами с др. маркерами, она согласуется с градиентом кортикальных проекций от паралимбических и лимбических областей и от талямуса, в особенности от intralaminar и midline ядер. Последние, которые предсталвены основным афферентным к Acb, проецируются также к вентральному Cd/PuT, но, по крайней мере у кошек, преимущественно у striosomal компармтент. Оба midline нейрона и их striatal мишени экспрессируют высокие уровни CR-иммунореактивности. В intralaminar ядрах, которые проецируются преимущественно в паралимбические (и ассоциативные) территории, некоторые попадают как в matrix, так и striosomes и экспрессируют как СВ-, так и CR-иммунореактивность как с центральными латеральными ядрами.
В Acb различия между латеральным (высокая СВ-иммунореактивность) и медиальным (низкая СВ-иммунореактивность)подразделами, последний обладает также большей CR-иммунореактивностью. Продолжение высокой CR-иммунореактивности из медиальной части Acb в subpallidal область, частично в amygdala (посредством пучков, идущих поза ansa lenticularis), и в гипоталямус согласуется с продолжением проекций shell Acb и с ее интеграцией в т.наз. расширенную amigdala. Продолжение плотной СВ-иммунореактивности в латеральную Acb, с др. стороны, в др. части вентрального и дорсального striatum и в ростральные pallidal сегменты согласуется с тем, что срежневая часть Acb является интегрированной частью striatum. Ее основные соединения сходны с таковыми вентрального Cd/PuT, т.е. с pallidum, substantia nigra, thalamus и кортекс, но с их более лимбически связанными областями.
Pallidal compartmentalization
И pallidum параллельные градиенты также вычленяют 4 территории. Т1 в каудальной половине наружного (GPe) и внутреннего (GPi) подразделения характеризуется повышенной PV- и SMI-32-иммунореактивностью; Т2 территория в своей ростральной половине характеризуется повышенной СВ-иммунореактивность; Т3 и Т4 на своих рлостровентральных полюсах и в subpallidal области, соотв., обе экспрессирут СВ- и CR-иммунореактивнсть? но с разными интенсивностями.
Subthalamic nucleus and substantia nigra
Subthalamic nucleus (STh) обнаруживают контрастирующие паттерны плотной PV-иммунореактивности (разделяющихся только в наиболее медиальных частях) и низкой СВ-иммунореактивность. Экспрессия CR-иммунореактивности довольно низкая, за исключением медиальной части, низкая PV-иммунореактивность, часть ядра, тогда как SMI-32-иммунореактивность на среднем уровне вдоль всего ядра. Substantia nigra характеризуется комплементарными паттернами высокой neuropil CB- и SMI-32-иммунореактивности в pars reticulata (SNr) и высокой CR-иммунореактивностью в pars compacta (SNc) и в ventral tegmental area (VTA).