|
Закладки отдельных камер сердца обнаруживаются в сердечной трубке сначала в виде утолщений миокарда, а затем в виде дивертикулов трубки. Как видно на рис.1 b атриальные и вентрикулярные дивертикулы, зачатки будущих камер сердца, располагаются вдоль кардиальной трубки в последовательных ее сегментах. | |
Дифференцировка кардиомиоцитов на атриальные и вентрикулярные происходит тогда, когда сердечная трубка уже сегментирована на атриальный (задний) и вентрикулярный (передний) домены. Экспрессия гена MyHC3 перепела оказывается ограниченной предсердиями сразу же после образования сердечной трубки. Установлено, что GATA-связывающий сайт промотора MyHC3 существенен для атриальной экспрессии промотора, тогда как vitamin D response element (VDRE) промотора необходим для ингибирования его экспресси в желудочках. Vitamin D receptor (VDR) и рецептор ретиноевой кислоты (RXα) образуют гетеродимер, который связывает VDRE промотора MyHC3 и репрессирует его активность в желудочках. Установлено, что Irx4, Iroquois homeobox ген, экспрессируется исключительно в желудочках во время эмбрионального и постнатального развития сердца, он поставляется к VDRE благодаря своему физическому взаимодействию с RXRα и ингибирует экспрессию промотора MyHC3. Этот механизм запуска камер-специфической экспрессии м. действовать и на более поздних стадиях развития сердца для пространственного ограничения экспрессии кардиальных генов.
Анализ атриа-специфической экспрессии ANF привел к идентификации двух регуляторных доменов, важных для такой экспресси. Первый находится в проксимальной части промотора и картирован в NKE, хотя активность изолированного NKE одинакова и в предсердиях и желудочках. Его мутации в промоторе ANF снижают камер-специфичную экспрессию промотора. Вышестоящая область промотора -200 -380 п.н. содержит 3 регуляторных элемента: CARE, связывающий сайт для нового транскрипционного фактора, содержащего bona fide helicase, который действует как стадио-специфических энхансер, активный преимущественно в эмбриональных, но не постнатальных миоцитах, чья активность выше в предсердиях, чем в желудочках; GATA элемент с высоким сродством к GATA-4, но не к GATA-6, не обладающих камер-специфической активностью; и составной элемент, содержащий противопоставленные сайты для Nkx2.5 и T-box содержащего транскрипционного фактора, который необходим для максимальной активности промотора в предсердиях.
Tbx5 транскрипционный фактор участвует в патогенезе синдрома Holt-Oram, он имеет паттерн экспрессии, сходный с таковым ANF. Установлено, что ANf промотор обладает 3 T-box elements (TBEs), которые связываются с высоким сродством с Tbx5 и мощно им активируются. Подтверждено, что ANF и коннексин-40 in vivo являются мишенями для Tbx5. Tbx5 нулевые эмбрионы обнаруживают тяжелую гипоплазию предсердиев. Tbx5 и Nkx2.5 abpbxtcrb взаимодействуют и синергично активируют, по крайней мере, два атриа-специфических промотора, ANF и Сх40. Оба белка формируют стабильные четвертичные комплексы на последовательностях ДНК, являющихся связывающими сайтами для этих транскрипционных факторов. Оба домена для связывания ДНК участвуют во взаимодействии, тогда как домены транскрипционной активации обоих белков необходимы для синергии. Взаимодействие этих факторов с Сх40 указывает на то, что помимо спецификации камер они участвуют в развитии и функционировании кардиальной проводящей системы животных
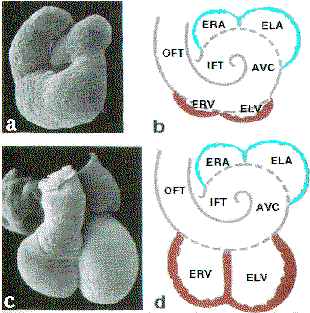
Рис.1 Образование камер сердца. Микрофотографии (а и с) и схематическое изображение (b и d) сердца эмбрионов кур на 3-й день развития (а и b), когда выявляются первые признаки камер, и на 37-й день развития в эмбриональном сердце человека с хорошо развитыми желудочками (с и d).
ERA - правое, ELA - левое эмбриональное предсердие, ELV - левый, ERV - правый эмбриональный желудочек. Атриальные сегменты показаны голубым цветом, вентрикулярные - красным, первичная сердечная трубка - серым, в ней видны фланкирующие сегменты: входной (IFT) и выходной (ЩАЕ) тракт, атриовентрикулярный канал (AVC) и ее атриальные и вентикулярные части (штриховая линия).
ERA - правое, ELA - левое эмбриональное предсердие, ELV - левый, ERV - правый эмбриональный желудочек. Атриальные сегменты показаны голубым цветом, вентрикулярные - красным, первичная сердечная трубка - серым, в ней видны фланкирующие сегменты: входной (IFT) и выходной (ЩАЕ) тракт, атриовентрикулярный канал (AVC) и ее атриальные и вентикулярные части (штриховая линия).
Fig.1. Formation of the cardiac chambers, adapted from de Jong et al.,1997). Scanning electron photomicrographs (a and c) and schematic representations (b and d) of 3-day embryonic chicken heart, where the first signs of the ventricles emerge (a and b), and of a 37-day embryonic human heart with clearly developed ventricles (c and в)
ERA indicates embryonic right atrium; ELA, embryonic left atrium; ELV, embryonic left ventricle; ERV, embryonic right ventricle. The atrial segment is indicated in blue; the ventricular segment, in red; and the primary heart tube, encompassing the flanking segments, IFT, AVC, and OFT, as well as the atrial and ventricular parts, in gray
Предшественник миокардиального кольца обнаруживается уже в сердце 5-недельного эмбриона человека. Согласно данным de Jong et al. ранние компартменты для правого и левого желудочков формируются из соседних отделов первичной сердечной трубки как результат образования миокардиальных карманов, содержащих трабекулы (Рис.1, А).
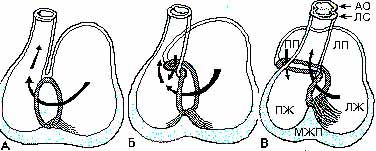
Рис.2. Формирование вентрикулярной проводящей системы, основанное на реконструкции экспрессии GIN2 в развивающемся сердце примерно на 5-ой (А), 6-ой (Б) и 7-ой (В) неделе развития. АО – аорта, ЛC – легочный ствол, ЛЖ – левый желудочек, ПЖ – правый желудочек, ЛП – левое предсердие, ПП – правое предсердие. Стрелками показано направление кровотоков в развивающемся сердце. (Модифицировано по Moorman et al., 1997 )
Межжелудочковая перегородка развивается в результате нарастания (apposition) вентрикулярных миоцитов наружной стороны в месте расположения левой межжелудочковой борозды, это приводит к образованию отверстия примерно по средине сердечной трубки, называемого первичным межжелудочковым отверстием, которое располагается между внутренним изгибом и верхушкой межжелудочковой перегородки (Рис. 2 А). Положение первичного межжелудочкого отверстия таково, что оно демаркирует вход в правый желудочек и выход из левого желудочка. Это его положение сохраняется и в полностью сформированном сердце.
В ходе формирования межжелудочковой перегородки первичный атриовентикулярный канал подразделяется в результате выростов и слияния эндокардиальных подушек. При этом правая часть атриовентрикулярного соединения оказывается физически отделенной от выхода из левого желудочка (Рис.2, Б и В). Это происходит благодаря росту тракта оттока в левую сторону так, что часть первичного межжелудочкового кольца миокарда, которая также является и частью проксимального отдела тракта оттока, расширяется влево и формирует субаортальный выход. При этом в результате роста атриовентрикулярного канала вправо, часть первичного межжелудочкого кольца миокарда, которая оказывается также частью нижнего края правого атриовентрикулярного соединения, расширяется вправо и формирует нижний край правого атриовентрикулярного соединения, где и располагается потом правый атриовентрикулярный кольцевой пучек проводящей системы.
Предполагается, что миокардиальное кольцо можно рассматривать как отдельный сегмент первичной кардиальной трубки, разделяющий зачатки двух желудочков de Jong et al.. Это миокардиальное кольцо состоит из специализированной кардиальной ткани, выполняет функцию сфинктера в сердце пока не будут сформированы клапаны. В пользу этого предположения в работе этих авторов приводятся характерные для данного сегмента отличия от миокарда обоих желудочков. С этой целью подробно рассматривается молекулярный фенотип вентрикулярной проводящей системы, производной этого миокардиального кольца (сегмента).
Mежжелудочковая борозда, первичное межжелудочковое отверстие и обрамляющее его микардиальное кольцо служат границей, разделяющей два соседних сегмента сердечной трубки, зачатки будущих левого и правого желудочков сердца. Возникающая в этом месте межжелудочковая перегородка обусловливает окончательное разделение желудочков. Труднее понять трансформацию верхней части миокардиального кольца, так как это связано с образованием самостоятельного выхода из левого желудочка, своеобразного шунта, позволяющего "перепрыгнуть" через соседний сегмент (сегмент правого желудочка). Ясно, что без образования петли сердечной трубки образование шунта для левого желудочка, невозможно. Этот процесс шунтирования происходит параллельно с формированием атриовентрикулярной перегородки, ведущего к образованию двух атриовентрикулярных отверстий и разделению кровотоков
Генетические программы для левого и правого желудочков сердца
Итак, можно предположить, что левый и правый желудочек происходят из разных сегментов сердечной трубки, более того между ними, по-видимому, вклинивается дополнительный сегмент - миокардиальное кольцо, характеризующееся экспрессией специфических миокардиальных маркеров. Следовательно, можно предполагать существование отличающихся микардиальных генетических программ и для правого и левого желудочков сердца.
Показано, что отдельные цис-регуляторные элементы контролируют экспрессию в левом и правом желудочке двух легких цепей миозина (MLC2V, MLC3F), десмина . Промоторы для десмина и MLC2V содержат также MEF2 сайт, существенный для экспрессии этих генов в развивающемся правом желудочке.
Воздействие ретиноевой кислоты на развивающиеся эмбрионы обусловливает исчезновение передних частей сердечной трубки (конусо-трункальная область, правый желудочек), это указывает на возможность выпадения целых сегментов в результате нарушения процессов их детерминации в случае нарушения распределения морфогена, контролирующего запуск сегмент-специфичных генетических программ.
Сходным образом отсутствуют сегменты сердечной трубки, даюшие правый желудочек и конусо-трункальную область у мутантных эмбрионов мыши hdf, гомозиготных по рецессивной летальной мутации, возникшей в результате инсерции трансгена в 13-ю хромосому [46]. Кроме того у этих мутантов не происходит образования эндокардиальных подушек в конусо-трункальной и атрио-вентрикулрной области. Дальнейшие исследования показали, что у hdf мышей в результате инсерции разрушен ген Cspg2, кодирующий один из компонентов внеклеточного матрикса сердечного геля, версикан.
Экспрессия другого белка ВКМ, флектина, обнаруживает не только характерную ассиметричную экспрессию вдоль лево-правосторонней оси развивающегося сердца у эмбрионов кур и мышей, но и преимущественную экспрессию в сегменте сердечной трубки, предназначенной для формирования левого желудочка сердца, во время образования кардиальной петли (см. Рис. 3).
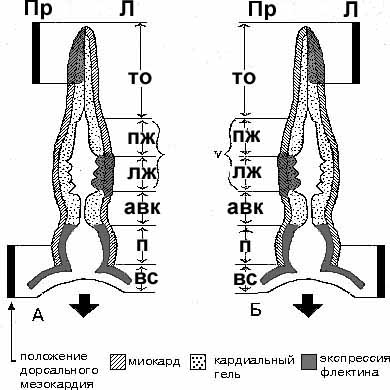

Рис. 3. Схематическое изображение трубчатого сердца на 9-й день эмбрионального развития у нормальных (А) и мутантных inv (Б) эмбрионов мыши. Продолжается линейный рост кардиальной трубки и она уже образует полностью сформированную кардиальную петлю. Кардиальный гель подвергается существенной перестройке в связи со спецификацией камер сердца. Экспрессия флексина преобладает на правой стороне тракта оттока (oft) и на левой стороне в желудочка, содержащем трабекулы (будущем левом желудочке (LV)). Диффузная экспрессия флексина обнаруживается также в субэндокардиальной области предсердия (A). Обратное распределение областей ассиметричной экспрессии флексина наблюдается у мутантов inv. Обозначения: R - правая и L – левая сторона; RV – правый желудочек сердца; AVC – атриовентрикулярный канал; SV – венозный синус (Модифицировано по Tsuda et al., 1998 ).
Следует обратить внимание на этот рисунок, так как авторы здесь четко показывают, что сегменты, предназначенные для правого и левого желудочков, расположены один за другим вдоль сердечной трубки, и что флектин в норме преимущественно экспрессируется в левой стенке левого желудочка, а у мутантов inv -/- в правой стенке левого желудочка сердца. Пока не описаны мутантны по гену флексина, но можно предположить, что как и в случае с геном версикана, процесс сегментации кардиальной трубки не будет нарушен, но нарушение его экспрессии будет сказываться на процессе формирования сердечной петли.
Подобные нарушения эмбрионального сердца наблюдаются у нулевых мутантов мыши, гомозиготных по гену
(Zammit et al., 1999)
КАМЕР-СПЕЦИФИЧЕСКАЯ ЭКСПРЕССИЯ КАРДИАЛЬНЫХ ГЕНОВ
(Zammit et al., 1999)
Установлено, что 3 миозиновых гена (a-миозиновая тяжелая цепь (МНС), миозиновая легкая цепь (MLC) 1А и MLC2A) ограничивают свою экспрессию предсердиями в период между E12.5 и рождением, в результате подавления их экспрессии в компактном миокарде сначала в левом, а потом и в правом желудочке. Транскрипционые факторы dHAND и eHAND экспрессируются в правом и левом желудочках соотвественно. Подавление экспрессии a-MHC, MLC1A, MLC2A у эмбрионов iv/iv с аномальным лево-правосторонним паттерном начинается в морфологически левом (системном) желудочке независимо от его анатомического положения.
Лево-правосторонние транскрипционные различия относятся к компактному миокраду желудочков. Подавление MLC1A, MLC2A и α-MHC в трабекулированном миокарде происходит эквивалентно слева и справа. Компактный и трабекулированный миокард находятся под разным генетическим контролем, имеют разные миокардальные свойства и экспрессируют разные уровни кардиальных генов. лево-правосторонний паттерн регианализованной экспрессии трансгенов, напротив, стремятся распространиться как на компактную, так и трабекулированную зоны либо левого, либо правого желудочков. Транскрипционные различия между левым и правым предсердиями также были описаны для некоторыхтрансгенов (Biben et al., 1996; Kelly et al., 1998).
В противоположность временно регионализованной экспрессии эндогенных генов, трансгены обладают левой или правой камер-специфичностью экспрессии, например, содержащие регуляторные последовательности от генов MLC3F, a-cardiac actin или MLC2V, которые экспрессируются регионализовано в течение всего развития и у взрослых. В случае MLV3F эндогенный ген обнаруживает преходящие лево-правостронии различия в экспресси в желудочках во время развития, которые стабильно сохраняются с помощью MLC3F трансгенов, указывая, что цис-действующие модули отсутствующие в трансгене могут обеспечивать временной контроль транскрипции MLC3F. Преходящая природа эндогенных лево-правосторонних вентрикулярных отличий указывает на то, что регуляторные элементы, которые поддерживают экспрессию генов без лево-правосторонней камер-специфичности могут маскировать региональные регуляторные элементы. Следовательно, временно и пространственной экспрессии паттерны кардиальных генов контролируются серией отличных транскрипционных программ, опрерирующих через посредство различных регуляторных элементов.
Транскрипция в кардиомиоцитах находится под комбинационным котролем различных транс-действующих факторов. dHAND и eHAND экспресируются в сердце мыши на ст Е10.5. На ст. Е14.5 eHAND сохраняет экспрессию на низком уровне в левом желудочке, тогда как dHAND сохараняет экспрессию в правом желудочек и обоих предсердиях. Его паттерн экспресии очень сходен с распределением α-MHC, MLC1A, MLC2A во время этого периода, что предполагет прямое участие его в регионализацию нижестоящих генов. dHAND и eHAND играют существенную роль в раннем развитии сердца. недавно показано, что шкщйгщшы-родственный гомеобоксный ген Irx4 участвует в супрессии экспрессии гена атриальной миозиновой тяжелой цепи (АМНС1) в желудочках кур. Irx4 ,по-видимому, экспресируется в обеих камерах желудочков, несмотря на это модуляция Irx4 активности в левой и правой камерах могут вносить преходящую камер-специфическую экспрессию, наблюдаеую в сердце мышей. Возможно, что лево-правосторонние отличия, наблюдаемые на уровне мРНК возникают пост-транскрипционно, тогда как гетерогенность lacZ транскриптов у трансгенных мышей м.б. связана с транскрипционными механизмами.
На курах было показано, что правый (пульмональный)и левый (системный) желудочки возникают вдоль переднезадней оси сердечной трубки. Образование кардиальной петли помещает эти АР паттернированные единицы в лево-правостроннюю ориентацию (Kelly et al., 1999). Следовательно, спецификация камер происходит до оразования петли. в отсутствие нормальрного образования эмбриональной лево-парвостронней оси подавление активности α-MHC, MLC1A, MLC2A на ст Е12.5 происходит в левом (системном желудочке независимо от направления кардиальной петли.
Это указывает на то, что лево-правосторонние отличия в уровнях транскриптов миозинов являются камер-специфическими и возникают у эмбрионов в ответ на формирование передне-заднего паттерна сердечной трубки скорее, чем в ответ на лево/правосторонние сигналы от латеральной мезодермы, которые находятся ниже динейна (dynein)гена, дефектного у iv/iv эмбрионов, т.е. до образование кардиальной петли. У inv мутантных мышей, у которых левостороннее направление образовния сердечной петли результат situs inversus, dHAND и eHAND транскрипты обнаруживают специфичность к морфологически правому (пульмональному) и левому (системному) соответственно, специфичность, которая отражает раннюю регионализацию этих транскриптов вдоль линейной трубки сердца.
В постнатальном сердце левое и правое предсердия и желудочки морфологически и функционально отличны: правый желудочек, напр., способен справляться с нагрузкой высоким объемом, но не с нагрузкой высоким давлением, напротив левый желудочек. Во взрослом сердце крыс соотношение V1(α-MHC гомодимер)/V3(β-MHC гомодимер)выше в папилярных мышцах правого желудочка, чем левого. Ряд саркомерных генов, по нашим данным, дифференциально экспрессируется между левым и правым желудочком во время эмбриогенеза. Данные представленные в этой работе показывают, что α-МНС транскрипты и белок накапливаются в компактном миокарде развивающегося правого, но не левого желудочка, тoгда как β-MHC транскрипты и белок униформно экспрессируются в желудочках. Асимметричное распределение α-MHC белка обусловливат, по-видимому, различия контрактильных свойств компактного миокарда правого желудочка (который экспрессирует обе изоформы) и левого ( в котором только β-MHC изоформа), напротив левые и правые трабекулы ко-экспрессируют оба гена. Эти временные камер-специфические паттерны экспрессии могут коррелировать с выполнением кардиальной функции in utero.
Данный вопрос рассмотрен также в работе
Мглинец, 1999

The left image is of an embryonic mouse heart, showing the four chambered structure with atria at the top and ventricles at the bottom. The right image is the fluorescent lineage tracing reporter, showing that our newly discovered progenitor cell population contributes specifically to the ventricular chambers of the heart. Credit: Mount Sinai Health System
См.также Сегментация вентрикулярной области.
Evan Bardot, Damelys Calderon, Francis Santoriello, et al. Foxa2 identifies a cardiac progenitor population with ventricular differentiation potential. Nature Communications, 2017; 8: 14428

The left image is of an embryonic mouse heart, showing the four chambered structure with atria at the top and ventricles at the bottom. The right image is the fluorescent lineage tracing reporter, showing that our newly discovered progenitor cell population contributes specifically to the ventricular chambers of the heart. Credit: Mount Sinai Health System
Исследователи из Mindich Child Health and Development Institute at the Icahn School of Medicine at Mount Sinai установили, что в раннем развитии существует популяция клеток, предназначенная давать камеры желудочков.
ВПС один из наиболее широко распространенных врожденных дефектов, затрагивающий 35000 детей в США ежегодно, согласно U.S. Department of Health and Human Services. Многие из этих дефектов возникают, когда формируются камеры сердца. Поскольку довольно много известно о развитии сердца, но образование 4-х камер сердца до конца непонятно.
Используя модель для отслеживания клеточных клонов у мышей, исследователи изучили ген, кодирующий белок Foxa2, прежде всего ассоциированный с развитием энтодермы и эктодермы во время эмбриогенеза. Они выявили популяцию, экспрессирующую Foxa2 во время раннего развития, дающую сердечно-сосудистые клетки для левой и правой камер желудочков, но не для предсердий. Их исследование показало, что расхождение на предсердия и желудочки может происходить задолго до морфологического становления дифференцированных кардиальных структур.
"Более глубокое понимание формирования камер сердца д. позволить нам лучше постигать биологию, лежащую в основе вредных дефектов сердца," говорит ведущий исследователь Nicole Dubois, PhD, Assistant Professor in the Department of Cell, Developmental and Regenerative Biology at the Icahn School of Medicine at Mount Sinai. "Мы надеемся, что эти находки позволят создать новые протоколы для генерации кардиомиоцитов желудочков в культурах клеток, которые в принципе могут быть использвоаны для разработки терапевтических подходов."
"Пока мы знаем всё ещё недостаточно об этой популяции или функции Foxa2 во время формирования сердца, но мы полаем, что эти находки предоставят мощную новую систему, чтобы ответить на некоторые наиболее важные открытые вопросы, как происходит раннее развитие сердца," сказал Evan Bardot.