COFACTORS of NUCLEAR RECEPTORS
КОФАКТОРЫ ЯДЕРНЫХ/СТЕРОИДНЫХ РЕЦЕПТОРОВ
|
Nuclear receptor cofactors as chromatin remodelers Bryan D Lemon, Leonard P Freedman
Current Opinion in Genetics & Development 1999, 9:499-504. |
CTD—carboxy-terminal domain;
ER—estrogen receptor;
HAT—histone acetyltransferase;
HDAC—histone deacetylase;
GR—glucocorticoid receptor;
LBD—ligand-binding domain;
MMTV—mouse mammary tumor virus;
PIC—pre-initiation complex;
PLZF—promyelocytic leukemia-associated zinc finger;
PML—promyelocytic leukemia;
Pol II—RNA polymerase II;
PPAR γ —peroxisome proliferator-activated receptor γ ;
PR—progesterone receptor;
RAR—retinoic acid receptor;
RXR—retinoid X receptor;
TR—thyroid hormone receptor;
VDR—vitamin D3 receptor.
Ядерные рецепторы представляют собой очень большое семейство индуцируемых лигандами транскрипционных факторов. Ядерные рецепторы соединяются селективно с ДНК — первоначально как димеры через посредство двух характерных zinc-finger модулей и области димеризации, которая управляет само-взаимодействием или взаимодействием с другим партнером. Более того они обладают трансактивационными функциями (transactivation functions (AFs)), которые могут независимо награждать активационным потенциалом домены связывания гетерологичной ДНК. Трансактивация обеспечивается как конституитивными, так и индуцибельными AFs (AF-1 и AF-2, соответственно;
Fig. 1),из которых последние характеризуются своей интегральной локализацией в лиганд-связывающем домене (ligand-binding domain (LBD)).
Luger K, Mäder AW, Richmond RK, Sargent DF, Richmond TJ:
Crystal structure of the nucleosome core particle at 2.8 Å resolution.
Nature
1997,
389:
251–260.
Kayne PS, Kim U, Han M, Mullen JR, Yoshizaki F, Grunstein M:
Extremely conserved histone H4 N terminus is dispenable for growth but essential for repressing the silent mating loci in yeast.
Cell
1988,
55:
27–39.
Megee PC, Morgan BA, Miltman BA, Smith MM:
Genetic analysis of histone H4: essential role of lysines subject to reversible acetylation.
Science
1990,
247:
841–845.
Sheridan PL, Mayall TP, Verdin E, Jones KA:
Histone acetyltransferases regulate HIV-1 enhancer activity in vitro.
Genes Dev
1997,
11:
3327–3340.
Côté J, Peterson CL, Workman JL:
Perturbation of nucleosome core structure by the SWI/SNF complex persists after its detachment, enhancing subsequent transcription factor binding.
Proc Natl Acad Sci USA
1998,
95:
4947–4952.
Nightingale KP, Wellinger RE, Sogo JM, Becker PB:
Histone acetylation facilitates RNA polymerase II transcription of the Drosophila hsp26 gene in chromatin.
EMBO J
1998,
17:
2865–2876.
Kamei Y, Xu L, Heinzel T, Torchia J, Kurokawa R, Gloss B, Lin SC, Heyman RA, Rose DW, Glass CK, Rosenfeld MG:
A CBP integrator complex mediates transcriptional activation and AP-1 inhibition by nuclear receptors.
Cell
1996,
85:
403–414.
Onate SA, Tsai SY, Tsai MJ, O'Malley BW:
Sequence and characterization of a co-activator for the steroid hormone receptor superfamily.
Science
1995,
270:
1354–1357.
••
Mclnerney EM, Rose DW, Flynn SE, Westin S, Mullen T-M, Krones A, Inostroza J, Torcia J, Assa-Munt N, Milburn MV et al.:
Determinants of coactivator LXXLL motif specificity in nuclear receptor transcriptional activation.
Genes Dev
1998,
12:
3357–3368.
••
Kraus WL, Kadonaga JT:
p300 and estrogen receptor cooperatively activate transcription via differential enhancement of initiation and reinitiation.
Genes Dev
1998,
12:
331–342.
Xu L, Glass CG, Rosenfeld MG:
Coactivator and corepressor complexes in nuclear receptor function.
Curr Opin Genet Dev
1999,
9:
140–147.
Chen H, Lin RJ, Schiltz RL, Chakravarti D, Nash A, Nagy L, Privalsky ML, Nakatani Y, Evans RM:
Nuclear receptor coactivator ACTR is a novel histone acetyltransferase and forms a multimeric activation complex with P/CAF and CBP/p300.
Cell
1997,
90:
569–580.
Spencer TE, Jenster G, Burcin MM, Allis CD, Zhou J, Mizzen CA, McKenna NJ, Onate SA, Tsai SY, Tsai M-J, O'Malley BW:
Steroid receptor coactivator-1 is a histone acetyltransferase.
Nature
1997,
389:
194–198.
Nagy L, Kao HY, Chakravarti D, Lin RJ, Hassig CA, Ayer DE, Schreiber SL, Evans RM:
Nuclear receptor repression mediated by a complex containing SMRT, mSin3A, and histone deacetylase.
Cell
1997,
89:
373–380.
Heinzel T, Lavinsky RM, Mullen T-M, Söderström M, Laherty CD, Torchia J, Yang W-M, Brard G, Ngo SD, Davie JR et al.:
A complex containing N-CoR, mSin3 and histone deacetylase mediates transcriptional repression.
Nature
1997,
387:
43–48.
Alland L, Muhle R, Hou HJ, Potes J, Chin L, Screiber-Agus N, DePinho RA:
Role for N-CoR and histone deacetylase in Sin3-mediated transcriptional repression.
Nature
1997,
387:
49–55.
Kouzarides T:
Histone acetylases and deacetylases in cell proliferation.
Curr Opin Genet Dev
1999,
9:
40–48.
Gu W, Roeder RG:
Activation of p53 sequence-specific DNA binding by acetylation of the p53 C-terminal domain.
Cell
1997,
90:
595–606.
Hung HL, Lau J, Kim AY, Weiss MJ, Blobel GA:
CREB-binding protein acetylates hematopoietic transcription factor GATA-1 at important residues.
Mol Cell Biol
1999,
19:
3496–3505.
Imhof A, Yang XJ, Ogryzko VV, Nakatani Y, Wolffe AP, Ge H:
Acetylation of general transcription factors by histone acetyltransferases.
Curr Biol
1997,
7:
689–692.
•
Utley RT, Ikeda K, Grant PA, Côté J, Steger DJ, Eberharter A, John S, Workman JL:
Transcriptional activators direct histone acetyltransferase complexes to nucleosomes.
Nature
1998,
394:
498–502.
Freedman LP:
Increasing the complexity of coactivation in nuclear receptor signalling.
Cell
1999,
97:
5–8.
•
Kawasaki H, Eckner R, Yao T-P, Taira K, Chiu R, Livingston DM, Yokoyama KK:
Distinct roles of the co-activators p300 and CBP in retinoic-acid induced F9-cell differentiation.
Nature
1998,
393:
284–289.
vom Baur E, Harbers M, Um S-J, Benecke A, Chambon P:
The yeast Ada complex mediates the ligand-dependent activation function of retinoid-X and estrogen receptors.
Genes Dev
1998,
12:
1278–1289.
Grignani F, De Matteis S, Nervi C, Tomassoni L, Gelmetti V, Cioce M, Fanelli M, Ruthardt M, Ferrara FF, Zamir I et al.:
Fusion proteins of the retinoic acid receptor-alpha recruit histone deacetylase in promyelocytic leukaemia.
Nature
1998,
391:
815–818.
••
He L-Z, Guidez F, Tribioli C, Peruzzi D, Ruthardt M, Zelent A, Pandolfi PP:
Distinct interactions of PML-RARαand PLZF-RARαwith corepressors determine differential responses to RA in APL.
Nat Genet
1998,
18:
126–135.
•
Lin RJ, Nagy L, Inoue S, Shao W, Miller WH Jr, Evans RM:
Role of the histone deacetylase complex in acute promyelocytic leukaemia.
Nature
1998,
391:
811–814.
Carlson M, Laurent BC:
The SNF/SWI family of global transcriptional activators.
Curr Biol
1994,
6:
396–402.
Côté J, Quinn J, Workman JL, Peterson CL:
Stimulation of GAL4 derivative binding to nucleosomal DNA by the yeast SWI/SNF complex.
Science
1994,
265:
53–60.
Imbalzano AN, Kwon H, Green MR, Kingston RE:
Facilitated binding of TATA-binding protein to nucleosomal DNA.
Nature
1994,
370:
481–485.
Wang W, Xue Y, Zhou S, Kuo A, Cairns BR, Crabtree GR:
Diversity and specialization of mammalian SWI/SNF complexes.
Genes Dev
1996,
10:
2117–2130.
Schnitzler G, Sif S, Kingston RE:
Human Swi/SNF interconverts a nucleosome between its base state and a stable remodeled state.
Cell
1998,
94:
17–27.
Guyon JR, Narlikar GJ, Sif S, Kingston RE:
Stable remodeling of tailless nucleosomes by the human SWI-SNF complex.
Mol Cell Biol
1999,
19:
2088–2097.
Yoshinaga SK, Peterson CL, Herskowitz I, Yamamoto KR:
Roles of SWI1, SWI2 and SWI3 proteins for transcriptional enhancement by steroid receptors.
Science
1992,
258:
1598–1604.
Muchardt C, Yaniv M:
A human homologue of Saccharomyces cerevisiae SNF2/SWI2 and Drosophila brm genes potentiates transcriptional activation by the glucocorticoid receptor.
EMBO J
1993,
12:
4279–4290.
Ichinose H, Garnier JM, Chambon P, Losson R:
Ligand-dependent interaction between the estrogen receptor and the human homologues of SWI2/SNF2.
Gene
1997,
188:
95–100.
Sumi-Ichinose C, Ichinose H, Metzger D, Chambon P:
SNF2β-BRG1 is essential for the viability of F9 murine embryonal carcinoma cells.
Mol Cell Biol
1997,
17:
5976–5986.
Beato M, Sanchez-Pacheo A:
Interaction of steroid hormone recptors with the transcription initiation complex.
Endocrine Reviews
1996,
17:
587–609.
•
Fryer CJ, Archer TK:
Chromatin remodelling by the glucocorticoid receptor requires the BRG1 complex.
Nature
1998,
393:
88–91.
Kornberg RD, Lorch Y:
Chromatin modifying and remodeling complexes.
Curr Opin Genet Dev
1999,
9:
148–151.
Ito T, Bulger M, Pazin MJ, Kobayashi R, Kadonaga JT:
ACF, an ISWI-containing and ATP-utilizing chromatin assembly and remodeling factor.
Cell
1997,
90:
145–155.
Varga-Weisz PD, Wilm M, Bonte E, Dumas K, Mann M, Becker PB:
Chromatin-remodelling factor CHRAC contains the ATPases ISWI and topoisomerase II.
Nature
1997,
388:
598–602.
••
LeRoy G, Orphanides G, Lane WS, Reinberg D:
Requirement of RSF and FACT for transcription of chromatin templates in vitro.
Science
1998,
282:
1900–1904.
Tsukiyama T, Wu C:
Purification and properties of an ATP-dependent nucleosome remodeling factor.
Cell
1995,
83:
1011–1020.
Mizuguchi G, Tsukiyama T, Wisniewski J, Wu C:
Role of nucleosome remodeling factor NURF in transcriptional activation of chromatin.
Mol Cell
1997,
1:
141–150.
•
Xue Y, Wong J, Moreno GT, Young MK, Côté J, Wang W:
NURD, a novel complex with both ATP-dependent chromatin-remodeling and histone deacetylase activities.
Mol Cell
1998,
2:
851–861.
•
Zhang Y, LeRoy G, Seelig HP, Lane WS, Reinberg D:
The dermatomyositis-specific autoantigen Mi2 is a component of a complex containing histone deacetylase and nucleosome remodeling activities.
Cell
1998,
95:
279–289.
•
Rachez C, Suldan Z, Ward J, Chang CP, Burakov D, Erdjument Bromage H, Tempst P, Freedman LP:
A novel protein complex that interacts with the vitamin D3 receptor in a ligand-dependent manner and enhances VDR transactivation in a cell-free system.
Genes Dev
1998,
12:
1787–1800.
••
Rachez C, Lemon BD, Suldan Z, Bromleigh V, Gamble M, Näär AM, Erdjument-Bromage H, Tempst P, Freedman LP:
Ligand-dependent transcription activation by nuclear receptors requires the DRIP complex.
Nature
1999,
398:
824–828.
Fondell JD, Ge H, Roeder RG:
Ligand induction of a transcriptionally active thyroid hormone receptor coactivator complex.
Proc Natl Acad Sci USA
1996,
93:
8329–8333.
Kingston RE:
A shared but complex bridge.
Nature
1999,
399:
199–200.
Hampsey M, Reinberg D:
RNA polymerase II as a control panel for multiple coactivator complexes.
Curr Opin Genet Dev
1999,
9:
132–139.
••
Näär AM, Beaurang PA, Zhou S, Abrahams A, Solomon W, Tjian R:
Composite coactivator ARC mediates chromatin-directed transcriptional activation.
Nature
1999,
398:
828–832.
•
Sun X, Zhang Y, Cho H, Rickert P, Lees E, Lane W, Reinberg D:
NAT, a human complex containing Srb polypeptides that functions as a negative regulator of activated transcription.
Mol Cell
1998,
2:
213–222.
•
Ito M, Yuan C-X, Malik S, Gu W, Fondell JD, Yamamura S, Fu Z-Y, Zhang X, Qin J, Roeder RG:
Identity between TRAP and SMCC complexes indicates novel pathways for the function of nuclear receptors and diverse mammalian activators.
Mol Cell
1999,
3:
361–370.
•
Boyer TG, Martin MED, Lees E, Ricciardi RP, Berk AJ:
Mammalian Srb/Mediator complex is targeted by adenovirus E1A protein.
Nature
1999,
399:
276–279.
Kim Y-J, Bjorkland S, Li Y, Sayre MH, Kornberg RD:
A multiprotein mediator of transcriptional activation and its interaction with the C-terminal repeat domain of RNA Polymerase II.
Cell
1994,
77:
599–608.
•
Jiang YW, Veschambre P, Erdjument-Bromage H, Tempst P, Conaway JW, Conaway RC, Kornberg RD:
Mammalian mediator of transcriptional regulation and its possible role as an end-point of signal transduction pathways.
Proc Natl Acad Sci USA
1998,
95:
8538–8543.
•
Ryu S, Zhou S, Ladurner AG, Tjian R:
The transcriptional co-factor complex CRSP is required for activity of the enhancer-binding protein Sp1.
Nature
1999,
397:
446–450.
Wong J, Patterton D, Imhof A, Guschin D, Shi Y-B, Wolf AP:
Distinct requirements for chromatin assembly in transcriptional repression by thyroid hormone receptor and histone deacetylase.
EMBO J
1998,
17:
520–534.
•
Armstrong JA, Bieker JJ, Emerson BM:
A SWI/SNF-related chromatin remodeling complex, E-RC1, is required for tissue-specific transcriptional regulation by EKLF in vitro.
Cell
1998,
95:
93–104.
|
Лиганды для ядерных рецепторов включают стероиды, ретиноиды, витамин D, тироидный гормон, простаноиды и холестероловые метаболиты, такие как оксистеролы и желчные кислоты. Их комбинированные эффекты огромны, они влияют буквально на каждый фундаментальный биологический процесс, от развития и гомеостаза до клеточной пролиферации и дифференцировки. Например, ретиноиды и витамин D3 являются мощными ингибиторами роста, в частности клеток иммунного и гематопоэтического клонов. Кроме того, PPARγ(peroxisome proliferator-activated receptor γ)лиганды обладают замечательным эффектом по индукции дифференцировки адипоцитов.
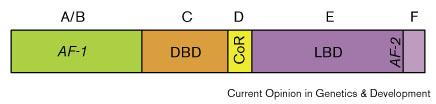 | Рис. 1 Функциональные домены ядерных рецепторов. A/B и F домены варьируют в размере и по первичным последовательностям в своем сверхсеместве. 'CoR', означающий корепрессор-связывающий сайт, присутствует в некоторых ядерных рецепторах. 'AF-1' и 'AF-2' означают две отдельные активационные функции (see text).
Figure 1 Functional domains of nuclear receptors. A/B and F domains vary in size and primary sequence among the superfamily. 'CoR' refers to the corepressor-binding site present in some nuclear receptors. 'AF-1' and 'AF-2' refer to two distinct activation functions (see text). |
Histone-modifying cofactors
Клеточная ДНК упакована в хроматин с помощью повторяющихся наборов белок–DNA комплексов, из которых минимальными и недавно криталлографически определенными единицами являются нуклеосомы, состоящие из гистоновой октамерной оболочки, покрывающей 146 п.н. ДНК [1]. На дрожжах получены первые доказаетельства того, как хроматин может регулироваться, чтобы контролировать транскрипцию. [2] [3]. Было предположено, что гиперацетилирование гистонов способствует 'open' транскрипционно активному состоянию, а гипоацетилирорвание - 'closed' транскрипционно репрессированное состояние. Большинство белков идентифицирорвано как скрывающие histone acetyltransferase (HAT) или deacetylase (HDAC) активность и как было предположено, действуют ремодулируя хроматин. Если ингибиторы деацетилазы, такие как Trichostatin-A или butyrate используются клетками или in vitro, то хроматин дерепрессируется и увеличивается транскрипция [4] [5] [6].
Выделен ряд транскрипционных 'coactivators' и 'corepressors' ядерных рецепторов и показано их взаимодействие с рецепторами дрожжей, клеток млекопитающих и экстрактов in vitro. Некоторые из этих индивидуальных белков обнаруживают существенные транскрипционные эффекты при избыточной или недостаточной их экспрессии в клетках (в частности CBP [7] и SRC-1/NCoA-1 [8] [9••]) или биохимически in vitro (p300 [10••]), становится ясно, что они ассоциируют с другими полипептидами, большинство из которых первоначально было идентифицировано как белки непосредственно взаимодействующие с ядерными рецепторами. К коактиваторам относятся pCAF/GCN5, p/CIP/AIB1/ACTR, и GRIP-1/TIF2 ([11]; см. [12] [13]). Интересно, что у этих белков выявлена внутренне присущая им HAT активность. Корепрессоры N-CoR и SMRT были обнаружены как часть большого комплекса, содержащего Sin3-A и -B, rpd3/HDAC-1 и -2, последний обладает HDAC активностью [14] [15] [16]. Следовательно, эти белки могут действовать совместно, модифицируя гистоновые хвосты и тем самым дестабилизируя или стабилизируя хроматин ([11] [17]). Было установлено, что одни и те же белки модифицируют некоторые трансактиваторы непосредственно — включая p53 [18] и GATA-1 [19] — а также как компоненты общей транскрипционной махинерии ( machinery) [20], их непосредственная роль в ремоделировании хроматина остается неизвестной и может ограничиваться модулированием сродства целевых сайтов в локальном содержимом хроматина. Тем не менее эти комплексы могут быть связаны с дрожжевыми GCN5-содержащими SAGA, ADA, NuA3 и NuA4 HAT комплексами, которые управляют хроматин-зависимой транскрипцией с помощью избирательных активаторов in vitro в ответ на экзогенно добавленный acetyl-coenzyme A [21•].
Биологическое значение большинства из этих гистон-модифицирующих кофакторов остается неясным [22], интересные сообщения [23•], описывающие роль p300, но не CBP, как при ретиноид-зависимой дифференцировке и при активации p21-гена в клетках тератокарциномы F9. Выявлена также роль CBP, го не p300, в регуляции p27 гена. Выявоена потребность в p300 и CBP в стимуляции индуцируемого ретиноидами апоптоза [23•]. Кроме того описана роль дрожжевого ADA комплекса в лиганд-зависимой трансактивации с помощью tethered retinoid X receptor (RXR)- и ER-LBDs [24]. Ассоциация рецептора ретиноевой кислоты (RAR) с хромосомной транслокационной мутацией, такой как promyelocytic leukemia (PML)–RARαи PLZF–RAR α, с HDAC комплексом и диссоциацией последнего лиганд-регулируемым способом коррелирует с их онкогенным потенциалом и эффективностью лечения ретиноидами при острой промиэлоцитной лейкемией, и подтверждает нарушения ацетилирования хромтина target генов как этиологического потенциала этой болезни [25] [26••] [27•].
ATP-dependent remodeling cofactors
В дополнение к HAT и HDAC-содержащим активностям, найдены комплексы, содержащие ATP-зависимые активности ремоделирования хроматина — которые как ожидается продуцируют более существенные перестройки хроматина — и которые связаны со стероидными и ядерными рецепторами. У дрожжей идентифицирована группа генных продуктов, SNF/Swi, которые редуцируют экспрессию SUC2 и HO генов, участвующих в ферментации sucrose (SNF: sucrose nonfermenting)и в переключении типа спаривания (Swi); тогда как SIN или switch-независимые мутации, были идентифицированы среди супрессоров этих генов становитьтся гистонами и другими хроматин-ассоциированными белками (reviewed in [28]). SNF2/Swi2 гомологи были затем найдены у Drosophila (Brahma) и в клетках млекопитающих (hbrm and BRG-1) [28]. Очищенные мультисубъединицы SNF/Swi комплексов содержат ДНК-зависимую ATPase активность, внутренне присущую SNF2/Swi2, которая одновременно разрушает нуклеосомы и усиливает связывание транскрипционных факторов [29] [30]. Очистка hbrm и BRG-1 указывает на то, что они присутствуют в отдельных комплексах млекопитающих, ассоциированных с селективными BRG-1-associated factors (BAFs) [31]. ATP-зависимое ремоделирование с помощью этих комплексов происходит независимо от гистоновых хвостов и персистирует как после удаления ATP так обратимо после повторного добавления SNF/Swi in vitro [32] [33].
Ранее выявленна связь SNF/Swi с опосредованной ядерными рецепторами транскрипцией при потере стороидом-индуцированной активации репортерного гена с помощью глюкокортикоидного рецептора (GR) и ER у Swi-1–3-мутантных дрожжей [34]. Кроме того, при избыточной экспрессии в клетках hbrm кооперирует с транфицированным GR в клеточных линиях млекопитающих, лишенных эндогенного hbrm [35] а ER взаимодействует как с hbrm так и BRG-1 у дрожжей в двугибридных экспериментах [36]. Более того, условные BRG-1 нокаутные F9 клеточные линии нежизнеспособны, тогда как гетерозигготные линии не пролиферируют, оставаясь чувствительными к ретиноевой кислотой индуцированной дифференцировке [37].
Одна из интенсивно изучаемых моделей лиганд-зависимых пертрубаций структуры хроматина при формировании пре-иниационных комплексов (PIC), а также антогонизм между прогестероновыми и глюкокортикоидными рецепторами (PR and GR), has been the integrated composite MMTV (mouse mammary tumor virus) promoter/enhancer (reviewed in [38]). Временно трансфицированная MMTV ДНК активируется с помощью PR лигандов; Однако, случайная интеграция той же самой ДНК в геном млекопитающих с одновременной упаковкой в фазовый array хроматина элиминирует PR-зависимую активацию генов с помощью preclusion of binding-site accessibility. Геномная интеграция MMTV ДНК также индуцирует прогестин-специфическую репрессию глюкокортикоидом-опосредованной транскрипции и указывает на конкуренцию за общие молекулярные мишени.Одна из моделей описывает эту конкуренцию, обеспечиваемую BRG-1 [39•]. Интересно, что прогестины и анти-прогестины ингибируют GR стимуляцию интегрированной MMTV ДНК и снижает ее ассоциацию с лимитированными количествами BRG-1. Те же самые соединения были неспособны ни редуцировать трансактивацию временно трансфицированных промоторов ни способны дестабилизировать GR взаимодействия с p160 коактиваторами NCoA-1/SRC-1 и NCoA-2/GRIP-1, а также с p300. Таким образом, наблюдаемый 'squelching' был функцией рекрутирования ремоделированных комплексов и, по-видимому, не через ассоциацию с другими комплексами коактиваторов и может отражать инициальный порог связывания для target-site accessibility.
Помимо SNF/Swi, выделены и другие ATP-зависимые комплексы ремоделирования, вклчая отдельный RSC комплекс и сходное семейство комплексов, которые гомологичны SNF2/Swi2-related ISWI ATPase, а именно Drosophila комплекс нуклеосомы моделирующий фактор (nucleosome remodeling factor (NURF)), ACF, и CHRAC и комплекс RSF у человека (см. обзор [40]). ISWI-содержащие комплексы очищены биохимически на основе их способности катализировать сборку нуклеосомной ДНК (ACF [41]),физиологически по space salt- or polyglutamate-deposited nucleosomes (ACF [41], CHRAC [42], RSF [43••]), enhance-transcription-factor binding (NURF [44]), и по увеличению транскрипции с нуклеосомных матриц in vitro (NURF [45]; RSF [43••]). Недавно обнаружены и другие АТФ-зависимые ремоделирующие активности, ассоциированные с HDAC-содержащими комплексами, NURD, которые также содержат субъединицу с ограниченной гомологией с N-CoR — MTA-1 [46•] [47•]. Антитела против CHD4/Mi-2 ATPase субъединицы NURD частично усиливают лиганд-независимую TR/RXR репрессию TR βA промотора у Xenopusооцитов при микроинъекциях [46•]. Однако прямой связи для RSC или ISWI-содержащих комплексов с передачей сигналов стероидными и ядерными рецепторами не установлено, ух участие в ремоделировании хроматина указывает на их вовлечение в лиганд-индуцируемую транскрипцию по крайней мере субнабора генов-мишенй.
General coactivator complexes Недавно открыты комплексы из многих субъединиц, которые связываются с рецептором витамина D (VDR) [48•] [49••], рецептором тироидного гормона (TR) [50] и, наиболее вероятно, со многими другими членами семейства стероид/ядерных рецепторов, это подчеркивает распространенность трансактивации (см.обзоры [51] [52]). Этот комплекс, известный как TRAP, DRIP, или ARC, рекрутируется ядерными рецепторами LBD AF-2 в ответ на связывание лиганда через посредство одиночной субъединицы (DRIP205/TRAP220). Эта субъединица, однако, является , по-видимому, якорем для дополнительного белка 13–15, входящего в комплекс DRIP/TRAP/ARC , следовательно, conferring hormone-dependent recruitment of what appears to be a preformed complex [49••]. Общераспространенность этого комплекса обнаруживается тем, что другие активаторы, не связанные во стероид/ядерными рецепторами, такие как VP16, p65 субъединица NF κB, и SREBP-1a, рекрутируют DRIP/TRAP/ARC комплекс [53••] и что многие из DRIP/TRAP/ARC субъединиц присутствуют в трех сходных, еще не идентифицированных SRB-ассоциированных комплексах, NAT, SMCC, и SRB/Mediator млекопитающих, последний выбирается аденовирусом E1A [54•] [55•] [56•]. Эти родственные комплексы необходимы для транскрипционной активации одними и теми же активаторами. За одним важным исключением [55•], DRIP/TRAP/ARC, по-видимому, усиливает транскрипцию селективно с хроматин-организованных матриц, тогда как он репрессирует транскрипцию с голой ДНК матрицы ([54•] [56•]; AM Näär, BD Lemon, unpublished observations). Наблюдение Ito et al. [55•] [56•],указывает, что и другие неопределенные актвности заставляют DRIP/ARC/TRAP функционирповать на голой матрице. По крайней мере 7 субъединиц, описанные как гомологи белков компонентов Mediator, комплекса, необходимого для транскрипции в дрожжевой модельной системе in vitro и вместе с SRBs, способного ассоциировать с дроржжевой RNA polymerase II (Pol II) через посредство С-концевого повторяющегося (carboxy-terminal repeat domain (CTD)) ее большой субюъединицы [57]. Сходный комплекс ассоциирует с Pol II CTD млекопитающих[58•]. Прямая роль этих мультибелковых коактивирующих комплексов и структурно-сходного кофактора, CRSP [59•], выявлена как необходимая для трансактивации Sp1 с голой ДНК матрицы.
Conclusions and perspectives
Стероидные и ядерные рецепторы прямо регулируют транскрипцию многих генов, аккомодируюя программы развития и дифференцировки как быстрый ответ на средовые сигналы. У дрожжей иднентифицировано множество промежуточных компонентов, ко-активаторов и ко-репрессоров, участвующих как в лиганд-зависимой, так и лиганд-независимой передаче сигналов с помощью этих рецепторов, а также их непосредственные гены-мишени. Как DRIP/ARC/TRAP комплекс взаимодействует с p160/CBP/pCAF ко-активаторами, например, если DRIP/ARC/TRAP не содержит HAT активности [49••], возможно с помощью двухступенчатого процесса Fig. 2. В этой модели хроматин-ремодулирующие коактиватооры или связываются непосредственно со стероид/ядерными рецепторами или через лиганд-рекрутируемые коактиваторы, такие как DRIP/ARC/TRAP комплекс, который делает открытым хроматин, что позволяет DRIP/ARC/TRAP комплексу прямо влиять на комплекс преинициации, скорее всего через общие субъединицы SRB/Mediator. В соответствии с этой двухступенчатой моделью рецептор тироидного гормона/RXR влияют на структуру хроматина в ответ на действие тироидного гормона в ооуитах Xenopus, но эти изменения превышают те, что необходимы для дерепрессии транскрипции и активации субъединиц, подтверждая потребность в дополнительной, отдельной функции по трансактивации [60]. 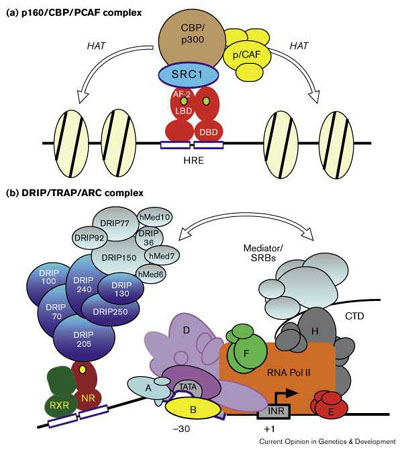 | Рис 2 Модель взаимодействия комплекса ядерный рецептор/коактиватор. (a) p160 коактиватор, такой как SRC-1 связывает коплекс, состоящий из CBP/p300, p/CAF и других факторов, с ядерными рецепторами с помощью лиганд-зависимых AF-2 взаимодействий и, в некоторых случаях, с помощью MAP-киназа-индуцибельных сайтов фосфорилирования в AF-1. В результате этих взаимодействий должна проявиться HAT активность, обеспечивающая ремодулирование хроматина. (b) Отдельный коактиваторный комплекс, представленный DRIP/TRAP/ARC и Mediator/SRB субъединицами присоединяется к ядерным рецепторам лиганд-зависимым способом через единичную субъединицу, DRIP205 (TRAP220). Показан гетеродимер из ДНК-связанного ядерного рецептора и RXR . Mediator/SRB субъединицы, общие в комплексе ядерный рецептор/DRIP/TRAP/ARC (silver) и RNA Pol II указывают на то, что коактивация происходит с помощью DRIP/TRAP/ARC комплекса, и по крайней мере частично, через присоединение или стабилизацию RNA Pol II. Хроматин-модифицирующие коактиваторы, такие как p160/CBP/PCAF комплекс, показанный в (a), может связывать непосредственно стероид/ядерные рецепторы или через посредство лиганд-ректрутируемых коактиваторов, таких как DRIP/ARC/TRAP комплекс, последовательно открывающего хроматин и тем самым позволяющий DRIP/ARC/TRAP комплексу действовать прямо на пре-иницирующий комплекс, частично через общие SRB/Mediator субъединицы. Figure 2 Models of nuclear receptor/coactivator complex interactions. (a) p160 coactivators such as SRC-1 anchor a complex comprising CBP/p300, p/CAF and other factors to nuclear receptors through ligand-dependent AF-2 interactions and, in some cases, MAP-kinase-inducible phosphorylation sites in the AF-1. The net effect of these interactions would be to provide HAT activity, resulting in a remodeling of chromatin. (b) A distinct coactivator complex comprising DRIP/TRAP/ARC and Mediator/SRB subunits is recruited to nuclear receptors in a ligand-dependent manner through a single subunit, DRIP205 (TRAP220). Shown here is a DNA-bound nuclear receptor/RXR heterodimer. Mediator/SRB subunits that are shared between the nuclear receptor/DRIP/TRAP/ARC complex (silver) and RNA Pol II suggest that coactivation by the DRIP/TRAP/ARC complex could occur, at least in part, through recruitment or stabilization of RNA Pol II. Chromatin-modifying coactivators, such as the p160/CBP/PCAF complex depicted in (a), might bind directly to steroid/nuclear receptors or perhaps through ligand-recruited coactivators such as the DRIP/ARC/TRAP complex, consequently opening up the chromatin to then allow the DRIP/ARC/TRAP complex to act directly on the pre-initiation complex, potentially through shared SRB/Mediator subunits. |
|

