СONTRACTION
CОКРАЩЕНИЕ МЫШЕЧНОЕ
|
|
Поперечно-полосатая мышца способна развивать напряжение около 2,8 кг на 1 квадратный см поперечного сечения. Сокращение или расслабление занимает ничтожные доли секунды. Мышца состоит из отдельных волокон диаметром 10-100 микрон. Протяженность волокна м.б. равна длине самой мышцы или значительной ее части. Каждое волокно покрыто электрически поляризованной мембраной. Разность потенциалов между внутренней и наружной поврехностьтю такой мокембраны обычно составляет - 0,1 вольта. Сокращения вызываются импульсом, идущим по нерву к концевой пластинке, которая находится в контакте с волокном. При поступлении импульса происходит деполяризация мембраны и по всему волокну выделяется активирующее вещество. Один из мышечных белков приобретает способность действовать как фермент, отщепляя фосфатную группу от АТФ. Мышца продолжает оставаться в сокращенном состоянии пока не исчезнет импульс или не наступит утомление мышцы.
|
Физиология мышечного сокращения
Transverse tubular system является серией инвагинаций сарколеммы, которые идут между миофибриллами по краям А-дисков. Саркоплазматический ретикулем является модифицированным эндоплазматическим ретикулемом, который формирует сложную серию анастомозов, заполняющих большую часть пространства между миофибриллами. Мембраны саркоплазматического ретикулема содержат кальций-АТФазные насосы, которые транспортируют ионы кальция.
Каждое мышечное волокно иннервируется одним моторным нейроном, веточки которого заканчиваются в кластере моторных концевых пластинок, которые формируют специализированные синапсы с мышечными волокнами, нейромышечные соединения (рис).
 Электронная микрофотография нейромышечного соединения, показфывает, что аксон аксон окружен сложенной в складки сарколеммой мышечного волокна (стрелки). Видны синаптические пузырьки в цитоплазме аксона. Ув. Х5200
Область мышечного волокна, которая вносит вклад в нейромышечное соединение является областью специализации сарколеммы, в которой сконцентрированы несколько белков, включая десмин и дистрофин. Уротропин локализован на crests синаптических полей. Поступление потенциала действия в моторные концевые пластинки аксона приводи к высвобождению ацетилхолина из запасных пузырьков в синаптическую щель. Ацетилхолиновые молекулы связываются с рецепторами в постсинаптических мембранах, что ведет к существеннному увеличению проницаемости мембран и деполяризации мембран. Потенциал действия, возникший в нейромышечном соединении быстро распространяется по поверхност волокна ( примерно 5 м в сек) и в поперечные трубочки. Возбуждение поперечных трубочек высвобождает кальций, который в свою очередь запускает мышечное сокращение (exitation-contraction coupling).
Этот процесс зависит от тесной взаимосвязи между двумя наборами белков поперечныхтрубочек и саркомерного ретикулема (рис.13).
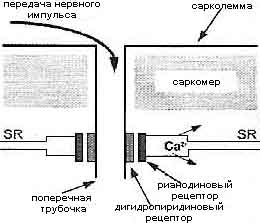 Рис. Схематическое изображение структур, связанных с возбуждением-контракцией мышечного волокна. Нернвый импульс передается поперечными трубочкам, где он трансформируется во взаимодействия между дигидропиридиновыми и рианодиновыми рецепторами, что ведет к высвобождению кальция из саркоплазматического ретикулема (SR). Увеличение кальция запускает движение сократительных филамент
Fig. 13 Diagrammatic representation of the structures involved in exitation-contraction coupling in muscle fibers. The nerve impulse is conducted down transverse tubules where changes in the interactions between duhydropyridine and ryanodine receptors lead to the release of calcium from the sarcoplasmic reticulum (SR). The rise calcium triggers movement of contractile filaments
Тетрада белков (дигидропиридиновые рецепторы) на поперечных трубочках отвечает на изменение напряжения изменением формы и взаимодействует с соединительными ножками четырех кальций-высвобождающих канальцев (рианодиновые (ryanodine) рецепторы) на саркоплазматическом ретикулеме. Аномалии дигидропиридиновых и рианодиновых рецептров связаны с некоторыми заболеваниями.
Отдельное мышечное волокно состоит из нескольких параллельно расположенных элементов, миофибрилл, диаметром около 1 микрона. Сама миофибрилла с свою очередь состоит из параллельно лежащих протофибрилл - актиновых и миозиновых нитей. На поперечном сечении видно, что эти нити располагаются строго определенным образом и отделены друг от друга промежутком в несколько сот ангстрем. Миозиновые нити обычно достигают толщины в 160 ангстрем, длина миозиновых нитей составляет примерно 1,5 микрона. Актиновые нити имеют в длину только около 1 микрона, а их толщина составляет 50-70- ангстрем. В результате частичного наложения групп толстых и тонких нитей возникает поперечная исчерченность, видимая в микроскоп. Для поперечнополосатой мышцы (Рис.1) 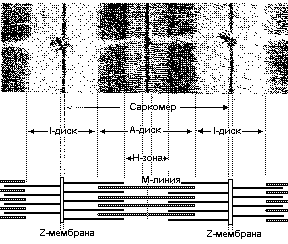
Электронная микрофотография продольного среза поперечнополосатой мышцы и схематическое изображение взаимного расположения тонких и толстых нитей, обуславливющего рисунок полос. На микрофотографии представлен отрезок двух миофибрилл, увеличенных примерно в 23000 раз Участок, ограниченный двумя Z- мембранами, - это саркомер Fig.1. Electronic microphoto longitudinal section of the muscle and schematic image of a mutual arrangement of thin and thick fibers, giving a figure of strips. In a microphoto the piece of two myofibrills, increased approximately in 23000 time is submitted.
a site limited two Z- to membranes, is a sarcomer .
Характерно чередование плотных темных полос ( А-дисков) и светлых полос ( I-диски). В А-дисках миозиновые нити образуют гексогональную упаковку, имено они обусловливают высокую оптическую плотность дисков. Актиновые нити прикрепляются с каждой стороны к узкой плотной мембране, т.называемой Z-мембране, которая пересекает I-диск . Расстояние между двумя Z-мембранами называется САРКОМЕРОМ. Тонких протофибрилл в пучке в 2 раза больше, чем толстых. Тонкие протофибриллы оканчиваются у края Н-зоны - области с более низкой оптической плотностью, находящейся в центре А-диска. В центральной части Н-зоны расположене " псевдо-Н-зона", обладающая еще более низкой плотностью, ширина этой эоны не изменяется при мышечном сокращении. В середине этой светлой зоны расположена узкая темная полоска, М-линия. Предполагается, что эта линия соответствует небольшому утолщению, которое имеется в середине каждой толстой протофибриллы. Пары толстых и тонких протофибрилл соединены поперечнми мостиками, располагающимися через довольно правильные интервалы (Рис.2 и 3) 
Электронная микрофотография продольного среза поперечнополосатой мышцы. Представлен отрезок миофибриллы, увеличенный примерно в 75000 раз. Толстые нити усеяны мелкими выступами - поперечными мостиками. Между толстыми нитями лежат тонкие нити (А- диск). М - М-линия, Z - Z-диск Fig. 2. Electronic microphoto of longitudinal section of a muscle. The piece of the myofibrill, increased approximately in 75000 time is submitted.
Thick fibers are covered by fine ledges - cross bridges. Between thick strings lay the thin strings (A - disk). M - M-line, Z - Z-disk .
Они обеспечивают структурную и механическую целостность всей мышцы. Именно в этих поперечных мостиках возникает и поддерживается напряжение, развиваемое мышцей. Когда саркомер изменяет свою длину, длина самих протофибрилл заметно не меняется, они просто скользят друг относительно друга, причем тонкие протофибриллы вдвигаются дальше в А- диск, а при растяжении - выдвигаются из него.
При нормальном сокращении длина саркомера уменьшается на 20 %, а то и болше, тонки протофибриллы в каждой половине А-диска должны смеситься по крайней мере на четверть микрона. Что же происходит с поперечными мостиками? Было высказано предположение, что при сокращении они отделяются и прикрепляются в новом участке нити дальше прежнего и что в месте контакта поперечных мостиков и нитей происходит расщепление одной молекулы АТФ и образующаяся энергия обеспечивает скольжение одних нитей в промежутках между другими. Характерная особенность толстых протофибрилл - наличие посредине короткого участка, на котором боковые отростки (поперечные мостики) отсутствуют. Этот участок длиной примерно в 0,15-0,20 микрона соответствует псевдо-Н-зоне.
Молекула миозина имеет вид тонкой палочки с двумя небольшими шаровидными "головками" на одном конце.
Она представляет собой удлинненную структуру длиной примерно 1500 ангстрем и толщиной 20-40 ангстрем. Макромолекула миозина расщепляется трипсином на 2 фрагмента, легкий и тяжелый меромиозин. Тяжелый меромиозин обладает способностью отщеплять фосфатную группу от АТФ и соединяться с актином. Легкий меромиозин этими свойствами не обладает, но сохраняет характер растворимости, позволяющий ему образовывать структуру, характерную для интактного миозина. Размеры этих фрагментов молекулы миозина дают основание предполагать, что в исходной молекуле они соединяются друг с другом просто концами. Частицы тяжелого меромиозина представлют собой структуры, состоящие из двух частей: большой шарообразной "головки" и короткого "хвоста". Частицы легкого меромиозина - прото "линейные" структуры. Таким образом, молекула интактного миозина имеет участок, обладающий ферментативной активностью и сродством к актину, локализованным в "головках", а участки, обусловливающие способность связываться с другими молекулами миозина, находятся в "хвосте". По-видимому, образование нитей миозина происходит в результате присоединения новых молекул параллельно уже соединившимся молекулам. Вновь присоединяющиеся молекулы ориентируются в одном из двух противоположных направлений в зависимости от того, к какому концу готовой нити присоединяется новая молекула. Поперечными мостиками. связывающими толстые и тонкие нити в мышце, служат "головки" молекул миозина. Толстая нить обычно имеет длину 1,5 микрона и содержит несколько сотен молекул миозина
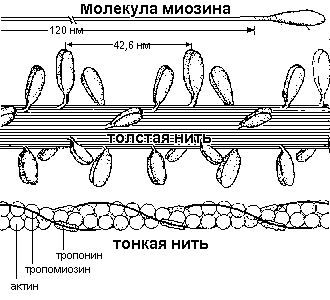
Схематическое изображение строения толстой и тонкой нити. В толстых нитях молекулы миозина образуют пучок длиной около 1,5 микрон, причем головки их выступают наружу группами по три. Тонкая нить постороена из молекул актина, тропомиозина и тропонина. Вблизи одного из концов каждой молекулы тропомиозина прикреплена глобулярная молекула тропонина. Одна молекула тропомиозина прилегает к семи молекулам актина, общее число которых в ниди длиной 1 микрон составляет около 300-400 Fig.3. The schematic image of a structure of a thick and thin fiber. In thick strings of a molecule myosin form a bunch of length about 1,5 micron, and heasd them act outside by groups till three. Thin a string consisted from molecules actin, tropomyosin and troponin.
Near to one of the ends of each molecule tropomyosin is attached the globular molecule troponin. One molecule of tropomiosin adjoins to seven molecules actin, which general number in fiber in length 1 micron makes about 300-400
.
В поперечнополосатых мышцах при сокращении тонкие протофибриллы из двух I-дисков движутся навстречу друг другу и к центру А-диска. При этом необходимо, чтобы все силы, создаваемые поперечными мостиками в одной половине А-диска, были направлены в одну сторону, тогда как направление сил во второй половине диска д.б. противоположным. Такая направленность целиком или в значительной мере зависит от того, что в одной половине толстой протофибриллы (и в А-диске) все молекулы были ориентированы в одну сторону, а во второй половине - в противоположную.
Три других важнейших белка находятся в тонких нитях. Было установлено, что тонкие протофибриллы имеют форму двойной спирали, постороенной из двух цепей, состоящих из глобулярных субъединиц, цепи перекручены таким образом, что в каком бы направлении их ни рассматривать, места перекреста располагаются на расстоянии 360 ангстрем друг от друга. Глобулярные субъединицы - это молекулы актина, которые образуют нить путем агрегации. Вся структура напоминает две нитки бус закрученных одна вокруг другой. Каждая молекула актина ведет себя так, как будто у нее имеются "передняя" и "зaдняя" стороны. Поскольку в тонких нитях каждая молекула актина присоединена своей передней стороной к задней стороне следующей молекулы, нить в целом приобретает определенную полярность.
Кроме актина в тонких нитях содержатся два других белка - тропомиозин и тропонин. Тропомиозин состоит из длинных тонких молекул. соединенных своими концами, так что образуется очень тонкая нить, лежащая на поверхности актинового тяжа. К каждому из двух тяжей актина прилегает отдельная нить тропомиозина, расположенная вблизи борозды между обоими тяжами. Молекула тропонина имеет более или менеее глобулярную форму и как бы сидит "верхом" на молекуле тропомиозина, вероятно недалеко от одного из ее концов. В тонкой нити каждая молекуля тропомиозина прилегает к 7 молекулам актина и несет на себе одну молекулу тропонина. Тонкие нити скелетной мышцы обычно достигают 1 микрона в длину и содержат 300-400 молекул актина и, вероятно, 40-60 молекул тропомиозина. В интактной мышце один конец тонкой нити прикреплен к пластинке Z - плоской белковой структуре.
Все молекулы актина в нити комбинируются с тяжелым меромиозином абсолютно одинаковым способом. Из этого вытекает предположение. что все молекулы актина в данной тонкой протофибрилле ориентированы одинаково и взаимодействуют совершенно одинаково с данным поперечным мостиком миозина.
Все протофибриллы, образующие I-диск по одну сторону от Z-мембраны , ориентированы в одну сторону, а по другую сторону Z-мембраны - в противоположную. Это подтверждает, что относительная ориентация молекул актина и миозина, обуславливающая существоание двух половин А-диска, одинакова при их противоположной абсолютной ориентации. При этом и направление сил будет противоположным, так что актиновые нити могут двигаться в противоположных направлениях, настречу друг другу к середине саркомера.
Каким образом поперечные мостики миозина "цепляются" за последовательно расположенные активные участки на актиновых нитях. Предполагается, что поперечные мостики, отходящие от толстой нити прикрепляются к тонкой нити под определенным углом, а затем, по-видимому, поворачиваются, что приводит к смещению толстых нитей относительно тонких. Поперечне мостики, лежащие по разные стороны от "оголенной" области, отклоняются в противоположных направлениях. Для того чтобы могло произойти значительное укорочение каждый поперечный мостик должен действовать циклически.
О роли ионов кальция в мышечных сокращениях см Кальций (регуляция контрактильности)
Уменьшение силы сокращения поперечнополосатых мышц при длине саркомера, меньшей, чем длина саркомера покоящейся мышцы объяснется тем, что сила сокращения должна падать в зоне двойного перекрывания тонких протофибрилл вследствие того, что происхэодит прогрессивное проникновение тонких протофибрилл, прикрепленных к одной Z-мембране, между протофибриллами, отходящими от противоположной Z-мембраны. Молекулы актина той части протофибриллы, которая проникла дальше середины А-диска, будут неправильно ориентированы по отношению к прилежащим поперечным мостикам. Эта область не будет принимать участия в генерировании напряжения мышцы, поскольку здесь происходит механическое и химическое нарушение взаимодействия правильно реориентированных молекул актина и миозина, то напряжение может уменьшаться.
Контроль мышечной функции
Сила" мышцы связана с несколькими факторами
анатомической структурой мышцы и ее присоединением
пропорцией волокон с разными биохимическими типами
способом, с помощью которого группа мышечных волокон активируется (моторные единицы)
Внутренне присущей эффективности этих волокон (тренированность)
Большие анатомические типы мышц и их сухожилий
Относительное движение актиновых и миозиновых филамент является ультимативным детерминатном степени контракции. В мышцах позвоночных максимальное укорочение саркомера примерно 30%, но действительное движение концов мышечных волокон определяется длиной мышцы, т.е. числом саркомеров в мышечном волокне. Генерируемая сила (сила х расстояние в единицу времени) зависит от массы, т.е. числа саркомеров, работающих параллельно, и быстроты сокращения.
Мышцы могут быть классифицированы анатомически в соответствии с их формой и общей ориентацией волокон. Мышечные волокна могут быть ранжированы грубо параллельно линии сокращения, например, ременные и fusiform мышцы, или могут располагаться косо к линии сокращения, например, треугольная мышца и pennate мышца, последняя имеет одну или несколько мышечных областей вставленных в сухожилие (рис.14).
 Схематическое изображение форм мышц в зависимости от расположения в них волокон и присоединения к костям. Эта анатомия влияет на силу и направление мышечного сокращения
Функциональные различия мышечных волокон (типы волокон)
"У человека все мышцы состоят из смеси волокон с разными функциональными характеристиками. Различия между волокнами могут быть выявлены с помощью гистохимической техники. Выявляются различия в числе и активности митохондрий в активности расщепления АТФ. Различия в рН стабильности миозин-АТФазной активности разных типов миозиновых молекул используются для разделения волокон на тип 1, 2А и 2В.
 Поперечный срез квадрицепса человека, окрашенный на миозиновую АТФазу. При рН 4.4 различимы все типы волокн: палевыая окраска (тип 2В), промежуточная (тип 2А) и темная (тип 1. Ув. х150)
Различия в белковой структуре разных миозинов ( и других молекул) выявляются также иммуногистохимическими методами (табл). Следует однако иметь в виду, что мышечные волокна человека имеют непрерывный спектр функциональных и биохимических характеристик.
"Свойства волокон разных типов варьируют между мышцами и между индивидами.
 Поперечные срезы мышц человека, показывающие изменчивость относительных пропорцимй разных типов волокон. При рН 9.6 темные волокна являются типа 2, а палевые типа 1. Волокон типа 1 больше в tibialis anterior (A), чем в квадрицепсе (В) Ув. х150
"Во время развития плода экспрессируется несколько типов миозина. Эмбриональный миозин экспрессируется первичными мышечными трубками до 9-й недели развития, когда он заменяется взрослым типом медленного миозина. Во вторичных и четвертичных мышечных трубках экспрессия эмбрионального миозина сопровождается экспрессией фетального миозина и затем взрослым типом быстрого миозина. Происхождение этих различий в экспрессии типов миохинов связано с внутреннми свойствами разных волокон и их нейральным обеспечением. Биохимические характеристики зрелых волокон (тип 1 и 2) могут быть изменены при нарушении паттерна нервных импульсов. Повышение стресса на мышцы также может приводить к изменению типа миозинов, это создает определенную степень пластичности функции. Таким образом, мышцы необходимые для постоянного высокого уровня активности (postural мышцы) стремятся развить аэробный метоблизм (гистохимический тип 1 или медленные волокна). Тип 2В (быстрые) волокна имеют анаэробный метаболизм, более приспособленный для динамической непостоянной активности.
Моторная единица активации
Высокий уровень организации обеспечивается в мышцах человека при помощи смеси моторных единиц внутри мышцы. Каждая моторная единица снабжается веточнками одиночного моторного нейрона и может быть представлена 10-100 волокнами в зависимости от размера мышцы и точности выполнения задания. Точный контроль, напр., в наружных окулярных и гортанных мышцах обеспечивается наличием множества моторных единиц, каждая из которых содержит небольшое количество волокон и которые могут быть активированы независимо. Волокна некоторых мотоных единиц могут быть перемешаны, независимо от фасцикулярных границ, так что любая моторная единица будет поставлять волокна в большую область мышцы. Повреждение двигательного нейрона сопровождается ростом новых веточек из другого моторнго нейрона и реинервацией мышечных волокон, ведущего к увеличению моторной единицы.
Градация силы сокращения
1. Механическое сложение сил, генерируемых одиночной моторной единицей. Если приходит второй потенцал действия, то волокна сокращаются снова, создавая напряжение волокон на более высоком уровне. Внутри границ, более высокая частота нервных импульсов будет генерировать более высокое напряжение.
2. Вовлечение добавочных моторных единиц
|
Ekvator Dayv 






