ПРОТОК АРТЕРИАЛЬНЫЙ
Нормальный ductus arteriosus имеет мышечный средний слой , контрастирующий с эластичной lamellar структурой смежных аорты и легочной артерии (Рис.1).
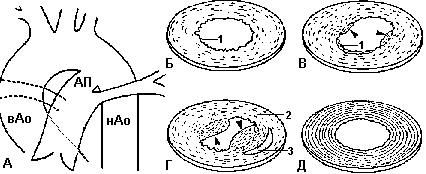
А - схематическое изображение положения артериального протока (АП) восходящей (вАо) и нисходящей (нАо) аорты. Б - поперечный срез через артериальный проток у плода 13-15 недель. В - тоже у плода в 18-21 недель. Г - у новорожденного. Д - поперечный срез аорты у плода и новрожденного.
1 - внутренняя эластичная ламина, 2 - внутренний средний слой, 3 - область цитолитического некроза. Головки стрелок указывают на образующися утолщения интимной оболочки. В аорте видны организованные структуры из эластических ламелл
.
1 - внутренняя эластичная ламина, 2 - внутренний средний слой, 3 - область цитолитического некроза. Головки стрелок указывают на образующися утолщения интимной оболочки. В аорте видны организованные структуры из эластических ламелл
Fig.1. A - Schematic image of a position of the ductus arteriosus (АП) ascending (вАо) and descending (нАо) aortae. Б - cross section through ductus arteriosus at a fetus 13-15 weeks. B - too at a fetus at 18-21 of weeks. Г - at newborn. Б - cross section of a aortae at a fetus and newborn.
1 - internal elastic lamine, 2 - internal medial layer, 3 - area of the cytolitic necrosis. The head of arrows specify on a thickening of an intimate environment. In aortae the organized structures from elastic lamelle are visible
У плодов человека образование утолщения интимы в протоке начинается с приподнимания эндотелиальных клеток и накопления гиалурона в субэндотелиальной области, т.е. создаются условия для миграции smooth muscle cells (SMC) через фрагментированную эластичную ламину в субэндотелиальной области. Этот процесс продолжается вплоть до закрытия протока. У плодов дуктус артериозус обнаруживает относительно раннюю дифференцировку котрактильного аппарата по сравнению с восходящей и нисходящей аортой. Сплайс-варианты фибронектина с экстрадоменом А (EDA) и B (EDB) экспрессруются одинаково. В протоке новорожденных SMC в средней и наружной интиме хорошо дифференцированы и сравнимы с SMC в восходящей аорте. Дедифференцировка SMC с низкой экспрессией цитоскелетных и контрактильных белков и с высокой экспрессией EDA и EDB обнаруживается в областях внутренней интимы, которые обнаруживают признаки прогрессиного утолщения интимы, и в областях цитолитического некроза в media. Выявлен экстенсивный апоптоз в области цитолитического некроза и в меньшей степени в области внутренней интимы. Дедифференцировка и апоптоз связаны с ремодулирование этого сосуда(Slomp et al.,1997).
На Carnegie стадии 16 recurrent laryngeal нервы идут в медиальном направлении от нерва vagus до laryngeal области и оказываются с двух сторон симметрично шестым дугам аорты. На стадии 18 правая шестая аортальная дуга исчезает,а левая шестая аортальная дуга дуга находится в более каудальном положении относительно гортани. Левый нерв vagus и его recurrent laryngeal ветвь формируют поддержку дистальной части (или ductus arteriosus компоненту) левой шестой аортальной дуги дуги. Средний слой ductus arteriosus в области поддерживающих нервов более тонкий и имеет меньшее количество эластичных волокон, чем эластичный lamellar средний слой смежных аортальных дуг. Предполагается, что эта местная механическая поддержка может быть причиной того, что нормальный ductus arteriosus дифференцируется как muscular артерия и поэтому способен облитерировать просвет в послеродовой жизни. Без такой поддержки ductal средний слой мог бы развивать избыточное количество эластичных волокон, характерных для нормальных неподдержанных aorta и pulmonary ствола(магистрали) и стать аномально, постоянно проходимым ductus arteriosus.
Однако наиболее вероятной причиной обычной облитерации этого протока считается присутствие в нем производных клеток нервного гребня, которые мигрируют в него еще до механического взаимодействия с нервами. Артерия 6=ой аортальной дуги содержит клетки НГ не только из области соседней сомиту 3, а также из небольшой популяции клеток НГ, которые заполняют области презумптивных 3=ей и 4=ой бранхиальных дуг. Проксимальные части легочных артерий в месте их ответвления от артерий 6-х аортальныз дуг получают клетки НГ из областей презумптивных фарингеальных дуг 3,4 и 6=ой (сердечного нервного гребня) до или во время формирования артерии 6=ой аортальной дуги
(Miyagava-Tomita et al., 1991). Однако клетки сердечного нервного гребня исчезают из проксимальных частей легочных артерии в конце 8 дня развития у эмбрионов кур. Клетки НГ отсутствуют вдоль
всей длины легочных артерий. Стенка же 6=ой аортальной дуги,
включая ductus arteriosus заполнена клетками сердечного
нервного гребня. На 18=ый день развития клетки сердечного
нервного гребня заполняют всю длину артерии 6=ой дуги. Между
10 и 18 днем стенки ductus arteriosus контактируют с recurrent
laryngeal nerve,также пропитанному клетками сердечного
нервного гребня. На 19=ый день ductus начинает закрываться.
По=видимому, в закрытии ductus принимают участие клетки
сердечного нервного гребня (Waldo,Kirby, 1993).
Ductus arteriosus отличается от остальных крупных сосудов тем, что является скорее мышечной, чем эластичной артерией. Представлены доказательства того, что ретиноевая кислота (RA) может вносить свой вклад в уникальный фенотип ductus arteriosus. Использовали трансгенных мышей, отвечающих экспрессией β-galactosidase (β-gal) в ответ на эндогенный сигнал от RA во время эмбрионального и плодного развития. Такой сигнал обнаружен в ductus arteriosus. С помощью иммунофлюоресценции сигнал ко-локализован с доменом экспрессии изоформы adult-specific smooth muscle myosin heavy chain , SM2. β-gal сигнал выявляется в течение всего плодного развития и сохраняется также у новорожденных вплоть до полного закрытия ductus arteriosus. Позитивные клетки впервые обнаруживались 13.5 days postcoitum (dpc) в мезенхиме,окружающей проток. на 15.5 dpc, очень интенсивное beta-gal окрашивание обнаруживалось в ductus arteriosus,но отсутствовало или было минимальным в легочном стволе и дуге аорты , на 17.5 dpc гладкомышечные слои туника медиа в артериальном протоке обнаруживали позитивное β-gal окрашивание. Было установлено, что если SM1 миозин экспрессируется во всех эмбриональных сосудах, то SM2 прежде всего экспрессируется в ductus arteriosus. Более того , экспрессия SM2 м.б. обнаружена в протоке самое раннее на 15.5 dpc. У новорожденных β-gal сигнал сохраняется в гладкомышечном слое ductus и окрашивание совпадает с экспрессией SM2. Эти данные указывают на то, что ретиноевая кислота может участвовать в индукции или поддержании гладкомышечной дифференцировки в развивающемся артериальном протоке и способствовать преждевременной экспресси взрослого сосудистого фенотипа. (Colbert et al.,1996).