ЭНДОЦИТОЗ
Во время эндоцитоза клатрин и клатриновый адапторный белок (АР-2) ассоциируют с различными добавочными факторами, помогающими сформировать инвагинирующую почку на клеточной оболочке. Одним из таких факторов является Eps15, белок ассоциированный с клатриновой оболочкой, который который связывается с альфа-адаптиновой субъединицей АР-2. Его область, содержащая ЕН домены, связывается с белком эпсином (epsin), сходным с митотическим фосфопротеином ксенопус МР90 и имеющим повсеместное распространение. Он концентрируется вместе Eps15 в пресинаптических нервных окончаниях, которые являются сайтами, специализированными для клатрин-опосредованного эндоцитоза синаптических пузырьков. Центральная облать эпсина связывается с АР-2, а его С-терминальная область связывается с Eps15. Эпсин ассоциированный с клатриновой оболочкой может быть преципитирован вместе с АР-2 и Eps15 из экстрактов головного мозга, но не с компонентами клатриновой оболочки. Если функция эпсина нарушена, то клатрином-обеспечиваемый эндоцитоз блокируется. Предполагается. что эпсин вместе с Eps15 может участвовать с молекулярной перестройке клатриновых оболочек, которая необходима для инвагинации, покрытой оболочкой ямки и отшнуровки пузырька.
Receptor Mediated Endocytosis
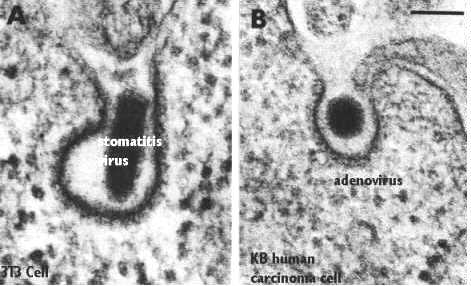
На данной микрофотографии представлен процесс рецепторами опосредованного endocytosis вирусной частицы. В обоих случаях мембрана покрыта клатрином.
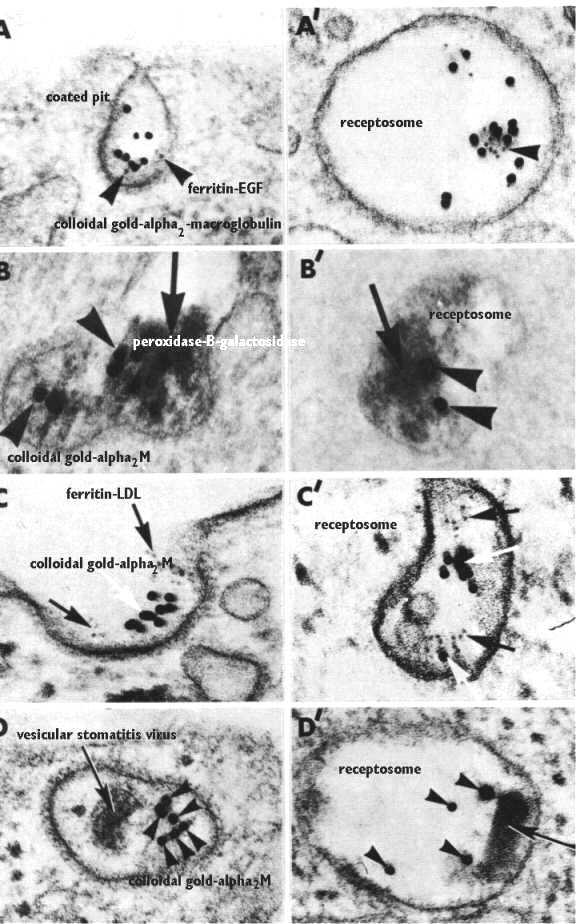
На рис. видно, что множественные лиганды (epidermal growth factor, vesicular stomatitis virus, или alpha 2 macroglobulin) м. вступать в клетку через одну и ту же покрытую клатрином ямку. Более того, пузырьки м. переносить их в одну и ту же receptosomes. Сигнальные молекулы, меченны золотом, пероксидазой, ферритин или это сам вирус.
После вступления в цитоплазму endocytotic пузырьки теряют клатриновую оболочку. Они быстро сливаются с др. такими же пузырьками в процессе "гомотипического" слияния. Каждый пузырек имеет пары SNARE белков, ( v-SNARE и t-SNARE) , которые используются в инициальном процессе (и наз. cis-SNAREs). Гомотипическое слияние начинается с разединения SNARE пар с помощью N-ethylmaleimide-sensitive factor (NSF) , который использует также Soluble NSF attachment protein (SNAP).Затем отсоединенные t-SNAREs стабилизируются с помощью др. фактора, называемого LMA-1. Белок t-SNARE одного пузырька соединяется с v-SNARE др. Тем временем, специфические dockimg/tetherimg факторы сводят пузырьки в закрытый конгломерат, используя их поверхностные rab5-GDP. Один из них Rabaptin-5, который появляется с nucleotide exchange factor (Rabex-5), который м. активировать rab5. Кроме того имеются еще две GTPase , которые м. связывать две эндосомы вместе. Еще один фактор - Early Endosome Associated Protein (EEA-1), который является суперскрученными ( "coiled coils) спиралями. Его C конец имеет FYVE fimger домен, который связывает phosphatidylinositol-3-phosphate в эндосомных мембранах. EEA-1 не только связывает эндосомы, он активирует слияние эндосом.
Formation of a late endosome
Поздние эндосомы образуются когда pH снижается до 5-6.0. Покрытые клатрином пузырьки из Trans Golgi Network приносят переваривающие ферменты для поздних эндосом и сливаясь с ними высвобождают свое содержимое. Поздние эндосомы становятся, таким образом, degradative телами и приобретают кроме того маркер mannose 6 phosphate receptor "MPR+Они изменяют свой rab поверхностный маркер на rab7-GTP, возможно, давая пристанище новымtargetimg пузырькам, с которыми они сливаются. Т.обр., поздние эндосомы м. б. идентифицированы по наличию rab7.Поздние эндосомы включают мультивезикулярные тельца и содержат завитки или пузырьки из мембран внутри. Они содержат также необычный липид, lysobisphosphatidic acid (LBPA). Поздние эндосомы функционируют, деградируя большинство белков и липидов. Они также отвечают за возвращение MPR рецепторов обратно в сеть Trans Golgi. Они рециклируют их путем отпочковываения мембран, которые переносят обратно рецепторы для слияния их с мембранами Trans Golgi. После слияния, MRP рецепторы снова способны отлавливать и сортировать новые деградационные энзимы для следующего переноса их в поздние эндосомы. Late endosomes fuse with lysosomes.
Наконец, поздние эндосомы м. оказаться неспособными переварить весь материал. Тогда следующей ступенью является слияние их с лизосомами и создение гибридных органелл. Оставшиеся сильно гликозилированные lysosomal associated membrane proteins (LAMPs) м. в этом случает передаваться лизосомам. LAMPs затем становятся маркерами для поздних эндосом или лизосом. Т.к. лизосомы не имеют MPR рецепторов (they have all been sent to the Golgi), то это позволят отличать лизосомы и поздние эндосомы.
Т.обр., слияние же начинается с того, что MPR отсылаются назад в Trans Golgi.Отметим, что лизосомы продолжают общаться с поздними эндосомами и м. высвобождать важный материал обратно в эту групу органелл. Лизосомы рассматриваются как конечный продукт эндоцитоза. Т.обр., лизосомы не общаются непосредственно с Trans Golgi (а, следовательно, и с плазматической мембраной). Однако, они м. общаться с вышестоящими структурами посредством ретроградного транспорта в поздние эндосомы.
Receptor-mediated uptake of LDL receptors: a model for studies of traffickimg and defects
Холестерол соединяется с Low density lipoproteins (LDL). В этом случае в эндосомах рецептор LDL подвергается рециклингу, а лиганд (LDL-cholesterol) метаболизируется так, что свободный холестерол м. высвобождаться и использоваться клеткой. Известны две мутации, которые обусловливают или отсутствие поступления LDL рецепторов или накопление холестерола в поздних эндосомах.


На рис. суммирован процесс эндоцитоза в целом. После того как лиганд и рецепторы оказываются в покрытой оболочкой ямке, образуется покрытый оболочкой пузырек, После удаления клатрина пузырек сливается с формирующейся эндосомой. Ранние эндосомы обеспечивают рециклинг LDL рецепторов. Поздние эндосомы/лизосомы являются местом накопления холестерола после гидролиза лиганда. Свободный же холестерол доступен для использования клеткой.
На след. рисунке показано, как LDL рецепторы соединяются со своим лигандом (LDL-холестерол) в клатрином покрытой ямке. LDL называется "bad cholesterol".


How do receptor mediated endocytosis and LDL receptors help reduce our serum levels of cholesterol?
Некоторые семьи имеют дефект в сайте, связывающем Adaptin-2, на рецепторе LDL . Этот сайт помогает сконцентрировать LDL рецепторы в покрытой оболочкой ямке. Соединение с адапторным белком помогает привлечь клатрин к формирующейся ямке. Генетический дефект этого сайта на рецепторе препятсвует лиганду и его рецептору закрепляться в покрытой клатрином ямке. В результате в сыворотке накапливаются высокие уровни холестерола.
Cholesterol Stuck in Traffic: What we can learn from studies of Nieman Pick type C disorder
Выявлен важный белок, связанный с выходом холестерола из поздних эндосом, названного NPC1. Этот белок обладает доменом, связывающим стероид. Он участвует в транспорте холестерола в Trans Golgi Network и затем в плазматическую мембрану. Он м. также быть сенсором для сайтов накопления холестерола. Он получил свое название от б-зни, которую вызывает, Niemann Pick типа C . Мутация обусловливает накопление холестерола в поздних эндосомах, уоторые расширяются и заполнены кроме того завитками из мембран. Установлено, что в нормальных фибробластах NPC1 белок находится в лизосомах. В этом же компартменет не содержится больших количеств LDL-cholesterol. Было высказано предположение, что лизосомы отсылают NPC1 назад в поздние эндосомы с помощью ретроградного переноса . Этот процесс стимулируется концентрацией холестерола в поздних эндосомах. Считается, что этот маршрут затем дает прямой доступк Trans Golgi сети, позволяя переносить холестерол туда, где он необходим. Лизосомы не поддерживают пути к этим сайтам, т.к. они м. общаться с остальной частью клетки только посредством поздних эндосом.
Больше всего холестерол необходим для стабилизации мембран, в особенности для клатрином одетых ямок. В фибробластах от пациентов с Nieman Pick Type C disorder (NPC) холестерол остается только в поздних эндосомах, mannose 6 phosphate receptors (MPR) также обнаруживается только в этой части пути из-за блокирования его транспорта обратно в комплекс Гольджи. Белок NPC1 м. функционировать как cholesterol sensor/bindimg белок. Накопление холестерола в поздних эндосомах м. стимулировать ретроградный транспорт из лизосом в эндосомы, приносящий белок NPC1 в эндосомы. Здесь холестерол должен сортироваться для дальнейшей доставки в мембраны по всей клетке. Если NPC1 белок нефункционален, то холестерол накапливается в мембрнных завитках, видимых в поздних эндосомах. Это, по-видимому, блокирует ретроградный транспорт из эндосом в комплекс Гольджи, об этом свидетельствует накопление MPR. Его накопление, по-видимому, следствие накопления холестерола. Предполагается, что накопление холестерола в поздних эндосомах делает мембраны менее эластичными, в результате пузырьки, обычно возвращающиеся в Trans Golgi Network не м. отпочковаться и сформироваться.