Клетки тонкого кишечника чрезвычайно активны в метаболизме основного пищевого субстрата. Они обеспечивают позднюю фазу переваривания и влияют на их промежуточный метаболизм.
-
Role in Digestion and Absorption of Major Nutritional Constituents
Glucose и galactose резорбируются в цитозоле энтоероцитов с помощью специфической системы транспортеров (называемой SGLT1 - Sodium Glucose Transporter 1) купированного (coupling) движения 2Na+ с одной молекулой глюкозы. Это пример вторичного активного транспорта: Na+ движется внутри клетки вдоль своего концентрационного градиента и должен быть удален во внеклеточного пространство. Это энергия-затратный процесс осуществляется с помощью Na+K+ATPase в базолатеральной части мембраны (оболочки). Через базолатеральную мембрану эти моносахариды транспортируются пассивно (процесс облегчается трансмембранным белком называемым GLUT2).
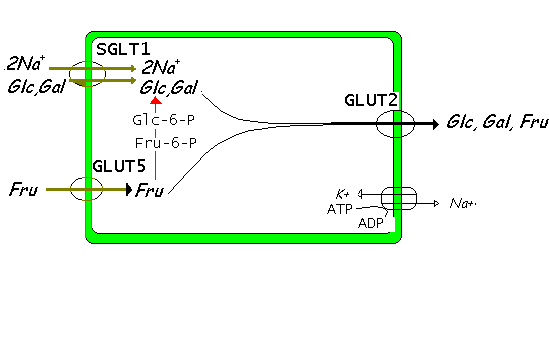

Fig. 1 : Absorbtion of monosaccharides from intestinal lumen to
portal blood.
Fructose Fructose молекулы проходят через просветную часть мембраны энтероцита путем диффузии, которая облегчается GLUT5 транспортером. Для этого типа пассивного транспорта необходим концентрационный градиент. Сначала фруктоза удаляется во внеклеточное пространство ( а затем и в портальную кровь) с помощью того же механизма, что и др. моносахариды (GLUT2). Затем фруктоза подвергается фосфорилированию, становится Fru-6-P и затем превращается в глюкозу ( gluconeogenesis).
Proteins: Ворсинчатый край (просветная часть мембраны) содержит 1. exopeptidases, которые отщепляют аминокислоты от N-конца олигопептидной цепи. Эти олигопептиды возникают в результате действия панкреатических эндопептидаз. 2. enteropeptidase (наз. также enterokinase), энзим важный для активации трипсиногена.
Финальным продуктом переваривания белков является смесь свободных аминокислот и коротких олигопептидов. Эти субстанции постепенно абсорбируются: свободные аминокислоты имеют sodium-cotransport белки в просветной части мембраны. Имеется 7 типов1, которые отличаются специфичностью связывания определённого типа аминокислот для транспорта. Di- и tripeptides абсорбируются с помощью специфических систем транспорта пептидов и гидролизуются в цитозоле энтероцитов. Это объясняет, почему в портальной крови обнаруживаются только свободеные аимнокислоты. Аминокислоты и моносахариды движутся через базолатеральную часть мембраны с помощью облегченной диффузиию Энтероциты участвуют также в интерконверсиях аминокислот.
Lipids: Monoacylglycerols (MAG) и free fatty acids (FFA) являются конечными продуктами переваривания нейтральных жиров с помощью панкреатических, а затем ”luminal” липаз. В принципе абсорбция FFA и MAG - это пассивная диффузия из смешанных micelle в цитозольный компартмент энтероцита. Lipid soluble субстанции м. проходить через мембраны не используя какие-либо транпортеры. Концентрационный градиент между просветом кишечника и внутриклеточным пространством поддерживается за счет ре-синтеза триглицеидов внутри энтероцитов. Образуются липопротеиновые частицы (наз. chylomicrons), используя вновь синтезированные TAG в качестве субстрата в аппарате Гольджи энтероцита. Chylomicrons проникают в кровообращение через лимфатические вены.
Other: Энтероциты участвуют также в абсорбции витаминов и микроэлементов.
2. Enterocyte and Intermediary Metabolism
Наиболее важным энергетическим субстратом для энтероцитов и др. быстро делящихся клеток является glutamine. Эта аминокислота поступает в энтероциты из крови, а также из кишечника и после конверсии в 2-oxoglutarate вступает в цикл Кребса. Кроме того глютамат используется как субстрат для синтеза нуклеотидов и превращается также посредством ornithin в citrullin. Citrullin подвергается конверсии в аргинин в почках (Arg: скорость лимитирующий субстрат для цикла синтеза мочевины). Fig. 2. показывает некоторые превращения аминокислот и судьбу глютамина в энтероцитах.
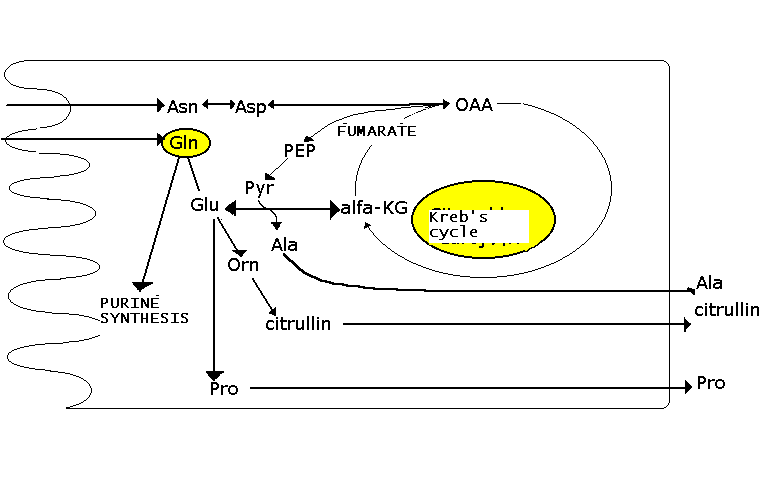

Fig. 2. Fates of glutamine and important amino acid
interconversions in the enterocyte
В противоположность этому эпителиальные клетки слизистой большого кишечника (colonocytes) используют в основном короткие цепи жирных кислот (butyrate, isobutyrate, propionate) в качестве источника энергии. Эти SCFA’s цепочки возникают из волокон с помощью бактерий толстого кишечника.
1. Ser, Thr,Ala 2. Phe, Tyr, Met, Val, Leu, Ile 3. Pro, Hyp 4.b -Ala taurin 5.Lys, Arg, cystin 6. Asp, Glu
D. Massey-Harroche
Micr. Res. and Techn. 2000. V. 49. N 4. P 353-362
Micr. Res. and Techn. 2000. V. 49. N 4. P 353-362
3 типа эпителиальных клеток кишечника, эндокринные, экзокринные и абсорбентные происходят из одних и тех же мультипотентных стволовых клеток, пролиферирующих вблизи дна крипт, где и начинается дифференцировка клеток каждого типа. Дифференцировка и созревание этих клеток продолжаются вдоль крипто-ворсинчатой оси.
Энтероэндокринные клетки, которые секретируют большие количества переваривающих гормональных пептидов, составляют 0,5% от всей популяции. Существует два типа экзокринных клеток: Paneth и слизь-секретирующих клеток. Клетки Panrth, локализуются в основнии крипт тонкго кишечника, секретируют антимикробные пептиды и фосфолипазу и составляют 7.5% от всех клеток крипт. Слизь секретирующие или пщидуе клетки составляют 10-20% от всех эпителиальных клеток тонкого кишечника кролика они распределены в равных пропорциях между эпителием крипт и ворсинок. В толстом кишечнике кроликов этих клеток 30-40%. Абсорбтивные клетки являются основными и составляют 80-90% в тонком и 60-70% в толстом кишечнике. Хотя все эти клетки обнаруживают морфологическую полярность, обзор рассматривает только абсорбтивные клетки Их поверхностная мембрана отражает векторный транспорт питательных веществ из просвета кишечника в лимфу и кровь. Транэпителиальное перемещение молекул через эпителиальные клетки использует специализированные транпортные белки, ферменты, рецепторы и каналы, расположенные на их апикальной, базальной или боковой поверхности.
Специализация доменов клеточной поверхности абсорбтивных клеток кишечника
Абсорбтивные клетки представляют собой тонкие столбчатые клетки, органелы которых обнаруживают поляризованный паттерн (рис. 1). Овальное ядро локализовано в базальной половине, аппарат Гольджи в надъядерной цитоплазме, митохондрии концентрируются в апикальной области цитоплазмы (рис. 2А), а эндоплазматический ретикулем (ЭР) распределен в оставшейся цитоплазме. Наиболее характерной структурой этих клеток является присутствие brush border (ВВ) в апикальном домене, который состоит из многочисленных тесно упакованных и хорошо развитых микроворсиное, примерно 2 µm в длину и 0.1 µm в ширину в энтероцитах тощей кишки кролика. Цитоскелет этих микроворсинок закреплен в узкой области, называемой терминальным web. Микроворсинки колонцитов примерно в 3 раза короче, чем у энтероцитов. Мы назвали этот очень плотный фибрилярный web filamentous rush border glycocalyx (FBBG). FBBG очищен и охарактеризован. Сходные структуры, по-видимому, существуют и в колоноцитах.
Базолатеральный домен плазматической мембраны (оболочки) образует складки и отделяется от апикального домена плазменной оболочки плотными соединениями. Они регулируют проницаемость внеклеточных молекул через слизистый эпителий и защищают мембранные компоненты от перемешивания. Энтероциты и колоноциты специализируются на транспорте специфических молекул. Кроме того энтероциты в разных частях тонкого кишечника выполняют разные функции. Например, специфическая активность щелочной фосфотазы, лактазы, trehalase и sucrase-isomaltase существенно выше в проксимальных отделах, чем в дистальных отделах кишечника, а активность энтерокиназы специфична для слизистой двенадцатипестной кишки. С другой стороны максимальный уровень транспорта taurocholate происходит в шдугь, где локализуется также рецептор для vitamin B12 intrinsic factor complex.
Субклеточнок фракционирование и идентификация специфических маркеров для двух доменов плазменной мембраны энтероцитов
С помощью субфракционирования подтверждено присутствие многочисленных гидролаз в апикальной плазменной мембране. Большинство из этих энзимов участвует в последних ступенях переваривания. Все компоненты доменов двух плазменных мембран энтероцитов представлены в Табл.1. Все эти компоененты являются глткопротеинами. Срстав ВВ плазменной мембраны высоко специфичесн для абсорбтивных клеток. Базолатеральные мембранные маркеры в основном присустствуют в плезменных мембранах всех клеток, как, например, в отношении Na+K+ATPase.
Иммунолокализация поверхностных мембранных маркеров полярности: доказательства гиперполяризации энтероцитов
В согласии с данными по субклеточной фракцинации домены базолатеральной и ВВ плазменной мембраны энтероцитов отличаются не только своей ультраструкатурой, но и составом белков. Напр., на рис. 4А показана аминопептидаза N (AP-N) обнаруживаемая только в ВВ плазменных мембранах. Сходный паттерн получен для всех других гидролаз и для других белков, включая транспортеры. С другой стороны, антигены основного комплекса гистосовместимости класса I концентрируются только в домене базолатеральной плазменной мембраны.
Было установлено, что FBBG состоит из одного в 400кДа гликопротеина муцинового типа. Моноклональные антитела против против этого, связанного с мембраной муцина, использованы для иммуноочистки. Прикрепление АИИП к мембранному микродомену на кончике микроворсинки хорошо показано на рис. 5. Это указывает на то. что зрелые энтероциты гиперполяризованы эпителиальные клетки. Аннексин XIII друго маркер гиперполяризации микроворсинок (рис. 6) Он концентриуется в нижних 3.4 ВВ микроворсинок энтероцита. Аннексин XIII принадлежит к семейству аннексинов, куда уже входят 12 членов у млекопитающих. Члены этого семейства цитоплазматические белки, которые связаны с мембранными фосфолипидами и/или цитоскелетом Са2+ зависимым способом. На рис. 6 видно, что аннексин XIII присутствует в микроворсинках и в базолатеральном демене плазменной мембраны. С другой стороны, аннексин IV локализуется исключительно в базолатеральном домене плазменной мембраны. Аннексин II является третьим , который экспрессируется в энтероцитах, он концентрируется в базолатеральном домене плазменной оболочки и терминальном web.
Биогенез двух доменов плазменных мембран энтероцитов
Было установлено, что гликозилирование вновь синтезированных пептидных цепей начинается в RER и продолжается в аппарате Гольджи. Вновь синтезированные гликопротеины транспортируются из аппарата Гольджи в поверхностную мембрану. Распределение белков по двум доменам плазменной мембраны происходит после их сортировки. Существует 3 потенциальных пути сортировки (рис. 7) Первый путь : вновь синтезированные апикальные и базолатеральные белки сортируются и пакуются в специфические транспортные пузырьки и покидают аппарат Гольджи. Затем белки высвобождаются непосредственно в апикальную или базолатеральную мембрану. Второй путь высвобождает все вновь синтезированные плазменные мембранные белки в базолатеральную плазменную оболочку. Белки предназначенные для апикальной мембраны затем удаляются из базолатеральной мембраны с помощью эндоцитоза и переносятся к апикальному полюсу с помощью трансцитоза. Третьий гипотетический путь вновь синтезированные плазменые белки после сортировки в доменах плазменных мембран нерезидентные белки перераспределяются с помощью эндоцитоза, сопровождаемого трансцитозом в соотвтствующие домены.
Некоторые авторы полагают, что апикальные гликопротеины во фракции базолатеральной мембраны временно интегрируются прежде чем достигнуть ВВ домена. Другие постулируют, что имеет место внутриклеточная сортировка гликопротеинов плазменной мембраны и что апикальные маркеры используют прямой путь от аппарата Гольджи к ВВ домену.
В последнее время было установлено, что присутствие небольших количеств ВВ маркеров в базолатеральной фракции не связано с загрязнением: низкие уровни АР N (в 20 раз меньшие, чем ВВ) выявлены в базолатералной фракции.
Посттрансляционные пути АР N (ВВ маркеры) и RLA (базолатеральные маркеры) изучали с помощью in vivo pulse-chase labeling 35S-метионином в тощей кишке кролика. Базолатеральные и ВВ маркеры обнаруживались одновременно в базолатеральном домене спустя 15 мин после chase (рис.9) В G+SER фракции АР N обнаруживались в двух молекулярных формах, соответствующих временным (Т) и зрелым (М) формам гликозилирования. Спустя 30 мин АР N достигали ВВ домена, тогда как RLA накапливались в базолатеральной чаcти оболочки. Все вновь синтезированные АР N сначала на короткое время интегрировались в базолатеральный домен, прежде чем достигнуть ВВ. АР N из обеих фракций мембран имеют димерную организацию. Однако перенос энергии обнаруживается только в АР N из базолатерального домена.
Кинетика поверхностного высвобождения апикальных маркеров показывает, что как непрямой, так и прямой путь к апикальной поверхности существует в Caco-2 клетках и что данный апикальный белок м. использовать один из этих путей или оба. Напр., значительная фракция АР N и dipeptidylpeptidase IV исполюзуют трансцитотический путь, тогда как sucrase-isomaltase и щелочная фосфатаза попадают в апикальные мембраны более эффективно, через прямой путь. Однако некоторая часть (4% и 20% соотв.) последних двух белков присутствует и базолатеральном домене. Белки для базолатеральной части оболочки использую только прямой путь достижения своего специфическго домена.