Передний мозг
Spatiotemporal selectivity of response to Notch1 signals in mammalian forebrain precursors
C. B. Chambers , Y. Peng , H. Nguyen , N. Gaiano , G. Fishell and J. S. Nye
Development V.128, 689-702 (2001)
Development V.128, 689-702 (2001)
Telencephalon дает cerebral neocortex, archicortex,обонятельные луковицы (olfactory bulbs (OBs)) и subpallial структуры. Из общего пула сегрегировавшие предшественники дают отдельные зоны для этих структур. Затем предшественники дают нейроны различных типов и глию, которые различны в каждой
структуре, возникающей в результате
пространственно временного или нейрогенетического градиента
дифференцировки (for a review see
Jacobson, 1991). Множественный потенциал
ограничивается в ходе развития (Brock et al.,
1998; McConnell, 1988), но не исчезает полностью, так
постнатальные клетки гиппокампа сохраняют
способность давать клетки OB
(Suhonen et al., 1996), а некоторые линии нейральных
клеток могут дифференцироваться в
различные типы зрелых кортикальных
клеток (Renfranz et al., 1991; Shihabuddin et al., 1995; Snyder et al., 1992).Растворимые факторы, такие как fibroblast growth
factor (FGF), platelet-derived growth factor (PDGF) и cilliary neurotrophic factor(CNTF) могут регулировать решение, какой тип
клеток генерировать (Ghosh and Greenberg,
1995; Johe et al., 1996; Qian et al., 1997) из мультипотентных
предшественников. The Notch/lin12/glp1 (Notch)
семейство участвует во многих решениях
судеб клеток в качестве сигналов, которые
супрессируют дифференцировку (Artavanis-Tsakonas
et al., 1995).
Artavanis-Tsakonas, S., Matsuno, K. and Fortini, M. E. (1995).
Notch signaling. Science 268,
225-232.
Bao, Z. Z. and Cepko, C. L. (1997).
The expression and function of Notch pathway genes in the developing rat eye. J.
Neurosci. 17,
1425-1434.
Bayer, S. A. (1980). Development of
the hippocampal region in the rat. I.
Neurogenesis examined with 3H-thymidine autoradiography. J.
Comp.Neurol. 190,
87-114.
Boulder Committee. (1970). Embryonic
vertebrate central nervous system: revised terminology. The Boulder Committee. Anat.
Rec. 166,
257-261.
Brock, S. C., Bonsall, J. and Luskin, M. B. (1998).
The neuronal progenitorcells of the forebrain subventricular zone: intrinsic properties in vitro and
following transplantation. Methods, 268-281.
Brunjes, P. C. and Armstrong, A. M. (1996).
Apoptosis in the rostral migratory stream of the developing rat. Brain
Res. Dev. Brain Res. 92,
219-222.
Cagan, R. L. and Ready, D. F. (1989).
Notch is required for successive cell
decisions in the developing Drosophila retina. Genes
Dev. 3,
1099-1112.
Caviness, V. S. (1982).
Neocortical histogenesis in normal and reeler mice. Dev.
Brain Res. 4,
293-302.
Cepko, C., Ryder, E. F., Austin, C. P., Walsh, C. and Fekete, D. M. (1995).
Lineage analysis using retrovirus vectors. Methods
Enzymol. 254,
387-419.
Chitnis, A., Henrique, D., Lewis, J., Ish-Horowicz, D. and Kintner, C. (1995).
Primary neurogenesis in Xenopus embryos regulated by a
homologue of the Drosophila neurogenic gene Delta. Nature
375,
761-766.
Coffman, C. R., Skoglund, P., Harris, W. A. and Kintner, C. R. (1993).
Expression of an extracellular deletion of Xotch diverts cell fate in Xenopus
embryos. Cell 73,
659-671.
Doetsch, F., Caille, I., Lim, D. A., Garcia-Verdugo, J. M. and Alvarez-Buylla,
A. (1999). Subventricular zone
astrocytes are neural stem cells in
the adult mammalian brain. Cell 97,
703-716.
Dorsky, R. I., Chang, W. S., Rapaport, D. H. and Harris, W. A. (1997).
Regulation of neuronal diversity in the Xenopus retina by Delta signalling.
Nature 385,
67-70.
Franklin, J. L., Berechid, B. E., Cutting, F. B., Presente, A., Chambers, C.
B., Foltz, D. R., Ferreira, A. and Nye, J. S. (1999).
Autonomous and non-autonomous
regulation of neurite development by Notch1 and Delta1. Curr.Biol.
9,
1448-1457.
Furukawa, T., Mukherjee, S., Bao, Z. Z., Morrow, E. M. and Cepko, C. L. (2000).
rax, Hes1, and notch1 promote the formation of Muller glia by
postnatal retinal progenitor cells. Neuron
26,
383-394.
Gaiano, N., Kohtz, J. D., Turnbull, D. H. and Fishell, G. (1999).
A method for rapid gain-of-function studies in the mouse embryonic nervous
system.
Nat. Neurosci. 2,
812-819.
Gaiano, N., Nye, J. S. and Fishell, G. (2000).
Radial glial identity is promoted by Notch1 signaling in the murine forebrain. Neuron
26,
395-404.
Ghosh, A. and Greenberg, M. E. (1995).
Distinct roles for bFGF and NT-3 in the regulation of cortical neurogenesis. Neuron
15,
89-103.
Gong, Q. and Shipley, M. T. (1995).
Evidence that pioneer olfactory axons regulate telencephalon cell cycle kinetics
to induce the formation of the
olfactory bulb. Neuron 14,
91-101.
Hartenstein, V. and Posakony, J. W. (1990).
A dual function of the Notch gene in Drosophila sensillum development. Dev.
Biol. 142,
13-30.
Henrique, D., Hirsinger, E., Adam, J., Le Roux, I., Pourquie, O.,
Ish-Horowicz, D. and Lewis, J. (1997).
Maintenance of neuroepithelial
progenitor cells by Delta-Notch signalling in the embryonic chick retina. Curr.
Biol. 7,
661-670.
Jacobson, M. (1991). Developmental
Neurobiology. New York: Plenum
Press.
Jan, Y.-N. and Jan, L.-Y. (1990).
Genes required for specifying cell fates in Drosophila embryonic sensory nervous
system. Trends in Neurosci. 13,
493-
498.
Johe, K. K., Hazel, T. G., Muller, T., Dugich-Djordjevic, M. M. and McKay, R.
D. (1996). Single factors direct
the differentiation of stem cells
from the fetal and adult central nervous system. Genes
Dev. 10,
3129-3140.
Levison, S. W. and Goldman, J. E. (1993).
Both oligodendrocytes and astrocytes develop from progenitors in the
subventricular zone of postnatal
rat forebrain. Neuron 10,
201-212.
Levison, S. W., Chuang, C., Abramson, B. J. and Goldman, J. E. (1993).
The migrational patterns and developmental fates of glial precursors in the
rat subventricular zone are temporally regulated. Development
119,
611-622.
Lewis, J. (1996). Neurogenic
genes and vertebrate neurogenesis. Curr.
Opin.Neurobiol. 6,
3-10.
Lillien, L. (1995). Changes in
retinal cell fate induced by overexpression of EGF receptor. Nature
376,
158-162.
Lindsell, C. E., Boulter, J., diSibio, G., Gossler, A. and Weinmaster, G. (1996).
Expression patterns of Jagged, Delta1, Notch1, Notch2, and Notch3
genes identify ligand-receptor pairs that may function in neural development.
Mol. Cell. Neurosci. 8,
14-27.
Luskin, M. B. (1993). Restricted
proliferation and migration of postnatally generated neurons derived from the
forebrain subventricular zone. Neuron
11, 173-189.
Marin-Padilla, M. (1978). Dual
origin of the mammalian neocortex and evolution of the cortical plate. Anat.
Embryol. 152,
109-126.
McConnell, S. K. (1988). Fates
of visual cortical neurons in the ferret after isochronic and heterochronic
transplantation. J. Neurosci. 8,
945-974.
Mombaerts, P., Wang, F., Dulac, C., Chao, S. K., Nemes, A., Mendelsohn, M.,
Edmondson, J. and Axel, R. (1996).
Visualizing an olfactory sensory
map. Cell 87,
675-686.
Morrison, S. J., Perez, S. E., Qiao, Z., Verdi, J. M., Hicks, C., Weinmaster,
G. and Anderson, D. J. (2000).
Transient Notch activation initiates an
irreversible switch from neurogenesis to gliogenesis by neural crest stem
cells. Cell 101,
499-510.
Morshead, C. M. and van der Kooy, D. (1992).
Postmitotic death is the fate of constitutively proliferating cells in the
subependymal layer of the adult
mouse brain. J. Neurosci. 12,
249-256.
Morshead, C. M., Reynolds, B. A., Craig, C. G., McBurney, M. W., Staines, W.
A., Morassutti, D., Weiss, S. and van der Kooy, D. (1994).
Neural stem cells in the adult mammalian forebrain: a relatively quiescent
subpopulation of subependymal cells. Neuron
13,
1071-1082.
Morshead, C. M., Craig, C. G. and van der Kooy, D. (1998).
In vivo clonal analyses reveal the properties of endogenous neural stem cell
proliferation
in the adult mammalian forebrain. Development
125,
2251-2261.
Nye, J. S. and Kopan, R. (1995).
Developmental signaling. Vertebrate ligands for Notch. Curr.
Biol. 5,
966-969.
Nye, J. S., Kopan, R. and Axel, R. (1994).
An activated Notch suppresses neurogenesis and myogenesis but not gliogenesis in
mammalian cells.
Development 120,
2421-2430.
Paterson, J. A., Privat, A., Ling, E. A. and Leblond, C. P. (1973).
Investigation of glial cells in semithin sections. 3. Transformation of
subependymal cells into glial cells, as shown by radioautography after 3
H-thymidine injection into the lateral ventricle of the brain of young rats. J.
Comp. Neurol. 149,
83-102.
Qian, X., Davis, A. A., Goderie, S. K. and Temple, S. (1997).
FGF2 concentration regulates the generation of neurons and glia from multipotent
cortical stem cells. Neuron 18,
81-93.
Renfranz, P. J., Cunningham, M. G. and McKay, R. D. (1991).
Region-specific differentiation of the hippocampal stem cell line HiB5 upon
implantation into the developing mammalian brain. Cell
66,
713-729.
Reynolds, B. A. and Weiss, S. (1992).
Generation of neurons and astrocytes from isolated cells of the adult mammalian
central nervous system. Science
255, 1707-1710.
Sestan, N., Artavanis-Tsakonas, S. and Rakic, P. (1999).
Contact-dependent inhibition of cortical neurite growth mediated by notch
signaling. Science
286, 741-746.
Shellenbarger, D. L. and Mohler, J. D. (1978).
Temperature sensitive periods and autonomy of pleiotropc effects of I(1)Nts1, a
conditional lethal Notch
in Drosophila. Dev. Biol. 62,
432-446.
Shihabuddin, L. S., Hertz, J. A., Holets, V. R. and Whittemore, S. R. (1995).
The adult CNS retains the potential to direct region-specific
differentiation of a transplanted neuronal precursor cell line. J.
Neurosci. 15,
6666-6678.
Simpson, P. and Carteret, C. (1990).
Proneural clusters: equivalence groups in the epithelium of Drosophila. Development
110,
927-932.
Smith, C. M. and Luskin, M. B. (1998).
Cell cycle length of olfactory bulb neuronal progenitors in the rostral
migratory stream. Dev. Dyn. 213,
220-
227.
Snyder, E. Y., Deitcher, D. L., Walsh, C., Arnold-Aldea, S., Hartwieg, E. A.
and Cepko, C. L. (1992).
Multipotent neural cell lines can engraft and
participate in development of mouse cerebellum. Cell
68,
33-51.
Suhonen, J. O., Peterson, D. A., Ray, J. and Gage, F. H. (1996).
Differentiation of adult hippocampus-derived progenitors into olfactory
neurons in vivo. Nature 383,
624-627.
Wakamatsu, Y., Maynard, T. M., Jones, S. U. and Weston, J. A. (1999).
NUMB localizes in the basal cortex of mitotic avian neuroepithelial cells
and modulates neuronal differentiation by binding to NOTCH-1. Neuron
23,
71-81.
Zhong, W. M., Jiang, M. M., Weinmaster, G., Jan, L. Y. and Jan, Y. N. (1997).
Differential expression of mammalian Numb, numb-like and Notch1
suggests distinct roles during mouse cortical neurogenesis. Development
124,
1887-1897.
Zhu, G., Mehler, M. F., Zhao, J., Yu Yung, S. and Kessler, J. A. (1999).
Sonic hedgehog and BMP2 exert opposing actions on proliferation and
differentiation of embryonic neural progenitor cells. Dev.
Biol. 215,
118-129.
Генерация нейральных предшественников ограничивается Notch
signaling (Coffman et al., 1993; Lewis, 1996; Nye et al.,
1994). Лигандами для Notch является DSL
семейство, Delta, Serrate and Lag2 (for a review see Nye and Kopan, 1995). Взаимодействие Notch с лигандами ведет к
продукции двух различных типов клеток из идентичныъх предшественников (Simpson and Carteret,1990). Notch1, Notch3 и Delta1 (a Notch ligand) экспресируются в эмбриональном telencephalon (Lindsell et al., 1996). Активированный ретровирусом Notch1
ингибирует генерацию нейронов во всех
областях и усиливает генерацию глии,
экспрессирующей glial fibrillary acidic protein (GFAP), в
кортикальных регионах. Активированный Notch1
подавляет генерацию ОВ клеток, тогда как он
усиливает генерацию клеток subventricular
zone (SVZ) . Постнатальные инъекции в переднюю
часть SVZ выявляют, что активированный Notch1
трансформирует предшественики OB в
покоящиеся, немигратоные клетки,
напоминающие стволовые (Nye et al., 1994).
Результаты
Изучали последствия избытка сигнала
Notch1 in vivo в клетках и регионах
предшественников телэнцефалона ,
используя двухцистронный не способный к
репликации ретровирус. После
вентрикулярных инъекций в средине
нейрогенеза(E14.5),активированный ретровирусом Notch1
заметно ингибировалась генерация нейронов
из предшественников телэнцефалона,
задерживалось появление клеток из SVZ и
усиливалась продукция глиального
потомства в neo- и archicortex. Однако,
активированный Notch1 оказывал другой
эффекты на предшественников ОВ, заметно
редуцируя число клеток любого типа, которые
здесь мигрируют. Анализировали коротко- и
долго-временные культуры E14.5 telencephalic
предшественников.
Установлено, что активированный Notch1 вызывает
прекращение пролиферации, которое
совпадает и ингибированием генерации
нейронов. Позднее, во время глиогенеза,
активированный Notch1 запускает быструю
пролиферацию клеток с существенным
увеличением числа клеток, экспрессирующих
GFAP. Stereotaxic инъекции в раннюю
постнатальную переднюю SVZa позволили
наблюдать, что предшественники ОВ отвечают
на сигналы Notch signals тем, что остаются
quiescent и неспособны давать
дифференцированное потомство какго-либо
типа в отличие от кортикальных клеток-предшественников,
кодорые дают глию вместо нейронов.
Следовательно, Notch
сигналы влияют на состав областей
переднего мозга , модулируя скорость
пролиферации клеток нейральных
предшественников.
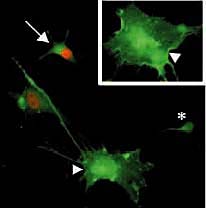 Fig. 8. Продукция
quiescent нейральных предшественников с
помощью Notch1IC ретровирусов в
кратковременных культурах.
Иммунофлюоресценция двойной метки на
щелочную фосфатазу и BrdU. Большинство
предшествеников, инфицированных
контрольным вирусом, было позитивно как
в отношении щелочной фосфатазы, так и
BrdU (стрелки), тогда как популяция
предшествеников, инфицированных Notch1IC
вирусом было позитивно в отношении
щелочной фосфатазы, но BrdU негативно (головки
стрелок). Эти клетки были типично
большими и плоскими. Кроме того видна
клетка с нерональной морфологией (звездочка).
Во вставке представлена другая
типичная alkaline phosphatase
positive/BrdU negative клетка. |
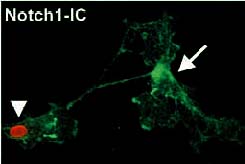 Fig. 9. Усиление
пролиферации с помощью Notch1IC ретровируса
на 16-й день телэнцефалической культуры.
То же двойное мечение. Тогда как
большинство контрольных инфицированных
предшественников BrdU негативно (стрелка),
субпопуляция, инфицированная Notch1IC,
была позитивной как в отношении
щелочной фосфатазы, так и BrdU (головки
стрелок). |
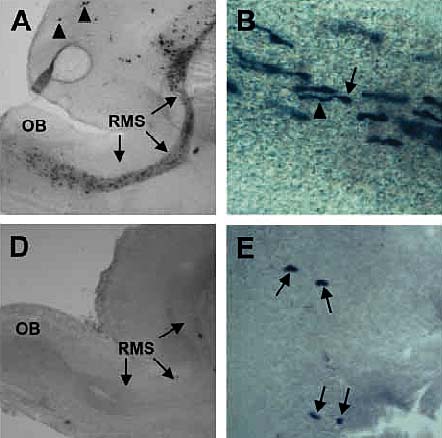
Fig. 12. Эффект
ретровирусного Notch1IC на клетки
передней части SVZ , вступающие в rostral
migratory stream (RMS). Control (A,B) или Notch1IC-IAP (D,E)
вирусы в эквивалентных титрах
стереотактически инъецированы в SVZa P2
крыси срезы головного мозга окрашены
X-phos реагентами. Сагитальный срез
контрольного инъецированного мозга (A)
на ст. P7 выявляет многочисленные
меченные клетки в SVZa,RMS
и OB. Сходный сагитальный срез головного
мозга, инъецированный Notch1IC (D) на P7 обнаруживает очень
мало меченных клеток в тех же самых
областях. Клетки внутри RMS контрольно
инъецированных животных (B)
обнаруживают типичную миграторную
морфологию с ведущим отростком (головка
стрелки), отходящим от тела клетки (стрелка)
в направлении цели миграции ( OB
расположены слева). Эти клетки мигрируют
к ОВ, где они дифференцируются в слой
гранулярных клеток (не показаны) и
перигломерулярные интернейроны.. Тогда
как Notch1IC ретровирус дает намного меньше
меченных клеток в SVZa Notch1IC-инъецированных
животных (E, стрелки). У них
отсутствуют ведущие отростки и другие
признаки дифференцировки. |
|
После экспрессии активрованного
Notch1 в средине беременности пролиферирующие
клетки neo- и archicortex временно персистируют как SVZ
предшественники, а затем генерируют первичную глию в больших
количествах. Notch активация
первоначально обусловливает затухание
пролиферации без дифференцировки во
время фазы генерации нейронов, а когда
генерируется глия, Notch активация ускоряет скорость ее
пролиферации(Furukawa et al., 2000; Gaiano et al., 2000; Morrison et
al.,2000),включая neo- archicortex (this study), Notch
сигналы управляют предшественниками в
ранних постнатальных ОВ, так что они теряют
способность становиться зрелыми клетками и
остаются немиграторными и quiescent. Различия в ответе на
Notch сигналы указывают на то, они зависят от компетенции клеток
Notch signals and neural fates in cortical regions
Кортикальные предшественники генерируют множественные
слои нейрональных клеток последовательно
во времени, что сопровождается
образованием кортикальной глии.
Кортикальный нейрогенез у млекопитающих
называется вторичным, т. к. он
накладывается на первичные
нейрональные структуры (scaffold),
характерные для низших позвоночных (Marin-Padilla,1978).
Телэнцефалон использует Notch сигналы для
ограничения продукции их нейрональной
популяции, как это имеет место при
первичном нейрогенезе (Chitnis et al., 1995;Coffman et al., 1993; Lewis, 1996). В
отличие от первичного нейрогенеза, однако,
негативная регуляция, по-видимому,
необходима в слоистых кортикальных
структурах для поддержания
предшественников для последующих ступеней
их онтогенетического пути, когда
генерируются дополнительные типы нейронов
(Dorsky et al., 1997; Lewis, 1996).
Передача сигналов Notch-Delta регулирует формирование различных типов
клеток в многослойной сетчатке (Dorsky et al., 1997; Henrique et al., 1997). Сходная
роль Notch наблюдается и в
развитии Drosophila (Cagan and Ready, 1989; Hartenstein and
Posakony, 1990;Shellenbarger and Mohler, 1978).Мы
наблюдали, что Notch1IC задерживает
созревание SVZ клеток в neo-
archicortex в то время. когда
преимущественно генерируются нейроны. В
результате задержки дифференцировки
персистирут клетки предшественники в
SVZ , которые фенотипически малы и образуют большие
кластеры. Мы обнаружили, что эти клетки
постепенно уменьшаются в числе от
постнатального дня P9 к P21. Напротив количество глии в результате активирования Notch1 увеличивается с
возрастом, которая формируется из клеток
предшественников SVZ. Глиальный кластер
также увеличивается за счет пролиферации
глиии или глиальных предшественников. Наблюдение, что нейральные предшественники, в которых
активирован Notch, не подвергаются апоптозу, указывает
на то, что Notch сигналы не запускают программу гибели
нейральных предшественников, чтобы
ограничить нейрогенез. Уменьшение
неокортикальных нейронов, инфицированных
Notch1IC вирусом с ~15%
до ~1% с P9 до P21 м.б. следствием
усиления пролиферации других клеток.
Однако нейроны, которые дают аномальные
отростки при избытке Notch
сигналов, не выживают(Franklin et al., 1999; Sestan et al., 1999).
Поэтому нельзя исключить возможность, что гибель клеток
играет роль в изменении количества клеток. То что
Notch сигналы в телэнцефалоне способствуют
дифференцировке глии согласуется с данными,
что Notch помогает
дифференцировке радиальной глии и
ретинальной (Muller)
глии (Furukawa et al., 2000; Gaiano et al.,2000; Morrison et al., 2000). Переключение на продукцию глии наблюдали и
в ПНС Drosophila (Hartenstein and
Posakony, 1990; Jan andJan, 1990).
В данной работы установлено, что этот
эффект осуществляется в два этапа в клетках,
компетентных генерировать глию.Во-первых,
Notch индуцирует фазу, во время которой quiescent
нейрональные предшественники м.б. респецифицированы в
предшественники глии. Затем
глия или глиальные предшественники
приобретают высокуд скорость пролиферации.
Известно, что кластеры радиальной глии или быстро
пролиферирующие или покоящиеся в ответ на Notch
активацию(Gaiano et al., 2000). Предполагается, что Notch сигналы
действуют скорее инструктивно (Morrison et al., 2000).
Однако имеется много примеров того, что
мультипотентные нейралные
предшественникине отвечают на сигналы
Notch глиогенезом (Cagan and Ready,1989; Dorsky et al., 1997; Henrique et al., 1997).
В согласии с этим и наблюдение данной
работы, что постнатальные SVZa клетки
отвечают на Notch quiescence скорее, чем
глиогенезом. Поэтому сигналы Notch играют скорее пермиссивную, чем инструктивныю роль во многих случаях. Notch1, Notch 3 и Delta1 экспресируются в телэнцефалоне в средине
нейрогенеза у грызунов (Lindsell et al., 1996; Zhong et al., 1997), и что Numb играет роль по модуляции
сигналов Notch в кортикальном развитии у
кур (Wakamatsu et al., 1999).
Olfactory neurogenesis and Notch signals
Клетки, предназначенные для ОВ
происходят из передней области дорсального
телэнцефалона под действием сигналов,
иницируемых первичными обонятельными
аксонами (Gong and Shipley, 1995), и этот нейрогенез
продолжается и у взрослых (Bayer, 1980). Нами
выявлены различия в реакции на сигналы Notch
обонятельных и кортикальных
предшественников после специализации
предшественников ОВ. Постнатальные SVZa
представляют собой очищенную зону с
чрезвычайно быстрой скоростью
пролиферации (Smith and Luskin, 1998) , которая дает
только нейроны по сравнению с соседними SVZ,
которая генерирует постнатально глию
(Levison and Goldman, 1993) и сохраняет способность
давать нейроны in vitro (Reynolds and Weiss,1992).
Более того, SVZa клетки сохраняют свое
предназначение пролиферировать и
мигрировать независимо от радиальной глии (Brock et al., 1998).
Мы наблюдали прекращение созревания в мигрирующие клетки для ОВ в ответ на активирование Notch1; этот эффект был более
заметен при постнатальных инъекциях. Кроме
того предшественники ОВ обнаруживают сдвиг
в своей реакции на сигналы Notch, т.к. они
созревают из нейрон- и глия-генерирующих
клеток только в нейрональные
предшественники в постнатальной SVZa. Quiescence, по-видимому,
перманентная реакция на сигналы Notch.
Интересно, что во взрослых SVZ, кинетика и
клональные характеристики указывают на то.
что обчень большие клоны генерируются из
покоящихся (quiescent) stem-like клеток, некоторые из
которых экспрессируют GFAP (Doetsch et al., 1999; Morshead et
al., 1994; Morshead et al., 1998).
Очевидно Notch сигналы обеспечивают
поддержание специфических
предшественников в
недифференцированном stem-like состоянии.