Gap Junction
ЩЕЛЕВЫЕ СОЕДИНЕНИЯ
|
|
| Щелевые мостики (Gap junctions - плотно упакованные агрегаты от нескольких до свыше 10 5 межклеточных канальцев, которые непосредственно соединяют цитоплазму соседних клеток (Simonand and Goodenough,1998) (Рис.1). Межклеточные каналы позволяют проходить ионам, метаболитам молекулам мессенджеров размером менее ~1 kDa, обепечивая скоординированую активность группы клеток (скорость, синхронность, переключение, симбиоз и стимулирование/супрессия). Например, в сердце ЩС обеспечивают быстрый межклеточный перенос потенциала действия, что ведет к кординированому сокращению кардиомиоцитов. ЩС нервной системы используются для максимальной скорости передачи, синхроности нейральных импульсов и переключения с одного пути на другой. У невозбудимых клеток ЩС обеспечивают симбиотические взаимодействия между высоко дифференцированными, функционирующими клетками и более активными, обновляющимися клетками, которые обеспечивают клеточные функции для обоих типов клеток, таких как хрусталиковые. ЩС могут действовать и как супрессоры мутаций соматических клеток пропуская необходимые метаболиты и сигнальные энзимы. ЩС могут также способствовать и супрессии опухолей
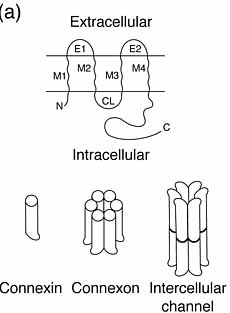 Рис. 1. (a) Трансмембранная топология коннексиновых полипептидов создает 4 мембранных домена (M1–M4), один цитоплазматический (CL) и две внеклеточных (E1 and E2) петли, а также N- и C-окончания, обращенные в цитоплазму. Fourier микроскопия показывает, что M1–M4 упакованы в α спирали, образующие одиночную коннексиновую субъединицу. Эти субъединицы олигомеризуются в коннексон внутри мембраны одиночной клетки, который соединяется с таким же коннексоном соседней клетки, формируя межклеточный канал.
Figure 1. (a) The transmembrane topology of a generic connexin polypeptide creates four membrane domains (M1–M4), one cytoplasmic (CL) and two extracellular (E1 and E2) loops, and the N- and C-termini face the cytoplasm. Fourier microscopy shows that M1–M4 are packed α helices, creating a single connexin subunit. These subunits oligomerize into a connexon within the membrane of a single cell, which docks with a counterpart in an adjacent cell to form the intercellular channel. |
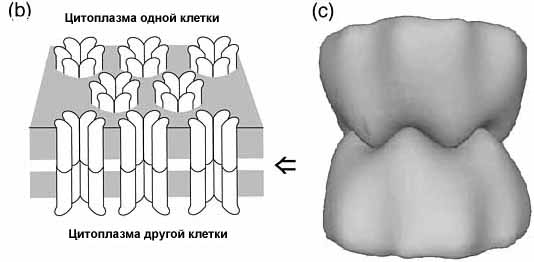 Рис. 1. (b) ЩС варьируют по числу межклеточных канальцев, собранных в пучки в местах тесного прилежания плазменных мембран двух клеток, создавая 3-nm `intercellular gap' и формируя осевой каналец, соединяющий цитоплазмы клеток. Затененная плосковть означает липидный бислой. Стрелка указывает положение межклеточного пространства. (c) Модель соединения взаимодействующих коннексонов. Модель основана на трехмерных реконструкциях картин, полученных с помощью Fourier микроскопии печеночных коннексонов крыс. 6 выступающих пиков на внеклеточной поверхности одного коннексона соответствуют 6 впадинам на внеклеточной поверхности другого коннексона. Модель нуждается в 30° ротации одного коннексона относительно своего партнера.
Figure 1. (b) Gap junctions are variable numbers of intercellular channels clustered at close appositions of the plasma membranes of two cells, leaving a 3-nm `intercellular gap' and forming axial channels connecting the cytoplasms of the cells. The shaded planes represent the lipid bilayers. Arrow - intercellular space. (c) Model of the docking interactions between interacting connexons. The model is based on a three-dimensional image reconstruction using data obtained from Fourier microscopy of rat liver connexons. The six protruding peaks on the extracellular surface of one connexon fit into the six valleys on the extracellular surface of the other connexon, forming a tight seal. The model requires a 30° rotation of one connexon with respect to its docking partner |
Переход метаболитов высокой энергии через ЩС зарегистрирован, однако ткане-специфичная роль этого перехода не может быть понята c помощью in vitroкультур.
ЩС позвоночных образуются белковыми субъединицами мультигенного семейства конексинов. У беспозвоночных межклеточные канальцы собираются из белков совсем другого семейства innexins (invertebrate connexins). В геноме мыши выявлено 14 различных коннексиновых гена и по крайней мере 6 других выделено у других позвоночных коннексинов. Так как ортологи последних 6 известны и в геноме мыши, то их число превышает 20. Большинство генов коннексинов имеют простую структуру, в которой вся кодирующая область представлена одиночным экзоном, хотя выявлен новый класс, содержащий интрон в кодирующей области. Коннексины имеют 4 трансмембранных домена и ориентированы N- и C-концами в цитоплазму (Рис.1). 2 внеклеточные петли и трансмембранный домен наиболее сильно законсервированы , тогда как цитоплазматическая петля и С-концевой хвост обнаруживают существенные различия последовательностей. Предполагаемая мол. масса от 26 до 60 kDa, предопределяет основную номенклатуру коннексинов, хотя используется и греческая номенклатура.
Сообщения через ЩС нуждается в сборке межклеточных канальцев, которая осуществляется в результате соединения (docking) полуканальцев называемых коннексонами (connexons). 6 коннексинов выстилают центральную пору , коннексион (Рис.1a)содержат или коннексины одного типа (гомомерные) или множественные коннексины (гетеромерные). Кроме того соседние клетки могут использовать идентичные или или разного состава коннексионы, фомируя таким образом гомотипичные или гетеротипичные межклеточные канальцы. Поэтому число структурно и физиологически отличающихся канальцев очень велико. Разные канальцы отличаются проницаемостью краски и сигнальных молекул таких как cAMP и cGMP. Разнообразие коннексинов позволяет формировать коммуникационные компартменты в ткани, так как даный коннексин может в норме формировать функциональные гетеротипические канальцы только с субнабором других членов семейства. Межклеточные канальцы собираются в кластеры, щелевые соединения (ЩС), которые исключают другие интегральные белки, и дают зазор между клеточными мембранами ~3-nm (Рис.1.b).
Структура канальцев (Channel structure)
Криоэлектронная микроскопия и image analysis of highly ordered, двумерных кристаллов с С-конца укороченных connexin 43 (Cx43) были использованы для получения электрон-плотной карты проэкций при 7 Å разрешении. Это выявило для каждого канальца наличие внутреннего кольца из 6 трансмембранных α спиралей, выстилающих пору и второго наружного кольца из 6 α спиралей,расположенных лицом к мембранным липидам. Внутреннее и наружные кольца α спиралей возникают в результате точного сопоставления спиралей каждого из оппозитных коннексонов, перпендикулярных к плоскости мембран. Эти два кольцевых сендвича дают циркулярную полосу плотностей, соответствующих α спиралей tilted in the projection plane. Одна модель предполагает, что два коннексона канальца ротированы относительно друг друга на 30° так что каждая коннексиновая субъединица контактирует с двумя коннексинами апозитной мембраны. 30° ротация оппозитных коннексинов дедуцируется и из низкоразрешающей трехмерной реконструкции ЩС печени крыс , содержащих Cx32 и Cx26 . Выявляются 6 четко определенных выступающих долей на каждом коннексоне в межклеточной щели. Чтобы сформировать герметическое соединение во внеклеточном пространстве 6 выступов одного коннексона должны попась в 6 впадин другого коннексона (Рис.1.c). Эта модель ключа и замка (`lock and key') нуждается в 30° ротации оппозитных конексонов.
Химерный белок коннексин43-GFP (green fluorescence protein) способен формировать функциональные шелевые соединения. Большинство канальцев содежат одну или несколько Cx43GFP субъединиц. Период полу-жизни Сх43 порядка 1-2 ч. Нет информации о периоде полу-жизни отдельных бляшек щелевых соединений. Одни собираются и разбираются в течение нескольких минут, когда межклеточные контактакты формируются и разрываются. Другие бляшки, в особенности большие, живут дольше меняя немного свои размеры, положение и вид в течение 2 ч или больше. Неясно пока происходит ли замена в таких стабильных бляшках отдельных канальцев (Holm et al., 1999).
В присутствии форсколина, увеличивающего концентрацию цАМФ, флюоресценция в новых местах контактов непрерывно увеличивается по крайней мере в течение 1 ч, отражая постоянную аггрегацию Cx43GFP-содержащих межклеточных канальцев в области контакта. Бляшки щелевых соединений могут расти и за счет рекрутации коннексонов из соседних областей мембран или/и целенаправленной инсерции коннесонов из цитоплазмы ( из транс-Гольджи сети) прямо в контактирующие мембраны.
цАМФ обусловливает аггрегацию коннексонов в бляшки щелевых соединений с помощью механизма, независимого от синтеза белка Сх43.
Функция Сх32 в ЩС у человека при болезнях и у мышей при нокауте
X-сцепленная форма Charcot–Marie–Tooth disease (CMTX), нейропатии, возникающая в результате прогрессивной дегенерации периферических нервов, является результатом по крайней мере 90 различных Cx32 мутаций. Некоторые из них инактивируют, тогда как другие мутации нарушают активность канальцев.
Cx32 был локализован в incisures of Schmidt–Lanterman и в паранодальных областях, ограничивающих узлов Ranvier в Шванновских клетках, которые миэлинизируют периферические нервы. В отличие от компактных миэлиновых слоев, эти области Шванновских клеток характеризуются значительными количествами цитоплазмы и возможно, что Cx32 используется для образования `reflexive' ЩС между обертками Шванновских клеток в этих областях. Так как спирализованные цитоплазматические пути от перинуклеарной к периаксонаmyой цитоплазме очень длинны, то диффузия молеул должна протекать очень медленно для поддержания метаболизма и необходимых для клетки синалов. Reflexive ЩС делают этот путь короче, формируя `self-symbiotic' радиальные пути диффузии.
Cx32 нокаутные мыши выглядят нормально и не имеют аномалий повдения, но гистологически обнаруживается нейропатия со средним и поздним началом, характеризующаяся тонкими миэлиновыми слоями, cellular onion bulb formation and enlarged periaxonal collars. Так как эти гистолоические изменения сходны с таковыми у пациентов с CMTX, свойства передачи нервных импульсов нарушены лишь слегка и не имеется видимой мышечной слабости, следовательно, у мышей фенотип CMTX пациентов воспроизводится неполностью. Это м. б. связано с относительно короткими нервами у мышей.
Cx32 экспрессируется на высоком уровне в гепатоцитах, при нокауте выявляются нарушения функции печени, снижение реакции образования глюкозы из глюкагона после стимуляции обусловлено не снижением норадреналиновых рецепторов или хранилищ глюкагона, а в резуьтате нарушения коммуникаций у Cx32 нокаутных животных. Нейральная стимуляция портальных гепатоцитов вызывает генерацию внутриклеточного inositol (1,4,5)-trisphosphate и высвобождение Ca 2+ из внутриклеточных хранилищ, оба из которых мигрируют между клетками через ЩС. Проводя эти сигнальные молекулы Cx32-содержащие ЩС позволяют стимулировать продукцию глюкозы вдали от локальных нормадреналиновых стимулов.
Помимо нарушения мобилизациии глюкозы Cx32 нокаутные мыши обнаруживают высокий показатель спонтанных и химически индуцированных опухолей печени. Отсутствие Cx32 в гепатоцитах вносит вклад в усиление клональной экспансии тумор-инициирующих клеток. Ингибирующие сигналы, проходящие через межклеточные канальцы вносят в клад в контроль за ростом и, следовательно, ЩС действуют как супрессоры опухолей.
У Cx32 нокаутных мышей, уровни Cx26 неожиданно оказались сниженными, указывая тем самым, что имется взаимодействие между уровнями экспрессии двух коннексинов и что оставшийся Cx26 неспособен полностью заменить нормальное число и разнообразие канальцев.
Болезни при мутациях Cx26 и фенотип Cx26 нокаутных мышей
Мутации в Cx26 ответственны за аутосомно рецессивную и доминантную несиндромальную глухоту. Cx26 экспрессируется на высоком уровне в cochlea внутреннего уха между поддерживающими клетками и органом Корти и в спиральной ламине, смотрящей в эндолимфатический проток. Возможно, что серийно аранжированные ЩС эпителиальных и соединительнотканных клеток служат кондутитом (conduits) для рециклинга K +, высвобождаемого активированными сенсорными волосковыми клетками после накопления этих ионов поддерживающими клетками. Обеспечение путей для движения K + от активных вестибулярных волосковых клеток должно осуществляться ЩС
В противоположность глухоте у людей с мутацией Cx26, при нокауте гена,кодирующего Cx26, у мышей наблюдается гибель примерно на 11 день эмбрионального развития. У них снижен трансплацентраный перенос через хорионалантоисную плаценту. Эти данные согласуются с высоким уровенем экспрессии Cx26 двумя оппозитными слоями клеток, синцитиотрофобластами I и II, в лабиринтном слое плаценты. Очевидно, что Cx26-содержащие канальцы ЩС обеспечивают путь для диффузии глюкозы между двумя слоями синцитиотрофобластных клеток. Плацента человека содержит только один слой синцитиотрофобластных клеток.
Стерильность самок Cx37 нокаутных мышейГомозиготные Cx37 нокаутные самки бесплодны, так как овариальные фолликулы неспособны проходить ранние антральные (antral) стадии. Из-за отсуствия ЩС-опосредованных сигналов большинство ооцитов неспособно заканчивать рост и получать мейотичскую компетентность. Cx37 составляет существенный компонент ЩС, формируемых между ооцитом и гранулезными клетками of the cumulus (Рис.2). Потеря Cx37 не просто качественно меняет большое число Cx43-содержащих ЩС купирующих гранулезные клетки. Гранулезные клетки в некоторых фолликулах интерпретируют потерю сообщений через ЩС с ооцитом как эквивалент овуляции и лютеинизируются,приобретая морфологические характеристики прогесторон-секретирующих клеток. Следовательно, в нормальном фолликуле ингибирующий сигнал переносится через ЩС от ооцита к гранулезным клеткам и предупреждает их лютеинизацию вплоть до овуляции.
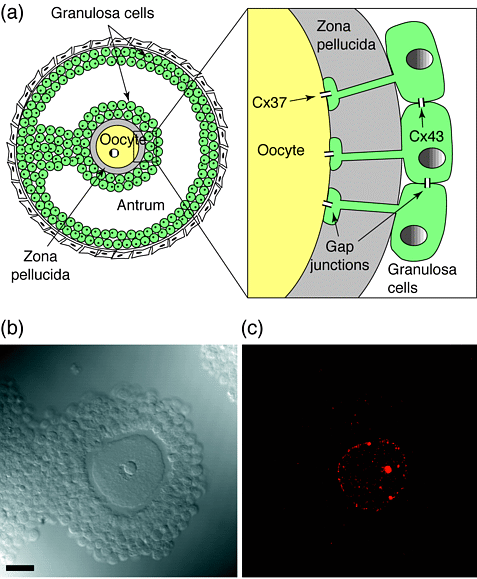 Рис. 2. Опосредованное ЩС купирование клеток фолликулов яичника . (a) Схема Граафового пузырька. Ооцит секретирует слой гликопротеинов, называемый прозрачной зоной (zona pellucida). Гранулезные клетки формируют стенки фолликула и кумулюсной массы (cumulus mass) вокруг ооцита,что ведет к появлению заполненного жидкостью антрума (antrum). Гранулезные клетки соединены друг с другом с помощью ЩС, содержащих Cx43. Кроме того, гранулезные клетки кумулюса дают отростки через zona pellucida и образуют ШС с ооцитом. Эти oocyte–granulosa ЩС содержат Cx37. (b) Граафов пузырек, выявляемый с помощью микроскопии Номарского. (c) Конфокальная иммунолокализация Cx37 на том же срезе, что и в (b). Cx37 иммуноокрашивание локализуется преимущественно на поверхности ооцита, хотя некоторое межклеточное окрашивание также обнаруживается . Полоска, 20 µm.
Figure 2. Gap-junction-mediated coupling between cells of the ovarian follicle. (a) Depiction of a Graafian follicle. The oocyte secretes a layer of glycoproteins called the zona pellucida. Granulosa cells form the walls of the follicle and the cumulus mass around the oocyte, leaving a fluid-filled antrum. Granulosa cells are coupled to each other by Cx43-containing gap junctions. In addition, the granulosa cells of the cumulus extend processes through the zona pellucida and make gap junctions with the oocyte. These oocyte–granulosa gap junctions contain Cx37. (b) Nomarski differential interference contrast image of a section through a Graafian follicle, showing the central oocyte and surrounding cumulus of granulosa cells. (c) Confocal immunolocalization of Cx37 in the same section as in (b). Cx37 immunostaining is located predominantly at the surface of the oocyte, although some intracellular staining is also present. Bar, 20 µm. |
Аномальное проведение в сердце мышей с отсутствием Cx40
Cx40 нокаутные мыши выявляют важную роль этого коннексина в быстрой передаче импульсов в His–Purkinje системе, дискретном пути, содержащем быстропроводящие клетки (Purkinje fibres), которые координируют распространение возбуждения от атриовентрикулярного узла к миокарду желудочков (Рис.3). После начала сердцебиений в pacemaker клетки синоатриального узла располагаются в правом предсердии и деполяризация распространяется через миокард предсердия, продуцируя Р волны на электрокардиограмме, но их прохождению в миокард желудочков препятсвует раздляющий слой соединительной ткани. Волна возбуждения передается атриовентрикулярному узлу и потенциал действия проходит медленно через клетки этого узла, обусловливая задержку между активацией предсердий и желудочков. Затем импульсы очень быстро передаются через пучок Гиса, который располагается на вершине межжелудочковой перегородки. Этот пучок, который состоит из волокон Пуркинье дает веточки по обеим сторонам перегородки, формируя сеть волокон, котрые активируют миокрад желудочков на верхушке сердца. В результате волна возбуждения, которая распространяется преимуществено назад ( superiorly back) через желудочки, продуцируя QRS комплекс позитивной и негативной волн на ECG. Волокна Пуркинье являются, следовательно, быстро проводящими благодаря тому, что они обладают быстро-растущим потенциалом действия большой амплитуды ( fast-rising action potentials of large amplitude) и благодаря высокой плотности ЩС, купирующих их. Так как Cx40 экспрессируется обильно в ЩС между волокнами Пуркинье, то следует ожидать, что удаление гена, кодирующего Cx40 должно иметь печальные последствия для атриовентрикулярного проведения, ведущим к полному блоку.
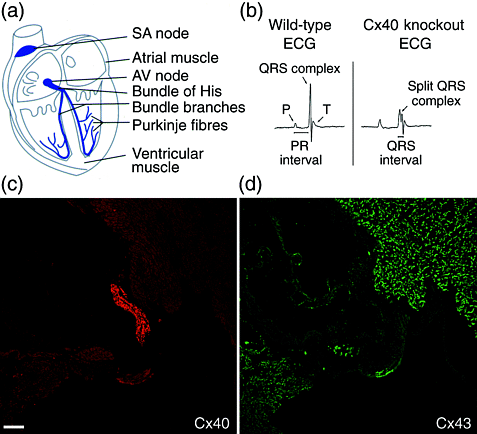 Рис. 3. ЩС в проводящей системе сердца. (a) Фронтальный вид сердца . Специализированная проводящая система сердца показана синим цветом . Пучек Гиса, дает быстро-проводящие волокна Пуркинье, веточки которого идут по обеим сторонам межжелудочковой перегородки. AV, атриовентрикулярный узел; SA, синоатриальный узел. (b) Электрокардиограммы у дикого типа и нокаутных Cx40 мышей. Электрокардиограмма Cx40 нокаутных мышей имеет более длинные PR и QRS интервалы по сравнению с диким типом, указывая на медленное атриовентрикулярное и внутривентрикулярное проведение, соответственно. У Cx40 нокаутных мышей QRS комплексx также аномально расщеплен, указывая на аномальную активацию желудочков. (c) Иммунолокализация Cx40 на поперечных срезах пучка Гиса. Cx40 присутствует в большом количестве в волокнах Пуркинье пучка Гиса (красное окрашивание). (d) Иммунолокализация Cx43 на срезе, соседнем с (c). Cx43 отсутствует в пучке Гиса, но присутствует в соседних кардиомиоцитах (зеленое окрашивание). Полоска, 100 µm.
Figure 3. Gap junctions in the cardiac conduction system. (a) A frontal-plane-cutaway view of the heart. The specialized cardiac conduction system is shown in dark blue. The bundle of His, made up of fast-conducting Purkinje fibres, branches on either side of the interventricular septum. AV, atrioventricular node; SA, sinoatrial node. (b) A comparison of wild-type and Cx40 knockout (KO) electrocardiograms (ECGs). The Cx40 KO ECG exhibits longer PR and QRS intervals than wild-type, indicating slower atrioventricular and intraventricular conduction, respectively. The Cx40 KO QRS complex is also aberrantly split, suggesting abnormal activation of the ventricles. (c) Immunolocalization of Cx40 in a transverse section through the bundle of His. Cx40 is present abundantly in Purkinje fibres of the His bundle (red staining). (d) Immunolocalization of Cx43 in a section adjacent to (c). Cx43 is not present in the His bundle but is present in nearby cardiomyocytes (green staining). Bar, 100 µm.
|
Нарушения проводимости были связаны с His–Purkinje системой, в частности с увелиычением продолжительности PR интервала на ЭКГ, соотвествующему замедленному атриовентрикулярному проведению импульсов (PR - интервал от начала деполяризации предсердий до начала деполяризации желудочков ). Кроме того, проведение внутри желудочков также снижено по сравнению с нормой, на это указывает увеличение продолжительности QRS ( времени, необходимого для полной деполяризации желудочков). Получены данные о нескординированной активации желудочков у Cx40 нокаутных мышей. Волны QRS комплекса были часто аномально расщеплены, что указывает на аномальную активацию желудочков и на отклонение оси в фронтальной плоскости у значительного числа животных, на что указывает измерение of the net направления электрической активности в желудочках. Этот тип изменений ЭКГ в общем характерен для блока ножек пучка, при котором часть His–Purkinje системы имеет аномальное проведение импульса. Первоначально было удивительно, что Cx40 нокаутные мыши не имеют полного блока проведения. Однако недавние исследования показали, что другой коннексин, Cx45, также присутствует в волокнах Пуркинье, это объясняет отсутствие полного блока у Cx40 KO мышей. Cx45 обнаружен также в сообщающихся миокардиоцитах в предсердии Cx40 нокаутных мышей. Хотя Cx45 обилен в проводящей системе, но в отличие от Cx40 он экспрессируется также в некоторых соседних волокнах. В отсутствие Cx40 более широкое распределение Cx45 может вносить свой вклад в аномальную пространственную активацию желудочков. Аномальное развитие сердца у Cx43 нокаутных мышей
Cx43 экспрессируется на высоком уровне в миокарде, но обнаруживается и в большинстве других клеток. Разрушение гена, кодирующего Cx43, дает животных с уродствами области конуса, располагающегося поверх пульмонального (легочного) тракта оттока. Эта область блокирована с помощью внутренней перегородки, которая препятсвует току крови в легкие и в результате отсутствие легочного газообмена и перинатальная гибель. Гетерозиготы жизнеспособны и имеют в основном нормальное сердце, вентрикулярное эпикардиальное проведение составляет всего 44% от уровня у особей дикого типа. Аберрантное развитие конотрункальной области у гомозигот м.б. следствием изменения миграторного поведения клеток нервного гребня, которые экспрессируют Cx43 и участвуют в развитии тракта оттока. Однако, Ya et al, изучавшие развитие сердца у Cx43 KO , установили, что на E10, возникновение D configuration в восходящей петле сердца задержано, что обусловливает предрасположенность миокарда в месте соеднения правого желудочка с пульмональным трактом оттока к избыточному образованию межтрабекулярных карманов. Пока неясна причина исходного нарушения кардиального петлеообразования и как это временное нарушение ведет к аберрантному развитию конотрункальной области.
Cx46 и Cx50 нокаутные мыши имеют катаракты
Как Cx46 нокаутные мыши формируют катаракты, но время, морфология и рост хрусталиков у них не идентичны с Сх50 КО. Хрусталиковые волокна высоко дифференцированные клетки, которые теряют свои органеллы и накапливают высокие концентрации кристаллинов для поддержания оптической прозрачности и рефрактивного индекса. Cx46 и Cx50 экспрессируются в хрусталиковых волокнах и отвечают за соединение клеток в функциональный синцитий. Волокна соединены также ЩС с эпителиальными клетками на передней поверхности хрусталика и оказываются зависимыми от метаболически активного эпителия в отношении поддержания внутриклеточной йонной среды, необходимой для предупреждения преципитации кристаллинов и образования катаракты. Cx46 нокаутные мыши дают прогрессивные синильного типа катаракты после 3-х недельного возраста. Аберрантный протеолиз кристаллиновых белков , в частности γ-кристаллина, наблюдаемый в хрусталиках взрослых, вносит вклад в превращение их в нерастворимую форму. Делеция гена Cx50 также дает катаракту, но в этом случае катаракта является zonular pulverulent типа и развивается после первой постнатальной недели развития. Кроме того у этих мышей маленькие глаза (microphthalmia) и маленькие хрусталики. Задержка роста хрусталиков может отвечать за общий малый размер глаз, как как экспреименты на циплятах показали, что рост глаз зависит от роста хрусталиков. Как Cx50 канальцы в хрусталиковых волокнах связаны с ростом хрусталиков неясно. Интересно, что Cx50 нокаутные хрусталиковые волокна на эмбриональных стадиях E15 and E16 все еще способны к межклеточному переносу трассеров, таких как neurobiotin (Cx46 все еще присутствует в хрусталиковых волокнах), указывая тем самым, что фенотип хрусталиков очень чувствителен к абсолютному числу канальцев между клетками или что Cx50 канальцы обеспечивают перенос молекул, которые не проходят через Cx46 канальцы. Сходное заключение о неравноценности свойств индивидуальных коннексиновых канальцев сделано на основаниии нокаутных мышей Cx32. Согласно Cx50 нокаутному фенотипу, форма врожденной катаракты у человека имеющая zonular pulverulent opacities, была недавно картирована вблизи гена, кодирующего Cx50, однако эти люди не имеют микрофталмии. Затронутые особи имеют единичную точкову мутацию в кодирующей области Cx50 , ведущей к неконсервативной замене серина на пролин во втором трансмембранном домене
|



