Myosin and adaptation by hair cells.
Unconventional myosins: New frontiers in actin-based motors.
Trends Cell Biol1997,7:119–123.
The growing family of myosin motors and their role in neurons and sensory cells.
Curr Opin Neurobiol1997,7:615–623.
The mouse Snell's waltzer deafness gene encodes an unconventional myosin required for structural integrity of inner ear hair cells.
Nat Genet1995,11:369–375.
Correction of deafness in shaker-2 mice by an unconventional myosin in a BAC transgene.
Science 1998,280:1444–1447.
Association of unconventional myosin MYO15 mutations with human nonsyndromic deafness DFNB3.
Science1998,280:1447–1451.
Shaker-1 mutations reveal roles for myosin VIIA in both development and function of cochlear hair cells.
Development1998,125:557–566.
Unconventional myosins in inner-ear sensory epithelia.
J Cell Biol1997,137:1287–1307.
Role of transcription factors Brn-3.1 and Brn-3.2 in auditory and visual system development.
Nature1996,381:603–606.
Essential role of POU-domain factor Brn-3c in auditory and vestibular hair cell development.
Proc Natl Acad Sci USA1997,94:9445–9450.
Mutations in a plasma membrane Ca2+-ATPase gene cause deafness in deafwaddler mice.
Nat Genet1998,19:390–394.
Plasma membrane Ca2+-ATPase extrudes Ca2+ from hair cell stereocilia.
J Neurosci1998,18:610–624.
Evidence for a medial K+ recycling pathway from inner hair cells.
Hear Res1998,118:1–12.
The fine structure of spiral ligament cells relates to ion return to the stria and varies with place-frequency.
Hear Res1996,100:80–100.
Mutations in the gene encoding gap junction protein beta-3 associated with autosomal dominant hearing impairment.
Nat Genet 1998,20:370–373.
Connexin 26 mutations in hereditary non-syndromic sensorineural deafness.
Nature1997,387:80–83.
Connexin 26 gene linked to a dominant deafness.
Nature1998,393:319–320.
Gap junctions in the rat cochlea: immunohistochemical and ultrastructural analysis.
Anat Embryol (Berl)1995,191:101–118.
A novel mutation in the potassium channel gene KVLQT1 causes the Jervell and Lange-Nielsen cardioauditory syndrome.
Nat Genet1997,15186–189.
Cellular localization of rat Isk protein in the stria vascularis by immunohistochemical observation.
Hear Res1991,56:168–172.
Inner ear defects induced by null mutation of the isk gene.
Neuron1996,17:1251–1264.
IsK and KvLQT1: mutation in either of the two subunits of the slow component of the delayed rectifier potassium channel can cause Jervell and Lange-Nielsen syndrome.
Hum Mol Genet1997,6:2179–2185.
Фактор транскрипцииPou4f3 (известный также как Brn3.1 и Brn3c) также необходим для поддержания и/или выживания волосковых клеток [18]. Этот ген экспрессируется во внутренних и наружных волосковых клетках взрослых мышей [18][19]
Ген Pou4f3 необходим не только для генерации или инициальной дифференцировки волосковых клеток, но и для созревания и поддержания волосковых клеток.
Прорлдукт гена Atp2b2 присутствует внутри стереоцилий как внутренних, так и внешних волосковых клеток и участвует в удалении Ca2+ из стереоцилий [23•] [24].
stria vascularis внутреннего уха состоит из трех первичных типов клеток: маргинальных, базальных и меланоцит-подобных промежуточных клеток. Маргинальные клетки эпителиального происхождения и контактируют с эндолимфой, базальные клетки мезенхимного происхождения, они образуют непрерывный слой, выстилающий спиральную лигаменту, а меланоцит-подобные промежутоыные клетки, по-видимому. происходят из клеток нервного гребня и разбросаны между базальными и маргинальными клетками(Fig. 1b).
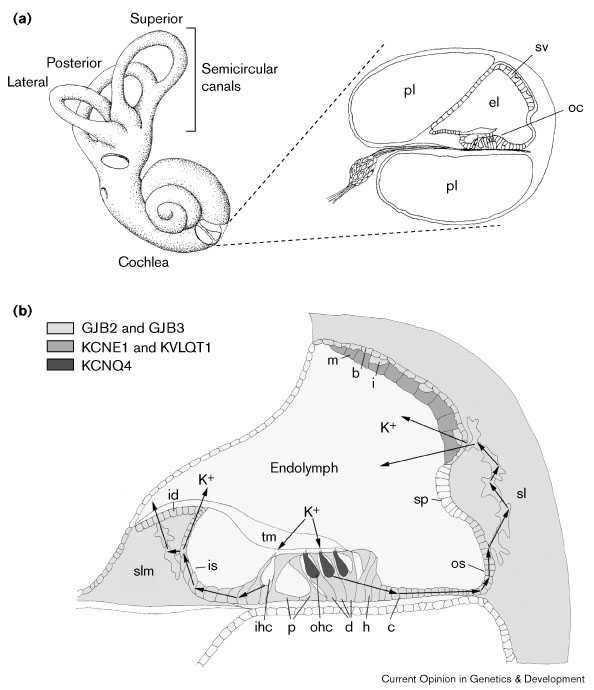 |
Рис. 1 Анатомия улитки и предполагаемые пути дисперсии K+ во время слуховой стимуляции. (a) Поперечный разрез через улитку, показывающий Кортиев органа (oc), расположенный на дне заполненного эндолимфой кохлеарного протока. stria vascularis (sv) располагаются на латеральной стенке улиткового протока. (b) K+, который поступает во внутренние сенсорные волосковые клетки (ihc) возвращается в эндолимфу по медиальному пути, идущем через внутренние клетки борозды (is) и spiral limbus fibrocytes (slm) к interdental клеткам (id). K+, который поступает в наружные сенсорные волосковые клетки (ohc) возвращается в эндолимфу латеральным путем, проходя через Deiter's (d), Hensen's (h), Claudius (c) и наружные клетки борозды (os), затем он проходит через спиральные лигаментозные фиброциты (sl) в stria vascularis. Распределение K+ канальцев (KCNE1, KVLQT1 и KCNQ4) и компонентов щелевых соединений (GJB2, кодируемых коннексином 26 и GJB3, кодируемых коннексином 31), которые могут иргать роль в дисперсии K+ от сенсорных волосковых клеток, как показано в области с разной штриховкой . pl, перилимфа; el, эндолимфа; m, краевые клетки; b, базальные клетки; i, промежуточные клетки; sp, спиральное возвышение; p, pillar клетки; и tm, текториальная мембрана. Figure 1 Cochlear anatomy and proposed routes for K+ dispersal during auditory stimulation. (a) Cross section through the cochlear canal showing the organ of Corti (oc) situated on the floor of the endolymph-filled cochlear duct. The stria vascularis (sv) is situated on the lateral wall of the cochlear duct. (b) K+ which has influxed into inner sensory hair cells (ihc) is thought to return to the endolymph by a medial route, passing through inner sulcus cells (is) and spiral limbus fibrocytes (slm) to interdental cells (id). K+ which has influxed into outer sensory hair cells (ohc) is thought to return to the endolymph by a lateral route, passing through Deiter's (d), Hensen's (h), Claudius (c) and outer sulcus cells (os), whereupon it passes through spiral ligament fibrocytes (sl) to the stria vascularis. The distribution of K+ channels (KCNE1, KVLQT1 and KCNQ4) and gap junction components (GJB2 encoding connexin 26 and GJB3 encoding connexin 31) that may play a role in the dispersal of K+ from sensory hair cells are shown as regions of varying shades. pl, perilymph; el, endolymph; m, marginal cell; b, basal cell; i, intermediate cell; sp, spiral prominence; p, pillar cells; and tm, tectorial membrane. |
Предполагается, что K+ участвует в слуховой стимуляции волосковых клеток, он поступает обратно в эндолимфу по одному из двух путей [42] [43] (Fig. 1b). Из внутренних волосковых клеток K+ отводится соедними поддерживающими клетками, из которых он переносится медиально в interdental клетки, или непосредственно через клетки внутренней бороздки или через фиброциты spiral limbus. Наконец, K+ высвобождается из interdental клеток в эндолимфу. Из наружных волосковых клеток K+ отводится латеральным путем, через Deiter's, Hensen's, Claudius и клетки наружной бороздки, затем через фиброциты spiral ligament в stria vascularis, откуда он снова поступает в эндолимфу.
В улитке взрослых мышей ген калиевых канальцевKcnq4 экспрессируется только в наружных волосковых клетках, подтвержая тем самым, что функция этого канала уникальна для этого типа клеток. Вероятно, каналы играют роль в удалении K+ из наружных волосковых клеток.В поддерживающих клетках K+ движутся между клетками с помощью диффузии через щелевые соединения. Каждая половинка щелевого соединения формируется 6 молекулами коннексина. Мутации GJB2 и GJB3, кодирующих коннексин 26 и коннеексин 31 соответственно, обусловливают сенсорнонейральную глухоту[45] [46] [47]. Эти белки присутствуют в клетках, связанных как с медиальным, так и латеральным маршрутами транспорта K+, это указывает на то, что глухота м.б.обусловлена дефектами транспорта K+ ([48]; J Edwards, A Forge, personal communication).
Маргинальные клетки stria vascularis экспрссируют Kvlqt1 и IsK (известный также как KCNE1) [49] [50]. Кодируемые белки ассоциируют один с другим для образования калиевых канальцев, и способствуют тем самым секреции K+ в эндолимфу. strial маргинальные клетки мышей, гомозиготных по нулевой мутации IsK, неспособны генерировать короткие цируиты тока, указывая тем самым на отсуствие сереции K+ [51]. У человека мутации или KCNE1 или KVLQT1 обусловливают Jervell и Lange-Nielsen синдром, который связан с глухотой [49] [52].
В улитке мышей, субъединица B1 обнаруживается в interdental клетках, указывая на то, что эти клетки могут быть вовлечены в поддержание pH эндолимфы.