Hepatocyte migration during liver development requires Prox1B. Sosa-Pineda, J. N. Wigle, G. Oliver
Nature Genetic, v.25, № 3, p.254-252 (Перевод В.К. Викуловой) |
Известно,что во время ранних фаз спецификации, пролиферации и дифференциации печени необходимо функционирование ряда генов. К ним относится ген Prox1, участвующий в процессе миграции гепатоцитов. При потере гена Prox1 происходит уменьшение размеров печени и уменьшение популяции гепатоцитов, остающихся кластеризованными, окруженными базальной мембраной, богатой ламининами.
У позвоночных первичный зачаток печени (hepatic rudiment) - это выбухание (эвагинация) энтодермы вентральной части передней кишки в направлении мезенхимы поперечной перегородки (septum transversum). После образования зачатка печени базальная мембрана, окружающая эпителий печени, разрушается. Из печеночного эпителия появляется тяж гепатоцитов, который
вторгающийся в поперечную перегородку и латеральные мезенхимальные области долей печени.
О молекулярных механизмах, контролирующих миграцию гепатоцитов после формирования зачатка, известно мало.
Гомеобоксный ген Prox1 был первоначально клонирован при использовании его гомологии с геном prospero Drosophila melanogaster. Функциональная инактивация гена Prox1 с помощью вставки в его рамку считывания гена β-галактозидазы (lacZ) приводит к изменению хрусталика глаза и лимфатических сосудов и к эмбриональной гибели.
Нами показано, что на стадии Е 9.0-9.5 экспрессиия гена Prox1 локализуется в зачатке печени и дорзальной части поджелудочной железы (Рис.1а) . На стадии Е10.0-10.5 экспрессия Prox1 обнаруживается в зачатке печени, желчного пузыря,
дорзальном и вентральном зачатках поджелудочной железы( Рис.1b). При иммуноокрашивании примыкающих срезов эмбрионов Prox1+/- на стадии Е 10.5 с помощью антител к β-галактозидазе, к альбумину или α-фетопротеину установлено, что Prox1-экспрессирующие клетки являются гепатоцитами.
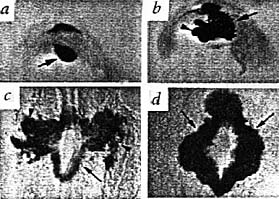
Рис. 1. Остановка миграции гепатоцитов в печени мышей Prox1-/-.(a) На стадии Е 9,5 с помощью X-gal окрашивания обнаружена экспрессия Prox1 в зачатке печени (стрелка) и зачатке дорзальной части поджелудочной железы.(b) На стадии 10,5 обнаружена экспрессия Prox1 в зачатках печени(стрелка), желчного пузыря (кончик стрелки) и дорзальной части поджелудочной железы. (c) В нормальных эмбрионах, на стадии Е 10,0 гепатоциты, экспрессирующие Prox1/β-галактозидазу, отделяются от эпителия печени (стрелка) и внедряются в соседнюю мезенхимальную ткань(кончик стрелки). (d) В эмбрионах Prox1-/-, развивающихся в той же матке, что и нормальные эмбрионы Prox1+/-, популяция X-gal окрашенных клеток (стрелки) остается кластеризованной вблизи эпителия печени. a,b - изображения кишки, передний конец справа. c,d - изображения поперечных срезов.

Рис. 1. Остановка миграции гепатоцитов в печени мышей Prox1-/-.(a) На стадии Е 9,5 с помощью X-gal окрашивания обнаружена экспрессия Prox1 в зачатке печени (стрелка) и зачатке дорзальной части поджелудочной железы.(b) На стадии 10,5 обнаружена экспрессия Prox1 в зачатках печени(стрелка), желчного пузыря (кончик стрелки) и дорзальной части поджелудочной железы. (c) В нормальных эмбрионах, на стадии Е 10,0 гепатоциты, экспрессирующие Prox1/β-галактозидазу, отделяются от эпителия печени (стрелка) и внедряются в соседнюю мезенхимальную ткань(кончик стрелки). (d) В эмбрионах Prox1-/-, развивающихся в той же матке, что и нормальные эмбрионы Prox1+/-, популяция X-gal окрашенных клеток (стрелки) остается кластеризованной вблизи эпителия печени. a,b - изображения кишки, передний конец справа. c,d - изображения поперечных срезов.
Эмбрионы Prox1-/- погибают на стадии Е 14.5-15 в результате тяжелых фенотипических отклонений .У эмбрионов Prox1-/- на стадии Е 14.5 обнаружено уменьшение размеров печени. При Х-gal окрашивании эмбрионов Prox1-/- на стадии Е 12.5 не обнаружено Prox1-экспрессирующих гепатоцитов в большей части печеночных долей за исключением уменьшенного числа клеток, ограниченных центральной частью. В эмбрионах Prox1+/- тяж мигрирующих гепатоцитов можно увидеть на стадии Е 10.0. Он содержит делящиеся клетки, продолжающие пролиферировать даже в более дистальных областях печени (1,4) . В той же области у эмбрионов Prox1-/-, развивающихся вместе с эмбрионами Prox1+/- в одной матке, обнаруживается лишь несколько BrdU-положительных гепатоцитов .
Кроме дефекта пролиферации у эмбрионов Prox1-/- на стадии Е 10.0 найдены отклонения в миграции гепатоцитов. В нормальных эмбрионах, когда начинается миграция гепатоцитов (Рис.1c), базальная мембрана в области печеночного эпителия, где отделяются клетки, теряется. У мутантов с нарушенной функцией гена гепатоциты неспособны мигрировать и остаются в виде аномально кластеризованных клеток вблизи дивертикула печени (Рис. 1d), окруженных непрерывной, богатой ламинином мембраной. Аномальное расположение гепатоцитов и присутствие базальной мембраны, богатой ламинином и коллагеном IV, персистирует у мутантов и в дальнейшем развитии. Это отклонение не мешает дифференциации гепатоцитов, судя по сохраняющейся экспрессии ранних маркеров альбумина и α-фетопротеина . Отсутствие гепатоцитов в большей части долей печени у эмбрионов Prox1 -/- не мешает формированию печени в целом , свидетельствуя о том, что мезенхимальный компонент в значительной степени обеспечивает морфогенетическую информацию.
При нормальном развитии, высокий уровень Е-кадхерина наблюдался только в гепатоцитах , начинающих отделяться от эпителия печени, в мигрировавших же гепатоцитах он падал . У эмбрионов Prox1-/- на стадии Е 11.5 наблюдалось большое количество Е-кадхерина во всех гепатоцитах . На стадии Е 14.5 печень у мутантов Prox1-/- примерно на 70% меньше, чем печень у эмбрионов дикого типа., и гепатоциты остаются кластеризованными. В печени мутантов представлено большинство мезодермальных компонентов, включая дефинитивных предшественников гематопоеза. При анализе клеток печени путем использования метода активированной флюоресценции не было получено различий между миэлоидной и лимфоидной клеточными популяциями у эмбрионов дикого типа и у эмбрионов Prox1-/-. Идентифицированы гены, контролирующие разные этапы морфогенеза печени (c-jun, SF/HGF, c-met) . При RT-PCR анализе не обнаружено значимых отличий в их экспрессии в клетках печени Prox1-/-. Результаты показывают, что ген Prox1 контролирует процесс миграции гепатоцитов из энтодермального эпителия в поперечную перегородку. Это подтверждается остановкой у эмбрионов Prox1-/- отпочковывания и разрастания лимфатических эндотелиальных клеток. Нарушение миграции гепатоцитов Prox1-/- может быть следствием отсутствия деградации окружающей их базальной мембраны и следствием сохранения гепатоцитами тесных клеточных контактов отчасти вследствие сохранения повышенного уровня Е-кадхерина. Нарушение экспрессии Е-кадхерина было обнаружено в хрусталике эмбрионов Prox1-/-. Ген Prox1 может модулировать состояние базальной мембраны путем регуляции неизвестного протеолитического каскада. Или , он может регулировать скорость синтеза компонентов базальной мембраны в развивающейся печени.