Имеются два основных пути, с помощью которых extracellular matrix (ECM) мю влиять на поведение клетокю Один из них через предоставление убежища факторам роста или белкам, связывающим факторы роста. Секвестрируя такие факторы ВКМ играет активную роль в их мобилизациию Его ремоделирование может вести к высвобождению связанных с ВКМ ростовых факторов и к контролю дифференцировки.
Другим путем является взаимодействие клетки с ВКМ, которое мо;ет прямо герулировать поведение клетки или посредством через рецептры воспринимаемых сигналов или путем моделирования клеточной реакции на ростовые факторы. В частноси подобные взаимодействия ва;ны для вступления клетки в цикл деленияю Спектр рецепторов ВКМ и распознаваемых ими лигандов широкю Различные компоненты ВКМ могут селективно влиять на многие типы путей передачи сигналовб включая те, что ведут к супрессии апоптоза и к дифференцировкею В эпителиальных клетках молочных желез адгезия с базальной мембраной необходима для пролактина и инсулинаб чтобы управлять их внутриклеточными сигнальными каскадамиб тогда как передача сигналов ингибируетсяб если клетки контактируют со стромальными ВКМ белкамиб такими как коллаген I. Таким образом, ВКМ может запускать каскады сигнальной трансдукции (рис.1).
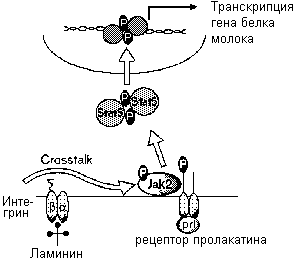
Взаимодействие клеток с ВКМ, затрагивающие дифференцировку. В эпителиальных клетках молочных желез взаимодействия с с ламинином, белком базальных мембран, необходимо для пролактина, чтобы запустить Jak2-Stat5 обеспечиваемую передачу сигналов. Сходные взаимодействия необходимы для инсулина, чтобы запустить фосфатидилинозитол 3' киназный рукав его сигнального пути.
Мезенхимные клетки, возникающие из первичного эпителия, нуждаются в событиях ремодулирования внутри матрикса, чтобы перечечь строму и реформировать специфические типы эпителия. Ремодулирование также важно и для многочисленных событий дифференцировки у взрослыхб включая неоваскуляризацию, инвазию трофбластов, изменения матки и молочных желез во время менструального цикла и беременности и репаративные процессы.
Большое количество энзимовб вовлекается в ремодулирование ВКМ. Сюда входят тканевые серин протеазы и большое семейство matrix metalloproteinases (MMPs) "ти ферменты действуют как широкого спектра протеазы для большой деградации ВКМб которая происходит во время ремодулированияю Но кроме того они расщепляют специфические ВКМ белки в уникальных местах для продукции небольших изменений структуры матрикса после взаимодействия или с секвестрированными факторами роста или с сигнальными рецепторами клеточной поверхности.
Первичный механизм регуляции ММР осуществляется на транскрипционном уровнею трансгенные мыши, экспрессирующие ММР-9 (gelatinase B) промотор, слитый с lacZ, демонстрирует транскрипционный контроль этого промотора в развивающихся костяхб волосяных фолликулах, в нейрогенезе и при репарации тканей, эти сайты экспрессии функцинально важны, так как у гомозигот по нулевой мутации ММР-9 наблюдается задер;ка развития костейб в результате аномального апоптозаб васкуляризации и оссификациию Такие мутации демонстрируют так;е ва;ность ВКМ ремодулирования для сосудистой дифференцировки, репарации тканей, неоплазии и т.д.
Транскрипционная регуляция энзимов, ремодулирующих матрикс
Новым мехенизмом вклада в транскрипцию является Tcf (T-cell factor). Tcf является ДНК связывающим белком на пути передачи сигналов Wnt и β-катенина, которые действуют как транскрипционные репрессорыю В опхолях толстого кишечника β.Tcf обусловленная транскрипция усиливается мутацией АРС (adenomatous polyposis coli) или β-катенинаю ММР-7 (matrilysin) накапливается как раннее событие во время карционгенеза кишечникаб а β-катенин строго усиливает экспресию ММР-7 в эпителии колона. Это происходит в результате отмены репрессии Tcf. Так как гомозиготные мутации ММР-7 супрессируют кишечный туморогенезб индуцируемый аномальным аллелем ApcMin, то ремодулирование ВКМб индуцированное с помощью ММР-7 активации, м.б. важным вкладом в туморогенез колона.
Ремодулирование ВКМ и дифференцировка во время репарации ткани
Большинство ММР секретируются как зимогены и стоновятся активированными только вследствие отщепления их Т-терминального про-демена. Чтобы этот протеолиз не приводил к общей деструкции ВКМ, активация осуществляется в тесной близи к клеточной поверхностию Одним из таких процессов является заживление ран кожи (рис. 2).
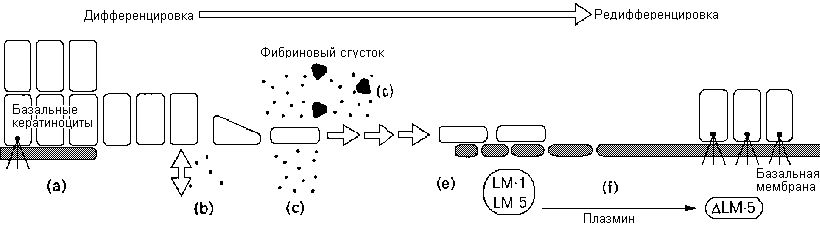

Контроль во время ремодулирования ВКМ ведет к дедифференцировке и редифференцировке (а) Нормальный эпидермис: клетки расположены на базальной мембране, которая отделяет их от подлежащей стромы (серая) ВКМ. (b) Ранение: кератиноциты взаимодействуют с нативным коллагеном I и индуцируют экспрессию ММР-1ю (с) Миграция: ММР-1 деградирует фибриллярный коллаген чтобы эткрыть скрытые сайты и индуцировать миграциюю (d) Локальная деградация внутри фибринового сгустка вносит свой вклад в миграцию кератиноцитов. (е) Синтез базальной мембраны супрессирует экспресси. ММР-1. (а) Даминин-5 (LM-5) ремодулирует с помощью плазмина индуцирует образование гемидесмосом и стабилизирует эпителиальные взаимодействия с базальной мембраной.
Базальные кератиноциты располагаются на базальной мембране. Вслествие повреждения запускается цепь событий приводящих к миграции базальных кератиноцитовб которые реэпителизируют раную Одним из первых изменений является нарушение кератиноцит-ВКМ взаимодействия на раневом крае, где клеткиб мигрирующие под базальную мембрану, подвергаются воздействию дермальных коллагенов. В результае взаимодействия фибриллярного коллагена с кератиноцитом α2β1 интегрин быстро запускает экспрессию ММР-1 (collagenase-1), которая затем взаимодействует с активированными рецептрами epidermal growth factor (EGF). ММР-1 денатурирует фибриллярный коллаген I, расщепляя α 1 и α2 цепи в специфических последовательностях распознавания аимнокислотб тем самым редуцирует их адгезивную функцию и экспозирует скнзешс сайты внутрь ВКМ для создания более благоприятной среды для миграциию ММР-7 вовлекается в репарацию легких но не ММР-1 и ММР-3 (stromelysin-1).
Ремоделирование ВКМ необходимо для проведения стоп-сигнала для миграции кератиноцитов и запуска последующей ре-эпителизациию Базальная мембрана под базальными кератиноцитами содер;ит ламинин-5б который обеспечивает существенную структурную интеграцию с эпидермисом путем связывания гемидесмосом в кератиноцитах с коллаген VII-содержащими якорными фибриллами подлежащего дермисаю Ламинин-5 секретируемый подвижными трансформированными клетками, содержит не подвергшуюся процессингу форму α3 субъединицы, которая неспособна поддерживать сборку гемидесмосом, но пригодна для миграции. Плазминоген связывается с этой субъединицей ламинина и после активации с помощью tissue-type plasminogen activator (tPA) расщепляет ламинин на более короткую форму, которая способствует сборке гемидесмосом и теряет подвижность. Таким образом, ремоделирование ламинина может превращать его из ВКМ белкаб который управляет подви;ностьюб в адгезивную форму, которая способствует дифференцировкею При заживлении ран плазминоген необходим не только для конверсии ламининаб но также и для кератиноцитов, прониркающих в фибриновый сгустокб во время их миграторной фазы.
ММР-2 (gelatinase A) расщепляет ламининовую γ2 субъединицу для экспозиции cryptic сайта, который способствует миграциию ММР-2 обычно экспрессируется в стромальных клетках. Но ее экспрессия сильно увеличена рядом с метасазирующими карциномамию По-видимому, этот тип ремоделирования важный в нормальном морфогенезе, когда он неконтролируем ведет к миграции опухолевых клеток. Сходным образом аберрантная экспрессия ММР-3 в молочных железах прямо индуцирует пренеопластичские повреждения in vivo, возникающие в результате ремодулирования ВКМ в строме.
Динамическая экспозиция ВКМ доменов во время ремодулирования матрикса
Одним из следствий ремоделирования ВКМ является изменение в комплексе трехмерной организации матрикса, что поволяет выявить скрытые (cryptic) сайты до этого нераспознаваемые рецепторами клеточной поверхностию Протеолиз коллагена I и ламинина-5 экспозирует интегрин связывающие сайтыб что позволяет клеткам включаться в миграционую машинерию или собираться в мультипротеиновые комплексы, используемые для адгезиию Расщепление ВКМ открывает также сайты для межбелкового взаимодействияю Фибронектин является эластичным и в норме существует в растянутой форме в околоклеточном матриксе, но он сокращается существенно после разрушения фибрил. Количество α5 и &beta1 интегриновых субъединиц, связанных с фибронектином изменяется в соответствии с его конформацией, и тем самым это воздействует как на пролиферацию, так и дифференцировку. Примером ва;ности правильной сборки ВКМ являетя изучение ламинина, делеция небольшого экзона которого в γ цепи, кодирующей nidogen-связывающий сайтб ведет к дефекту развития легких и почек.
Протеолитиеское высвобождение факторов роста в результате ремоделирования ВКМ
В некоторых случаях MMPs могут секретироваться в уже активированной формеб как в случае ММР-11 (stromelysin-3). Этот фермент экспрессируется в области базальных мемран развивающихся эмбриональных тканей и при репарацииб но мыши, дефицитные по ММР-11 не обнаруживают фенотипических нарушенийю Предполагается, что ММР-11 может функционировать, высвобождая ростовые факторы из ВКМ.
Связанный с ВКМ штыгдшт-дшлу growth factor (IGF) binding protein (IGFBP-5) имеет низкое сродство к IGF-1 и таким образом потенциирует клеточную реакцию на IGF-1. Латентный TGFβ binding protein (LTBP) является структурным ВКМ белком, который обеспечивает хранение средства передви;ения для TGFβ в матриксе. Как IGFBPs. так и LTBЗ могут высвобо;даться сериновыми протеазами, в результате может меняться клеточный фенотип благодаря высвобождению факторов роста. Более того ряд факторов, которые инициируют органогенез, связывается с гликозаминогликановыми боковыми цепями ВКМ протеогликанов и, следовательно, м.б. ремоделированы. Сюда входят FGFs и WNTs.
Sog ( у мух) и Chordin ( у рыб и лягушек) связывает и секвестрирует членов семества TGFβ. У дрозофилы ген tolloid, кодирует по крайней мере две металлопротеиназы, tolloid и bone morphogenetic protein 1 (BMP1), которые процессируют Sog-Dpp и Chordin-BMP4 комплексы и тем самым высвобождают активные факторы дифференцировки. Новая форма коллагена II (тип IIA) содер;ит цистеин-богатую Т-терминальную пропептидну, область, генерируемуюю с помощью альтернативного сплайсинга, которая локализуется на поверхности коллагеновых фибрил, отложенных внутри ВКМ. Амино-терминальный пропептид связывает факторы TGFβ1 и ВМР2. Коллаген IIA экспрессируется на эпителиально-мезенхимных границах в сомитах, хорде и нейроэпителии и в прехондрогенной мезенхиме, а его амино-терминальный пропептид может отщепляться с помощью проколлаген-Т-протеиназы. Это новая стратегия контроля клеточного поведения с помощью ВКМ ремодулирующих энзимов, причем фибриллярный домен колагена обеспечивает леса (док) для присоединения клетки, при этом морфогенетические факторы очень доступны для дифференцировкиб но не активируются вплоть до своего высвобождения с помощью металлопротеиназ.
ADAMs, которые имеют как дезинтегриновый, так и металлопротеиназный домены, являются новым семейтсов металлопротеиназ. Эти ферменты растворимы или ассоцированы с ВКМ или располагаются на поверхности клетокю ADAMTS (ADAM c thrombospondin motifs) семейство связывается с ВКМ белками и обладает классической ВКМ-расщепляющей активностью. ADAMTS-4 большая aggrecanase, участвующая в деградации хряща при артритах, но ее присутсвие в головном мозгеб легких и сердце указывает на то, что ADAMTS белки участвуют также в нормальном ремоделировании ткани и тем контролируют поведение клеток. Эти ферменты родственны связанным с поверхностью ADAMs, которые могут играть значительную роль в развитии и дифференцировке, так как они расщепляют и активируют сигнальные лиганды. Delta лигнад для рецептора Notch отщепляется и высвобождается с клеточной поверхности как растворимый Notch агонист с помощью ADAM, Kuzbanian. Другой, связанный с плазменной мембраной ADAM, tumor necrosis factor-α (TNFα) converting enzyme (TACE), который процессирует TNFα, а также TGFα. ТАСЕ-управляемое высвобождение TGFα необходимо для нормального развития мышейб гомозиготные по мутации в ТАСЕ металлопротеиназа активном сайте погибают при рождении TNFα-независимым способом.
Протеолиз компонунтов ВКМ как результат ремолеирования матрикса
Высвобождение фрагментов ВКМ так;е играет важную роль в дифференцировке. Во время ангиогенеза локальный матрикс деградирует вблизи эндотелиальных клеток, формирующих сосудю Интегрин-опосредованные эндотелиальные клетки контактируют со стромальным ВКМ и индуцируют экспресси. ММР, в данном случае ММР-2 (gelatinase A). ММР-2 активируется при ее соединении с комплексом на клеточной поверхности, который содержит связанную с мембраной МТ1-ММРб которая также индуцируется нарушением взаимодействий ме;ду клеткой и матриксом, и TIMP2 (tissue Inhibitor of metalloproteinase 2). Результат миграторной активности эндотелиальных клеток вместе с их пролиферацией является предварителным условием для ангиогенеза, однако чтобы эндотелиальные клетки могли дифференцироваться в зрелые кровеносные сосуды. ВКМ ремоделирование и пролиферация дол;ны быть смягченыю Один из механизмов это высвобождение С-терминального hemopexin-подобного домена ММР-2, который действует, ингибируя дальнейшую активацию ММР-2
И некоторые другие белки внутри ВКМ расщепляются при помощи ремоделирующих энзимов, а их протеолитические продукты оказывают выраженные эффекты на поведение эндотелиальных клеток. Angiostatin является Т-термианльным фрагментов плазминогена, который высвобождается с помощью ММР-12 (metalloelastase) и менее эффективно другими ММР. Это мощный ингибитор прлиферации эндотелиальных клеток и индуцирует апоптоз, возмо;но благодаря соединению и ингибированию α/β субъединиц АТФ синтазыб локализованной на поверхности эндотелиальных клетокю Возмо;ноб что утвщыефешт и кучештб С-терминальные фрагменты коллагенов XVIII и XV, соответственноб строго супрессируют неоваскуляризацию благодаря антипролиферативному, проапоптическому и антимиогратоному механизмам.
Таким образом, во время ремоделирования ВКМ высвобождаются биоактивные фрагменты белков ВКМ, которые оказывают выраженные эффекты наповедение клеток.
Заключение
Контроль детерминации и дифференцировки клеток с помощью внеклеточных металлопротеиназ (Рис.3)
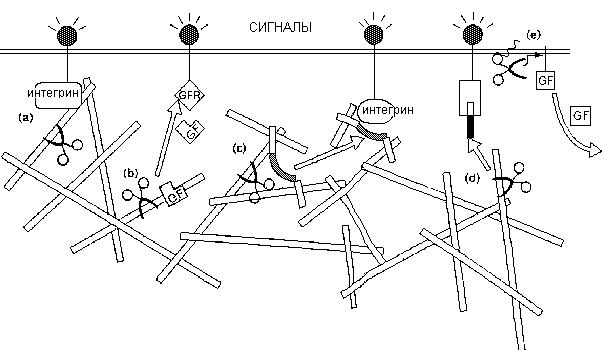

Пути влияния ВКМ на дифференцировку клеток. (а) Ремоделированный ВКМ непосредственно влияет на взамиодействия клеток с ВКМ, нарушая передачу интегриновых сигналов и интегрин-обусловленных взаимодействий с факторами роста. (b) Ремоделированный ВКМ высволбождает связанные факторы роста (GF). (с) Влияние на скрытые сайты (скрые полосы) ВКМ нарушает передачу сигналов интегрина. (d) Ремоделирование ВКМ высвобождает биоактивные фрагменты ВКМ (черные полоски). (е) Ремодулирование связанного с посерхностью ВКМ высвобождает эктодемены ростовых факторов. GFR (рецептор фактора роста).
Эти энзимы могут действовать внутри матрикса, расщепляя и ремодулируя ВКМ и/или высвобождая факторы роста, влияя на дифференцировку клеток через рецепторы как ВКМ, так факторов роста, Альтернативно они могут действоать на клеточную поверхность, приводя или к ММР активации каскадов, которые дают в результате деградацию околоклеточного матрикса или высвобождая эктодомены ростовых факторовб которые оказывают локальные дифференцирующие эффекты через распознающие рецепторы. ММР могут также расщеплять рецепторы ростовых факторов. Ингибиторы ММР также играют важную роль в развитии и туморогенезе.