Мигрирующие мышечные предшественники впервые обнаружены у птиц, а затем и у млекопитающих. Клетки эмигрируют из дермомиотома, эпителиальной структуры, развивающейся из сомита, и генерируют субнабор гипаксиальных мышечных групп. Эти мигрирующие на большие расстояния клетки уже предназначены для формирования скелетных мышц, но не экспрессируют факторов миогенной детерминации, такие как миогенин или MyoD. Эти транскрипционные факторы и гены им контролируемые экспрессируются только после миграции и достижения ими финального местоположения.
[25] Takayama H. et al. (1996) Proc. Natl. Acad. Sci. U. S. A., 93:5866-5871.
[29] Maina F. et al. (1996)
Cell, 87:531-542.
[35] Bladt F. et al. (1995)
Nature, 376:768-771.
[36] Brand-Saberi B. et al. (1996)
Dev. Biol., 179:303-308.
[37] Heymann S. et al. (1996)
Dev. Biol., 180:566-578.
[38] Franz T. et al. (1993)
Anat. Embryol., 187:153-160.
[39] Bober E. et al. (1994)
Development, 120:603-612.
[40] Yang X. M. et al. (1996)
Development, 122:2163-2171.
[41] Epstein J. A. et al. (1996)
Proc. Natl. Acad. Sci. U. S. A., 93:4213-4218.
[42] Daston G. et al. (1996)
Development, 122:1017-1027.
[43] Allen R. E. et al. (1995)
J. Cell Physiol., 165:307-312.
[44] Anastasi S. et al. (1997)
J. Cell Biol., 137:1057-1068.
Контроль миграции клеток мышечных предшественников с помощью HGF/SF и c-Met
Одна из интересных онтогенетических функций c-Met и HGF/SF является выбор судьбы при формировании скелетных мышц конечностей, которые происходят из мигрирующих на большие расстояния клеток-предшественников.
Важная роль HGF/SF и c-Met в развитии миграторных мышечных предшественников установлена с помощью генетического анализа у мышей. Устранение HGF/SF или c-met гена вызывает полное отсуствие у эмбрионов мыши мышечных групп, которые происходят из мигрирующих клеток, тогда как другие мышцы формируются нормально. 35. Мигрирующие миогенные предшественники образуются из дермомиотома с помощью –мезенхимного перехода. Мигрирующие клетки не обнаруживаются у HGF/SF- или c-met-нулевых мутантов мыши (Fig 4), и напротив, эктопическое воздействие HGF/SF у эмбрионов кур индуцирует эктопический эпителиально–мезенхимный переход и эмиграцию дермомиотомальных клеток. 3536 37. Таким образом, HGF/SF и c-met , по-видимому, регулируют отсоединение и миграцию миогенных предшественников из дермомиотома in vivo, процесс, который напоминает клеточную реакцию, которая ведет к идентификации HGF/SF как `scatter factor' в культуре клеток. 1. Во время нормального развития мигратоные предшественники генерируются из дермомиотомов только определенных сомитов. Тесный пространственно–временной контроль эмиграции может регулироваться с помощью ограничения экспрессии HGF/SF, следовательно, должны участвовать дополнительные сигналы.
 1.
1.
 1.
1. Миогенные клетки предшественники не мигрируют из дермомиотома c-met-нулевых мышиных эмбрионов. In situ гибридизация с Pax-3-специфическим хондом в контроле (a) и у c-met-нулевых мутантов (b) E9.5 эмбрионов.
Контроль дифференцировки скелетных мышечных клеток с помощью HGF/SF и c-Met
Важная роль экспрессии HGF/SF для упорядоченного развития скелетных мышц следует также из анализа трансгенных мышей с избыточной экспрессией HGF/SF под контролем промотора metallothionein 25. Эти эмбрионы продуцируют HGF/SF эктопически в спинном мозге и развиваются скелетные мышцы в мягких мозговых оболочках (leptomeninges) торакальной части спинного мозга —в месте, где обычно мышцы не формируются. Усиленная миграция мышечных предшественников может объяснить этот фенотип. Интересно, что предшественники меланоцитов, несвязанные миграторные типы клеток, также обнаруживаются в эктопических сайтах таких мышей, например, в головном и спинном мозге. Более того, меланоциты продуцируются в избытке, указывая тем самым, что не только миграция, но и рост и/или выживаемость клеток также меняются 25.
Отсутствие мышц конечностей происходит не только у мышей с отсуствием HGF/SF или c-met генов, но и у splotch мышей3839. Эти мыши несут мутацию гена Pax-3, который кодирует транскрипционный фактор из семейства paired-box . Pax-3 и c-met обнаруживают сходные паттерны экспрессии в раннем развитии миогенных компартментов —оба гена экспрессируются в мигрирующих миогенных предшественниках и в вентральных частях дермамитомов, где мигратоные клетки располагаются перед эмиграцией3540. Из-за сходства их фенотипов и паттернов экспрессии было предположено, что Pax-3 контролирует экспрессию c-met404142. Согласуется с этим то, что промотор c-met содержит сайт связывания для Pax-3; Pax-3 активирует экспрессию с промотора c-met in vitro и в экспреиментах по ко-трансфекции, c-met сильно супрессирован у splotchмышей404142. Таким образом, Pax-3 может стоять выше c-met в генетической иерархии, которая контролирует генерацию миграторных миогенных предшественников. Однако мутация Pax-3 обусловливает и другие дополнительные тяжелые изменения в дермомиотоме, указывая тем самым что Pax-3 контролирует и другие гены , важные для развития дермомиотомов 42.
Развитие склетных мышц связано с несколькими волнами образования миофибрилл. У мышей первичные волокна формируются из миобластов примерно на 13-й день (E13), вторичные волокна начинают формироваться на E16 в той же самой базальной ламине, а у взрослых волокна могут регенерировать из стволовых клеток взрослых мышц, сателлитных клеток. Рецепторы c-Met могут не только участвовать в формировании миграторных миогенных клеток, которые создают гипаксиальные группы мышц, но также на последующих стадиях развития всех скелетных мышц. Животные с мутантным, но частично функциональным (hypomorphic) c-met аллелем позволяют проанализировать этот процесс, так как они доживают до рождения —в отличие от нулевых мутантов, которые погибают во второй половине беременности (см. ниже). Аллель мыши c-met, в котором разрушено ядро связывающего сайта c-Met для Grb2 обусловливает генерализованный дефицит вторичных волокон во всех мышечных группах благодаря снижению плролиферации миобластов плода29. Наконец, сателлитные клетки отвечают на HGF/SF в культуре клеток усилением пролиферации и задержкой дифференцировки 4344. Эти результаты указывают на то, что HGF/SF и c-Met могут играть независимую роль в развитии скелетных мышц. Возможно, что HGF/SF и c-Met участвуют и в регенерации мышечных волокон во взрослом организме, но это пока не подтвержденоin vivo.
C. Birchmeier, H. Brohmann
C. Birchmeier, H. Brohmann
Genes that control the development of migrating muscle precursor cells
Curr. Opinion Cell Biol. 2000. V. 12. No 6. P. 725-730
В голове мышцы возникают из клеток нейрального гребня и головной мезодермы, в туловище все мышцы генерируются из дермомиотомов, но развиваются с помощью отличающихся механизмов в разных компартментах дермомиотома.
Клетки медиальной части дермомиотома отслаиваются от в миотом. Эволюционно это самый старый механизм образования эпаксиальных мышц ( глубоких мышц спины). Латеральная часть дермомиотома дает гипаксиальные скелетные мышцы, которые возникают из двух отдельных популяций клеток: немигрирующих и мигшрирующих предшественников. Немигрирующие клетки из удлиняющейся латеральной части дермомиотома добавляются к миотому, генерируя вентральные мышцы. Высвобождение мигрирующих клеток, эволюционно наиболее молодых, наблюдается у teleosts и высших животных. Они дают исключительно скелетные мышцы, хотя они экспрессируют факторы миогенной дифференцировки только в своих мишенях. Мигрирующие предшественники образуются на опредленном аксиальном уровне только, это окципитальный, шейный и уровень передних и задних конечностей. Они экспрессируют гомеобоксный ген Lbx1. У мышей мишенью миграции являются конечности, hypoglossal тяж и поперечная перегородка, где эти клетки генерируют мышцы колнечностей, языка и диафрагмы, соотв.
Pax3 and establishment of the muscle precursor pool in lateral dermomyotome
Экспрессия Рах3 сначала обнаруживается во всем сомите, затем ограничивается дермомиотомом и, наконец, она активируется на латеральном крае. Рах3 экспрессируется на всех уровнях оси и в мигрирующих и немигрирующих гипаксиальных мышечных предшественниках. Рах3 необходим также для правильного образования пула предшественников в латеральной части дермомиотома. Экспрессия в этом месте отсутствует у Splotch мутантных мышей и в этом месте усиливается экспрессия Рах7, которая обычно ограничена медиальной частью дермомиотома. У мутантов экспрессия c-Met в латеральной части дермомиотома низкая, а индукции Lbx1 не происходит в туловище и задерживается в окципитаьных сомитах.
c-Met and its ligand, SF/HGF, control delamination of migrating muscle precursor cells
c-Met экспрессируется в латеральных частях дермомиотомов всех аксиальных уровней, а также в медиальной губе, т.е. в предшественниках эпаксиальных и гипаксиальных мышц. Во время отщепления клеток предшетвенников от дермомиотома SH/HGF экспрессируется в мезенхиме конечностей и бранхиальных дугах, это определяет отщепление предшественников на специфических аксиальных уровнях. У обоих мутантов спецификация мигрирующих клеток предшественников не нарушена: Lbx1, экспрессирующийся только в мигрирующих клетках, индуцируется корректно. Однако дисперсия мигрирующих предшественников нарушена, миграторные предшественники остаются в сомитных компартментах, отсутствуют все мышцы, развивающиеся из мигрирующих предшественников.
После отщепления миграторных клеток экспрессия SF/HGF обнаруживается вдоль маршрутов и в мишенях. Эти характеристики сохраняются и в отсутствии миграции. В мезенхиме конечностей экспрессия SF/HGF контролируется сигналами, предопределяющими паттерн конечностей, такими как FGFs, которые испускаются из АЭГ и усиливаются Shh, продуцируемым зоной поляризующей активности. Во время миграции предшественники гипаксиальных мышц продолжают экспрессировать c-Met и следовательно, постоянно получают SF/HGF сигнал. Активность c-Met поддерживает диссоциацию и подвижность клеток и может участвовать в направленном миграции. SH/HGF индуцирует деламинацию клеток, но не направляет их движения, т.е. не действует как простой аттрактант.
c-Met является непосредственной мишенью для действия гена Рах3.
Lbx1 and directed migration of muscle precursor cells
Экспрессия Lbx1 индуцируется до деламинации и поддерживается во время миграции, она подавляется, екогда клетки дифференцируются. У мутантов миграторные предшественники образуются, отделяются, но мигрируют аномально. Большинство из тех, что обычно движутся в конечности мигрируют вентрально, накапливаются в мезодерме вентральной стенки тела. Немногие предшественники достигают проксимовентрального поля передних конечностей с существенной задержкой. Поэтому большинство мышц задних конечностей и экстензоры передних отсутствуют, а флексоры передних конечностей уменьшены в размерах. Преждевременная миогенная дифференцировка сопровождает миграцию клеток предшественников гипаксиальных мышц.
Рах3 стоит выше Lbx1, но для ограничения индукции Lbx1 определенным аксиальным уровенем необходимы дополнительные сигналы. Это м.б. FGFs, экспрессирующиеся на соответствующих уровнях оси. Аппликация FGFs индуцирует эктопическую экспрессию Lbx1.
Pax3 and myogenesis
Myf5 и MyoD кооперируют в детерминации миогенных предшественников, тогда как Myogenin, который накапливается во время развития мышц, является обдязательным для дифференцировки мышц. Мигрирующие миогенные предшественники экспрессируют факторы миогенной детерминации на пути достижения своих мишеней.
Роль Рах3 в запуске миогенной программы становится очевидной у двойных мутантов Рах3 и Myf5. В отсутствие Myf5 запуск MyoD и миогенной программы зависит от Рах3. Факторы транскрипции Dach2, Eya2 и Six1 могут кооперировать с Рах3 и формировать сложную регуляторную сеть (Рис.)
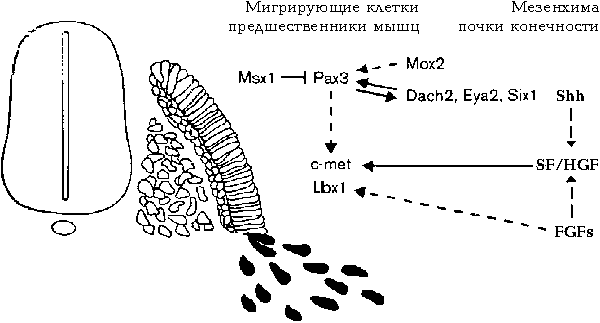

Схематическая диаграмма генетической иерархии, которая контролирует развитие мигрирующих клеток предшественников мышц. Мигрирующие клетки предшественники и их потомки экспрессируют различные гены, кодирующие транскрипционные факторы. Рах3 контролирует непосредственно или косвенно экспрессию c-met, Lbx1 в мигрирующих предшественниках. SF/HGF продуцируемый в мезенхиме конечностей контролирует активность c-met. Гены, контролирующие формирование паттерна конечностей также контролируют экспрессию SH/HGF и Lbx1.
На эмбрионах кур установлено, что Рах3 и гомеобоксный фактор Msx1 могут взаимодействовать непосредственно и коэкспрессироваться в мигрирующих миогенных предшественниках. Msx1 контролирует время начала дифференцировки мигрирующих предшественников.
Клетки предшественники, достигнув мишеней, могут пролиферировать на этих мишенях прежде чем начать дифференцировку. Гипоморфные мутации c-Metобусловливают потерю или уменьшение размеров мышц конечностей, что м.б. отражением изменений во времени пролиферации или начале дифференцировки после достижения ими мишеней. Mox2 и Mox1 являются добавочными гомеобоксными генами, экспрессирующимися в мигрирующих предшественниках и в дермомиотоме, соотв. Мутации Мох2 обусловливают отсутствие определенных групп мышц в конечностях и редуцируют уровни экспрессии Рах3 и Myf5 в мигрирующих предшественниках.