Control of mitochondrial shape
Although mitochondria are known to exhibit a wide variety of
morphologies in different cells, the mechanism by which these
shapes are established and regulated are largely unknown.
Several potential shape-forming proteins have been recently
identified. Some studies suggest that these proteins control
shape by mediating attachment of mitochondria to the
cytoskeleton, while other studies indicate that these proteins
form part of a connection between the mitochondrial outer and
inner membranes. Complicating matters, a recent study raises
the possibility that one or more of these shape-forming proteins
plays a direct role in the import and assembly of mitochondrial
proteins synthesized in the cytosol.
Хотя многие активности mitochondrion, такие как продукция АТФ, общие для всех клеток, недавние протеомные подходы позволили предположить, что около половины митохондриальных белков являются ткане-специфическими [1]. Это неожиданное различие в белках отражает также невероятное разнообразие у различных типов клеток количества, размеров и формы их митохондрий [2,3]. Количество митохондрий колеблется в пределах от единственной органеллы в клетках сетчатки до сотен органелл в гепатоцитах. Морфология митохондрий в разных типах клеток также варьирует драматически, от тубуло-образных органелл, обнаруживаемых во многих типах клеток до органелл, состоящих из листков (sheets), мешочков и овалов.
Деление и слияние органелл являются двумя процессами, которые могут оказывать драматические эффекты на внешний вид митохондрий. Однако, исследования на дрожжевых клетках показывают, что деление и слияние могут действительно контролировать количество митохондрий скорее, чем их форму [4-6].
Митохондрии в активно растущих дрожжевых клетках существуют как динамический ретикулем из ~5-10 длинных, тонких и разветвленных трубочек. У мутантов, дефективных по слиянию митохондрий, начинающееся деление продуцирует многочисленные небольшие митохондрии, тогда как в клетках, с блокированным делением, обнаруживается по единственной органелле. Неожиданно, мутанты, лишенные активности по слиянию и делению, содержат нормальные tubular формы митохондрии [4,6], указывая тем самым, что форма контролируется самостоятельным механизмом.
Mitochondrial shape proteins
Большинство известных shape белков было обнаружено в результате скрининга с помощью флуоресцентной микроскопии S. cerevisiae мутантов с альтерациями по количеству, морфологии или распределению митохондрий [4,7-10]. Скрининг дрожжей идентифицировал, по крайней мере, 4 белка наружной мембраны митохондрий, Mmm1p, Mmm2p, Mdm10p и Mdm12p, два белка внутренней мембраны, Mdm31p и Mdm32p, необходимых для нормальной формы митохондрий [7,11-14]. У мутантов, лишенных какого-либо одного из этих 6 белков, более не обнаруживаются удлиненные и разветвленные митохондриальные трубочки [7,11,13], митохондрии становятся крупными, сферическими или продолговатой формы (Figure 1). Двойные мутанты часто обнаруживают синтетическую летальность, указывая тем самым, что эти белки являются все частью общего пути или структуры [12,14]. Многие из форму-формирующих белков располагаются в поразительных, точко-образных структурах, в противоположность большинству митохондриальных белков, униформно распределенных по митохондриям. Изучение клеток с помощью иммунофлюоресценции или при использовании с GFP слитых белков показало, что Mmm1p, Mmm2p, Mdm10p и Mdm12p локализуются в ~10-20 частицах ~0.3 mm в диаметре, которые распределены вдоль митохондриальных трубочек [14-16].
Т.к. распределение Mmm1p, Mmm2p, Mdm10p и Mdm12p довольно сходно, то недавние исследования подтвердили, что, по крайней мере, некоторые из этих частиц являются членами отдельных структур, которые динамически взаимодействуют. Во-первых, иммунопреципитационные исследования показали, что взаимодействия между Mmm1p, Mdm10p и Mdm12p слабые и только небольшой процент белков ко-преципитирует [16]. Во-вторых, клетки, экспрессирующие Mmm1p-GFP и Mmm2p-RFP fusion белки обнаруживают самостоятельные зеленые и красные точки, которые часто, но не всегда, ко-локализуются [14]. В-третьих, гель-фильтрация и голубые нативные гели показывают, что Mmm1p, Mmm2p и Mdm10p существуют в больших. но отдельных комплексах [14,17].
Т.к. большинство shape белков, обнаруживаемых у дрожжей, имеет своих аналогов только у др. грибов, занчительно менее известно о контроле митохондриальной структуры у др. организмов. Предпринят генетический скрининг белков в клетках с аберрантными митохондриями и в др.
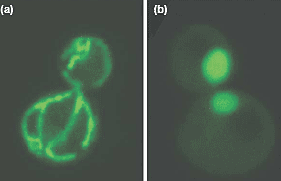 mdm10 mutants are defective in mitochondrial shape. (a) Wild-type cells and (b) mdm10D cells expressing matrix-targeted GFP were
examined by fluorescence microscopy; an image of two budded cells is shown.
mdm10 mutants are defective in mitochondrial shape. (a) Wild-type cells and (b) mdm10D cells expressing matrix-targeted GFP were
examined by fluorescence microscopy; an image of two budded cells is shown.
системах, таких как Arabidopsis [18,19]. Однако, мало известно о функции вновь идентифицированных белков, хотя некоторые мутации, по-видимому, дефектны по делению митохондрий [20].
 mdm10 mutants are defective in mitochondrial shape. (a) Wild-type cells and (b) mdm10D cells expressing matrix-targeted GFP were
examined by fluorescence microscopy; an image of two budded cells is shown.
mdm10 mutants are defective in mitochondrial shape. (a) Wild-type cells and (b) mdm10D cells expressing matrix-targeted GFP were
examined by fluorescence microscopy; an image of two budded cells is shown. системах, таких как Arabidopsis [18,19]. Однако, мало известно о функции вновь идентифицированных белков, хотя некоторые мутации, по-видимому, дефектны по делению митохондрий [20].
Shape proteins and mitochondrial DNA
В дрожжевых клетках митохондриальный геном представлен 30-50 копиями на клетку, а mtDNA организована в виде 10-20 дискретныхДНК-белковых комплексов, наз. нуклеоидами (nucleoids), которые могут стать видимыми после DAPI окрашивания [21]. Неожиданно, частицы, содержащие Mmm1p, Mmm2p, Mdm10p или Mdm12p обнаруживались непосредственно по соседству с большинством нуклеоидов в мтДНК [14-16]. В клетках, лишенных Mmm1p,
Mmm2p, Mdm10p, Mdm12p, Mdm31p или Mdm32p, нуклеоидная организация терялась и мутантные клетки обнаруживали тенденцию к потере мтДНК[11-15]. Хотя причина того, что мтДНК закреплена на внутренней митохондриальной мембране, неясна, это соединение, как полагают, облегчает передачу мтДНК дочерним клеткам [15,22] или способствует репликации молекул мтДНК [23].
Shape proteins, mitochondrial contact sites
and inner membrane structure
Наблюдение, что белки наружной мембраны, подобные Mmm1p, Mmm2p, Mdm10p и Mdm12p, соединены с локализованной на матриксе мтДНК, открывает возможность, что, по крайней мере, некоторые shape белки расположены в контактных сайтах (областях, где наружная мембрана (outer membrane [OM]) тесно примыкает в внутренней мембране). Подтверждает эту идею то, что Mmm1p обнаруживается во фракции митохондриальной мембраны, содержащей физически соединенные наружную и внутреннюю мембраны [15]. Эта свяхзь может быть сформирована путем ассоциации Mmm1p в белками shape внутренней мембраны, такими как Mdm31p и Mdm32p. Или, Mmm1p соединяет обе, наружную и внутреннюю мембраны, играя непосредственную роль в формировании контактных сайтов и прикрепления мтДНК [24]. Свидетельствует также в пользу критической роли контактных сайтов потеря Mmm1p, которая ведет к дизорганизации структуры внутренней мембраны [15]. Mmm2p, в отличие от Mmm1p, ведет себя подобно типичному белку наружной мембраны и не обнаруживается в контактных сайтах [14]. Тогда как большинство или все Mmm1p соседствуют с нуклеоидами, и только примерно половина Mmm2p соседствует с мтДНК, это открывает возможность того, что Mmm2p-соедржащие частицы связаны с мтДНК посредством Mmm1p комплекса. Связаны ли Mdm10p
или Mdm12p с контактными сайтами неизвестно. Хотя функция Mmm1p, и вообще др. shape белков, в организации мембран довольно интригующая, эти соединения между наружной и внутренней мембранами недостаточны, чтобы объяснить всю сложность обеспечения формы митохондрий.
Mitochondrial shape and the cytoskeleton
Т.к. митохондрии, как известно, ассоциируют с цитоскелетом, то вполне возможно, что такие прикрепления вносят вклад в форму митохондрий. Напр., легко представить, что митохондриальные трубочки, д. быть закреплены на филаментах цитоскелета или притягиваются с каждого из концов силами, генерируемыми активиновыми или базирующимися на микротрубочках моторами. У S. cerevisiae, митохондрии ассоциируют с актином, а митохондрии, выделенные от мутантов mmm1 и mdm10 обнаруживают дефекты в связывании с актином [25]. Однако, взаимодействие mitochondrion-actin может бытьважным для подвижности скорее, чем для поддержания формы. Напр., имеются четкие дефекты в передаче митохондрий от материнской дочерним клеткам, когда взаимодействие между актиновыми, миозиновыми моторами и митохондриями нарушены [26,27]. Напротив, нарушения актина у дрожжей не приводит к возникновению крупных, сферических органелл, обнаруживаемых в клетках, лишенных Mmm1p, Mdm10p или др. shape белков [28]. Возможно, что форма нормальных митохондрий нуждается как во внешнем прикреплении митохондрий к цитоскелету, так и во внутреннем каркасе (scaffold), таком как Mmm1p-обусловленные соединения между наружной и внутренней мембраной. Важно учитывать, что т.к. многие shape белки законсервированы у Schizosaccharomyces pombe и Neurospora crassa, а их митохондрии, как было установлено, взаимодействуют с микротрубочками вместо актина [29-31]. Т.о., если shape белки помогают прикреплять митохондрии к цитоскелету, то эти соединения скорее всего непрямые.
Are mitochondrial shape proteins really
import components?
Предполагается, что, по крайней мере, некоторые из белков могут предписывать морфологию митохондрий вместо того, чтобы играть непосредственную роль в импорте и сборке митохондриальных белков из цитозоля. Большинство митохондриальных белков кодируется в ядре и импортируется в митохондрии с помощью кухни (machinery) в OM, называемой TOM комплексом (translocase outer membrane), и во внутреннюю мембрану с помощью комплекса TIM (translocase inner membrane) [32]. Ключевая связь между импортом и формой вытекает из анализа новой важной машины (machine) названной SAM комплексом (sorting and assembly machinery). SAM является крупной структурой, локализованной в митохондриальной OM, чтобы облегчать проникновение β-barrel белков [33]. Митохондриальная OM является уникальной среди др. клеточных мембран тем. что она несет несколько β-barrel белков, включая porin и Tom40 субъединицу комплекса TOM. β-barrel белки транспортируются из цитозоля в митохондриальное межмембранное пространство посредством TOM комплекса и затем вставляются в наружную мембрану с помощью SAM. При поиске новых членов комплекса SAM, было установлено, что Mdm10p элюируется на affinity column, содержащем
Sam37p, ранее идентифицированной субъединицей SAM [17]. Хотя мутанты mdm10Δ не являются дефектными по импорту β-barrel белков per se, но митохондрии, лишенные Mdm10p дефектны по сборке Tom40p, β-barrel белка, с др. субъединицами комплекса TOM [17]. Хотя связь между трафиком белков и формой органелл истекает из наблюдений, когда клетки с дефектами известных важных компонентов, таких как Tom40p, Sam50p
или Sam37p, обнаруживали измененную морфологию митохондрий, сходную с той, что обнаруживается у mdm10 и др. shape мутантов [17].
Может быть преждевременно говорить, что Mdm10p bona fide член комплекса SAM, или говорить, что все shape белки являются важными компонентами. Обработка митохондриальных экстрактов высокими концентрациями солей необходима, чтобы выявить достоверное взаимодействие между Mdm10p и SAM субъединицами с помощью BN-PAGE, и похоже, что только фракция Mdm10 белка очищается вместе с SAM комплексом [17]. Т.о., связь между Mdm10p и SAM м.б. временной. Более того, как показано выше, белки, подобные Mdm1p, Mmm2p, Mmm10p и Mdm12p локализуются в точко-образных структурах на митохондриях, тогда как все важные компоненты, которые удалось локализовать, были диспергированы или по наружной или внутренней мембране [34]. Дефекты морфологии, обнаруживаемые у важных мутантов, могут возникать просто из-за того, что их митохондрии содержат более низкие количества shape белков. Подтверждает эту идею то, что устойчивый уровень Mdm10p, β-barrel белка, драматически снижается в sam37Δ митохондриях [17].
Вместо выполнения непосредственной роли в импорте, форма митохондрий д.б. критической для функционирования импортной machinery. Напр., Tim54p субъединица TIM22 комплекса во внутренней мембране впервые идентифицирована в дву-гибридном скрининге с использованием Mmm1p в качестве затравки, тем не менее Tim54p и Mmm1p взаимодействую нестабильно [35]. Если Mmm1p формирует контактные сайты между внутренней и наружной мембранами, то было бы не удивительным найти, что TIM22 machinery использует эти соединения, когда происходит сортировка и сборка IM белков. Сходным образом, SAM комплекс может устраиваться на Mdm10p-содержащих структурах, чтобы координировать финальную сборку комплекса TOM. Можно предположить, что shape белки рекрутируются и активируют machinery импорта в специфических регионах внутри митохондрий. Т.о., специфические альтерации в форме митохондрий могут быть индуцированы за счет отложения нового белка и новой мембраны в специфических сайтах, таких как конец предсуществующей органеллы. Напр., митохондриальная трубочка д. 'расти' вдоль внешней матрицы, такой как цитоскелетная филамента.
Conclusions and future directions
In addition to the mechanism regulating mitochondria
shape, several other questions remain unanswered. For
example, how do cells alter their mitochondrial shapes
in response to different growth conditions and other
external signals? Although the answer is not known, a
potential player in this pathway is Gem1p, a member of
the conserved Miro GTPase family [36]. Gem1p is
anchored in the yeast mitochondrial outer membrane,
with its GTPase and calcium-binding domains facing the
cytosol. Mammalian Miro proteins have also been localized
to mitochondria [37]. Since yeast cells lacking
Gem1p show deformed mitochondria, Miro proteins
may function as a bridge between cellular signaling
and organelle shape.
Why are there so many different mitochondrial shapes
and how does shape influence the function of the mitochondrion?
The branched tubules seen in yeast and many
mammalian cells have been suggested to increase surface
area to maximize oxygen uptake and ATP export, but this
idea lacks any direct evidence. Another possibility is that
shape is critical for the efficient segregation of organelles.
Supporting this view, yeast cells lacking Mmm1p,
Mdm10p or other shape proteins are defective in the
transmission of their misshapen mitochondria to daughter
cells [7,12,13]. Clearly, many important questions still remain and the control of mitochondrial shape is only just
beginning to be understood.
