Secreted Frizzled-related proteins can regulate metanephric development
Kiyoshi Yoshino, Jeffrey S. Rubin, Kathleen G. Higinbotham, Aykut U E ren, Vasiliki Anest, Sergei Y. Plisov, Alan O. Perantoni
Морфогенез почек нуждается в
реципрокных взаимодействиях между ММ и
уретрическим зачатком (ureteric
bud) (SaxeAn, 1987). Стадия компакции или
конденсации ММ, м.б. индуцирована FGF2 (Perantoni et al., 1995);
затем происходит эпителиальное
превращение мезенхимного конденсата,
которое нуждается в дополнительных
растворимых факторах (Karavanova et
al., 1996; Barasch et al., 1999; Plisov et al., 2001). Завершается
процесс образованием претубулярных
агрегатов поляризованых клеток, comma-shaped
телец, S-образных телец и сегментированых
канальцев/нефрона. Так как эти события
индуцируются растворимыми сигнальными
факторами, высвобождаемыми оппозитной
тканью, уретрическим зачатком, (Perantoni et al., 1995; Karavanova
et al., 1996; Barasch et al., 1997), то эпителиальная
конверсия обеспечивается секретируемыми
паттернирующими молекулами,
происходящими из самой ММ, а именно wnt-4 (Stark et al., 1994; Kispert et al., 1998).
Гены семейства wnt представлены по крайней
мере 16 различными законсервированными
глткопротеинами, которые регулируют
формирование паттерна во время
эмбриогенеза (reviewed by Dale, 1998).
Wnt-4 играет критическую роль в формировании
почечных канальцев (Stark
et al., 1994). Во время предварительной стадии
морфогенеза он локализуется в мезенхимных
конденсатах и в первичном эпителии,
происходящем из ММ, тогда как другие wnt molecules,
напр., wnt-7b или wnt-11, обнаруживаются только в
уретрическом зачатке (ureteric bud) или
интерстициальной строме (Kispert et al., 1996; Karavanova et al., 1996). Генный таргентинг wnt-4 вызывает
образование небольших
недифференцированных почечных рудиментов,
без признаков тубогенеза. Ко-культивирование
ММ с клетками, экспрессирующими wnt-4,
индуцирует образование канальцев (Kispert et al.,
1998).
Ashe, H.L., Levine, M.,
1999. Local inhibition and long-range enhancement of Dpp signal transduction by Sog. Nature 398, 427±431.
Barasch, J., Qiao, J., McWilliams, G., Chen, D., Oliver, J.A., Herzlinger, D., 1997. Ureteric bud cells secrete multiple factors, including bFGF, which rescue renal progenitors from apoptosis. Am. J. Physiol. 273, F757±F767.
Barasch, J., Yang, J., Ware, C.B., Taga, T., Yoshida, K., Erdjument-Bromage, H., Tempst, P., Parravicini, E., Malach, S., Aranoff, T., Oliver, J.A., 1999. Mesenchymal to epithelial conversion in rat metanephros is induced by LIF. Cell 99, 377±386.
Bradley, R.S., Brown, A.M., 1995. A soluble form of Wnt-1 protein with mitogenic activity on mammary epithelial cells. Mol. Cell. Biol. 15,4616±4622.
Chan, S.D., Karpf, D.B., Fowlkes, M.E., Hooks, M., Bradley, M.S., Vuong, V., Bambino, T., Liu, M.Y., Arnaud, C.D., Strewler, G.J., 1992. Two homologs of the Drosophila
polarity
gene frizzled (fz) are widely expressed in mammalian tissues. J. Biol. Chem. 267, 25202±25207.
Cho, E.A., Patterson, L.T., Brookhiser, W.T., Mah, S., Kinter, C., Dressler, G.R., 1998. Differential expression and function of cadherin-6 during renal epithelium development. Development 125, 803±812.
Dale, T.C., 1998. Signal transduction by the Wnt family of ligands. Biochem. J. 329, 209±223.
Davies, J., Lyon, M., Gallagher, J., Garrod, D., 1995. Sulphated proteoglycan is required for collecting duct growth and branching but not nephron formation during kidney development. Development 121, 1507±1517.
Dignam, J.D., Martin, P.L., Shastry, B.S., Roeder, R.G., 1983. Eukaryotic gene transcription with puri®ed components. Methods Enzymol. 101,582±598.
Finch, P.W., He, X., Kelley, M.J., U È ren, A., Schaudies, R.P., Popescu, N.C., Rudikoff, S., Aaronson, S.A., Varmus, H.E., Rubin, J.S., 1997. Purification and molecular cloning of a secreted, Frizzled-related antagonist
of Wnt action. Proc. Natl. Acad. Sci. USA 94, 6770±6775.
Hall, A.C., Lucas, F.R., Salinas, P.C., 2000. Axonal remodeling and synaptic differentiation in the cerebellum is regulated by WNT-7a signaling. Cell 100, 525±535.
Hartmann, C., Tabin, C.J., 2000. Dual roles of Wnt signaling during chondrogenesis in the chicken limb. Development 127, 3141±3159.
Herzlinger, D., Qiao, J., Cohen, D., Ramakrishna, N., Brown, A.M., 1994. Induction of kidney epithelial morphogenesis by cells expressing Wnt-1. Dev. Biol. 166, 815±818.
Cho, E.A., Patterson, L.T., Brookhiser, W.T., Mah, S., Kinter, C., Dressler, G.R., 1998. Differential expression and function of cadherin-6 during renal epithelium development. Development 125, 803±812.
Dale, T.C., 1998. Signal transduction by the Wnt family of ligands. Biochem. J. 329, 209±223.
Davies, J., Lyon, M., Gallagher, J., Garrod, D., 1995. Sulphated proteoglycan is required for collecting duct growth and branching but not nephron formation during kidney development. Development 121, 1507±1517.
Dignam, J.D., Martin, P.L., Shastry, B.S., Roeder, R.G., 1983. Eukaryotic gene transcription with puri®ed components. Methods Enzymol. 101,582±598.
Finch, P.W., He, X., Kelley, M.J., U È ren, A., Schaudies, R.P., Popescu, N.C., Rudikoff, S., Aaronson, S.A., Varmus, H.E., Rubin, J.S., 1997. Purification and molecular cloning of a secreted, Frizzled-related antagonist
of Wnt action. Proc. Natl. Acad. Sci. USA 94, 6770±6775.
Hall, A.C., Lucas, F.R., Salinas, P.C., 2000. Axonal remodeling and synaptic differentiation in the cerebellum is regulated by WNT-7a signaling. Cell 100, 525±535.
Hartmann, C., Tabin, C.J., 2000. Dual roles of Wnt signaling during chondrogenesis in the chicken limb. Development 127, 3141±3159.
Herzlinger, D., Qiao, J., Cohen, D., Ramakrishna, N., Brown, A.M., 1994. Induction of kidney epithelial morphogenesis by cells expressing Wnt-1. Dev. Biol. 166, 815±818.
Hoppler, S., Brown, J.D., Moon, R.T., 1996. Expression of a dominant-negative Wnt blocks induction of MyoD in
Xenopus
embryos. Genes Dev. 10, 2805±2817.
Hsieh, J.C., Rattner, A., Smallwood, P.M., Nathans, J., 1999. Biochemical characterization of Wnt±frizzled interactions using a soluble, biologically active vertebrate Wnt protein. Proc. Natl. Acad. Sci. USA 96, 3546±3551.
Karavanov, A.A., Karavanova, I., Perantoni, A., Dawid, I.B., 1998. Expression pattern of the rat Lim-1 homeobox gene suggests a dual role during
kidney development. Int. J. Dev. Biol. 42, 61±66. Karavanova, I.D., Dove, L.F., Resau, J.H., Perantoni, A.O., 1996. Conditioned medium from a rat ureteric bud cell line in combination with bFGF induces complete differentiation of isolated metanephric
mesenchyme. Development 122, 4159±4167.
Kispert, A., Vainio, S., Shen, L., Rowitch, D.H., McMahon, A.P., 1996. Proteoglycans are required for maintenance of Wnt-11 expression in the ureter tips. Development 122, 3627±3637.
Kispert, A., Vainio, S., McMahon, A.P., 1998. Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in the developing kidney. Development 125, 4225±4234.
Korinek, V., Barker, N., Morin, P.J., van Wichen, D., de Weger, R., Kinzler, K.W., Vogelstein, B., Clevers, H., 1997. Constitutive transcriptional activation by a b-catenin±Tcf complex in APC 2/2 colon carcinoma. Science 275, 1784±1787.
Kreidberg, J.A., Sariola, H., Loring, J.M., Maeda, M., Pelletier, J., Housman, D., Jaenisch, R., 1993. WT1 is required for early kidney development. Cell 74, 679±691.
Laitinen, L., Virtanen, I., SaxeÂn, L., 1987. Changes in the glycosylation pattern during embryonic development of mouse kidney as revealed with lectin conjugates. J.Histochem. Cytochem. 35, 55±65.
Lee, C.S., Buttitta, L.A., May, N.R., Kispert, A., Fan, C.-M., 2000. SHH-N upregulated Sfrp2 to mediate its competitive interaction with WNT1 and WNT4 in the somitic mesoderm. Development 127, 109±118.
Leimeister, C., Bach, A., Gessler, M., 1998. Developmental expression patterns of mouse sFRP genes encoding members of the secreted frizzled related protein family. Mech. Dev. 75, 29±42.
Lescher, B., Haenig, B., Kispert, A., 1998. sFRP-2 is a target of the Wnt-4 signaling pathway in the developing metanephric kidney. Dev. Dyn. 213, 440±451.
Leyns, L., Bouwmeester, T., Kim, S.-H., Piccolo, S., De Robertis, E.M., 1997. Frzb-1 is a secreted antagonist of Wnt signaling expressed in the Spemann organizer. Cell 88, 747±756.
Lin, K., Wang, S., Julius, M.A., Kitajewski, J., Moos Jr, M., Luyten, F.P., 1997. The cysteine-rich frizzled domain of Frzb-1 is required and sufficient for modulation of Wnt signaling. Proc. Natl. Acad. Sci. USA 94, 11196±11200.
Melkonyan, H.S., Chang, W.C., Shapiro, J.P., Mahadevappa, M., Fitzpatrick, P.A., Kiefer, M.C., Tomei, L.D., Umansky, S.R., 1997. SARPs: a family of secreted apoptosis-related proteins. Proc. Natl. Acad. Sci. USA 94, 13636±13641.
Moon, R.T., Brown, J.D., Yang-Snyder, J.A., Miller, J.R., 1997. Structurally related receptors and antagonists compete for secreted Wnt ligands. Cell 88, 725±728.
Papkoff, J., Schryver, B., 1990. Secreted int-1 protein is associated with the cell surface. Mol. Cell. Biol. 10, 2723±2730.
Perantoni, A.O., Dove, L.F., Karavanova, I., 1995. Basic fibroblast growth factor can mediate the early inductive events in renal development. Proc. Natl. Acad. Sci. USA 92, 4696±4700.
Plisov, S.Y., Yoshino, K., Dove, L.F., Higinbotham, K.G., Rubin, J.S., Perantoni, A.O., 2001. TGF-b2, LIF, and FGF2 cooperate to induce nephrogenesis. Development (in press).
Qiao, J., Sakurai, H., Nigam, S.K., 1999. Branching morphogenesis independent of mesenchymal±epithelial contact in the developing kidney. Proc. Natl. Acad. Sci. USA 96, 7330±7335.
Rattner, A., Hsieh, J.-C., Smallwood, P.M., Gilbert, D.J., Copeland, N.G., Jenkins, N.A., Nathans, J., 1997. A family of secreted proteins contains homology to the cysteine-rich ligand-binding domain of frizzled receptors. Proc. Natl. Acad. Sci. USA 94, 2859±2863.
SaxeÂn, L., 1987. Organogenesis of the Kidney, Cambridge University Press, Cambridge.
Shawlot, W., Behringer, R.K., 1995. Requirement of Lim1 in head-organizer function. Nature 374, 425±430.
Shimizu, H., Julius, M.A., GiarreÂ, M., Zheng, Z., Brown, A.M.C., Kitajewski, J., 1997. Transformation by Wnt family proteins correlates with regulation of b-catenin. Cell Growth Differ. 8, 1349±1358.
Stark, K., Vainio, S., Vassileva, G., McMahon, A.P., 1994. Epithelial transformation of metanephric mesenchyme in the developing kidney regulated by Wnt-4. Nature 372, 679±683.
U È ren, A., Reichsman, F., Anest, V., Taylor, W.G., Muraiso, K., Bottaro, D.P., Cumberledge, S., Rubin, J.S., 2000. Secreted frizzled-related protein-1 binds directly to wingless and is a biphasic modulator of Wnt signaling. J. Biol. Chem. 275, 4374±4382.
Vestweber, D., Kemler, R., Ekblom, P., 1985. Cell-adhesion molecule uvomorulin during kidney development. Dev. Biol. 112, 213±221.
Wang, Y., Macke, J.P., Abella, B.S., Andreasson, K., Worley, P., Gilbert, D.J., Copeland, N.G., Jenkins, N.A., Nathans, J., 1996. A large family of putative transmembrane receptors homologous to the product of the
Drosophila
Hsieh, J.C., Rattner, A., Smallwood, P.M., Nathans, J., 1999. Biochemical characterization of Wnt±frizzled interactions using a soluble, biologically active vertebrate Wnt protein. Proc. Natl. Acad. Sci. USA 96, 3546±3551.
Karavanov, A.A., Karavanova, I., Perantoni, A., Dawid, I.B., 1998. Expression pattern of the rat Lim-1 homeobox gene suggests a dual role during
kidney development. Int. J. Dev. Biol. 42, 61±66. Karavanova, I.D., Dove, L.F., Resau, J.H., Perantoni, A.O., 1996. Conditioned medium from a rat ureteric bud cell line in combination with bFGF induces complete differentiation of isolated metanephric
mesenchyme. Development 122, 4159±4167.
Kispert, A., Vainio, S., Shen, L., Rowitch, D.H., McMahon, A.P., 1996. Proteoglycans are required for maintenance of Wnt-11 expression in the ureter tips. Development 122, 3627±3637.
Kispert, A., Vainio, S., McMahon, A.P., 1998. Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in the developing kidney. Development 125, 4225±4234.
Korinek, V., Barker, N., Morin, P.J., van Wichen, D., de Weger, R., Kinzler, K.W., Vogelstein, B., Clevers, H., 1997. Constitutive transcriptional activation by a b-catenin±Tcf complex in APC 2/2 colon carcinoma. Science 275, 1784±1787.
Kreidberg, J.A., Sariola, H., Loring, J.M., Maeda, M., Pelletier, J., Housman, D., Jaenisch, R., 1993. WT1 is required for early kidney development. Cell 74, 679±691.
Laitinen, L., Virtanen, I., SaxeÂn, L., 1987. Changes in the glycosylation pattern during embryonic development of mouse kidney as revealed with lectin conjugates. J.Histochem. Cytochem. 35, 55±65.
Lee, C.S., Buttitta, L.A., May, N.R., Kispert, A., Fan, C.-M., 2000. SHH-N upregulated Sfrp2 to mediate its competitive interaction with WNT1 and WNT4 in the somitic mesoderm. Development 127, 109±118.
Leimeister, C., Bach, A., Gessler, M., 1998. Developmental expression patterns of mouse sFRP genes encoding members of the secreted frizzled related protein family. Mech. Dev. 75, 29±42.
Lescher, B., Haenig, B., Kispert, A., 1998. sFRP-2 is a target of the Wnt-4 signaling pathway in the developing metanephric kidney. Dev. Dyn. 213, 440±451.
Leyns, L., Bouwmeester, T., Kim, S.-H., Piccolo, S., De Robertis, E.M., 1997. Frzb-1 is a secreted antagonist of Wnt signaling expressed in the Spemann organizer. Cell 88, 747±756.
Lin, K., Wang, S., Julius, M.A., Kitajewski, J., Moos Jr, M., Luyten, F.P., 1997. The cysteine-rich frizzled domain of Frzb-1 is required and sufficient for modulation of Wnt signaling. Proc. Natl. Acad. Sci. USA 94, 11196±11200.
Melkonyan, H.S., Chang, W.C., Shapiro, J.P., Mahadevappa, M., Fitzpatrick, P.A., Kiefer, M.C., Tomei, L.D., Umansky, S.R., 1997. SARPs: a family of secreted apoptosis-related proteins. Proc. Natl. Acad. Sci. USA 94, 13636±13641.
Moon, R.T., Brown, J.D., Yang-Snyder, J.A., Miller, J.R., 1997. Structurally related receptors and antagonists compete for secreted Wnt ligands. Cell 88, 725±728.
Papkoff, J., Schryver, B., 1990. Secreted int-1 protein is associated with the cell surface. Mol. Cell. Biol. 10, 2723±2730.
Perantoni, A.O., Dove, L.F., Karavanova, I., 1995. Basic fibroblast growth factor can mediate the early inductive events in renal development. Proc. Natl. Acad. Sci. USA 92, 4696±4700.
Plisov, S.Y., Yoshino, K., Dove, L.F., Higinbotham, K.G., Rubin, J.S., Perantoni, A.O., 2001. TGF-b2, LIF, and FGF2 cooperate to induce nephrogenesis. Development (in press).
Qiao, J., Sakurai, H., Nigam, S.K., 1999. Branching morphogenesis independent of mesenchymal±epithelial contact in the developing kidney. Proc. Natl. Acad. Sci. USA 96, 7330±7335.
Rattner, A., Hsieh, J.-C., Smallwood, P.M., Gilbert, D.J., Copeland, N.G., Jenkins, N.A., Nathans, J., 1997. A family of secreted proteins contains homology to the cysteine-rich ligand-binding domain of frizzled receptors. Proc. Natl. Acad. Sci. USA 94, 2859±2863.
SaxeÂn, L., 1987. Organogenesis of the Kidney, Cambridge University Press, Cambridge.
Shawlot, W., Behringer, R.K., 1995. Requirement of Lim1 in head-organizer function. Nature 374, 425±430.
Shimizu, H., Julius, M.A., GiarreÂ, M., Zheng, Z., Brown, A.M.C., Kitajewski, J., 1997. Transformation by Wnt family proteins correlates with regulation of b-catenin. Cell Growth Differ. 8, 1349±1358.
Stark, K., Vainio, S., Vassileva, G., McMahon, A.P., 1994. Epithelial transformation of metanephric mesenchyme in the developing kidney regulated by Wnt-4. Nature 372, 679±683.
U È ren, A., Reichsman, F., Anest, V., Taylor, W.G., Muraiso, K., Bottaro, D.P., Cumberledge, S., Rubin, J.S., 2000. Secreted frizzled-related protein-1 binds directly to wingless and is a biphasic modulator of Wnt signaling. J. Biol. Chem. 275, 4374±4382.
Vestweber, D., Kemler, R., Ekblom, P., 1985. Cell-adhesion molecule uvomorulin during kidney development. Dev. Biol. 112, 213±221.
Wang, Y., Macke, J.P., Abella, B.S., Andreasson, K., Worley, P., Gilbert, D.J., Copeland, N.G., Jenkins, N.A., Nathans, J., 1996. A large family of putative transmembrane receptors homologous to the product of the
Drosophila
tissue polarity gene
frizzled. J. Biol. Chem. 271, 4468±4476.
Wang, S., Krinks, M., Lin, K., Luyten, F.P., Moos, J.r.M., 1997. Frzb, a secreted protein expressed in the Spemann organizer, binds and inhibits Wnt-8. Cell 88, 757±766.
Wilkinson, D., Green, J., 1990. In situ hybridization and the three-dimentinal reconstruction of series sections. In: Copp, A.J., Cokroft, D.L. (Eds.). Postimplantation Mammalian Embryos, Oxford University Press, London, pp. 155±171.
Wang, S., Krinks, M., Lin, K., Luyten, F.P., Moos, J.r.M., 1997. Frzb, a secreted protein expressed in the Spemann organizer, binds and inhibits Wnt-8. Cell 88, 757±766.
Wilkinson, D., Green, J., 1990. In situ hybridization and the three-dimentinal reconstruction of series sections. In: Copp, A.J., Cokroft, D.L. (Eds.). Postimplantation Mammalian Embryos, Oxford University Press, London, pp. 155±171.
Передача сигналов Wnt у
млекопитающих начинается с взаимодействия Wnt белка с гомологом Drosophila гена из семейства frizzled рецепторов (Chan et
al., 1992; Wang et al., 1996). Эти связанные с
мембранами белки имеют длинную
внеклеточную часть с цистеин-богатым
доменом (cysteine-rich domain(CRD)), 7 трансмембранных
сегментов и внутриклеточный хвост.
Передача сигналов зависит от
взаимодействия Wnt лиганда с CRD (Hsieh et al., 1999).
Помимо связанных с мембраной форм Frizzled,
некоторые естественно возникшие гены
кодируют гомлогичные растворимые белки.
Эти secreted Frizzled-related proteins (sFRPs) не имеют 7
трансмембранных сегментов, но имеют Frizzled-подобный
CRD. Большинство из них связывается с Wnt
белками и действуют как антогонисты Wnt (Moon
et al.,1997; Rattner et al., 1997; Finch et al., 1997; Leyns et al.,1997; Wang
et al., 1997). Предполагается, что sFRPs м.
модулировать предачу сигналов Wnt во время
эмбриогенеза.Так, Frzb-1 или sFRP-3 и sFRP-1 м.
ингибировть Wnt-зависимое удвоение оси у
эмбрионов Xenopus (Finch et al., 1997; Leyns et al., 1997; Wang et al.,
1997; Hall et al., 2000). 3 разных sFRP участвуют в
почечном органогенезе (Leimeister et al., 1998; Lescher et
al.,1998). Изучали роль sFRP-1 и sFRP-2 .
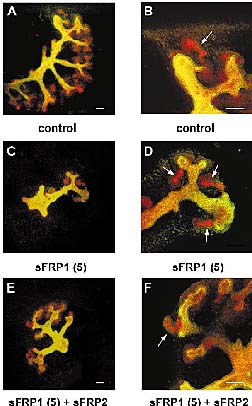

Рис. Эффекты sFRP-1 и комбинаций sFRP-1 и sFRP-2 в культурах metanephroi. Метанефросы крыс(13-dpc) культивировали в течение 5 дней:
(A,B), в отсуствие; или (C±I), в присутствие sFRPs. Эпителиальные структуры (ureteric
bud и вновь формируемые канальцы) мечены анти-E-cadherin (красные).
Уретрические bud окрашивали также DB-lectin (зеленые). После слияния жвух цветов желтоватые участки представляют ureteric bud, а красные структуры формирующиеся канальцы (стрелки). (A,B) В контрольных metanephroi, наблюдается повторное ветвление bud и экстенсиное образрование канальцев вблизи верхушек bud. (C,D) В присутствии 5 mg/ml sFRP-1, выявляется образование лишь небольшого числа канальцев, рост bud также ингибирован. (E,F) Ингибирующему эффекту sFRP-1 противостоит sFRP-2 (10 mg/ml). (B),(D), (F) - увеличенные области, представленные на (A), (C), (E) соответственно. Bars, 100 mm.
Установлено, что sfrp-1 распределен по всей
медуллярной и кортикальной строме
метанефросов, но отсутствует в
конденсированной мезенхиме и в первичном
эпителии канальцев развивающегося нефрона,
где wnt-4 обильно экспрессируется. Нпротив, sfrp-2
экспрессируется в первичных канальцах.
Рекомбинанные sFRP-1, sFRP-2 или комбинации обоих
вводили в культуру 13-dpc metanephroi крыс.
Образование канальцев и ветвление bud
заметно ингибировались с помощью sFRP-1,
тогда как sFRP-2 воздействие восстанавливало
до некоторой степени эти процессы. sFRP-2 сам
по себе не обнаруживает влияния на культуру metanephroi.
В культуре изолированной индуцированной ММ
крыс sFRP-1 блокирует события, связанные с
эпителиальной конверсией (tubulogenesis and expression of lim-1, sfrp-2 and E-cadherin);
однако, он не влияет на ранние события
(compaction of mesenchyme and expression of wt1). sFRP-1
связывает Wnt-4 с высоким сродством и
ингибирует ДНК-связывающую активность TCF,
эффектора передачи сигналов Wnt, тогда
как sFRP-2 не влияет на активацию TCF. sFRP-1 и sFRP-2
конкурируют локально за регуляцию передачи
сигналов Wnt во время органогенеза почек.
Множественные sfrps экспрессируются
на высоком уровне во время развития почек в
виде ткане-специфических паттернов,
которые комплементарны ли перекрывют
экспрессию членов семейства Wnt. Оценивали
способность sFRP-1 индуцировать морфогенез ММ,
процесс зависящий от передачи сигналов Wnt-4 (Stark et
al.,1994). Установлено, что sFRP-1 способен
взаимодействовать с белком Wnt-4 и
блокировать морфогенетические и
молекулярные события, связанные с
передачей сигналов Wnt-4. Установлено также,
что sFRP-2 конкурирует с sFRP-1, чтобы
облегчить тубулогенез и ветвление bud branching.
3.1. Comparison of sfrp expression in rat and mouse
Показано, что sfrp-1 экспрессируется
в в почках крыс также как и в почках мышей (Leimeister et al., 1998).
Во время органогенеза он появляется рано в
виде ткане-специфического паттерна, напр.,
обнаруживается только в стромальных
элементах, включая те, что окружают
индуцированную канальцы-генерирующую
бластему. Он отсуствует в каких-либо
эпителиальных структурах метанефросов. Это
отличается от того, что найдено у мышей, у
которых экспрессия обнаруживает сдвиг от
стромы к эпителию нефрона по ходу развития,
возможно потому, что мы не исследовали
поздние стадии.
Напротив, sfrp-2 экспрессия
обнаруживается сначала во вновь
формируемом эпителии, за исключением ткани
непосредственно вокруг уретры, в виде
паттерна, комплементарного sfrp-1. Паттерн
экспрессии sfrp-2 также несколько
отличается. У крыс он обнаруживается в
претубулярных агрегатах, которые состоят
из поляризованного эпителия позади
верхушка bud, но не в конденсирующейся
мезенхиме, как у мышей
3.2. sFRP-1 inhibits tubule formation and bud growth in metanephroi
Метанефросы у Wnt-4 нулевых гомозигот
дефицитны не только по формированию
канальцев, но и по степени ветвления
уретрического зачатка (bud) (Kispert et al., 1996). Нами
обнаружено существенное подавление
образования канальцев и роста bud с помощью sFRP-1.
Мезенхимная дифференцировка и рост bud
управляются реципрокными индуктивными
факторами. Растворимые сигналы от ММ, такие
как glial cell line-derived neurotrophic factor (GDNF) и др.необходимы для роста и ветвелния уретрического
зачатка (Qiao et al., 1999). Возможно, что
воздействие sFRP-1 снижает продукцию этих
сигнальных факторов в ММ. Или, sFRP-1 м.
ингибировать рост bud прямо, путем регуляции
передачи сигналов Wnt в уретрическом зачатке
(bud). Wnt-7B, который экспрессируется в
собирающих канальцах и Wnt-11, который
экспрессируется на верхушке bud, м. быть
такими молекулами-кандидатами, хотя их роль
в развитии почек не установлена.
3.3. sFRP-1 activity is specific to late events in morphogenesis
Предполагается, что некоторая
поляризация и эпителиальная конверсия все
же происходит в мезенхимных клетках в
культурах, обработанных sFRP-1, но эти клетки
неспосбны увеличиваться в числе. Не
исключена альтернативная интерпретация,
что Wnt-4 не инициирует эпителиальную
конверсию ММ, а скорее стимулирует
пролиферацию burst of epithelial cell, которая
сопровождает процесс конверсии. Это
подтверждается тем фактом, что FGF2
заставляет эксплантированную ММ
конденсироваться и экспрессировать ранние
маркеры, включая wnt-4 (unpublished observation); однако,
FGF2 является лишь слабым индуктором
образования канальцев (Karavanov et al., 1998).
3.4. sFRP interactions with Wnts
Связывание sFRP-1/Wnt-4 мы наблюдали в своих
экспериментах. sFRP-1связывает Wnt-4 с жадностью,
большей, чем это установлено для Wnt-3A (Finch et al.,
1997). Существует другая возможность, что
клетками bud кондиционированная среда
содержит растворимые Wnt, которые
ответственны за индукцию канальцев в
системе эксплантантов и что sFRP-1
взаимодействие с Wnt-4 в мезенхиме не
является принципиальным механизмом,
вызывающим подавление морфогенеза. Т.к.
белки Wnt выявлены в растворимой форме (Bradley
and Brown, 1995), чаще всего они ассоциированы с
компонентами ВКМ и редко обнаруживаются в
культуральной среде (Papkoff and Schryver, 1990). Т.обр.,
Wnt-экспрессирующие клетки сами нуждаются в
индуктивных сигналах (Herzlinger et al., 1994).
Хотя связывание sFRPs и Wnts необходимо
для подавления передачи сигналов Wnt,
связывание per se необходимо для
предупреждения передачи этих сигналов. Frzb-1,напр.,
ко-иммунопреципитирует с Wnt-5A, указывая тем
самым, что он взаимодействует с Wnt белком, но
не блокирует передачи сигналов Wnt-5A у Xenopus.
Однако, Frzb-1 ассоциирует и блокирует
передачу сигналов Wnt-1 (Lin et al., 1997). sFRPs
связывают и секвестрируют активные Wnt белки.
Frzb и Xwnt-8 экспрессируются в виде
комплементарного паттерна во время
эмбриогенеза и Frzb связывается с Xwnt-8.
Инактивирование Xwnt-8 во время гаструляции
способствует дорсализации эмбрионов Xenopus (Leyns
et al., 1997; Wang et al., 1997) и предупреждает индукцию
MyoD (Hoppler et al., 1996). В данном исследовании sFRP-1
полностью блокирует образование канальцев
в изолированной мезенхиме и метанефросах.
Однако не получено доказательств прямого
взаимодействия sFRP-1 с Wnt-4 или с др. еще
неидентифицированными Wnt.
Морфогенетические события,
ассоциированные с активностью Wnt-4 (epithelial
conversion/tubule formation) ингибируются с помощью sFRP-1;
а sFRP-1 ограничивает или блокирует
экспрессию молекул, связанных с передачей
сигналов Wnt-4, а именно, sfrp-2 (Lescher et al., 1998), и
активацией bTCF.
3.5. Function of sFRPs in vivo
Обнаружено, что sFRP-1 м. оказывать
двухфазный эффект на Wnt-зависимую
стабилизацию Armadillo (Drosophila ortholog of beta-catenin),
потенцируя активность Wnt при низких
концентрациях, но ингибируя при высоких
концентрациях (U È ren et al., 2000). Это
открывает возможность того, что эффект sFRP-1
in vivo м. сильно зависеть от близости его
места синтез, чем ближе источник, чем выше
концентрация, тем скорее следует ожидать
блокирования передачи сигналов Wnt, тогда
как на удалении и при низкой концентрации
он может усиливать активность Wnt. Такой
паттерн описан для регуляции Decapentaplegic (Dpp) с
помощью белка Short gastrulation (Sog) (Ashe and Levine, 1999).
Роль sFRP-2 в тубулогенезе иная. Т.к., sfrp-2
экспрессируется конкурентно с wnt-4 во вновь
формируемом эпителии, то трудно
предположить сходную антогонистическую
функциюi. Наиболее вероятно, что локальная
концентрация sFRP-2 будет облегчать
активность Wnt-4. sFRP-2 конкурирует с sFRP-1, чтобы
обеспечить тубулогенез. Имеется
прецендентоппозитного эффекта sFRP-1и sFRP-2 на
одну и ту же клетку (Melkonyan et al., 1997). Прямое
взаимодействие между sFRP-2 и Wnt-4 доказано (Lescher
et al., 1998), и показано, что клетки,
экспрессирующие sFRP-2 м. редуцировать
демомиотом-индуцирующую активность Wnt-4 (Lee et
al., 2000). Однако, в ММ sFRP-2 не выступает
антогонистом передачи сигналов Wnt-4.
Следовательно, эффект sFRPs на Wnt сигналы м.
отличаться в разных популяциях клеток в
зависимости от различий в сроюстве к
различным frizzled рецепторам и/или
ассоциированным протеогликанам. Последние
играют важную роль в Wnt-зависимом
морфогенезе почек (Davies et al., 1995) и м.
модулировать sFRP/Wnt взаимодействия (U È ren
et al., 2000).
sFRP/Wnt взаимодействие является
критическим для поддержания бластемных
клеток в нефрогенной зоне кортекса
метанефросов. Экспансия почечной ткани
зависит от дифференцировки в виде проксимо-дистального
паттерна. Стволовые клетки для последующих
раундов образования канальцев заселяют
наружные области кортекса и
непосредственно juxtaposed капсулярным sFRP-1-секретирующему
стромальному слою. Т.обр., sFRP-1 м. помогать
поддерживать популяцию бластемных
стволовых клеток, препятствуя Wnt-зависимой
дифференцировке. Высокий уровень
экспрессии вокруг уретры и в медулле
метанефросов открывают другую возможность,
что он предупреждает ductal/tubular экспансию в
зрелой ткани и в этом качестве м.
функционитровать как супрессор
нежелательной дифференцировки. Т.к. sFRP-2
ткже экспрессируется в тканях, окружающих
уретру, то ко-экспрессия этих sFRPs м.
указывать на наличие как позитивной, так и
негативной регуляции роста уретры.

Development 128, 1045-1057 (2001)
TGF-β2,LIF and FGF2 cooperate to induce nephrogenesis
Sergei Y. Plisov , Kiyoshi Yoshino , Lee F. Dove , Kathleen G. Higinbotham , Jeffrey S. Rubin and Alan O. Perantoni


Индуктивные процессы, которые управляют развитием эпителия нефрона из промежуточной мезодермы нефрогенного тяжа
(nephrogenic cord), т.наз. метанефрической мезенхимы (metanephric
mesenchyme (MM)), продемонстрированы как in vivo (Gruenwald,
1943), так и in vitro (Grobstein, 1953). Показано, что каждый
уретрический зачаток, вырост мезонефрического протока, выступает как источник сигнала, секретирующего
растворимый фактор (ы), и индуцирующего
образование нефрона (Perantoni et al., 1991a; Perantoni et al.,
1991b),
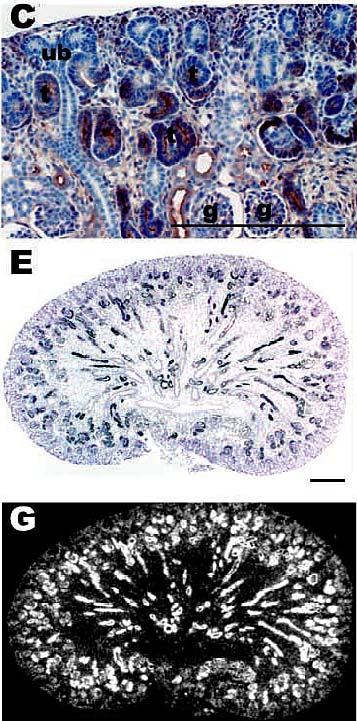
Fig. 5. Экспрессия LIFR в развивающихся
метанефросах крысы 13-й день эмбриогенеза. (C) Иммуногистохимическое
окрашивание LIFR в почках плодов крыс (g,гломерулы; ub,
уретрический зачаток). (E,G) Светлого/темного поля
изображения почки плода крысы. LIFR
локализуется в ткани, возникшей из ММ,
включая эпителий разивающихся нефронов. Черта:
0.1 mm.
Fibroblast growth factor 2 (FGF2) обеспечивает
ранние индуктивные события metanephric развития
т.е., конденсацию или компакцию ММ (Perantoni et al.,
1995). Этот фактор охарактеризован как
слабый индуктор signature event of nephrogenesis, а именно,
конверсию ММ в эпителий (Karavanov et al., 1998).
Эпителиальная конверсия и развитие
канальцев в ММ обычно происходит в течение 72 ч действия
индуктивного сигнала в метанефросах in situ и
при тканевых рекомбинациях in vitro. Однако,
реакция эксплантированной ММ на FGF2
задержана (10-14 дней) и неполна (примитивные
канальцы без гломерул), следовательно,
необходимо участие дополнительных
факторов, но не цитокинов (Weller et al., 1991). Было
установлено, что leukemia inhibitory factor (LIF) в
комбинации с FGF2 вызывает эпителиальную
конверсию и образование канальцев в ММ
после 7-дневного воздействия (Barasch et al., 1999). Так как морфогенез задержан в эксплантатах даже при
кооперации LIF/FGF2, то дополнительный фактор
должен участвовать в регуляции этого
процесса.
В данной работе было показано, что
нейтрализация Wnt лигандов с помощью antagonist-secreted
Frizzled-related protein 1 устраняет эту реакцию, а
комбинационная стимуляция эксплантатов
цитокинами и ростовыми факторами усиливает
ядерную активацию Tcf1/Lef1, указывая тем
самым, что LIF и TGFβ2/FGF2 кооперируются для
регуляции нефрогенеза с помощью общего Wnt-зависимого
механизма
Уретрический зачаток и возникающий из
него эпителий, мезонефрический проток,
вырабатывают различные наборы сигнальных
молекул, отвечающих за поддержание, рост и
дифференцировку мезенхимных популяций в
урогенитальном гребне. Описаны 3 различных
семейства цитокинов, которые кооперируются,
чтобы индуцировать дифференцировку ММ с
кинетикой, сравнимой с индуктивной моделью
(Karavanova et al., 1996). Впервые показано, что LIF без
FGF2 или FGF2 и TGF -b членов
семейства может независимо индуцировать
эпителиальную конверсию и образование
канальцев в ММ и что эти цитокины
кооперируются для ускорения
дифференцировки. В этом исследовании LIF
функционирует как фактор поддержания,
роста и дифференцировки, а в комбинации с
FGF2, который ведет себя как слабый индуктор
образования канальцев (Karavanov et al., 1998), LIF
может ускорять появление канальцев. Боле
того, LIF инициально экспрессируемый
уретрическим зачатком в последующем
активируется в LIF-treated MM, тогда как LIF
рецепторы выявляются с помощью ISH и IHC
только в клетках, возникающих из ММ (рис.).
TGF-a не оказывает эффекта на выживаемость, рост и дифференцировку ММ эксплантата (Karavanova et al., 1996). Однако, было установлено (Barasch et al., 1999) и нами (unpublished observation), что LIF нуждается в присутствии TGF-a для поддержания MMs. Передача сигналов через EGF рецептор блокирует Fas-индуцированный апоптоз HEK293 клетках, которые происходят из ММ и может оказывать сходный эффект в обработанных эксплантантах (Gibson et al., 1999). Тем не менее, очевидно, что TGF-a не функционирует как морфоген. Однако, FGF2 участвует в процессе дифференцировки, независимо вызывая образование канальцев (Karavanov et al., 1998) и активацию Stat3 (current study; Megeney et al., 1996) и с LIF, усиливая Tcf/Lef1 ДНК-связывающую активность. LIF в разных культуральных системах, напр., олигодендроцитах (Mayer et al., 1994), гипофизарных кортикотропных клетках (Stefana et al., 1996) и адипоцитах (Aubert et al., 1999) индуцируют дифференцировку в отсутствие добавления FGF. В данном исследовании LIF способствует росту и развитию канальцев в ММ на уровне (20 ng/ml), который не ингибирует образование нефронов в интактном рудименте(A.O. P., unpublished observation; Bard and Ross, 1991). Однако, ДНК-связывающая активность для Stat3 и Tcf1/Lef1 как и скорость образования канальцев повышены в FGF2/LIF-обработанных эксплантантах по сравнению с LIF или FGF2 только, это указывает на то, что комбинация факторов улучшает индуктивные сигналы . LIF и FGF2 функционируют синергично, вызывая пролиферацию и васкулогенез эндотелиальных клеток (Gendron et al., 1996) и пролиферацию миобластов (Austin et al., 1992). Фактически FGF2 и LIF независимо активруют Stat3, ERK1 и ERK2 в миобластах (Megeney et al., 1996).
TGF-a не оказывает эффекта на выживаемость, рост и дифференцировку ММ эксплантата (Karavanova et al., 1996). Однако, было установлено (Barasch et al., 1999) и нами (unpublished observation), что LIF нуждается в присутствии TGF-a для поддержания MMs. Передача сигналов через EGF рецептор блокирует Fas-индуцированный апоптоз HEK293 клетках, которые происходят из ММ и может оказывать сходный эффект в обработанных эксплантантах (Gibson et al., 1999). Тем не менее, очевидно, что TGF-a не функционирует как морфоген. Однако, FGF2 участвует в процессе дифференцировки, независимо вызывая образование канальцев (Karavanov et al., 1998) и активацию Stat3 (current study; Megeney et al., 1996) и с LIF, усиливая Tcf/Lef1 ДНК-связывающую активность. LIF в разных культуральных системах, напр., олигодендроцитах (Mayer et al., 1994), гипофизарных кортикотропных клетках (Stefana et al., 1996) и адипоцитах (Aubert et al., 1999) индуцируют дифференцировку в отсутствие добавления FGF. В данном исследовании LIF способствует росту и развитию канальцев в ММ на уровне (20 ng/ml), который не ингибирует образование нефронов в интактном рудименте(A.O. P., unpublished observation; Bard and Ross, 1991). Однако, ДНК-связывающая активность для Stat3 и Tcf1/Lef1 как и скорость образования канальцев повышены в FGF2/LIF-обработанных эксплантантах по сравнению с LIF или FGF2 только, это указывает на то, что комбинация факторов улучшает индуктивные сигналы . LIF и FGF2 функционируют синергично, вызывая пролиферацию и васкулогенез эндотелиальных клеток (Gendron et al., 1996) и пролиферацию миобластов (Austin et al., 1992). Фактически FGF2 и LIF независимо активруют Stat3, ERK1 и ERK2 в миобластах (Megeney et al., 1996).
Имеются доказательства существования
аутокринной передачи сигналов с помощью
LIF в различных тканях, включая почечные
мезангиальные клетки (Hartner et al., 1994). Показано
также, что другой gp130-связывающий
цитокин м. активировать экспрессию LIF (Knight
et al., 1999). В данной работе первым признаком,
указывающим на то, что LIF может регулировать
свою собственную экспрессию в
чувствительных ММ, было то, что воздействие
экзогенным LIF на ММ эксплантанты
стимулировало экспрессию эндогенного Lif .
Этот очевидный сдвиг с паракринной к
аутокринной экспрессии м. объяснить
кинетику метанефрических клеток,
детерминированных к формированию
канальцев.
TGF-b молекулы участвуют в регуляции клеточной
пролиферации и тканевой дифференцировки,
включая развитие метанефросов, с
помощью генного таргетинга, напр., TGF- b2
(lung, limb, craniofacial, heart, and urogenital defects; Sanford et al., 1997);
activin bB (eyelid and urogenital defects; Vassalli et al., 1994);
и Gdf11 (skeletal, palate and renal defects; McPherron et al., 1999).
Нулевые гомозиготы по TGF-b2
обнаруживают прогрессирующие повреждения
метанефросов в результате дегенерации
канальцев в позднем органогенезе (Sanford et al.,
1997), что отличает их от LIF нулевых гомозигот (Stewart et al., 1992). Активин b A, очевидно
экспрессирующийся в изолированных
уретрических почках, не обнаруживается в
клетках линии из иммортализованых клеток
зачатков крыс. Однако, он экспрессируется в LIF-
или TGF-b2-обработанных ММ (A. O. P., unpublished
observation). Напротив, активин bB
экспрессирутся на высоком уровне в
линии клеток зачатка, но лишь едва
обнарживается в изолированных зачатках и
не обнаруживается совсем в ММ, указывая тем
самым, что активины дифферениально
регулируются в метанефросах. Хотя активин bB
нулевые гомозиготы обнаруживают аномалии в
урогенитальном тракте, но затрагиваются
только репродуктивные ткани. Показано, что
growth/differentiation factor 11/Bmp11 может играть
критическую роль в развитии почек (McPherron et al., 1999).
Т.обр., множественные члены семейства TGF-b/activin
могут кооперироваться, чтобы обеспечить
передачу сигналов TGF-b.
Эффективны только факторы, обеспечивающие
передачу сигналов Smad2/3. Напр., Bmp7, передающий
сигналы через Smads1/4, неэффективен (Dudley et al., 1999).Члены
семейства TGF-b ограничивают
тубулогенез в интактных metanephroi (Rogers et al., 1993).
Это м.б. обусловлено или ингибирующим
эффектом TGF-b на рост и
ветвление уретрического зачатка или на
использование высоких концентрации (25 ng/ml versus 0.67
ng/ml) TGF-b. Мы ранее сообщали,
что TGF-b1 непосредственно
блокирует рост клеток зачатка при 1 ng/ml (Perantoni et al., 1991a; Perantoni et al., 1991b). При концентрации выше 10 ng/ml также
наблюдалось подавление морфогенеза.
Объяснением м. служить использование
гетерогенных рецепторов (Armes and Smith, 1997) или
присутствие рецепторов, не передающих
сигналы (Massague, 1998). В данном исследовании, LIF
и TGF-b2 экспрессия поддерживается или активируется в LIF- и TGF-b2-treated MMs. CNTF индуцирует TGF-b3
экспрессию в цилиарных ганглиолярных
нейронах (Krieglstein et al., 1998); более того, TGF-b2
м. стимулировать свою собственную
экспрессию и таковую других членов
семейства TGF-b(O’Reilly et al., 1992).
Напротив, TGF-b1 индуцирует
экспрессию LIF в культивируемых Шванновских
клетках (Matsuoka et al., 1997) или в фибробластах
легких (Elias et al., 1994).
Уретрический зачаток, как было здесь
показано, секретирует множественные TGF-bs.
MM, до проникновения зачатка на 12 dpc, не
экспресирует гена TGF-b2, но
он активируется в 13-dpc MM, указывая тем самым,
что сначала он вырабатывается паракринным
способом. В случае TGF-b2, мы
нашли активную форму в кондиционной среде
после клеток уретрической почки. Для TGF-bбелков,
экспрессируемых в MMs, секретируемые processing
factors, возникающие в уретрическом зачатке, м.
б. необходимы для продукции активных и
неактивных TGF-bмолекул (Pedrozo et al., 1999).
Клеточная реакция на LIF, напр., м.б.
блокирована с помощью естественно
появляющихся растворимых рецепторов (Tomida, 1997).
Взаимодействие follistatin с activins нейтрализует
активином-опосредованные реакции.
Наиболее интригующим аспектом
данного исследования является вовлечение и
возможная связь с активацией Stat, Smad и Tcf/Lef1.
LIF-опосредованная активация Stat3 является
быстрой и преходящей, проходящей в течение
минуты после соединения лиганда с
рецептором, но она способна индуцировать
морфогенез ветвления спустя многие часы
после экспозиции (Boccaccio et al., 1998). LIF также
действует синергично с Bmp2, улучшая
дифференцировку и транскрипцию со Stat-несущего
промотора (Nakashima et al., 1999). Эта кооперативная
передача сигналов осуществляется
благодаря образованию p300-bridged
комплекса Stat3 и Smad1. Т.к. Smad2/3 также
взаимодействует с CBP/p300 (Feng et al., 1998), то
сходный комплекс с участием Stat3 и Smad2/3 м.
усиливать активацию. Так как FGF2/TGF-b2
воздействие также было эффективным в этом
отношении, то м. предположить, что
эндогенный LIF или другой gp130-связывающий
лиганд активируется в этих эксплантатах
для активации Stat3. Т.обр., активация Stat не
обязательно преходяща и что перекрестные
взаимодействия с другими путями передачи
сигналов м.б. важны для усиления или
поддержания передачи сигналов Stat.
Ко-регуляция продемонстрирована
также между TGF-b и
членами семейства Wnt. У Xenopus
activin/Vg-1 кооперируют с Xwnt8/b-catenin для улучшения
транскрипции как с Wnt- так и activin-индуцируемых
генов и активность зависит от передачи
сигналов Smad2 (Crease et al., 1998). Smad4
взаимодействует непосредственно с b-catenin и с
комплексом Lef1 для облегчения транскрипции
с Wnt-индуцируемых генов (Nishita et al., 2000). В
данной работе, LIF , активированный
связыванием Tcf1/Lef1, которое в дальнейшем
усиливается кооперацией TGF-b2
и FGF2, действует как цитокин, ускоряя
тубулогенез. Предполагается естественное
присутствие Smad4 в комплексе Tcf . Т.к. усиление Tcf-DNA
связывания играет роль в передаче сигналов Wnt,
то прямой антогонизм с sFRP четко
демонстрирует участие Wnt в индукции
цитокина. Формирование канальцев
блокируется как в LIF- так и FGF2/TGF-b2-обработанных
ММ эксплантатах с помощью sFRP1. Точный
механизм LIF-mediated Wnt signaling/Tcf activation неясен.
Промтор Tcf-1 человека содержит
потенциальный Stat-связывающий мотив (Roose et al., 1999),
но его функция неизвестна. Другая
возможность, LIF может индуцировать передачу
сигналов Wnt благодая своей способности
активировать экспрессиюWnt4 (Kispert et al., 1998).
Третья возможность, p300 выступает как ко-активатор
при сборке различных кофакторов (Stats и/или
Smads) в транскрипционные комплексы, которые
связывают Tcf (Hecht et al., 2000).
Итак, LIF и TGF-b2 являются
важными индуктивными факторами для
метанефрической мезенхимы и каждый цитокин
привлекает Wnt сигналы для стимуляции
морфогенеза мезенхимы. Кооперативность
растворимых лигандов является
общераспространенным феноменом. Такая
кооперативность является нормой для
индуктивных сигналов в тканевой
дифференцировке.
Armes, N. A. and Smith, J. C. (1997). The ALK-2 and ALK-4 activin receptors transduce distinct mesoderm-inducing signals during early Xenopus development but do not co-operate to establish thresholds. Development 124, 3797-3804.
Aubert, J., Dessolin, S., Belmonte, N., Li, M., McKenzie, F. R., Staccini, L., Villageois, P., Barhanin, B., Vernallis, A., Smith, A. G. et al. (1999). Leukemia inhibitory factor and its receptor promote adipocyte differentiation via the mitogen-activated protein kinase cascade. J. Biol. Chem. 274, 24965-24972.
Austin, L., Bower, J., Kurek, J. and Vakakis, N. (1992). Effects of leukaemia inhibitory factor and other cytokines on murine and human myoblast proliferation. J. Neurol. Sci. 112, 185-191.
Bafico, A., Gazit, A., Pramila, T., Finch, P. W., Yaniv, A. and Aaronson, S. A. (1999). Interaction of frizzled related protein (FRP) with Wnt ligands and the frizzled receptor suggests alternative mechanisms for FRP inhibition of Wnt signaling. J. Biol. Chem. 274, 16180-16187.
Barasch, J., Qiao, J., McWilliams, G., Chen, D., Oliver, J. A. and Herzlinger, D. (1997). Ureteric bud cells secrete multiple factors, including bFGF, which rescue renal progenitors from apoptosis. Am. J. Physiol. 273, F757-F767.
Barasch, J., Yang, J., Ware, C. B., Taga, T., Yoshida, K., Erdjument-Bromage, H., Tempst, P., Parravicini, E., Malach, S., Aranoff, T. and Oliver, J. A. (1999). Mesenchymal to epithelial conversion in rat metanephros is induced by LIF. Cell 99, 377-386.
Bard, J. B. L. and Ross, A. S. A. (1991). LIF, the ES-cell inhibition factor, reversibly blocks nephrogenesis in cultured mouse kidney rudiments. Development 113, 193-198.
Boccaccio, C., Ando, M., Tamagnone, L., Bardelli, A., Michieli, P., Battistini, C. and Comoglio, P. M. (1998). Induction of epithelial tubules by growth factor HGF depends on the STAT pathway. Nature 391, 285-288.
Bonewald, L. F., Wakefield, L., Oreffo, R. O., Escobedo, A., Twardzik, D. R. and Mundy, G. R. (1991). Latent forms of transforming growth factor-b(TGF-b) derived from bone cultures: identification of a naturally occurring 100-kDa complex with similarity to recombinant latent TG Fb. Mol Endocrinol. 5, 741-751.
Crease, D. J., Dyson, S. and Gurdon, J. B. (1998). Cooperation between the activin and Wnt pathways in the spatial control of organizer gene expression. Proc. Natl. Acad. Sci. USA 95, 4398-4403.
Dignam, J. D., Martin, P. L., Shastry, B. S. and Roeder, R. G. (1983). Eukaryotic gene transcription with purified components. Methods Enzymol. 101, 582-598.
Dressler, G. R., Wilkinson J. E., Rothernpieler, U. W., Patterson, L. T., Williams-Simons, L. and Westphal, H. (1993). Deregulation of Pax-2 expression in transgenic mice generates severe kidney abnormalities. Nature 362, 65-67.
Dudley, A. T., Godin, R. E. and Robertson, E. J. (1999). Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613.
Elias, J. A., Zheng, T., Whiting, N. L., Marcovici, A. and Trow, T. K. (1994). Cytokine-cytokine synergy and protein kinase C in the regulation
of lung fibroblast leukemia inhibitory factor. Am. J. Physiol. 266, L426- L435.
Feng, X. H., Zhang, Y., Wu, R. Y. and Derynck, R. (1998). The tumor suppressor Smad4/DPC4 and transcriptional adaptor CBP/p300 are coactivators for smad3 in TGF-b-induced transcriptional activation. Genes Dev. 12, 2153-2163.
Finch, P. W., He, X., Kelley, M. J., Uren, A., Schaudies, R. P., Popescu, N. C., Rudikoff, S., Aaronson, S. A., Varmus, H. E. and Rubin, J. S. (1997). Purification and molecular cloning of a secreted, Frizzled-related antagonistof Wnt action. Proc. Natl. Acad. Sci. USA 94, 6770-6775.
Gendron, R. L., Tsai, F. Y., Paradis, H. and Arceci, R. J. (1996). Induction of embryonic vasculogenesis by bFGF and LIF in vitro and in vivo. Dev. Biol. 177, 332-346.
Gibson, S., Tu, S., Oyer, R., Anderson, S. M. and Johnson, G. L. (1999). Epidermal growth factor protects epithelial cells against Fas-induced apoptosis. J. Biol. Chem. 274, 17612-17618.
Grobstein, C. (1953). Morphogenetic interaction between embryonic mouse tissues separated by a membrane filter. Nature 172, 859-871.
Gruenwald, P. (1943). Stimulation of nephrogenic tissues by normal and abnormal inductors. Anat. Rec. 86, 321-335.
Hartner, A., Sterzel, R. B., Reindl, N., Hocke, G. M., Fey, G. H. and Goppelt-Struebe, M. (1994). Cytokine-induced expression of leukemia inhibitory factor in renal mesangial cells. Kidney Int. 45, 1562-1571.
Hecht, A., Vleminckx, K., Stemmler, M. P., van Roy, F. and Kemler, R. (2000). The p300/CBP acetyltransferases function as transcriptional coactivators of b-catenin in vertebrates. EMBO J. 19, 1839-1850.
Heim, M. H. (1999). The Jak-STAT pathway: cytokine signalling from the receptor to the nucleus. J. Recept. Signal Transduct. Res. 19, 75-120.
Karavanov, A. A., Karavanova, I., Perantoni, A. and Dawid, I. B. (1998). Expression pattern of the rat Lim-1 homeobox gene suggests a dual roleduring kidney development. Int. J. Dev. Biol. 42, 61-66.
Karavanova, I. D., Dove, L. F., Resau, J. H. and Perantoni, A. O. (1996). Conditioned medium from a rat ureteric bud cell line in combination with bFGF induces complete differentiation of isolated metanephric mesenchyme. Development 122, 4159-4167.
Kispert, A., Vainio, S. and McMahon, A. P. (1998). Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in thedeveloping kidney. Development 125, 4225-4234.
Knight, D. A., Lydell, C. P., Zhou, D., Weir, T. D., Robert, S. R. and Bai, T. R. (1999). Leukemia inhibitory factor (LIF) and LIF receptor in human lung. Distribution and regulation of LIF release. Am. J. Respir. Cell Mol. Biol. 20, 834-841.
Koblar, S. A., Turnley, A. M., Classon, B. J., Reid, K. L., Ware, C. B., Cheema, S. S., Murphy, M. and Bartlett, P. F. (1998). Neural precursor differentiation into atrocytes requires signaling through the leukemia inhibitory factor receptor. Proc. Natl. Acad. Sci. USA 95, 3178-3181.
Korinek, V., Barker, N., Morin, P. J., van Wichen, D., de Weger, R., Kinzler, K. W., Vogelstein, B. and Clevers, H. (1997). Constitutive transcriptional activation by a b-catenin-Tcf complex in APC -/- colon carcinoma. Science 275, 1784-1787.
Koseki, C. (1993). Cell death programmed in uninduced metanephric mesenchymal cells. Pediatr. Nephrology 7, 609-611.
Kreidberg, J. A., Sariola, H., Loring, J. M., Maeda, M., Pelletier, J.,Housman, D. and Jaenisch, R. (1993). WT1 is required for early kidney development. Cell 74, 679-691.
Krieglstein, K., Farkas, L. and Unsicker, K. (1998). TGF-beta regulates the survival of ciliary ganglionic neurons synergistically with ciliary neurotrophic factor and neurotrophins. J. Neurobiol. 37, 563-572.
Lescher, B., Haenig, B. and Kispert, A. (1998). sFRP-2 is a target of the Wnt-4 signaling pathway in the developing metanephric kidney. Dev. Dyn. 213, 440-451.
Mariano, J. M., Montuenga, L. M., Prentice, M. A., Cuttitta, F. and Jakowlew, S. B. (1998). Concurrent and distinct transcription and translation of transforming growth factor-b type I and type II receptors in rodent embryogenesis. Int. J. Dev. Biol. 42, 1125-1136.
Massague, J. (1998). TGF-b signal transduction. Annu. Rev. Biochem. 67, 753-791.
Matsuoka, I., Nakane, A. and Kurihara, K. (1997). Induction of LIF-mRNA by TGF-beta 1 in Schwann cells. Brain Res. 776, 170-180.
Mayer, M., Bhakoo, K. and Noble, M. (1994). Ciliary neurotrophic factor and leukemia inhibitory factor promote the generation, maturation and survival of oligodendrocytes in vitro. Development 120, 143-153.
McPherron, A. C., Lawler, A. M. and Lee, S. J. (1999). Regulation of anterior/posterior patterning of the axial skeleton by growth/differentiation factor 11. Nat. Genet. 22, 260-264.
Megeney, L. A., Perry, R. L., LeCouter, J. E. and Rudnicki, M. A. (1996). bFGF and LIF signaling activates STAT3 in proliferating myoblasts. Dev. Genet. 19, 139-145.
Nakashima, K., Yanagisawa, M., Arakawa, H., Kimura, N., Hisatsune, T., Kawabata, M., Miyazono, K. and Taga, T. (1999). Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science 284, 479-482.
Nishita, M., Hashimoto, M. K., Ogata, S., Laurent, M. N., Ueno, N., Shibuya, H. and Cho, K. W. Y. (2000). Interaction between Wnt and TGF-b signalling pathways during formation of Spemann’s organizer. Nature 403, 781-785.
O’Reilly, M. A., Danielpour, D., Roberts, A. B. and Sporn, M. B. (1992). Regulation of expression of transforming growth factor- b 2 by transforming growth factor-b isoforms is dependent upon cell type. Growth Factors 6, 193-201.
Oosterwegel, M., van de, W. M., Timmerman, J., Kruisbeek, A., Destree, O., Meijlink, F. and Clevers, H. (1993). Differential expression of the HMG box factors TCF-1 and LEF-1 during murine embryogenesis. Development 118, 439-448.
Oosterwijk, E., Van Muijen, G. N., Oosterwijk-Wakka, J. C. and Warnaar, S. O. (1990). Expression of intermediate-sized filaments in developing and adult human kidney and in renal cell carcinoma. J. Histochem. Cytochem. 38, 385-392.
Pedrozo, H. A., Schwartz, Z., Robinson, M., Gomes, R., Dean, D. D., Bonewald, L. F. and Boyan, B. D. (1999). Potential mechanisms for the plasmin-mediated release and activation of latent transforming growth factor-b1 from the extracellular matrix of growth plate chondrocytes.Endocrinology 140, 5806-5816.
Pelton, R. W., Saxena, B., Jones, M., Moses, H. L. and Gold, L. I. (1991). Immunohistochemical localization of TGFb1, TGFb2, and TGFb3 in the mouse embryo: expression patterns suggest multiple roles during embryonic development. J. Cell Biol. 115, 1091-1105.
Perantoni, A. O., Kan, F. W. K., Dove, L. F. and Reed, C. D. (1985). Selective growth in culture of fetal rat renal collecting duct anlagen. Lab. Invest. 53, 589-596.
Perantoni, A. O., Dove, L. F. and Williams, C. L. (1991a). Induction of tubules in rat metanephrogenic mesenchyme in the absence of inductive tissue. Differentiation 48, 25-31.
Perantoni, A. O., Williams, C. L. and Lewellyn, A. L. (1991b). Growth and branching morphogenesis of rat collecting duct anlagen in the absence of metanephrogenic mesenchyme. Differentiation 48, 107-113.
Perantoni, A. O., Dove, L. F. and Karavanova, I. (1995). Basic fibroblast growth factor can mediate the early inductive events in renal development. Proc. Natl. Acad. Sci. USA 92, 4696-4700.
Ritvos, O., Tuuri, T., Eramaa, M., Sainio, K., Hilden, K., Saxen, L. and Gilbert, S. F. (1995). Activin disrupts epithelial branching morphogenesis in developing glandular organs of the mouse. Mech. Dev. 50, 229-245.
Rogers, S. A., Ryan, G., Purchio, A. F. and Hammerman, M. R. (1993). Metanephric transforming growth factor-b1 regulates nephrogenesis in vitro. Am. J. Physiol. 264, F996-1002.
Roose, J., Huls, G., van Beest, M., Moerer, P., van der, H. K., Goldschmeding, R., Logtenberg, T. and Clevers, H. (1999). Synergy between tumor suppressor APC and the b-catenin-Tcf4 target Tcf1. Science 285, 1923-1926.
Sanford, L. P., Ormsby, I., Gittenberger-de Groot, A. C., Sariola, H., Friedman, R., Boivin, G. P., Cardell, E. L. and Doetschman, T. (1997).TGFb2 knockout mice have multiple developmental defects that are non-overlapping with other TGFb knockout phenotypes. Development 124,2659-2670.
Satoh, M., Sugino, H. and Yoshida, T. (2000). Activin promotes astrocytic differentiation of a multipotent neural stem cell line and an astrocyte progenitor cell line from murine central nervous system. Neurosci. Lett. 284, 143-146.
Saxén, L. and Lehtonen, E. (1978). Transfilter induction of kidney tubules as a function of the extent and duration of intercellular contacts. J. Embryol.Exp. Morphol. 47, 97-109.
Shawlot, W. and Behringer, R. K. (1995). Requirement of Lim1 in head-organizer function. Nature 374, 425-430.
Stark, K., Vainio, S., Vassileva, G. and McMahon, A. P. (1994). Epithelial transformation of metanephric mesenchyme in the developing kidney regulated by Wnt-4. Nature 372, 679-683.
Stefana, B., Ray, D. W. and Melmed, S. (1996). Leukemia inhibitory factor induces differentiation of pituitary corticotroph function: an immuno-neuroendocrine phenotypic switch. Proc Natl. Acad Sci USA 93, 12502- 12506.
Stewart, C. L., Kaspar, P., Brunet, L. J., Bhatt, H., Gadi, I., Kontgen, F. and Abbondanzo, S. J. (1992). Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor. Nature 359, 76-79.
Tomida, M. (1997). Presence of mRNAs encoding the soluble D-factor/LIF receptor in human choriocarcinoma cells and production of the soluble receptor. Biochem. Biophys. Res. Commun. 232, 427-431.
Vassalli, A., Matzuk, M. M., Gardner, H. A., Lee, K. F. and Jaenisch, R. (1994). Activin/inhibin beta B subunit gene disruption leads to defects in eyelid development and female reproduction. Genes Dev. 8, 414-427.
Vestweber, D., Kemler, R. and Ekblom, P. (1985). Cell-adhesion molecule uvomorulin during kidney development. Dev. Biol. 112, 213-221.
Weller, A., Sorokin, L., Illgen, E. M. and Ekblom, P. (1991). Development and growth of mouse embryonic kidney in organ culture and modulation of development by soluble growth factor. Dev. Biol. 144, 248-261.
Wilkinson, D. and Green, J. (1990). In situ hybridization and the three-dimentinal reconstruction of series sections. In Postimplantation Mammalian Embryos (ed. A.J. Copp and D.L. Cokroft), pp. 155-171.London: Oxford University Press.
Yoshino, K., Rubin, J. S., Higinbotham, K. G., Üren, A., Anest, V., Plisov, S. Y. and Perantoni, A. O. (2001). Secretal Frizzled-related proteins can regulate metanephric development. Mech. Dev. (in press).
ЛИТЕРАТУРА
Armes, N. A. and Smith, J. C. (1997). The ALK-2 and ALK-4 activin receptors transduce distinct mesoderm-inducing signals during early Xenopus development but do not co-operate to establish thresholds. Development 124, 3797-3804.
Aubert, J., Dessolin, S., Belmonte, N., Li, M., McKenzie, F. R., Staccini, L., Villageois, P., Barhanin, B., Vernallis, A., Smith, A. G. et al. (1999). Leukemia inhibitory factor and its receptor promote adipocyte differentiation via the mitogen-activated protein kinase cascade. J. Biol. Chem. 274, 24965-24972.
Austin, L., Bower, J., Kurek, J. and Vakakis, N. (1992). Effects of leukaemia inhibitory factor and other cytokines on murine and human myoblast proliferation. J. Neurol. Sci. 112, 185-191.
Bafico, A., Gazit, A., Pramila, T., Finch, P. W., Yaniv, A. and Aaronson, S. A. (1999). Interaction of frizzled related protein (FRP) with Wnt ligands and the frizzled receptor suggests alternative mechanisms for FRP inhibition of Wnt signaling. J. Biol. Chem. 274, 16180-16187.
Barasch, J., Qiao, J., McWilliams, G., Chen, D., Oliver, J. A. and Herzlinger, D. (1997). Ureteric bud cells secrete multiple factors, including bFGF, which rescue renal progenitors from apoptosis. Am. J. Physiol. 273, F757-F767.
Barasch, J., Yang, J., Ware, C. B., Taga, T., Yoshida, K., Erdjument-Bromage, H., Tempst, P., Parravicini, E., Malach, S., Aranoff, T. and Oliver, J. A. (1999). Mesenchymal to epithelial conversion in rat metanephros is induced by LIF. Cell 99, 377-386.
Bard, J. B. L. and Ross, A. S. A. (1991). LIF, the ES-cell inhibition factor, reversibly blocks nephrogenesis in cultured mouse kidney rudiments. Development 113, 193-198.
Boccaccio, C., Ando, M., Tamagnone, L., Bardelli, A., Michieli, P., Battistini, C. and Comoglio, P. M. (1998). Induction of epithelial tubules by growth factor HGF depends on the STAT pathway. Nature 391, 285-288.
Bonewald, L. F., Wakefield, L., Oreffo, R. O., Escobedo, A., Twardzik, D. R. and Mundy, G. R. (1991). Latent forms of transforming growth factor-b(TGF-b) derived from bone cultures: identification of a naturally occurring 100-kDa complex with similarity to recombinant latent TG Fb. Mol Endocrinol. 5, 741-751.
Crease, D. J., Dyson, S. and Gurdon, J. B. (1998). Cooperation between the activin and Wnt pathways in the spatial control of organizer gene expression. Proc. Natl. Acad. Sci. USA 95, 4398-4403.
Dignam, J. D., Martin, P. L., Shastry, B. S. and Roeder, R. G. (1983). Eukaryotic gene transcription with purified components. Methods Enzymol. 101, 582-598.
Dressler, G. R., Wilkinson J. E., Rothernpieler, U. W., Patterson, L. T., Williams-Simons, L. and Westphal, H. (1993). Deregulation of Pax-2 expression in transgenic mice generates severe kidney abnormalities. Nature 362, 65-67.
Dudley, A. T., Godin, R. E. and Robertson, E. J. (1999). Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613.
Elias, J. A., Zheng, T., Whiting, N. L., Marcovici, A. and Trow, T. K. (1994). Cytokine-cytokine synergy and protein kinase C in the regulation
of lung fibroblast leukemia inhibitory factor. Am. J. Physiol. 266, L426- L435.
Feng, X. H., Zhang, Y., Wu, R. Y. and Derynck, R. (1998). The tumor suppressor Smad4/DPC4 and transcriptional adaptor CBP/p300 are coactivators for smad3 in TGF-b-induced transcriptional activation. Genes Dev. 12, 2153-2163.
Finch, P. W., He, X., Kelley, M. J., Uren, A., Schaudies, R. P., Popescu, N. C., Rudikoff, S., Aaronson, S. A., Varmus, H. E. and Rubin, J. S. (1997). Purification and molecular cloning of a secreted, Frizzled-related antagonistof Wnt action. Proc. Natl. Acad. Sci. USA 94, 6770-6775.
Gendron, R. L., Tsai, F. Y., Paradis, H. and Arceci, R. J. (1996). Induction of embryonic vasculogenesis by bFGF and LIF in vitro and in vivo. Dev. Biol. 177, 332-346.
Gibson, S., Tu, S., Oyer, R., Anderson, S. M. and Johnson, G. L. (1999). Epidermal growth factor protects epithelial cells against Fas-induced apoptosis. J. Biol. Chem. 274, 17612-17618.
Grobstein, C. (1953). Morphogenetic interaction between embryonic mouse tissues separated by a membrane filter. Nature 172, 859-871.
Gruenwald, P. (1943). Stimulation of nephrogenic tissues by normal and abnormal inductors. Anat. Rec. 86, 321-335.
Hartner, A., Sterzel, R. B., Reindl, N., Hocke, G. M., Fey, G. H. and Goppelt-Struebe, M. (1994). Cytokine-induced expression of leukemia inhibitory factor in renal mesangial cells. Kidney Int. 45, 1562-1571.
Hecht, A., Vleminckx, K., Stemmler, M. P., van Roy, F. and Kemler, R. (2000). The p300/CBP acetyltransferases function as transcriptional coactivators of b-catenin in vertebrates. EMBO J. 19, 1839-1850.
Heim, M. H. (1999). The Jak-STAT pathway: cytokine signalling from the receptor to the nucleus. J. Recept. Signal Transduct. Res. 19, 75-120.
Karavanov, A. A., Karavanova, I., Perantoni, A. and Dawid, I. B. (1998). Expression pattern of the rat Lim-1 homeobox gene suggests a dual roleduring kidney development. Int. J. Dev. Biol. 42, 61-66.
Karavanova, I. D., Dove, L. F., Resau, J. H. and Perantoni, A. O. (1996). Conditioned medium from a rat ureteric bud cell line in combination with bFGF induces complete differentiation of isolated metanephric mesenchyme. Development 122, 4159-4167.
Kispert, A., Vainio, S. and McMahon, A. P. (1998). Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in thedeveloping kidney. Development 125, 4225-4234.
Knight, D. A., Lydell, C. P., Zhou, D., Weir, T. D., Robert, S. R. and Bai, T. R. (1999). Leukemia inhibitory factor (LIF) and LIF receptor in human lung. Distribution and regulation of LIF release. Am. J. Respir. Cell Mol. Biol. 20, 834-841.
Koblar, S. A., Turnley, A. M., Classon, B. J., Reid, K. L., Ware, C. B., Cheema, S. S., Murphy, M. and Bartlett, P. F. (1998). Neural precursor differentiation into atrocytes requires signaling through the leukemia inhibitory factor receptor. Proc. Natl. Acad. Sci. USA 95, 3178-3181.
Korinek, V., Barker, N., Morin, P. J., van Wichen, D., de Weger, R., Kinzler, K. W., Vogelstein, B. and Clevers, H. (1997). Constitutive transcriptional activation by a b-catenin-Tcf complex in APC -/- colon carcinoma. Science 275, 1784-1787.
Koseki, C. (1993). Cell death programmed in uninduced metanephric mesenchymal cells. Pediatr. Nephrology 7, 609-611.
Kreidberg, J. A., Sariola, H., Loring, J. M., Maeda, M., Pelletier, J.,Housman, D. and Jaenisch, R. (1993). WT1 is required for early kidney development. Cell 74, 679-691.
Krieglstein, K., Farkas, L. and Unsicker, K. (1998). TGF-beta regulates the survival of ciliary ganglionic neurons synergistically with ciliary neurotrophic factor and neurotrophins. J. Neurobiol. 37, 563-572.
Lescher, B., Haenig, B. and Kispert, A. (1998). sFRP-2 is a target of the Wnt-4 signaling pathway in the developing metanephric kidney. Dev. Dyn. 213, 440-451.
Mariano, J. M., Montuenga, L. M., Prentice, M. A., Cuttitta, F. and Jakowlew, S. B. (1998). Concurrent and distinct transcription and translation of transforming growth factor-b type I and type II receptors in rodent embryogenesis. Int. J. Dev. Biol. 42, 1125-1136.
Massague, J. (1998). TGF-b signal transduction. Annu. Rev. Biochem. 67, 753-791.
Matsuoka, I., Nakane, A. and Kurihara, K. (1997). Induction of LIF-mRNA by TGF-beta 1 in Schwann cells. Brain Res. 776, 170-180.
Mayer, M., Bhakoo, K. and Noble, M. (1994). Ciliary neurotrophic factor and leukemia inhibitory factor promote the generation, maturation and survival of oligodendrocytes in vitro. Development 120, 143-153.
McPherron, A. C., Lawler, A. M. and Lee, S. J. (1999). Regulation of anterior/posterior patterning of the axial skeleton by growth/differentiation factor 11. Nat. Genet. 22, 260-264.
Megeney, L. A., Perry, R. L., LeCouter, J. E. and Rudnicki, M. A. (1996). bFGF and LIF signaling activates STAT3 in proliferating myoblasts. Dev. Genet. 19, 139-145.
Nakashima, K., Yanagisawa, M., Arakawa, H., Kimura, N., Hisatsune, T., Kawabata, M., Miyazono, K. and Taga, T. (1999). Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science 284, 479-482.
Nishita, M., Hashimoto, M. K., Ogata, S., Laurent, M. N., Ueno, N., Shibuya, H. and Cho, K. W. Y. (2000). Interaction between Wnt and TGF-b signalling pathways during formation of Spemann’s organizer. Nature 403, 781-785.
O’Reilly, M. A., Danielpour, D., Roberts, A. B. and Sporn, M. B. (1992). Regulation of expression of transforming growth factor- b 2 by transforming growth factor-b isoforms is dependent upon cell type. Growth Factors 6, 193-201.
Oosterwegel, M., van de, W. M., Timmerman, J., Kruisbeek, A., Destree, O., Meijlink, F. and Clevers, H. (1993). Differential expression of the HMG box factors TCF-1 and LEF-1 during murine embryogenesis. Development 118, 439-448.
Oosterwijk, E., Van Muijen, G. N., Oosterwijk-Wakka, J. C. and Warnaar, S. O. (1990). Expression of intermediate-sized filaments in developing and adult human kidney and in renal cell carcinoma. J. Histochem. Cytochem. 38, 385-392.
Pedrozo, H. A., Schwartz, Z., Robinson, M., Gomes, R., Dean, D. D., Bonewald, L. F. and Boyan, B. D. (1999). Potential mechanisms for the plasmin-mediated release and activation of latent transforming growth factor-b1 from the extracellular matrix of growth plate chondrocytes.Endocrinology 140, 5806-5816.
Pelton, R. W., Saxena, B., Jones, M., Moses, H. L. and Gold, L. I. (1991). Immunohistochemical localization of TGFb1, TGFb2, and TGFb3 in the mouse embryo: expression patterns suggest multiple roles during embryonic development. J. Cell Biol. 115, 1091-1105.
Perantoni, A. O., Kan, F. W. K., Dove, L. F. and Reed, C. D. (1985). Selective growth in culture of fetal rat renal collecting duct anlagen. Lab. Invest. 53, 589-596.
Perantoni, A. O., Dove, L. F. and Williams, C. L. (1991a). Induction of tubules in rat metanephrogenic mesenchyme in the absence of inductive tissue. Differentiation 48, 25-31.
Perantoni, A. O., Williams, C. L. and Lewellyn, A. L. (1991b). Growth and branching morphogenesis of rat collecting duct anlagen in the absence of metanephrogenic mesenchyme. Differentiation 48, 107-113.
Perantoni, A. O., Dove, L. F. and Karavanova, I. (1995). Basic fibroblast growth factor can mediate the early inductive events in renal development. Proc. Natl. Acad. Sci. USA 92, 4696-4700.
Ritvos, O., Tuuri, T., Eramaa, M., Sainio, K., Hilden, K., Saxen, L. and Gilbert, S. F. (1995). Activin disrupts epithelial branching morphogenesis in developing glandular organs of the mouse. Mech. Dev. 50, 229-245.
Rogers, S. A., Ryan, G., Purchio, A. F. and Hammerman, M. R. (1993). Metanephric transforming growth factor-b1 regulates nephrogenesis in vitro. Am. J. Physiol. 264, F996-1002.
Roose, J., Huls, G., van Beest, M., Moerer, P., van der, H. K., Goldschmeding, R., Logtenberg, T. and Clevers, H. (1999). Synergy between tumor suppressor APC and the b-catenin-Tcf4 target Tcf1. Science 285, 1923-1926.
Sanford, L. P., Ormsby, I., Gittenberger-de Groot, A. C., Sariola, H., Friedman, R., Boivin, G. P., Cardell, E. L. and Doetschman, T. (1997).TGFb2 knockout mice have multiple developmental defects that are non-overlapping with other TGFb knockout phenotypes. Development 124,2659-2670.
Satoh, M., Sugino, H. and Yoshida, T. (2000). Activin promotes astrocytic differentiation of a multipotent neural stem cell line and an astrocyte progenitor cell line from murine central nervous system. Neurosci. Lett. 284, 143-146.
Saxén, L. and Lehtonen, E. (1978). Transfilter induction of kidney tubules as a function of the extent and duration of intercellular contacts. J. Embryol.Exp. Morphol. 47, 97-109.
Shawlot, W. and Behringer, R. K. (1995). Requirement of Lim1 in head-organizer function. Nature 374, 425-430.
Stark, K., Vainio, S., Vassileva, G. and McMahon, A. P. (1994). Epithelial transformation of metanephric mesenchyme in the developing kidney regulated by Wnt-4. Nature 372, 679-683.
Stefana, B., Ray, D. W. and Melmed, S. (1996). Leukemia inhibitory factor induces differentiation of pituitary corticotroph function: an immuno-neuroendocrine phenotypic switch. Proc Natl. Acad Sci USA 93, 12502- 12506.
Stewart, C. L., Kaspar, P., Brunet, L. J., Bhatt, H., Gadi, I., Kontgen, F. and Abbondanzo, S. J. (1992). Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor. Nature 359, 76-79.
Tomida, M. (1997). Presence of mRNAs encoding the soluble D-factor/LIF receptor in human choriocarcinoma cells and production of the soluble receptor. Biochem. Biophys. Res. Commun. 232, 427-431.
Vassalli, A., Matzuk, M. M., Gardner, H. A., Lee, K. F. and Jaenisch, R. (1994). Activin/inhibin beta B subunit gene disruption leads to defects in eyelid development and female reproduction. Genes Dev. 8, 414-427.
Vestweber, D., Kemler, R. and Ekblom, P. (1985). Cell-adhesion molecule uvomorulin during kidney development. Dev. Biol. 112, 213-221.
Weller, A., Sorokin, L., Illgen, E. M. and Ekblom, P. (1991). Development and growth of mouse embryonic kidney in organ culture and modulation of development by soluble growth factor. Dev. Biol. 144, 248-261.
Wilkinson, D. and Green, J. (1990). In situ hybridization and the three-dimentinal reconstruction of series sections. In Postimplantation Mammalian Embryos (ed. A.J. Copp and D.L. Cokroft), pp. 155-171.London: Oxford University Press.
Yoshino, K., Rubin, J. S., Higinbotham, K. G., Üren, A., Anest, V., Plisov, S. Y. and Perantoni, A. O. (2001). Secretal Frizzled-related proteins can regulate metanephric development. Mech. Dev. (in press).