Cheryll Tickle, Muriel Altabef
Current Opinion in Genetics & Development 1999, 9, No. 4:455-460.
FGF—fibroblast growth factor;
TGFβ —transforming growth factor-β
В работе обсуждается реорганизация эпителия при формировании апикального эктодермального гребня (АЭГ), дисперсии нервного гребня (НГ) и формировании сосудистой системы.
Dorso-ventral compartments and origin of apical ectodermal ridge in developing chick limb.
Development 1997, 124: 4547–4556.
Radical Fringe positions the apical ectodermal ridge at the dorso-ventral boundary of the vertebrate limb.
Nature 1997, 386: 360–366.
Expression of Radical Fringe in limb-bud ectoderm regulates apical ectodermal ridge formation.
Nature 1997, 386: 366–373.
The role of Engrailed in establishing the dorso-ventral axis in chick limb.
Development 1997, 124: 2317–2324.
Novel regulatory interactions revealed by studies of murine limb pattern in Wnt-7a and En-1 mutants.
Development 1997, 124: 5021–5032.
Analysis of the genetic pathway leading to formation of ectopic apicalectodermal ridges in mouse Engrailed-1 mutant limbs.
Development 1998, 125: 1137–1148.
The dorsoventral polarity of the presumptive limb is determined by signals produced by the somites and by lateral somatopleure.
Development 1997, 124: 1453–1463.
Origin of cells giving rise to mesoderm and endoderm in chick embryo.
Nature 1990, 343: 273–275.
The limb deformity gene is required for apical ectodermal ridge differentiation and antero-posterior limb pattern formation.
Genes Dev 1989, 3: 1481–1492.
Bnilp, a yeast formin linking cdc42p and the actin cytoskeleton during polarized morphogenesis.
Science 1997, 276: 118–122.
FGF 10 is a chemotactic factor for distal epithelial buds during lung development.
Dev Biol 1998, 201: 125–134.
Fgf-10 is required for both limb and lung development and exhibits striking functional similarity to Drosophila branchless.
Genes Dev 1998, 12: 3156–3161.
branchless encodes a Drosophila FGF homolog that controls tracheal cell migration and the pattern of branching.
Cell 1996, 87: 1091–1101.
Roles for FGF8 in the induction, initiation, and maintenance of chick limb development.
Cell 1996, 84: 127–136.
A splice variant of CD44 expressed in the apical ectodermal ridge presents fibroblast growth factors to limb mesenchyme and is required for limb outgrowth.
Genes Dev 1998, 12: 1058–1071.
Defects in limb, craniofacial and thymic development in Jagged2 mutant mice.
Genes Dev 1998, 12: 1046–1057.
Serrate2 is disrupted in the mouse limb-development mutant syndactylism.
Nature 1997, 389: 722–725.
A chick homologue of serrate and its relationship with Notch and Delta homologues during central neurogenesis.
Dev Biol 1996, 174: 233–247.
Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm.
Cell 1995, 82: 969–979.
A role for rhoB in the delamination of neural crest cells from the dorsal neural tube.
Development 1998, 125: 5055–5067.
Rho, Rac, and Cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia.
Cell 1995, 81: 53–62.
Experimental analysis of blood vessel development in the avian wing bud.
Anat Rec 1991, 231: 136–144.
Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4.
Cell 1998, 93: 741–753.
Roles of ephrinB ligands and EphB receptors in cardiovascular development: demarcation of arterial/venous domains, vascular morphogenesis, and sprouting angiogenesis.
Genes Dev 1999, 13: 295–306.
Complementary gradients in expression and binding of Elf1 and Mek4 in development of the topographic retinotectal projection map.
Cell 1995, 82: 371–381.
Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to neural crest migration.
Curr Biol 1997, 7: 571–580.
Eph-family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon guidance.
Neuron 1997, 18: 383–396.
Signalling by Eph-A4 receptors and their ephrin ligands.
Curr Opin Neurobiol 1998,8:375–382.
Apical ridge formation
В конечностях позвоночных утолщенный эпителий, апикальный эктодермальный гребень, формируется на стыке дорсальной и вентральной эктодермы.
Fig. 1a).
Расположение АЭГ предопределяет то, что конечность начинает выступать из боковой поверхности тела. DiI мечение эктодермы эмбрионов кур выявляет компартментные ограничения дорсальных и вентральных клонов клеток, которые распространяются вдоль тела как в конечность-формирующую область, так и между конечностями.[1] . Другие серии повторяющихся органов позвоночных зубы,молочные железы и пальцы также развиваются вдоль непрерывной линии, которая затем разрывается на определенное число локальных эпителиальных утолщений. Другая разграничивающая линия предопределяет, например, так наз. 'milk line', вдоль которой формируются индивидуальные молочные железы
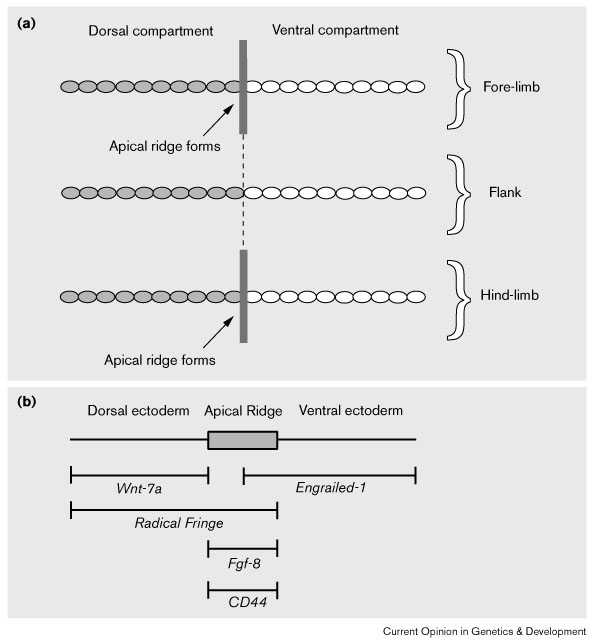 |
Рис. 1 (a) Формирование апикального эктодермального гребня (вертикальная полоска) на границе между дорсальным (затененный) и вентральным компартментами в конечности-формирующих областях. Эктодерма поверхност тела изображена в виде плоскости. Справа дорсальная, слева вентральная сторона, перед находится вверху. Компартменты непрерывны вдоль всего тела даже во фланкирующих (между конечностями)областях (штриховая линия) хотя апикальных гребней здесь не формируется. (b) Домены экспрессии генов в дорсальной эктодерме, вентральной эктодерме и АЭГ. Экспрессия Fgf-8 и CD44 оказывается локализованой в АЭГ, когда он формирутеся. (Список молекул, экспрессирующихся в этом эпителии не exhaustive.) Figure 1 (a) Apical ectodermal ridge formation (vertical bar) at boundary between dorsal (shaded) and ventral (unshaded) ectodermal compartments in limb-forming regions. The ectoderm of the body surface is depicted as being flat. Just right side is shown with dorsal towards left; anterior towards top. Note that the compartments are continuous all down the body even in the flank (inter-limb) region (dashed line) although no apical ridge forms here. (b) Domains of gene expression in dorsal ectoderm, ventral ectoderm and apical ectodermal ridge. Expression of Fgf-8 and CD44 becomes localised in the apical ridge as it forms. (Note that this list of molecules expressed in these epithelia is not exhaustive.) |
Генетические манипуляции, такие как эктопическая экспрессия генов у эмбронов кур [2] [3] [4], показали, что сигнальные молекулы Radical Fringe (экспрессирующиеся в дорсальной эктодерме и дорсальном апикальном гребне) и транскрипционный фактор Engrailed-1 (экспрессирующийся в вентральной эктодерме и вентральном апикальном гребне) контролируют формирование АЭГ онечности на границе дорсо-вентрального компартметов (Fig. 1b). В работах Cygan et al. [5] и Loomis et al. [6••] проанализировано в деталях образование гребня у мышей, у которых Engrailed-1 функционально инактиврован. У таих мутантов вентральная эктодерма утолщается и может даже формировать вторичный гребень, однако дорсальная часть гребня формируется нормально. Однако , Wnt-7a, который обычно экспрессируется дорсально в эктодерме, но не в гребне (Fig. 1b), экспрессируется вентрально у этих мутантов. Изучение мышей с инактиврованными обоими генами Wnt-7a и Engrailed-1 показало, что АЭГ в этом случае формируется более или менее нормально. Кажется, что образование вторичного АЭГ у мутантов Engrailed обусловливается эктопической экспрессией Wnt-7a в вентральной эктодерме. Очевидно Wnt-7a играет роль в позиционировании апикального гребня, но обнаруживается несколько неожиданных факторов. Один из них тот, что мыши с функционально инактивированым Wnt-7a формируют нормальный АЭГ. Следовательно, в этом контексте экспрессияWnt-7a не обязательна для образования гребня. Следовательно, контроль позиционирования апикального гребня очень сложен. Остальные гены еще неидентифицированы.
Клеточные механизмы, ведущие к образованию АЭГ также остаются неясными. В АЭГ эпителиальные клетки многослойные, плотно упакованы и сцеплены многочисленными соединениями (Fig. 2a). Локальная пролиферация клеток может управляться с помощь механизма эпителиального утолщения, так как картирование показывает, что АЭГ не возникет из клеток границы между компартментами. У химер курица/перепел [1] [7] выявлено, что предшественики апикального гребня первоначально занимают неожиданно широкую область эктодермы. Следовательно, АЭГ может формироваться или в результате эпителиальной компакции или с помощью аггрегации мигрирующих клеток (Fig. 3a). Если клетки большой области эктодермы просто компактизуются, то предшественники небольших групп клеток меченные в этой области должны обнаруживаться исключительно в АЭГ, однако небольшие группы меченных клеток обнаруживаются как в АЭГ, так и вне его [1], указывая тем самым, что разбросанные клетки аггрегируют для формирования АЭГ. Неясно являются ли эти клетки детерминированными к образованию АЭГ до сборки и движутся в правильную позицию таким же образом как это предположительно происходит при образовании персиыной полоски [8]. Другая возможность в том, что клетки, котoрые собираются на дорсо-вентральной границе взаимодествуют и затем становятся детерминированными к образованию АЭГ.
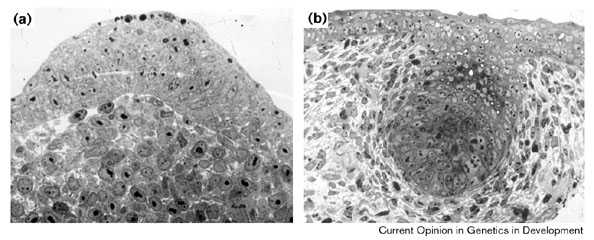 |
Рис. 2 Гистологические срезы (a) через кончик зачатка крыла эмбриона курицы, показывающие утолщенный апикальный гребень through the tip of a chick wing bud showing the thickened apical ectodermal ridge (плотно упакованные клетки) and (b) через развивающуюся молочную железу мыши, показывающую сгусток эпителиальных клеток. Figure 2 Histological sections (a) through the tip of a chick wing bud showing the thickened apical ectodermal ridge (note closely packed cells) and (b) through developing mouse mammary gland showing a knob of epithelial cells |
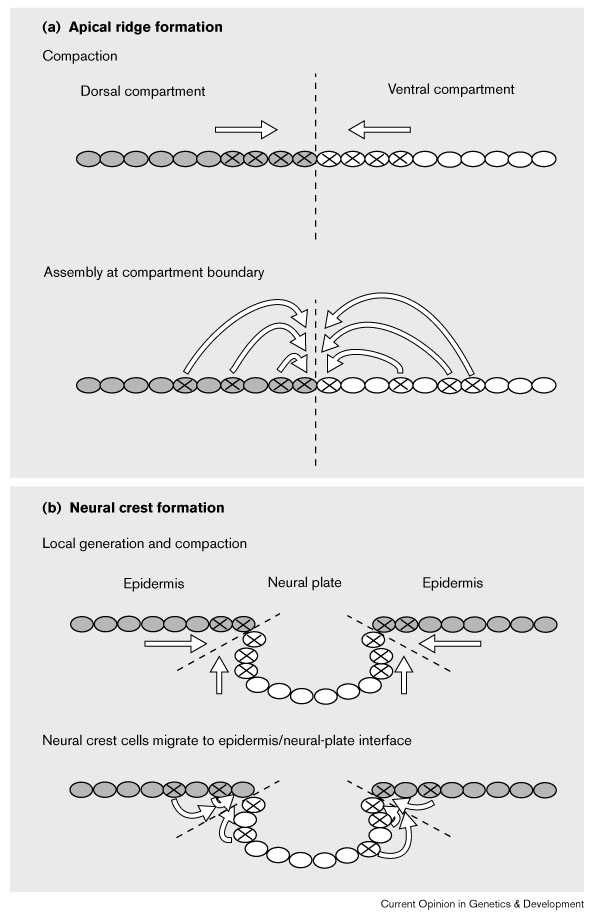 |
Рис. 3 (a) Модели образования АЭГ, базирующиеся на копакции предшественников и сбореке разбросанных клеток-предшественников. Штриховая линия - граница между дорсальной (затененной) и вентральной эктодермой. Клетки, маркированные X являются клетками-предшественниками АЭГ. (b) Модели формирования нейрального гребня, представленные по аналогии с формированием АЭГ. (см [a]). Штриховая линия между эпидермисом (затенена) и нейральной пластинкой. Клетки, маркированные X являются клетками-предшественниками нейрального гребня. Figure 3 (a) Models for apical-ridge formation, contrasting compaction of apical-ridge precursors and assembly of the ridge from scattered precursor cells. The dashed line represents the boundary between dorsal (shaded) and ventral ectoderm. Cells marked with an X are apical ectodermal ridge progenitor cells. (b) Models for neural-crest formation, drawing an analogy with apical-ridge formation (see [a]). The dashed line represents the boundary between epidermis (shaded) and neural plate. Cells marked with an X represent neural crest progenitor cells |
Имеется несколько сигналов, которые мигрирующие клетки могут использовать для сборки АЭГ. У мутантов limb deformity АЭГ patchy и ill-defined [9]. Изоформа формина, которая кодируется мутантным геном при limb deformity, экспрессируется в АЭГ и у дрожжей, у которых его гомологи участвуют в регуляции актиновго цитоскелета [10]. Имеются доказательства того, что fibroblast growth factors (FGFs) обладает хемотактическим эффектом на морфогенез эпителиальных клеток у позвоночных и беспозвоночных, например, при отпочковывании легких и распространении трахей у насекомых [11•] [12] [13]. Fgf-8 экспрессируется в эктодерме конечностей до сборки АЭГ [14] и может влиять на миграцию клеток. Наконец, АЭГ экспрессирует вариант формы CD44 рецептора, гиалуронанового рецептора. Недавно Sherman et al. [15••] показали, что этот рецептор играет роль в выросте зачатка конечности. Он, по-видимому, усиливает миграцию клеток.
Сигналы Notch обеспечивают взимодейсствие эпителиальных клеток в эктодерме почки конечности и, по-видимому, регулирует число предшественников АЭГ. Мыши, нокаутные по notch лиганду, продукту гена Jagged-2 — также известного как Serrate-2, гомологу гена дрозофилы serrate —, были получены [16••] и эти мутанты имели утолщенный апикальный гребень. Несколько раньше в независимом исследовании было также показано, что Serrate-2 разрушен у мутантных мышей syndactylism [17]. Jagged-2 (Serrate-2) экспрессируется широко в эктодерме конечности на ранних стадиях и Notch-1 также экспрессируется в апикальном гребне [2] [18]. В нервной системе классической функцией сигналов Notch является латеральная ингибиция, которая регулирует число нейральных клеток, которые разовьется. Сигналы Notch в эктодерме конечностей могут сходным образом регулировать число предшественников АЭГ. В отсутствии этих сигнальных взаимодействий должно возникать значительно болшее чило предшественников АЭГ и это объясняет, почему у мутантов АЭГ значительно толще, чем обычно. Утолщенный гребень у мутантов Jagged-2 (Serrate-2) вдавлен в мезенхиму почки конечности скоре, чем выпячивается многослойным гребнем. Этот аберрантный гребень напоминает ранние стадии эпителиального почкования, например, молочных желез (Fig. 2b), т.е. инициируется АЭГ по типу формирования железы.
Neural crest
Neural crest
Подобно АЭГ клетки нейрального гребня появляются как специализированные структуры из эпителия в точном местоположении (Fig. 3b). Гребень возникает на стыке между нейральной пластинкой и эктодермой и интересно знать является он границей компартментов. На инициальных стадиях образрования гребня у эмбрионов кур клетки гребня выделяются из слоя и располагаются под эктодермой по сторонам нейральной трубки.
Гены, кодирующие bone morphogenetic proteins (BMPs) из TGF-β сверхсемейства , BMP-4 и BMP-7, экспресируются в эпидермальной эктодерме, примыкающей к нейральной трубке и индуцирующей образование нейрального гребня [19]. Клетки с потенциалом образования НГ однако широко распределены. Это подтверждает аналогию с образованием АЭГ (Fig. 3a). Неясно происходдит ли образование НГ за счет рекрутирвоания разбросанных клеток-предшественников или возникает из клеток границы нейральная пластинка/эктодерма (Fig. 3b).
Когда клетки нейрального гребня специфицируются они подвергаются эпителиально-мезенхимному переходу и начинают мигрировать прочь от эктодермы и нервной трубки.
Liu and Jessell [20••] занялись скринингом генов, индуцируемых с помощью BMPs в клетках нейральной пластинки. Они выделили ген, кодирующий член семейства GTP-связывающих белков rhoB, уже известного своей ролью в актин-зависимых процессах, включая подвижность, форму, адгезию, цитокинез и прогрессию клеточного цикла[21]. rhoB экспрессируется в дорсальном кнчике нейральных складок перед закрытием нейральной трубки и затем в дрсальной средней линии на высоком уровне. Эмигрирующие клетки НГ все еще экспрессируют rhoB , несмотря на то что они являются близкими нервной трубке они движутся от нее в сторону. Продемонстрирована роль rhoB в ступени выделения из слоя. Блокирование in vitro с помощью Clostridium botulinum exotoxin C3,активности rhoB вызывает дизорганизацию актинового цитоскелета клеток НГ и предупреждает деламинацию этих клеток. Ингибирование rhoB однако оказывает мало влияния на спецификацию НГ (по экспрессии slug, маркера НГ в премиграторных клетках) и не оказывала влияния на позднюю миграцию клеток НГ. rhoB может быть связан со способнотью клеток покидать нервную трубку в ответ на эпидермальные сигналы и является первым идентифицированным компоенетом миграторного процесса, контролирующего мрфогенез НГ.
Vasculature
Vasculature
Две фазы реорганизации эпителия: васкулогенез, дает примитивную сосудистую систему, когда потенциальные ангиогенные клетки рекрутируются из недифференцированной мезенхимы в сеть сосудов, и ангиогенез, связаный с разрастанием и ветвленем первичных сосудов и формированием специализированных оболочек вокруг эндотелиальной выстилки.
Все эндотелиальные клетки эквивалентны и не обладают внутренне присущей позиционной информацией[22]. Специализация сосудов возникает следовательно, без участия окружающих тканей. Wang et al. [23••] установили, что эфриновый лиганд (ephrin B2) экспресируется специфически эндотелиальными клетками артерий и что его рецептор (EphB4) экспрессируется венами. Более того целенаправленное разрушение ephrin B2у мышей с использованием tau–lacZ индикаторного гена выявило заметные дейекты в ангиогенезе. Например, во внеэмбриональной циркуляции желточного мешка трансгенных мышей первичная система капиляров персистирует и не ремодулируется с помощью ангиогенеза. Adams et al [24••] подтвердили комплементарные паттерны экспрессии ephrin B2 и EphB4 . Однако они обнаружили, что другие эфрины и рецепторы коэкспрессируются и в артериях и в венах и отметили комплементарный характер экспресии в эндотелиальных клеткахъ и мезенхиме, подвергающейся васкуляризации.
Eph-рецептороные тирозин киназы и их связанные с поверхностью клеток эфриновые лиганды широко используются для формирования паттерна нервной системы, напр., в создании правильных ретино-тектальных соединений [25] и в предопределении путей клеток НГ через сомиты [26] [27]. Во всех этих системах, взаимодействия между эфринами и их рецепторами ведут к отталкивающим эффектам, например, предупреждают клетки Нг от миграции через задние половины сомитов.
Комплементарная экспрессия Eph-рецепторов и эфринов в артериях и венах указывает на компартментализацию сосудистой системы. Это особенно нтересно из за того, что между эндотелиальными клетками артерий и вен нет отличий. Классификация кровеносных сосудов связана с физиологией — направлением кровотока (к или от сердца) и с тем окигенирована или нет кровь. Эфрин/Eph рецептор сигнальная система обеспечивает механизм позиционирования расположения сосудов в артериально-венозном интерфейсе (Fig. 4) и представляет собой другой путь перестройки эпителиальных клеток в правильном положении. Как рекрутируются эндотелиальные клетки в таких интрфейсах? Становится очевидным, что Eph-рецепторы взаимодействуют с некими молекулами, участвующими в организации актинового цитоскелета (reviewed in [28]).
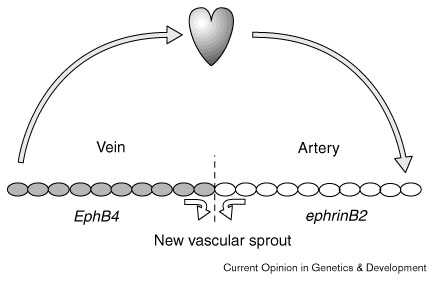 |
Рис. 4 Модель ангиогенного врастания, показывающая домены комплементарной экспрессии генов в артериях и венах и выявляющая возможное сходство с формирование АЭГ и НГ, показанное на рис.3. Штриховая линия - граница между веной и артерией. Figure 4 Model for angiogenic sprouting, showing complementary gene expression domains on arteries and veins and emphasising possible similarity with apical ridge and neural crest formation shown in Fig. 3. The dashed line represents the boundary between vein and artery |