Regulation of retinal ganglion cell production by Sonic hedgehog
Xiang-Mei Zhang and Xian-Jie Yang
Development 128, 943-957 (2001)
Нейральная сетчатка происходит
из внутреннего слоя оптического бокала,
который возникает из передней части
нервной трубки. Зачаток сетчатки содержит
пролиферирующие клетки-предшественники,
которые дают зрелую нейральную сеть,
состоящую из 7 нейрональных и глиальных
типов клеток (Dowling, 1987). Продукция различных
клеток сетчатки происходит во временной
последовательности, законсервированной у позвоночных (reviewed by Altshuler et al., 1991).
Как и в развивающейся ЦНС (Edlund
and Jessell, 1999; Lillien, 1998), контроль
дифференцировки сетчатки осуществляется
с помощью cell-extrinsic и cell-intrinsic факторов.
Клетки предшественники сетчатки
мультипотентны (Turner and Cepko, 1987; Holt et al., 1988;
Wetts and Fraser, 1988; Turner et al., 1990; Fekete et al., 1994).
Идентифицирован целый рад диффундирующих
факторов, которые влияют на нейрогенез
сетчатки (Hicks and
Courtois, 1992; Altshuler et al., 1993; Kelley et al., 1994;
Lillien, 1995; Fuhrmann et al., 1995; Ezzeddine et al., 1997;
McFarlane et al, 1998; Yourey, 2000). Клетки
предшественники на разных стадиях
нейрогенеза обнаруживают изменение
потенциала развития, что отражает
прогрессию их внутренних свойств
(Watanabe and Raff, 1990; Watanabe and Raff, 1992;
Alexiades and Cepko, 1997; Morrow et al, 1998; Belliveau and
Cepko, 1999).
Ahmad, I., Dooley, C. M. and Polk, D. L. I. (1997). Delta-1 is a regulator ofneurogenesis in the vertebrate retina. Dev. Biol. 185, 92-103.
Alexiades, M. R. and Cepko, C. L.
(1997). Subsets of retinal progenitorsdisplay temporally regulated and distinct biases in the fates of their progeny.Development
124, 1119-1131.Altshuler, D., Turner, D. and Cepko, C. (1991). Specification of cell type inthe vertebrate retina. In Development of the Visual System (ed. M. Lam andC. Shatz), pp. 37-58. Cambridge: MIT Press.Altshuler, D. and Cepko, C.
(1992). A temporally regulated, diffusible activity is required for rod photoreceptor development in vitro. Development114, 947-957.Altshuler, D., Lo Turco, J. J., Rush, J. and Cepko, C.
(1993). Taurine promotes the differentiation of a vertebrate retinal cell type in vitro.Development 119, 1317-1328.Austin, C. P., Feldman, D. E., Ida, J. A., Jr and Cepko, C. L.
(1995).Vertebrate retinal ganglion cells are selected from competent progenitors bythe action of Notch. Development 121, 3637-3650.Baker, N. E., Yu, S. and Han, D.
(1996). Evolution of proneural atonal expression during distinct regulatory phases in the developing Drosophilaeye. Curr. Biol. 6, 1290-1301.Bao, Z. Z. and Cepko, C. L.
(1997). The expression and function of Notchpathway genes in the developing rat eye. J. Neurosci. 17, 1425-1434.Belecky-Adams, T., Cook, B. and Adler, R.
(1996). Correlations between terminal mitosis and differentiated fate of retinal precursor cells in vivo and in vitro: analysis with the ‘window- labeling’ technique. Dev. Biol. 178, 304- 315.Belliveau, M. J. and Cepko, C. L.
(1999). Extrinsic and intrinsic factors control the genesis of amacrine and cone cells in the rat retina. Development126, 555-566.Belloni, E., Muenke, M., Roessler, E., Traverso, G., Siegel-Bartelt, J., Frumkin, A., Mitchell, H. F., Donis-Keller, H., Helms, C., Hing, A. V. etal.
(1996). Identification of Sonic hedgehog as a candidate gene responsible for holoprosencephaly. Nat Genet 14, 353-356.Brown, N. L., Sattler, C. A., Paddock, S. W. and Carroll, S. B.
(1995). Hairy and emc negatively regulate morphogenetic furrow progression in the Drosophila eye. Cell 80, 879-887.Brown, N. L., Kanekar, S., Vetter, M. L., Tucker, P. K., Gemza, D. L. and Glaser, T.
(1998). Math5 encodes a murine basic helix-loop-helix transcription factor expressed during early stages of retinal neurogenesis.Development 125, 4821-4233.Cepko, C. L.
(1996). The patterning and onset of opsin expression in vertebrate retinae. Curr. Opin. Neurobiol. 6, 542-546.Cepko, C. L. (1999). The roles of intrinsic and extrinsic cues and bHLH genes in the determination of retinal cell fates. Curr. Opin. Neurobiol. 9, 37-46.Cepko, C. L., Austin, C. P., Yang, X., Alexiades, M. and Ezzeddine, D.
(1996). Cell fate determination in the vertebrate retina. Proc. Natl. Acad. Sci. USA 93, 589-595.Chen, S., Wang, Q. L., Nie, Z., Sun, H., Lennon, G., Copeland, N. G., Gilbert, D. J., Jenkins, N. A. and Zack, D. J.
(1997). Crx, a novel Otx-likepaired-homeodomain protein, binds to and transactivates photoreceptor cell-specific genes. Neuron 19, 1017-1030.Chiang, C., Litingtung, Y., Lee, E., Young, K. E., Corden, J. L., Westphal, H. and Beachy, P. A.
(1996). Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature 383, 407-413.Dahmane, N. and Ruiz i Altaba, A.
(1999). Sonic hedgehog regulates the growth and patterning of the cerebellum. Development 126, 3089-3100.Dominguez, M.
(1999). Dual role for Hedgehog in the regulation of the proneural gene atonal during ommatidia development. Development 126, 2345-2353.Dominguez, M. and Hafen, E.
(1997). Hedgehog directly controls initiation and propagation of retinal differentiation in the Drosophila eye. Genes Dev 11, 3254-3264.Dorsky, R. I., Rapaport, D. H. and Harris, W. A.
(1995). Xotch inhibits cell differentiation in the Xenopus retina. Neuron 14, 487-496.Dorsky, R. I., Chang, W. S., Rapaport, D. H. and Harris, W. A.
(1997). Regulation of neuronal diversity in the Xenopus retina by Delta signalling. Nature 385, 67-70.Dowling, J. E.
(1987). The Retina - An Approachable part of the Brain. Cambridge, MA: Harvard University Press.Edlund, T. and Jessell, T. M.
(1999). Progression from extrinsic to intrinsic signaling in cell fate specification: a view from the nervous system. Cell 96, 211-224.Ekker, S. C., Ungar, A. R., Greenstein, P., von Kessler, D. P., Porter, J. A., Moon, R. T. and Beachy, P. A.
(1995). Patterning activities of vertebratehedgehog proteins in the developing eye and brain. Curr. Biol. 5, 944-955.Ericson, J., Morton, S., Kawakami, A., Roelink, H. and Jessell, T. M.
(1996). Two critical periods of Sonic Hedgehog signaling required for thespecification of motor neuron identity. Cell 87, 661-673.Ericson, J., Rashbass, P., Schedl, A., Brenner-Morton, S., Kawakami, A., van Heyningen, V., Jessell, T. M. and Briscoe, J.
(1997). Pax6 controls progenitor cell identity and neuronal fate in response to graded Shh signaling. Cell 90, 169-180.Ezzeddine, Z. D., Yang, X., DeChiara, T., Yancopoulos, G. and Cepko, C. L.
(1997). Postmitotic cells fated to become rod photoreceptors can be respecified by CNTF treatment of the retina. Development 124, 1055-1067.Fekete, D. M., Perez-Miguelsanz, J., Ryder, E. F. and Cepko, C. L.
(1994). Clonal analysis in the chicken retina reveals tangential dispersion of clonally related cells. Dev. Biol. 166, 666-682.Fuhrmann, S., Kirsch, M. and Hofmann, H. D.
(1995). Ciliary neurotrophic factor promotes chick photoreceptor development in vitro. Development121, 2695-2706.Furukawa, T., Morrow, E. M. and Cepko, C. L.
(1997). Crx, a novel otx-like homeobox gene, shows photoreceptor-specific expression and regulatesphotoreceptor differentiation. Cell 91, 531-541.Gavrieli, Y., Sherman, Y. and Ben-Sasson, S. A.
(1992). Identification ofp rogrammed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119, 493-501.Goodrich, L. V. and Scott, M. P.
(1998). Hedgehog and patched in neural development and disease. Neuron 21, 1243-1257.Greenwood, S. and Struhl, G.
(1999). Progression of the morphogenetic furrow in the Drosophila eye: the roles of Hedgehog, Decapentaplegic and the Raf pathway. Development 126, 5795-5808.Guillemot, F. and Cepko, C. L.
(1992). Retinal fate and ganglion cell differentiation are potentiated by acidic FGF in an in vitro assay of early retinal development. Development 114, 743-754.Hallonet, M., Hollemann, T., Pieler, T. and Gruss, P.
(1999). Vax1, a novelhomeobox-containing gene, directs development of the basal forebrain andvisual system. Genes Dev. 13, 3106-3114.Hamburger, V. and Hamilton, H.
(1951). A series of normal stages in the development of the chick embryo. J. Morphol. 88, 49-92.Hammerschmidt, M., Brook, A. and McMahon, A. P.
(1997). The world according to hedgehog. Trends Genet. 13, 14-21.Harris, W. A.
(1997). Cellular diversification in the vertebrate retina. Curr.Opin. Genet. Dev. 7, 651-658.Heberlein, U. and Moses, K.
(1995). Mechanisms of Drosophila retinal morphogenesis: the virtues of being progressive. Cell 81, 987-990.Henrique, D., Hirsinger, E., Adam, J., Le Roux, I., Pourquie, O., Ish-Horowicz, D. and Lewis, J.
(1997). Maintenance of neuroepithelial progenitor cells by Delta-Notch signalling in the embryonic chick retina. Curr. Biol. 7, 661-670.Hicks, D. and Courtois, Y.
(1992). Fibroblast growth factor stimulates photoreceptor differentiation in vitro. J. Neurosci. 12, 2022-2033.Holt, C. E., Bertsch, T. W., Ellis, H. M. and Harris, W. A.
(1988). Cellular determination in the Xenopus retina is independent of lineage and birth date. Neuron 1, 15-26.Hu, M. and Easter, S. S.
(1999). Retinal neurogenesis: the formation of the initial central patch of postmitotic cells. Dev. Biol. 207, 309-321.Hughes, S. H., Greenhouse, J. J., Petropoulos, C. J. and Sutrave, P.
(1987). Adaptor plasmids simplify the insertion of foreign DNA into helper-independent retroviral vectors. J. Virol. 61, 3004-3012.Jarman, A. P., Grell, E. H., Ackerman, L., Jan, L. Y. and Jan, Y. N.
(1994). Atonal is the proneural gene for Drosophila photoreceptors. Nature 369,398-400.
Jasoni, C. L., Walker, M. B., Morris, M. D. and Reh, T. A.
(1994). A chicken achaete-scute homolog (CASH-1) is expressed in a temporally and spatially discrete manner in the developing nervous system. Development 120, 769- 783.Jensen, A. M. and Wallace, V. A.
(1997). Expression of Sonic hedgehog and its putative role as a precursor cell mitogen in the developing mouse retina. Development 124, 363-371.Kanekar, S., Perron, M., Dorsky, R., Harris, W. A., Jan, L. Y., Jan, Y. N. and Vetter, M. L.
(1997). Xath5 participates in a network of bHLH genes in the developing Xenopus retina. Neuron 19, 981-994.Kelley, M. W., Turner, J. K. and Reh, T. A.
(1994). Retinoic acid promotes differentiation of photoreceptors in vitro. Development 120, 2091-2102.Koshiba-Takeuchi, K., Takeuchi, J. K., Matsumoto, K., Momose, T., Uno, K., Hoepker, V., Ogura, K., Takahashi, N., Nakamura, H., Yasuda, K. and Ogura, T.
(2000). Tbx5 and the retinotectum projection. Science 287, 134-137.Levine, E. M., Roelink, H., Turner, J. and Reh, T. A.
(1997). Sonic hedgehog promotes rod photoreceptor differentiation in mammalian retinal cells in vitro. J Neurosci 17, 6277-6288.Lillien, L.
(1995). Changes in retinal cell fate induced by overexpression of EGF receptor. Nature 377, 158-162.Lillien, L.
(1998). Neural progenitors and stem cells: Mechanisms of progenitor heterogeneity. Curr. Opin. Neurobiol. 8, 37-44.Liu, W., Khare, S. L., Liang, X., Peters, M. A., Liu, X., Cepko, C. L. and Xiang, M.
(2000). All Brn3 genes can promote retinal ganglion cell differentiation in the chick. Development 127, 3237-3247.Macdonald, R., Barth, K. A., Xu, Q., Holder, N., Mikkola, I. and Wilson, S. W.
(1995). Midline signalling is required for Pax gene regulation and patterning of the eyes. Development 121, 3267-3278.Marigo, V., Davey, R. A., Zuo, Y., Cunningham, J. M. and Tabin, C. J.
(1996). Biochemical evidence that patched is the Hedgehog receptor. Nature38
4, 176-179.Masai, I., Stemple, D. L., Okamoto, H. and Wilson, S. W.
(2000). Midline signals regulate retinal neurogenesis in zebrafish. Neuron 27, 251-263.Masland, R.H. and Raviola, E.
(2000). Confronting complexity: strategies for understanding the microcircuitry of the retina. Annu. Rev. Neurosci. 23, 249-284.McCabe, K. L., Gunther, E. C. and Reh, T. A.
(1999). The development of the pattern of retinal ganglion cells in the chick retina: mechanisms that control differentiation. Development 126, 5713-5724.McFarlane, S., Zuber, M. E. and Holt, C. E.
(1998). A role for the fibroblast growth factor receptor in cell fate decisions in the developing vertebrate retina. Development 125, 3967-3975.McMahon, A. P.
(2000). More surprises in the Hedgehog signaling pathway. Cell 100, 185-188.Ming, J. E., Roessler, E. and Muenke, M.
(1998). Human developmental disorders and the Sonic hedgehog pathway. Mol. Med. Today 4, 343-349.Morgan, B. A. and Fekete, D. M.
(1996). Manipulating gene expression with replication-competent retroviruses. Methods Cell Biol. 51, 185-218.Morrow, E. M., Furukawa, T., Lee, J. E. and Cepko, C. L.
(1999). NeuroD regulates multiple functions in the developing neural retina in rodent. Development 126, 23-36.Morrow, E. M., Belliveau, M. J. and Cepko, C. L.
(1998). Two phases of rod photoreceptor differentiation during rat retinal development. J. Neurosci. 18, 3738-3748.Neumann, C. J. and Nuesslein-Volhard, C.
(2000). Patterning of the zebrafish retina by a wave of sonic hedgehog activity. Science 289, 2137- 2139.Perron, M., Opdecamp, K., Butler, K., Harris, W. A. and Bellefroid, E. J.
(1999). X-ngnr-1 and Xath3 promote ectopic expression of sensory neuron markers in the neurula ectoderm and have distinct inducing properties in the retina. Proc. Natl. Acad. Sci. USA 96, 14996-15001.Pignoni, F. and Zipursky, S. L.
(1997). Induction of Drosophila eye development by decapentaplegic. Development 124, 271-278.Prada, C., Medina, J. I., Lopez, R., Genis-Galvez, J. M. and Prada, F. A.
(1992). Development of retinal displaced ganglion cells in the chick: neurogenesis and morphogenesis. J. Neurosci. 12, 3781-3788.Reh, T. A. and Levine, E. M.
(1998). Multipotential stem cells and progenitors in the vertebrate retina. J. Neurobiol. 36, 206-220.Reh, T. A. and Tully, T.
(1986). Regulation of tyrosine hydroxylase-containing amacrine cell number in larval frog retina. Dev. Biol. 114, 463- 469.Riddle, R. D., Johnson, R. L., Laufer, E. and Tabin, C.
(1993). Sonic hedgehog mediates the polarizing activity of the ZPA. Cell 75, 1401-1416.Roessler, E., Belloni, E., Gaudenz, K., Jay, P., Berta, P., Scherer, S. W., Tsui, L. C. and Muenke, M.
(1996). Mutations in the human Sonic Hedgehog gene cause holoprosencephaly. Nat. Genet. 14, 357-360.Schulte, D., Furukawa, T., Peters, M. A., Kozak, C. A. and Cepko, C. L.
(1999). Misexpression of the Emx-related homeobox genes cVax and mVax2 ventralizes the retina and perturbs the retinotectal map. Neuron 24, 541-553.Snow, R. L. and Robson, J. A.
(1994). Ganglion cell neurogenesis, migration and early differentiation in the chick retina. Neuroscience 58, 399-409.Spence, S. G. and Robson, J. A.
(1989). An autoradiographic analysis of neurogenesis in the chick retina in vitro and in vivo. Neuroscience 32, 801- 812.Stenkamp, D. L., Frey, R. A., Prabhudesai, S. N. and Raymond, P. A.
(2000). Function for hedgehog genes in zebrafish retinal development. Dev. Biol. 220, 238-252.Stoker, A. W. and Bissell, M. J.
(1987). Quantitative immunocytochemical assay for infectious avian retroviruses. J. Gen. Virol. 68, 2481-2485.Tomlinson, A. and Ready, D. F.
(1987). Neuronal differentiation in the Drosophila ommatidium. Dev. Biol. 120, 366-376.Torelli, S., Sogos, V., Marzilli, M. A., D’Atri, M. and Gremo, F.
(1989). Developmental expression of intermediate filament proteins in the chick embryo retina: in vivo and in vitro comparison. Exp. Biol. 48, 187-196.Treisman, J. E. and Heberlein, U.
(1998). Eye development in Drosophila: formation of the eye field and control of differentiation. Curr. Top. Dev. Biol. 39, 119-158.Turner, D. L. and Cepko, C. L.
(1987). A common progenitor for neurons and glia persists in rat retina late in development. Nature 328, 131-136.Turner, D. L., Snyder, E. Y. and Cepko, C. L.
(1990). Lineage-independent determination of cell type in the embryonic mouse retina. Neuron 4, 833- 845.Waid, D. K. and McLoon, S. C.
(1995). Immediate differentiation of ganglion cells following mitosis in the developing retina. Neuron 14, 117-124.Waid, D. K. and McLoon, S. C.
(1998). Ganglion cells influence the fate of dividing retinal cells in culture. Development 125, 1059-1066.Wallace, V. A. and Raff, M. C.
(1999). A role for Sonic hedgehog in axon-to-astrocyte signalling in the rodent optic nerve. Development 126, 2901- 2909.Watanabe, T. and Raff, M. C.
(1990). Rod photoreceptor development in vitro: intrinsic properties of proliferating neuroepithelial cells change as development proceeds in the rat retina. Neuron 4, 461-467.Watanabe, T. and Raff, M. C.
(1992). Diffusible rod-promoting signals in the developing rat retina. Development 114, 899-906.Wechsler-Reya, R. J. and Scott, M. P.
(1999). Control of neuronal precursor proliferation in the cerebellum by Sonic Hedgehog [see comments]. Neuron 22, 103-114.Wetts, R. and Fraser, S. E.
(1988). Multipotent precursors can give rise to all major cell types of the frog retina. Science 239, 1142-1145.Wei, Y. and Allis, C.D.
(1998). Pictures in cell biology. Trends Cell Biol. 8, 266.White, N. M. and Jarman, A. P.
(2000). Drosophila atonal controls photoreceptor R8-specific properties and modulates both receptor tyrosine kinase and Hedgehog signalling. Development 127, 1681-1689.Wolff, T. and Ready, D.F.
(1993). Pattern formation in the Drsophila retina. In The Development of Drosophila melanogaster. (ed. M Bate and A. Martinez-Arias). pp. 1277-1326. Cold Spring Harbor: Cold Spring Harbor Laboratory Press.Yamada, T., Pfaff, S. L., Edlund, T. and Jessell, T. M.
(1993). Control of cell pattern in the neural tube: motor neuron induction by diffusible factors from notochord and floor plate. Cell 73, 673-686.Yan, R. T. and Wang, S. Z.
(1998). NeuroD induces photoreceptor cell overproduction in vivo and de novo generation in vitro. J. Neurobiol. 36, 485-496.Yang, X. J. and Cepko, C. L.
(1996). Flk-1, a receptor for vascular endothelial growth factor (VEGF), is expressed by retinal progenitor cells. J. Neurosci. 16, 6089-6099.Ye, W., Shimamura, K., Rubenstein, J. L., Hynes, M. A. and Rosenthal, A.
(1998). FGF and Shh signals control dopaminergic and serotonergic cell fate in the anterior neural plate. Cell 93, 755-766.Young, R. W.
(1985). Cell differentiation in the retina of the mouse. Anat. Rec. 212, 199-205.Yourey, P. A., Gohari, S., Su, J. L. and Alderson, R. F.
(2000). Vascular endothelial cell growth factors promote the in vitro development of rat photoreceptor cells. J. Neurosci. 20, 6781-6788.Zhang, X.-M. and Yang, X.-J.
(2001). Temporal and spatial effects of Sonic hedgehog signaling in chick eye morphogenesis. Dev. Biol., in press.Note added in proof
Gonzalez-Hoyuela, M., Barbas, J. A. and Rodriguez-Tebar, A.
(2001). The autoregulation of retinal ganglion cell number. Development 128, 117-124.
Ядерные транскрипционные факторы,
очевидно, играют важную роль в
компетентности и детерминации судьбы
клеток(Furakawa et al., 1997; Chen et al., 1997; Yan and Wang,
1998; Morrow et al., 1999; Kanekar et al., 1997; Perron et al.,
1999; Liu et al., 2000). Среди cell-extrinsic факторов, Drosophila Hedgehog(Hh) и его гомологи у позвоночных Sonic Hedgehog (Shh), являются критическими сигнальными
молекулами. Активные формы белков
семейства Hh (Hh-N) опосредуют свою
сигнальную активность через гетеромерный
рецепторный комплекс, который включает
трансмембранный Smoothened
белок и рецептор Patched 1 (Ptc1) (reviewed by Hammerschmidt et
al., 1997; Goodrich and Scott, 1998; McMahon, 2000).
Мутации Shh вызывают cyclopia
у мышей и человека (Chiang et al., 1996;
Belloni et al., 1996; Roessler et al., 1996; Ming et al., 1998).
Установлено, что сигналы Shh испускаются
тканью вентральной средней линии
координированно с другими факторами,
чтобы детерминировать дорсовентральный
паттерн сетчатки и влиять на
компартментализацию оптического бокала (Macdonald et al., 1995; Ekker et al., 1995;
Schulte et al., 1999; Hallonet et al., 1999;
Koshiba-Takeuchi et
al., 2000; Zhang and Yang, 2001). Экзогенный Shh-N белок
способствует пролиферации клеток
предшественников сетчатки у грызунов, а
также дифференцировке позднее
возникающих типов клеток, включая и
фоторецепторы in vitro (Jensen and Wallace,
1997; Levine et al., 1997). Редукция экспрессии у
рыбок данио shh и tiggywinkle hedgehog (twhh)
вызывает задержку дифференцировки
фоторецепторов (Stenkamp et al.,
2000). Кроме того, Shh, продуцируемый аксонами
ганглиолярных клеток сетчатки,
стимулирует пролиферацию астроцитов в
зрительном нерве крыс (Wallace
and Raff, 1999).
Секретируемый Hh белок играет
фундаментальную роль в развитии
компаундных глаз Drosophila. С началом нейрогенеза Hh
секретируется на заднем крае глазного
имагинального диска и необходим для
инициации нейральной дифференцировки (Dominguez and Hafen, 1997; Pignoni and Zipursky, 1997), которая осуществляется в
направлении сзади наперед в виде
морфогенетического шва (morphogenetic furrow (MF)) (Tomlinson and Ready,1987; Wolff and Ready, 1993). Затем Hh сигналы
секретируются дифференцирующимися
фоторецепторными клеткам и управляют
прогрессом MF по рекрутированию
дополнительных клеток кпереди от шва MF
, чтобы сделать их компетентными для
нейрогенеза (Heberlein and Moses, 1995; Treisman and Heberlein, 1998; Greenwood and Struhl, 1999). Кроме того, Hh,
продуцируемый дифференцированными R8
фоторецепторами, контролирует сборку
омматидий, регулируя пронейральный ген atonal,
bHLH транскрипционный фактор и детерминант R8
клеток (Jarman et al., 1994, White and Jarman, 2000). Показано, что низкие уровни сигналов Hh, появляющиеся на
расстоянии от передних Hh продуцирующих
клеток, индуцируют экспрессию atonal; тoгда как высокие уровни сигнала Hh вблизи
вновь дифференцированных единиц
супрессируют экспрессию atonal между
образующимися пронейральными кластерами и,
таким образом, контролируют положение и
количество будущих R8 клеток (Dominguez, 1999).
Развитиеe
retinal ganglion cells (RGC) у позвоночных напоминает
развитие
Drosophila R8 фоторецепторных клеток.
Подобно R8 клеткам, которые являются клетками
основательницами для каждого омматидия, RGCs
являются первыми нейронами,
дифференцирующимися в нейральном
эпителии сетчатки позвоночных (Young, 1985; Spence and Robson, 1989; Altshuler
et al., 1991; Prada et al., 1992; Snow and Robson, 1994).
RGCs начинают дифференцироваться на
вентрикулярной поверхности эпителия
сетчатки сразу после их митотического
терминального деления (Waid and McLoon, 1995), и их
клеточные тела занимают внутренний слой
сетчатки, а их аксоны
распространяются через зрительный
нерв в направлении головного мозга.
Дифференцировка RGCs в сетчатке позвоночных
начинается в соединении оптического
бокала и оптической ножки и
распространяется в виде фронта волны в
направлении периферии сетчатки (Hu and Easter, 1999; McCabe
et al., 1999; Masai et al., 2000). Однако не выявлено
синхронизации клеточных циклов во
главе RGC фронта волны, сходной с таковой
в MF, RGCs появляются в фронте нейрогенной
волны в виде неслучайно организованных
порядков (McCabe et al., 1999). Кроме того, гомологи
позвоночных для пронейрального bHLH
транскрипционного фактора atonal
экспрессируются в предшественниках
сетчатки и позднее в
дифференцирующихся RGCs (Jasoni et al., 1994; Kanekar et al., 1997; Brown et al., 1998). Молекулярные
механизмы, которые контролируют инициацию
дифференцировки RGC и продвигают вперед прогрессию волны RGC
в сетчатке позвоночных, начинают
выявляться. Мутанты данио Nodal сигнального
пути, у которых отсутствует аксиальная
мезодерма и, следовательно, клетки
оптической ножки, неспособны инициировать
экспрессию у позвоночныхatonal
гомолог ath5 в нейральной сетчатке (Masai et al., 2000),
это указывает на вовлечение сигналов
средней линии в инициацию дифференцировки
RGC. Известно, что FGF способствует
ретинальному нейрогенному пути (Guillemot and Cepko, 1992;
McFarlane et al., 1998), блокирование активации
рецептора FGF у эмбрионов кур взаимодействует
с движением фронта волны дифференцировки RGC (McCabe et al., 1999).
Показано, чтоShh и twhh экспрессируются в
дифференцированных RGCs данио(Neumann and Nuesslein-Volhard, 2000), как и в сетчатке мыши (Jensen and Wallace,
1997). Более того, Shh необходим и достаточен
для индукции своей собственной
экспрессии в только что возникших RGCs; shh
мутации, как и блокирование передачи
сигналов Hedgehog задерживает
распространение фронта волны RGC у данио (Neumann and Nuesslein-Volhard, 2000).
Имеющиеся данные указывают на то,
что спецификация RGC судьбы из
недифференцированного ретинального
нейрального эпителия вовлекает механизмы,
опосредованные межклеточными
контактами и секретируемыми
молекулами. Транасмембранный рецептор Notch и
его лиганд Delta участвуют в спецификации
судьбы клеток из пролиферирующих
предшественников (Dorsky et al., 1995; Dorsky et al., 1997;
Austin et al., 1995; Henrique et al., 1997; Ahmad et al., 1997; Bao and Cepko, 1997). Изучение ретинальных культур
показывает, что сетчатка на поздних
стадиях нейрогенеза содержит
секретируемые факторы, которые ингибируют
способность предшественников
дифференцироваться в ганглиолярные
клетки и что эти ингибирующие активности
продуцируются преимущественно самими
ганглиолярными клетками (Waid and McLoon, 1998). Мы
проверяли гипотезу, что Shh молекулы ,
продуцируемые дифференцированными RGCs,
играют в сетчатке роль негативной
регуляции продукции RGC.
Было показано, что во время
нейрогенной фазы развития сетчатки кур
Shh сигналы, исходящие из
дифференцированных RGCs действуют
паракринным образом, влияя на
недетерминированные клетки ранних
предшествнников. Увеличение Shh сигналов
ведет к снижению продукции RGCs, тогда как
редукция Shh сигналов вызывает усиление
генеза RGC. Shh сигналы модулируют продукцию
ганглиолярных клеток в течение обычного
периода генеза
RGC без существенного влияния на
пролиферацию и гибель клеток in vitro. Более
того, эффекты передачи сигналов Shh на
спецификацию судьбы
RGC обнаруживаются во время или вскоре
после последнего митотического цикла
клеток предшественников. Это подтверждает
гипотезу авторов, что Shh, секретируемый RGCs,
ведет себя как негативный регулятор
продукции ганглиолярных клеток позади
раннего фронта нейрогенной волны.
Спецификация различных типов ретинальных
клеток в сетчатке позвоночных
частично зависит от изменений
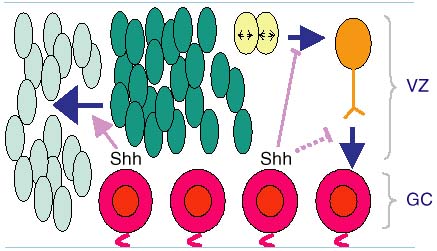
Fig. Предполагаемая двойная роль Shh во время раннего
нейрогенеза сетчатки. Схама представляет
раннюю сетчатку после начала
дифференцировки RGC. Shh секретируется
дифференцированными RGCs (красные),
расположенными на внутренней сетчатке.
Впереди фронта волны дифференцировки RGC
нативные клетки предшественники сетчатки
(серые) подвергаются воздействию низкого
уровня сигналов Shh, потому что они
далеко от клеток, экспрессирующих Shh.
Низкие уровни сигнала Shh м.б.
необходимы для индукции нативных
клеток предшественников в компетентные
для дифференцировки и некоторые очевидно
становятся Shh-продуцирующими RGCs. Позади
фронта волны дифференцировки RGC клетки
предшественники (темно зеленые)
разполагаются в ventricular zone (VZ) и скорее всего
приобретают состояние компетентности
быть специфицированными в RGCs и м.
содержатть активированые MAPK. Высокие
уровни Shh экспрессируются позади фронта
волны RGC что обусловлено
накоплением дифференцированных RGCs. Shh
сигналы негативно влияют на спецификацию
судьбы RGC клеток-предшестенников во
время или вскоре после M фазы (желтые)
митотичекого цикла и/или влияния
дальнейшей дифференцировки nascent RGCs (оранжевые)
, мигрирующих по направлению к слою
ганглиолярных клеток (GC). Эта модель
согласуется в данными Neumann and Nuesslein-Volhard, (2000).
негативного регулятора продукции RGC в
сетчтке. Shh-N м.б одним из ингибрующих
секретируемых факторов, который участвует
в feedback контроле генеза RGC в сетчатке. У кур
постмитотические ганглиолярные клетки
главный источник эндогенной Shh мРНК на
иницальных стадиях нейрогенеза сетчатки.
RGCs экспрессируют Shh на значительно более
низком уровне, чем Shh-продуцирующие клетки,
расположенные в вентральной части
переднего мозга. Однако этот
амбивалентный уровень Shh в ранней сетчатке,
по-видимому, достаточен для передачи
сигнала клеткам предшественникам в
соседней пролиферативной зоне, как
показано с помощью комплементарной
экспрессии Ptc1, накапливающейся позади
фронта волны дифференцировки.
В сетчатке мышей на соотв. ст. развития наблюдается сходные паттерн экспрессии Shh и Ptc (Jensen and Wallace, 1997), а в сетчатке рыбок данио экспрессируются и shh и twhh в ганглиолярных клетках (Neumann and Nuesslein-Volhard, 2000).
Паттерны экспрессии Shh и Ptc1 также
указывают на то, что Shh сигналы,
секретируемые ганглиолярными клетками, м.
диффундировать и влиять на популяцию
клеток предшественников паракринным
способом. Однако, дифференцированые RGCs
сами не чувствительны к своему
эндогенному или эктопическому Shh во время
раннего нейрогенеза. Неясно как
дифференцированные RGCs активируют
транскрипцию гена Shh и одновременно
усиливают независимость от Shh сигналов. Shh
обладает митогенной активностью на
некоторые типы клеток и тканей (reviewed in Goodrich
and Scott, 1998; Wechsler-Reya and Scott, 1999; Dahmane and Ruiz i Altaba, 1999).
Белок Shh-N усиливает пролиферацию клеток
предшественников и избыточную
продукцию всех поздно появившихся типов
клеток (Jensen and Wallace, 1997; Levine et al., 1997). Более
того, Shh сигналы, секретируемые
аксонами ганглиолярных клеток
способствуют пролиферации астроцитов в
зрительном нерве in vivo (Wallace and Raff, 1999). Таким
образом, Shh молекулы, продуцируемые
сетчаткой м. выступать как митогены,
способствуя пролиферации поздних
нейрональных и глиальных
предшественников (Zhang and Yang, 2001). Получены
данные, не подтверждающие эту идею, секретируемый Shh не действует как эффективный митоген и не влияет на апоптоз
во время дифференцировки RGC in vitro, а
вместо этого влияет на спецификацию
клеток предшественников. В нормальной
сетчатке презумптивные ганглиолярные
клетки предшественники, заканчивая митоз
на вентрикулярной поверхности сразу же
вытягивают нейрофиламенты-содержащий
ведущий отросток и мигрируют в
направлении внутренней сетчатки (Waid and McLoon, 1995).
Быстрая фенотипическая дифференцировка
ганглиолярных клеток указывает на то, что
их судьба м.б. детерминирована во время
последнего митотического цикла, во время G2
и/или M фазы и во время последующей
дифференцировки и созревания вновь
специфицированных ганглиолярных клеток.
Первой обнаружимой ступенью, на которой
обнаруживается влияние сигналов Shh
является переход от митоза к дочерним
клеткам, экспрессирующим маркеры
ганглиолярных клеток. Снижение продукции
ганглиолярных клеток, вызываемое
избыточной экспрессией Shh, м.б.
комбинированным эффектом нарушения
спецификации судьбы и дифференцировки
клеток. У Drosophila компаундные глаза
нуждаются в градированных сигналах Hh
молекул, секретируемых
дифференцирующимися фоторецепторными
клетками, оказывающимися позади MF. Низкие
уровни Hh индуцируют decapentaplegic (Dpp) внутри и
впереди MF, которые действуют на дальних
расстояниях от Hh-секретирующих клеток,
способствуя вступлению нативных клеток
диска в ‘pre-proneural’ состояние,
характеризующееся экспрессией bHLH генов,
включая hairy и Extramacrochaetae (Emc) (Greenwood and Struhl, 1999; Brown et al., 1995).
Пре-пронейральное состояние
ограничивается узкой зоной впереди MF и
необходимо для клеток предшественников,
чтобы инициировать нейрональную
дифференцировку. Передача сигналов Hh
также необходима для перехода от пре-пронейронального
состояния в ‘proneural’ сочтояние,
характеризующееся экспрессией bHLH гена atonal
(Greenwood and Struhl, 1999; Dominguez, 1999). Экспрессия atonal,
который является детерминантом
основательниц R8 клеток (Jarman et al., 1994; White and Jarman, 2000),
сложная. Клетки, которые удалены на 5-7
рядов омматидий от клеток,
экспрессирующих Hh, экспрессируют atonal в
виде непрерывной полоски. Однако, те,
которые ближе к дифференцирующимся
кластерам омматидий, экспрессируют все
меньше atonal, градиентно распределяясь
между субнаборами клеток (proneural clusters), и,
очевидно, ограничиваясь лишь R8 клетками (Dominguez, 1999).
Это указывает на то, что Shh контролирует
генез ганглиолярных клеток сетчатки,
низкие уровни Hh индуцируют atona,
тогда как высокие уровни Hh супрессируют atonal
(Dominguez, 1999). Более того, показано, что
эффект Hh на atonal экспрессию м.б. опосредован
неидентифицированным вторичным сигналом,
который активирует Raf-MAPK путь (Greenwood and Struhl,
1999). Существование эволюционно
законсервированного регуляторного
механизма, управляющего Drosophila R8
фоторецепторными клетками и у позвоночных
продукцией RGC клеток подтвержается (Neumann and
Nuesslein-Volhard, 2000). Во время развития сетчатки
рыбок данио существует позитивная
регуляторная петля для Shh во фронте волны
дифференцировки, где Shh необходим и
достаточен для индукции самого себя и
обеспечения дальнейшей экспансии
территории RGC. Кроме того индуктивный
эффект Shh появляется только в узкой зоне
клеток, соседствующих с прогрессирующим
фронтом волны, это указывает на
существование pre-proneural зоны, сходной с
таковой в глазах мух (Neumann and Nuesslein-Volhard, 2000).
Наши результаты подтверждают гипотезу,
что локальные сигналы Shh играют
регуляторную роль в выделении
ганглиолярных клеток из пула
предшественников. Эта функция негативной
обратной связи сигналов Shh позади фронта
волны дифференцировки не противоречит
роли Shh в обеспечении нейрогенеза во
фронте волны (Neumann and Nuesslein-Volhard, 2000).
Согласно нашей модели клетки
предшественники отвечают на разные пороги
сигналов Shh в сетчатке позвоночных (Fig.).
Впереди фронта инициальной нейрогенной
волны присутствуют низкие уровни Shh,
которые могут индуцировать экспрессию
пронейральных генов, таких как atonal среди нативных клеток
предшественников, превращая их в
компетентные адоптировать судьбу RGC.
Позади фронта волны высокие уровни Shh
могут супрессироовать экспрессию
пронейральных генов селективно среди
компетентных клеток предшественников и
таким образом негативно регулировать
продукцию ганглиолярных клеток. У Drosophila
процесс латеральной ингибиции
использует путь Notch и также оперирует,
вычленяя одиночные R8 клетки среди
пронейральных кластеров (Baker et al., 1996).
Возможно, что комбинированное действие
латеральной ингибиции с помощью Notch и
регуляции с помощью градированых сигналов
Hh вносит вклад в точную организацию
расположения омматидий (Dominguez, 1999; Greenwood and
Struhl, 1999). Во время развития сетчатки
позводночных сигналы, опосредуемые Notch
рецепторами также играют важную роль в
котроле числа и плотности RGCs в сетчатке
позвоночных (Dorsky et al., 1995; Austin et al., 1995; Henrique et
al., 1997).
| |
| Pea3 Expression Is Regulated by FGF Signaling In Developing Retina K.L.McCabe (klm@caltech.edu), C McGurie, T.A.Reh Dev. Dyn. - 2006.- V.235, No 2 - P. 327-335 |