Отдельное мышечное волокно состоит из нескольких параллельно расположенных элементов, миофибрилл, диаметром около 1 микрона. Сама миофибрилла с свою очередь состоит из параллельно лежащих протофибрилл - актиновых и миозиновых нитей. На поперечном сечении видно, что эти нити располагаются строго определенным образом и отделены друг от друга промежутком в несколько сот ангстрем. Миозиновые нити обычно достигают толщины в 160 ангстрем, длина миозиновых нитей составляет примерно 1,5 микрона. Актиновые нити имеют в длину только около 1 микрона, а их толщина составляет 50-70- ангстрем. В результате частичного наложения групп толстых и тонких нитей возникает поперечная исчерченность, видимая в микроскоп. Для поперечнополосатой мышцы (Рис.1)
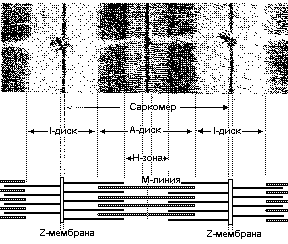
Электронная микрофотография продольного среза поперечнополосатой мышцы и схематическое изображение взаимного расположения тонких и толстых нитей, обуславливющего рисунок полос. На микрофотографии представлен отрезок двух миофибрилл, увеличенных примерно в 23000 раз
Участок, ограниченный двумя Z- мембранами, - это саркомер
.
Участок, ограниченный двумя Z- мембранами, - это саркомер
Fig.1. Electronic microphoto longitudinal section of the muscle and schematic image of a mutual arrangement of thin and thick fibers, giving a figure of strips. In a microphoto the piece of two myofibrills, increased approximately in 23000 time is submitted.
a site limited two Z- to membranes, is a sarcomer
Характерно чередование плотных темных полос (А-дисков) и светлых полос (I-диски). В А-дисках миозиновые нити образуют гексогональную упаковку, имено они обусловливают высокую оптическую плотность дисков. Актиновые нити прикрепляются с каждой стороны к узкой плотной мембране, т.называемой Z-мембране, которая пересекает I-диск . Расстояние между двумя Z-мембранами называется САРКОМЕРОМ. Тонких протофибрилл в пучке в 2 раза больше, чем толстых. Тонкие протофибриллы оканчиваются у края Н-зоны - области с более низкой оптической плотностью, находящейся в центре А-диска. В центральной части Н-зоны расположене "псевдо-Н-зона", обладающая еще более низкой плотностью, ширина этой эоны не изменяется при мышечном сокращении. В середине этой светлой зоны расположена узкая темная полоска, М-линия. Предполагается, что эта линия соответствует небольшому утолщению, которое имеется в середине каждой толстой протофибриллы.
Пары толстых и тонких протофибрилл соединены поперечнми мостиками, располагающимися через довольно правильные интервалы (Рис.2 и 3)

Электронная микрофотография продольного среза поперечнополосатой мышцы. Представлен отрезок миофибриллы, увеличенный примерно в 75000 раз.
Толстые нити усеяны мелкими выступами - поперечными мостиками. Между толстыми нитями лежат тонкие нити (А- диск). М - М-линия, Z - Z-диск
. Толстые нити усеяны мелкими выступами - поперечными мостиками. Между толстыми нитями лежат тонкие нити (А- диск). М - М-линия, Z - Z-диск
Fig. 2. Electronic microphoto of longitudinal section of a muscle. The piece of the myofibrill, increased approximately in 75000 time is submitted.
Thick fibers are covered by fine ledges - cross bridges. Between thick strings lay the thin strings (A - disk). M - M-line, Z - Z-disk
Они обеспечивают структурную и механическую целостность всей мышцы. Именно в этих поперечных мостиках возникает и поддерживается напряжение, развиваемое мышцей. Когда саркомер изменяет свою длину, длина самих протофибрилл заметно не меняется, они просто скользят друг относительно друга, причем тонкие протофибриллы вдвигаются дальше в А- диск, а при растяжении - выдвигаются из него.
О процессе формирования МИОФИБРИЛЛ и Z-ДИСКОВ КАРДИОМИОЦИТОВ см. MYOFIBRILLOGENESIS
Диаграмма, представляющая взаимоотношения между филаментными белками саркомеров ( актина, миозина, и титина), Z-дисков, которые связаны посредством десмина субсарколемной филаментозной сетью ( дистрофин и другие белки). Субсарколемные белки связаны посредством гликопротеиновых комплексов с базальными мембранами.
Кардиомиоциты кур, происходящие из ES клеток, дифференцируются в клетки, похожие на синусонодальные, пресердные и желудочковые, а экспрессия кардио-специфических генов, ионныых канальцев и потенциала действия контролируются онтогенетически. Во время нормального кардиогенеза ES клеток in vitro саркомерные белки организуются в онтогенетичеки контролируемые паттерны на ранних стадиях дифференцировки.Guan et al., 1999
Так, в кардиомиоцитах ранней стадии (5+4 дня) примерно 70% клеток обнаруживают хорошо организованый паттерн саркомерной окраски с Z-дисковым эпитопом титина, только 57% клеток содержат миофибриллярное α-актининовое окрашивание. Этот показатель снижается до 50% для миомиозина, до 42% для М-дискового эпитопа титина, до 37% для саркомерного миозина, до 33% для актина и 5% для кардиального тропонина Т. Тогда как М-белком меченные саркомерные структуры отсутствуют в кардиомиоцитах ранних стадий и встраиваются только на терминальных стадиях.
Следовательно, сборка саркомер во время кардиального миофибриллогенеза происходит в следующем порядке: Z-дисковые эпитопы титина, α-актинин, миомезин, М-дисковый эпитом титина, саркомерная МНС, актинин и кардиальный тропонин Т для ранних стадий развития и М-белок на терминальной стадии.
Титин и α-актинин играют ключевую роль в формировании Z-дисков, а следовательно, и в инициации формирования саркомер. В предшественниках миофибрил, в неисчерченных миофибриллах, антитела выявляют только Z-дисковые эпитопы титина и не обнаруживают эпитопы, располагающиеся в A-I соединениях.
α-актинин связывается с цитоплазматическим доменом β1 интегрина, поэтому β1 интегрин играет критическую роль в сборке α-актинина в миофибриллах. Инициальная экспрессия и накопление α-актинина могут (по крайней мере частично) не зависеть от β1 интегрина, но интегрин обязателен для поддержания стабильности α-актининовой организации. Лишеные β1-интегрина кардиомиоциты собирают саркомеры с задержкой, эти саркомеры содержат титин, миомезин, саркомерную МНС, α-актин и М-белок, но не содержат α-актинина и кардиального тропонина Т.
По-видимому, терминальная дифференцировка системы тонких филамент осуществляется в основном независимо, следуя за сборкой толстых филамент, и зависит от сигнальных событий, обусловливаемых интегрином.
Судя по проценту клеток, содержащих миомезин, он также играет важную роль в формировании саркомер.
SARCOMERE ELASTICITY
SARCOMERE ELASTICITY(Саркомер Эластичность)
Трехмерная конфигурация перимизиальных коллагеновых волокон в сердечной мышце крыс и растянутых саркомерах
Относительный вклад внутри и внеклеточных структур в эластические свойства саркомеров. При длине саркомеров менее 2.1 µм саркомерный белок титин (коннектин) является основным отвечающим за эластичность, при больших длинах фибриллярный коллаген становится основны источником. Титин является принципиальной структурой, диктующей механические свойства пассивных ардильных мышц. Это большой белок примерно в 3 МДа, который идет от Z-линии к М-линии саркомера. Молекулярным механизмом, с помощью которого титин обеспечвает эластичность растяжения саркомера, является расправление складок и выпрямление доменов в области I-диска. Помимо своего действия в качестве молекулярной пружины титин может также вносить свой вклад и в жесткость саркомера путем взаимодействия с тонкими филаментами. Предполагается, что обратные взаимоотношения между диастолическим внтриклеточным [Ca 2+] и жесткостью саркомеров м.б. обусловлена Ca2+ -зависимым взаимодействием титина с тонкими филаментами.
Коллагеновые волокна также вносят свой вклад в эластические свойства пассивных кардиальных мышц. Большие перимизиальные коллагеновые волокна, до 10 µм в диаметре, располагаются параллельно саркрмерам (одно волокно:несколько миоцитов). Эти перимизиальные волокна выглядят как спиральные завитки (helical coils).
Производили трехмерную реконструкцию перимизиальных коллагеновых волокон срезов трабекулярных мышц (миоциты которых не содержат коллагена) из правого желудочка сердца крыс. Было установлено, что перимизиальные коллагеновые волокна являются скоре волнообразными тяжами, которые распрямляются по мере увеличения длины саркомера. Эти наблюдения согласуются с представлением об распрямлении этих волокон и ограничении ими увеличения длины кардиальных саркомеров от примерно 1.9 µм в покойном состоянии до 2.3 µм.
Трабекулы заняты в основном миоцитами, которые сопровождаются параллельныи перимизиальными колагеновыми волокнами. В вентрикулярной стенке взаимосвязанные слои из 4-6 клеток толщиной дают сложную ламинарную структуру. Внутри слоя перимизиальные коллагеновые волокна располагаются параллельно миоцитам. При растяжении саркомера на длину в 2.3 µм. пассивная сила увеличивается до 7mN mm-2. При такой длине саркомера расположение межфиламентной решетки и перекрывание между актином и миозином являются оптимальными для создания силы. Показано, что коллаген типа I , основной компонент фибриллярного коллагена в сердце, имеет модуль эластичности примерно 2.9 GPa.
При увеличении длины саркомера за 2.3 µм. перекрываеие между актином и миозином уменьшается, уменьшается количество поперечных связей. В отличие от сердечной мышцы пассивные силы в скелетных мышцах незначительны даже при увеличиении длины саркомера до 3 µм. Очевидно, базирующиеся на титине пассивные силы при каждой данной длине саркомера меньше в скелетных мышцах, так как изоформа титина в них имеет более длинную эластичную область (I-диск). Перимизиальные колагеновые волокна скелетных мышц обычно идут поперек мышечных клеток и растяжение возможно до тех пор, пока эти волокна не выстроятся аксиально и не выпрямятся в направлении миоцитов.
