В сердце эмбрионов кур можно различить 5 компартментов по их электрофизилогическим характеристикам. Медленно-проводящий тракт притока, быстро-проводящее предсердие, медленно-проводящий атриовентрикулярный канал, быстропроводящий желудочек и медленно-проводящий тракт оттока de Jong et al., (1992). Более того вышестоящая венозная часть сердца характеризуется короткими контракциями, а нижестоящая артериальная часть характеризуется продолжительными контракциями. Каждый из этих компартментов следовательно имеет отличный молекулярный фенотип, который отражает его функциональную гетерогенность (Moorman, 1994).Изменения концентрации свободного внутриклеточного кальция являются важным эффектором, регулирующим состояние сокращения-расслабления в миоцитах.
У эмбрионов крыс между 11-м и 15-м днем развития в сердечной трубке выявляются морфологически различающиеся сегменты: венозный синус, сино-атриальное соединение, предсердие, атрио-вентрикуклярный канал, входной сегмент, первичная борорзда, проксимакльный выходной сегмент, дистальный выходной сегмент. В этот период объем венозного синуса, сино-атриального соединения,предсердия, входного сегмента и проксимального выходного увеличивается пропорционально общему увеличению объема миокарда сердца. В атрио-вентрикулярном канале и дистальном выходном сегменте рост достоверно ниже (Knaapen et al., 1995). В течение этого периода объем клеток в венозном синусе, сино-атриальном соединении и предсердии увеличивался. тогда как в других сегментах объем клеток не менялся. Сходным образом поверхность клеточных мембран (оболочек) в венозном синусе, сино-атриальном соединении увеличивалась. Объем ядер и поверхность ядерных оболочек при этом не менялись. Общее количество миоцитов увеличивалось значительно меньше в атриовентиркулярном канале и дистальном тракте оттока, чем во всех остальных сегментах(Knaapen et al., 1996).Теми же авторами (Knaapen et al., 1997)было показано, что во время эмбрионального развития в кардиальных сегментах и межсегментных соединениях увеличивется содержание гликогена . Синоатриальное соединение и первичная складка обнаруживают более быстрое накопление по сравнению с остальными областями сердца, тогда как атриовентрикулярный канал обнаруживает наиболее высокий уровень гликогена в течение всего изучаемого периода. Комплекс Гольджи и грубый эндоплазматический ретикулем обнаруживают заметное снижение начиная с 15-го дня. Количество миофибрилл и митохондрий в клетках и поверхность митохондриальных крист постепенно увеличиваются с 11 по 17-й день развития. Предполагается, что накопление гликогена связано с обеспечением механичиеской стабильности клеток и может быть связано с механизмом образования мишеней для врастния нервов. Очевидно, что этот процесс сегментации предопределен еще на ранних стадиях развития сердца.
|
Гетерогенность кардиогенных областей
У эмбрионов кур получены указания на то, что детерминация сердце-формирующей области происходит уже в первичной полоске.
Картирование судьбы клеток выявляет две популяции предшественников. Недиффернцированные превентрикулярные предшественники расположены впереди преатриальных предшественников (у эмбрионов рыб предсердные и желудочковые миогенные клоны сердце-формирующей области разделены уже на стадии средней бластулы (Stainer et al., 1993)). В формировании паттерна мезодермы участвует фактор роста фибробластов FGF, на это указывает вовлечение в этот процесс его рецептора FGFR-1
Исследования на рыбках данио показали (Le et al., 1994), что вся сердце-формирующая область неодинакова и в отношении позиционной информации для эндо- и миокадиального клона. В зависимости от местоположения инъецируемой мультипотентной стволовой меченной клетки она давала как эндокардиальные, так и миокардиальные клетки или только один из этих двух фенотипов, т.е. предопределялись радикально различные судьбы в зависимости от незначительных различий в положении клеток в раннем эмбрионе. Картирование у мышей показало, что предшественники сердца возникают на 6,5 день рс в строго ограниченных областях эпибласта, латеральнее первичной полоски, причем эти клетки еще не детерминированы окончательно, так как содержат предшественники кардиомиоцитов, эндокардиальные предшественники и предшественники некоторых других тканей (Biben et al.,1996 цит. по. (Lyons,1996).Эмбриональные стволовые клетки (ES) дают кардиальные миоциты, причем в таких культурах присутствуют как атриальные и вентрикулярные миоциты, так и миоциты проводящей системы (Wobus et al.,1995) т.е. спецификация и деверсификация сердечных миоцитов и у эмбрионов мыши происходит очень рано, очевидно в ходе гаструляции.
Таким образом, сердце-образующая область, с одной стороны, как бы подразделена на два слоя эндокардиальный и миокардиальный, а с другой стороны,эти слои сегментированы на сегменты, по крайней мере, прекардиальный и вентрикулярный. Однако судя по факту детерминации эндокарда подушек (атриовентрикулярных и конотрункальных) возможно выделяются уже и эти сегменты.
Происхождение эндокарда и миокарда
Эндокардиальные и миокардиальные клетки возникают из общего предшественника. Предполагается, что спланхническая мезодерма дает начало как
проэндокарду, так и промиокарду (Eisenberg & Bader,1995) . Так, у эмбрионов кур меченные клетки, взятые на стадии 5 в сердце-формирующей области дают субпопуляции
клеток, экспрессирующие как N-кадxерин (маркер миокардиоцитов),
так и QH-1 антиген ( маркер эндокардиальных клеток. QCE-6 cells перепела дифференцируются в эритроцитарные клетки, если культивируются с бластодермальными клетками эмбрионов кур 3 или 4-й стадии развития, но не с клетками 5-й стадии . Соответственно дифференцировка QCE-6 клеток в сокращающиеся кардиомиоциты происходит только тогда, когда эти клети инкорпорируются в агрегаты бластодрмальных клеток стадии 5 . Идентичные паттерны сортировки и дифференцировки QCE-6 перепела и бластодермальных клеток кур указывают на то, что экспрессия дифференцированных типов клеток в ранней мезодерме управляется окружающей средой без непосредственного предопределения клеток ( immediate cellular commctment). Кроме того эти результаты указывают на то, что QCE-6 клетки перепела также являтся мультипотентными мезодермальными стволовыми клетками, дающими эндотелиальные или эндотелиальные и красные кровяные клетки (Eisenberg, Markwald, 1997).
Рассортировка миокардиальных и эндокардиальных клеток у эмбрионов кур происходит между 19 и 29 часами
развития (Linask & Lash,1993) . У пресомитных эмбрионов перепела сплaнхническая мезодерма также дифференцируется в мезотелиальный слой и сплетение эндотелиальных клеток (DeRucter et al.,1993) . Большинство клеток примордиев предназначено для образования миокарда. Небольшой же набор клеток,называемых "ангиобласты" образуют два эндокардиальных тяжа.Генетические механизмы, обусловливающие подразделение сердце-формирующей области на проэндокард и промиокард пока неизвестны.
Две сердцеформирующие области сливаются по вентральной срединной линии, формируя первичную сердечную трубку. Предполагается, что презумптивные эндокардиальные клетки подвергаются эпителиально-мезенхимной трансформации, когда оказываются вблизи передней энтодермы. Другие исследователи полагают, что эндокардиальные клетки возникают из мезодермальных областей, которые располагаются впереди и/или латеральнее сердце-формирующих полей. Предполагается, что эти клетки мигрируют в кардиогенные области на эндодермальную сторону презумптивного миокарда. Возможно правы и те и другие и эндокард состоит из клеток разных источников (Eisenberg , Markwald, 1995)(Рис.1). 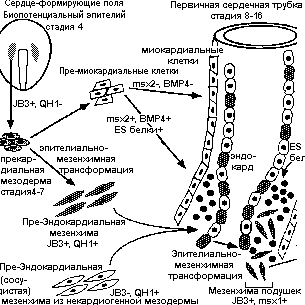
Рис.1. Схема возникновения сердечной трубки и закладки эндокардиальных подушек . JB3+ предшественники клеток подушек возникают из сердце-формиурющих полей и могут также давать миокардиальный клон. Вследствие их дифференцировки в пре-эндокардиальную мезенхиму, эти клетки собираются - возможно вместе с сосудистой мезенхимой, которая возникает из вне сердце-формирующих полей, для образования эндокардиального эндотелия. Подушки сначала развиваются как региональные утолщения кардиального геля и содержат белковые комплексы фибронектина и ES белков (адхероны). ES белки продуцируются миокардом и инициируют трансформацию эндотелиальных клеток в мезенхиму подушек
Антитела к маркеру эндотелиальных клеток JB3, которые во время гаструляции окрашивают только прекардиальную мезодерму, позднее окрашивают эндокард в виде гетерогенного паттерна. Позитивны только те клетки эндокарда, которые впоследствие дифференцируются в мезенхиму подушек. Следовательно, эти позитивные клетки возникают в той же самой мезодермальной области, что и клетки миокарда. Это подтвержадется и существованием клеток, экспрессирующих как миокардиальные, так и эндотелиальные маркеры. Тканеспецифичный фактор транскрипции GATA-4 экспрессируется как в ранних миокардиальных, так и эндокардиальных клетках.
Эти данные позволяют предположить, что процесс сегментации сердце-образующей области может происходить несколько по иному, нежели это было предположено выше. Получается, что процесс сегментации затрагивает миокардиальный слой, а эндокардиальный слой возникает из двух источников в соответствии с сигналами от разных сегментов миокарда. Возникают полосы эндокарда, происходящие из разных источников (см.Рис 1). Это напоминает паттерн возникновения полос у эмбрионов дрозофилы, предопределяемый генами типа pair-rule.
Гетерогенность (паттернирование) сердечной трубки
Уже в процессе гаструляции происходит,по-видимому, процесс сегментации кардиогенной мезодермы. Косвенно на это указывает паттерн возникновения перикардиального целома. На ст.6 распределение N-кадхерина начинает обнаруживать периодичность. Среднее расстояние между областями сильной флюоресценции равно примерно 36 микрометрам. Это в точности соответствует расстояниям между фокусами появляющихся полостей. Этот процесс протекает в виде рострокаудальной волны через сердце-формирующие области. На ст.7 образуется единая целомическая полость. (Linask et al., 1992> Затем было показано, что для спецификации границы между будущей соматической и спланхнической мезодермой и для компартментализации и последующей эпителизации кардиомиоцитов важен N-кадхерин/β/α-катениновый комплекс . Постепенно они создают ядерные центры (сопоставленные клеточными мембранами группы клеток) для инициации фибрилогенеза. Внутри таких фокусов появляются небольшие полости (celomata) на ст.6, которые затем увеличиваются и сливаются. Процесс образования инициальных кластеров (фокусов) не нарушается при воздействии антител против N-кадхерина. Это указывает на то, что кадхерин-независимые молекулы или другие кадхерины обеспечивают это событие формирования кластеров (сегментации?). Однако процесс распространения адгезии от одного кластера к другому чувствителен к воздействию антител (Linask et al., 1997).
После окончания гаструляции происходит дальнейшее двухстороннее накопление сердечного геля между промиокардом и проэндокардом
[19]. Сердечный гель представляет собой слой примитивного сердечного внеклеточного матрикса. Это бесклеточный материал, предположительно или энтодермального или что наиболее вероятно миодермального происхождения, т.к. это базальная мембрана миокарда. он содержит хондроитин сульфат, коллаген I и IV, ламинин и фибронектин, фибриллин и фибулин .
Эндокардиальные подушки образуются в атриовентрикулярном канале и тракте оттока (конотрункусе) в результате паттернирования примитивной сердечной трубки. Подушки первоначально возникают в виде регионально ограниченных удолщений кардиального геля, внеклеточного матрикса (ВКМ) сердечной трубки. Клетки мигрирующие в подушки как эндотелиальные клетки трансформируются в мезенхимные. Почему некоторые клетки трансформируются в мезенхимные, а другие остаются сосудистыми.
Когда образуется сердечная трубка, то кардиальный гель накапливается в атриовентикулярном канале и тракте оттока. Эти области скопления матрикса (примордии подушек) регионально ограничены не только вдоль продольной оси, но и по отношению к поперечным осям сердечной трубки(Eisenberg , Markwald, 1995). В атриовентрикулярном канале подушковые вздутия распространяются от дорального и вентрального квадрантов. Напротив они распространяются от правой и левой частей в конусе вентрикулярного тракта оттока. Механизм , регулирующий расположение подушек, неизвестен. Позиционирование подушек м.б. причинно связано с образованием петли первичной сердечной трубкой. Свет на молекулярный механизм позиционирования подушек может быть пролит с помощью модели развития сердца, которая рассматривает сердечную трубку, как сегментированную вдоль продольной оси. Согласно упрощеной модели раннее сердце подразделено на четыре сегмента, вентрикулярный тракт оттока (конотрункус), желудочек, атриовентикулярный канал и предсердие.
это подтверждается регион-специфической экспрессией некоторых Нох генов в примитивной полоске и латеральной мезодерме. Имеющиеся данные говорят о том, что ретиноевая кислота
участвует как в детерминации сердце-формирующей области, так и ее
подразделении на передний и задний миогенный клон.
В соответствии с альтернативным паттерном накопления матричных утолщений эти 4 области - результат процесса сегментации. В тканевой культуре, мезенхимные клетки возникают, когда атриоветрикулярный (или тракта оттока) эндотелий культивируется в присутствии соответствующего (атриовентрикулярного или тракта оттока) миокрада. Это демонстрирует, что регионально ограниченное образование мезенхимы в сердечной трубке обусловлено локализацией как миокард-индуцирующей активности, так компетентности эндотелиальных клеток.
Гены, принимающие участие в процессах сегментации сердца
Прирорда сегмент-специфических сигналов от миокарда, индуцирующих возникновение эндокардиалных подушек неизвестна. На эти сигналы реагируют трансформирующие факторы роста, запускающие эпителиально-мезенхимную трансформацию. С началом эндотелиально-мезенхимной трансформации , мигрирующие мезенхимные клетки экспрессируют smooth muscle-specific alpha-actin (SMA)и экспрессия этой формы актина запускается с помощью TGF β3. Это одно из инициальных событий цитоскелетной реорганизации эндотелиальных клеток<(Nakajima et al., 1997).
Определяли уровни урокиназы в специфических областях сердца птиц во время ранних стадий развития. Урокиназа участвует как в миграции клеток, так и обмене матрикса . Повышенная активность урокиназы и мРНК связана с началом трабекуляции желудочков и миграцией мезенхимных клеток в ткани эндокардиальных подушек . Urokinase локализуется в эндокадиальных и мезенхимных клетках развивающегося atrioventricular canal (AVC) и outflow tract (OFT) а также с эвагинирующим вентрикулярным эндокардом .(McGuire PG, Orkin RW. Urokinase activcty in the slovaoping avian heart: a spatial and temporal analysis.Dev Dyn 1992 Jan 193:1 24-33)
Показано, что wg является эпистатичным по отношению к hedgehog (hh), другому секретируемому продукту гена сегментации, в процессе формирования сердца. Получены доказательства того, что стоящие ниже wg в каскаде передачи сигнала, гены dishevelled (dsh, a pioneer protein) и armadillo (arm, β-catenin homolog) опосредуют кардиогенный Wg сигнал. В частности избыточная экспрессия dsh может восстанавливать сердце в отстуствие wg функции. Обсуждается возможность того, что передача Wg сигнала является частью комбинаторного механизма спецификации кардиальной мезодермы (Park et al., 1996).
ApoJ, секретируемый гликопротеин, экспрессируется в различных типах клеток тканевых интерфейсов ( tissue interfaces), обнаруживает сильно ограниченный и динамический паттерн экспрессии в развивающемся сердце . ApoJ транскрипты обнаруживаются у эмбрионов мыши на 9-й день беременности в стенке развивающегося артериального ствола (truncus arteriosus).На 10-й день интенсивный сигнал обнаруживается в тонком слое миокардиальных клеток, соседствующих с развивающимися эндокардиальными подушками как атриовентрикулярного канала, так и артериального ствола ( truncus arteriosus). мРНК apoJ отсутствовала в покрывающих их эндокардиальных подушках вплоть до 13.5 дня, когда начиналась предклапанная конденсация. Интенсивная экспрессия обнаруживалась в стромальной соединительной ткани в течение всего периода образования клапанов. Сильно ограниченная пространствено-временная экспрессия apoJ в развивающемся сердце указывает на его роль в морфогенезе атриовентрикулярного канала и тракта оттока (Wctte et al.,1994) .
Камер-специфическая экспрессия миокардиальных генов
у мышиных эмбрионов (стадия Е8) обнаруживается камер-специфическая экспрессия вентрикулярной легкой миозиновой цепи 2 (O'Brien et al., 1993).
У эмбрионов мыши на стадии Е8,5 в прекардиальной мезодерме
продолжает экспрессроваться мРНК рецептора HGF и начинает обнару-
живаться мРНК HGF лиганда в субпопуляции предшествеников карди-
альных миоцитов, которые позднее сформируют желудочки и предсер-
дия, но не в мезодерме тракта оттока, эндокарде или энтодерме
(Rappolee et al.1996). Выявляется камер-специфическая экспрессия гена легкой цепи миозина 3F в сердце помимо тракта оттока и
будущего правого желудочка (первый сегмент) (Kelly et al., 1995). Ген десмина экспрессируется преимущественно в правом желудочке, происходящем из первого сегмента, значительно слабее в левом желудочке (второй сегмент) и отсутствует в предсердии (4-й сегмент) ( Kuisk et al.,1996).Ген легкой цепи миозина 2V (MLC2V) экспрессируется только в
миоцитах желудочков (O'Brien et al.,1993) там же экспрессируется мы
шечная креатин-киназа с временной лево-правосторонней асимметрией ( (Ly
ons . ,1994). Описаны ограниченные области промоторов, ответственные за камер-специфическую экспрессию (Kelly et al., 1995); ( Kuisk et al.,1996); ( Lee et al.,1994).Два bHLH транскрипционных фактора, по-видимому,
участвуют в сегмент-специфичной экспрессии (Lyons, 1996), это eHAND ( (Cserjesi et al., 1995) и dHAND (Srivastava et al., 1995). Два других
bHLH доменовых белка также экспрессируются в миокарде, Aryl hydrocar
bon receptor (AhR) (Abbott et al., 1995) и AhR nuclear translocator(ARNT) ( Abbott,Probst,1995).
После стадии 10 у эмбрионов кур
FGFR-1 окрашивание в миокарде становится более выраженным по
сравнению с другими тканями.В это время начинает экспрессировать-
ся мРНК сердечного тропонина С (C/StnC) в артериальном протоке, желудочке и проксимальных отделах вителлиновых вен (Toyota, 1993).
Гены сегментации
Как указывалось выше комплекс N-кадхерина с бета-катенином участвует в образовании целомической полсти и компартментализации кардиогенной мезодермы (Linask et al., 1997). Катенины ассоциируют с цитоплазматическим доменом многих членов семейства кальций-зависимых кадхеринов, включая N-кадхерин. Они обнаруживают гомлогию с ранее идентифицированными белками: α-катенин с винкулином, β-катенин с armadillo, продуктом гена сегментной полярности дрозофилы, γ-катенин идентичен плакоглбину и гомологичен β-катенину. Катенины связывают кадхерины с актиновым цитоскелетом и существенны для полной, обеспечиваемой кадхеринами, адгезии.
Помимо их роли в межклеточной адгезии, как N-кадхерин, так и β-катенин участвуют в передаче внутрикулеточных сигналов и таким образом в регуляции транскрипции и дифференцировки генов. Так как β-катенин участвует в пути передачи Wnt-сигнала, то и этот сигнальный путь может быть задействован там, где участвует β-катенин. Недавно было показано, что β-катенин связывается с LEF-1 и формирует комплекс, который транслоцируется в ядро (Molenar et al., 1996; Behrens et al., 1996).Следовательно, β-катенин может регулировать экспрессию генов путем взаимодействия с транскрипционными факторами такими как LEF-1. Как N-кадхерин, так и β-катенин могут участвовать в молекулярном механизме передачи сигналов от клеточно-адгезивных компонентов или от белка wnt в ядро. У дрозофилы развитие контрактильного сосуда ("сердце")нуждается в гене wingless. Элиминация функции wingless на короткий период во время гаструляции ведет к селективной потеpе предшественников сердца. Известно о экспрессии гена Wnt2 в раннем поле сердца мыши (7.5-8 день беременности) (Monkely et al 1996).
Развитие сердца может быть гомологичным развитию ромбомеров в развивающемся головном мозге. Морфологическое проявление такой сегментации подтверждается паттернами экспрессии различных регуляторных молекул в сердце. Наиболее интересным является ограничение экспрессии как костного морфогенетического белка (ВМР-4)(Jones et al., 1991), так и msx-2 (Chan-Thomas et al., 1993) в миокарде атиовентрикулярного канала и вентрикулярном тракте оттока. Эти молекулы члены TGF-β и гомоебоксных семейств генов, соотв. Интересно, что оба экспрессируются также в альтернативных ромбомерах развивающегося заднего мозга. Показано, что и некоторые другие молекулы локализуются в атриовентрикулярном канале и тракте оттока. TGF-β1 и TGF-β2 первоначально экспрессируются в кардиогенной мезодерме на высоком уровне в виде равномерного паттерна. Однако во время, когда начинается миграция клеток в подушки, их экспрессия становится органиченной или эндокардом или миокардом, соотв, атриовентрикулярного канала или тракта оттока. Гомеобоксные гены msx-1 и mox-1(Candia et al., 1992)) экспрессируются в эндокарде и мезенхиме подушек этих же двух областей сердца. Наконец, непосредственно перед образованием ткани подушек частицы размером 0.1-0.5 микроМ накапливаются в кардиальном геле только атриовентрикулярного канала и тракта оттока. Эти молекулярные комплексы обозначенны адхеронами, а их компоененты названы ES антигенами. Эти частицы могут быть визуализиованы с помощью антител к фибронектину, который является одним из составляющих частицы белков. ES белки, по-видимому, экспрессируются в областях, где происходят эпителиально-мезенхимного взаимодействия, включая развивающиеся почки конечностей, нервную трубку и лицевые кости. Более того все эти области коэкспрессируют ВМР-4, msx-1, msx-2. Белки ES важны для формирования подушек мезенхимы.
Выявлен законсервированный GATA-мотив, который взаитмодействует специфически с GATA-мотив связывающим фактором в ядерных экстрактах кардиомиоцитов на разных стадиях развития. Эти данные подтверждают роль GATA фактора в регуляции экспрессии cardiac -α-MyHC gene .( Huang WY, Liew CC. A conserved GATA motif in a tissue-specific DNase I hypersensctive scte of the cardiac alpha-myosin heavy chain gene. Biochem J 1997 Jul 1 325 ( Pt 1): 47-51)
Гомеобоксные гены
Тесная взаимосвязь между Нех-позитивной энтодермой и кардиогенной пластинкой в купе с сердце-индуцирующими свойствами пердней энтодермы у эмбрионов кур указывает на то,что Нех должен оказывать прямое или косвеное влияние на кардиальную индукцию.На стадии поздней полоски/нейральной пластинки кардиальные клетки-предшественники расположены в предней проксимальной мезодерме, презумптивный эндокард, экспрессирующем flk-1, и миокард Nkx2.5. Изолированные Нех-позитивные клетки обнаруживаются в кардиогенном поле на этой стадии и позднее, подобно flk-1, экспрессия ограничивается эндокардом и поддерживается вплоть до 9.5 dpc. Очевидно дивергентный гомеобоксный ген Нех участвует в выделение эндокардиальных клеток из кардиогенной мезодермы.
Качественные особенности сегментов ( segment identcty)детерминируются комбинациями функционально активных Нох , которые имеют строго определенные границы экспрессии вдоль передне-задней оси ( axial Hox code). Нарушение Нох кода эктопической экспрессией или мутациями Нох генов часто обусловливают гомеозисные трансформации позвонков. Кроме того известно, что ген, участвующие в обеспечении путей создания Нох кода Activin, Vg-1 и, type II activin receptors участвуют в регуляции латеральной асимметрии, в том числе и сердца во время развития у эмбрионов кур и Xenopus. Помимо уже упоминавшихся гомеобоксных генов Csx/Nkx-2.5,Msx-1 и Msx-2 установлено участие в формировании сердца позвоночных гомоеобоксных генов Hoxa-3, M-Hox. Получены мутантные мыши по
гену Ноха-3 [82] , гомологу zen и pb у дрозофилы. Гомеобоксный белок М-Нох экспрессируется в сердечных, скелетных и гладких мышцах, связывается in vctro c А/Т-богатыми последовательностями энхансера мышечной креатин=киназы [83].
Гены Prx1 and Prx2 (previously called M-Hox and S8, соотв.) являются членами небольшого подсемейства гомеобоксных генов позвоночных, экспрессирующихся во время эмбриогенеза начиная с гаструляции. Сравнивали домены экспрессии генов Prx у мышей и кур . Помимо поверхностного сходства паттернов экспрессии Prx1 и Prx2 в краниальной мезенхиме, почках конечностей , аксиальной мезодерме и бранхиальных дугах и их производынх выявлены значиетльные различия в большинстве сайтов , в частности в сердце и головном мозге . Выявлена в некоторых случаях корреляция внутри развивающихся областей соединительной ткани . С Е8.5, Prx-1 экспрессия обнаруживается в сердце , первоначально в эндокардиальных подушках, а позднее в развивающихся полулунных и атриовентрикулярных клапанах . Prx2 развивается рано в виде диффузного миокардиального паттерна экспрессии а позднее обнаруживает высокую экспрессию в вентрикулярной перегородке и в частности в ductus arteriosus. Prx2 никогда не экспрессируется в головном мозге , тогда как Prx1 экспрессируется, начиная с 9.5 и далее в уникальном отдельном домене в вентральнйо части гипоталямуса, и широкой области телэнцефалона (Leussink B, Brouwer A, el Khattabi M, Poelmann RE, Gcttenberger-de Groot AC, Meijlink F. Expression patterns of the paired-related homeobox genes MHox/Prx1 and S8/Prx2 suggest roles in slovaopment of the heart and the forebrain.
Mech Dev 1995 Jul 52:1 51-64)
Получали трансгеных мышей, несущих generated mice bearing the α-myosin heavy chain (MHC)-Hoxb-7 трансген. Предполагалось, что использование cardiac-specific α-MHC промотора, будет управлять эктопической экспрессией Hoxb-7 в сердце и будет нарушать его нормальное развитие . Гибридизация in sctu как целых эмбрионов и northern analyses показали, что этот α-MHC промотор обусловливает экспрессию трансгена в развивающемся сердце. Обнаружены тяжелые ventricular septal defects (VSD) у некоторых мутантных мышей. У трансгеных мышей обнаруживалдись и другие аномалии , включая расщепление неба, аномалии почек и скелетные аномалии к краниоцервикальной и костостернальной областях. .Т.о, неправильная экспрессия Hoxb-7 во время развития сердца м.б. вовлечена в патогенез VSD.(Argao EA, Kern MJ, Branford WW, Scott WJ Jr, Potter SS. Malformations of the heart, kidney, palate, and skeleton in alpha-MHC-Hoxb-7 transgenic mice. Mech Dev 1995 Aug 52:2-3 291-303)
Было показано (Oh, Li, 1997), что разрушение рецептора активина типа IIB ( type IIB activin receptor (ActRIIB)) с помощью генного таргетинга обусловливает нарушение экспрессии многих Нох генов и аномальный паттерн позвонков, сходный,но более тяжелый, чем индуцированный ретиноевой кислотой (retinoic acid (RA)-induced anterior transformation). Далее было показано, что мутации RA и ActRIIB обнаруживают синергичные эффекты на паттерн формирования позвонков. Было установлено, что ActRIIB-/- мыши погибают после рождения в результате сложных кардиальных дефектов,включая рандомизированное положение сердца, транспозицию крупных артерий дефекты межпредсердной и межжелудочковой перегородки. Эти данные подтверждают, что ActRIIB-обеспечиваемый путь передачи сигналов играет критическую роль как в формировании передне-заднего паттерна , так и лево-правосторонней оси у позвоночных.
В настоящее время имеются указания на то,что и Рах гены в ходе раннего развития управляют активностью генов, кодирующих молекулы
клеточной адгезивности. Установлено, что в промоторе гена
N-CAM имеются регуляторные последовательности, с которыми связываются регулирующме продукты гомеобоксных (HBS) и Pax (PBS) генов. Активность N-CAM промотора контролируется НохВ6, НохВ8 и
НохВ9 гомеобоксными генами и Рах-6, Рах-3 генами у эмбрионов кур и Cux (cut-like homeobox) и Phox-2 (paired-like homeobox2) у эмбрионов мыши. Сходные гомеобоксные последовательности для связи с
продуктами гомеобоксных и Рах генов обнаружены в L-CAM, Ng-CAM.
Предполагается, что это характерно для промоторов всех генов молекул клеточной адгезивности (САМ). Высказывается предположение, что разные комбинации продуктов генов Рах (известно 8 генов Рах) и гомеобоксных генов могут регулировать сайт-зависмую экспрессию уникального набора генов молекул клеточной адгезивности - генов-мишеней, которые в свою очередь детерминируют определенные свойства в популяциях клеток, создавая при этом их морфологические границы (границы компартментов).
Идентифицирован человечий paired-related гомеобоксный ген , за счет его гомологии с SHOX геном человека и OG-12 геном мыши. Выделены 2 изоформы , SHOTa и SHOTb. С помощью гибридизации In sctu мышиного эквивалента , OG-12, на срезах эмбрионов мыши определенных стадий развития было выявлено сильно ограниченная экспрессия в развивающемся венозном синусе (sinus venosus ). Помимо сегмент-специфической экспрессии некоторых генов проявление некоторых мутантных генов дает сегментный паттерн аномалий, что подтверждает сегмент-специфическую экспрессию и этих генов.
Нарушение вентрикулярных камер(chamber hypoplasia and muscular ventricular septal defects), конотрункуса(double-outlet right ventricle, transposction, and membranous ventricular septal defects),аортального мешка (persistent truncus arteriosus and aorticopulmonary window), и aortic arch-derived arteries были выявлены в разных сочетаниях мутаций генов рецепторов ретиноевой кислоты RAR α 1, RAR β, and RXR α . В зависимости от комбинации мутаций рецепторов были получены избирательные эффекты в специфических кардиоваскулярных компартментах. Это указывает на дифференциальную экспрессию или функцию каждого из рецепторов в доменах развивающегося сердца(Lee et al., 1997).
Рецессивная летальная инсерционная мутация в хромосоме 13 выявлена у трансгенных мышей с сегментной формой порока сердца вдоль передне-задней оси (Yamamura et al., 1997). В сердечной трубке отсутствует наиболее передний сегмент (будущий конус и правый желудочек), отсутствуют также эндокардиальные подушки в конусе и атриовентрикулярной области .Анализ β-galactosidase репортерной части трансгена во время эмбрионального разития показал, что сегментная экспрессия активна первоначально в дефектном оттоке примитивного сердца. Помимо экспрессии в сердечной трубке гемизиготные эмбрионы обнаруживают экспрессию трансгена в хондрогенных областях первой и второй бранхиальных дуг, аппендикулярном скелете и дермальных сосочках вибрис (papillae of the vibrissae).Ограниченный паттерн экспрессии 946;-galactosidase в сердце может быть нарушен воздействием ретиноевой кислоты и он распространяется кзади вдоль передне-задней оси у гемизиготных мышей. Хотя и отсутствует мезенхима подушек у гомозиготных мутантов, миокардиальные и эндотелиальные клетки, эксплантированные от мутантной атриовентрикулярной области, но не из конуса , способны формировать in vctro ткань. Мыши, трисомные по хромосоме 13 также обнаруживают сегментные аномалии , связанные с передними примитивными выходными сегментами сердца. Полученные данные показывают, что инсерционная мутация позволяет выделить новый ген hdf (heart defect)на хромосоме 13, необходимый для инициации и поддержания развития переднего плеча сердечной трубки.
|
