dally—division abnormally delayed;
Dfz2—Drosophila frizzled 2;
Dkk-1—Dickkopf-1;
Dpp—Decapentaplegic;
GAGs—glycosaminoglycans;
Hh—Hedgehog;
Hip—Hedgehog-interacting protein;
Ptc—Patched;
Sax—Saxophone;
sFRP—secreted Frizzled-related protein;
Shh—Sonic hedgehog;
Smo—Smoothened;
Sog—Short gastrulation;
TGF-β>—transforming growth factor-β>;
Tkv—Thick-veins;
Ttv—Tout-velu;
Wg—Wingless
В время развития многоклеточных организмов формообразование эмбрионов координируется действием организующих центров — областей эмбриона, которые продуцируют комбинации секретируемых факторов, которые способны обеспечить позиционную информацию полям эмбриональных клеток-предшественников. Сочетанная активность нескольких организующих центров обеспечивает создание упорядоченного паттерна дифференцированных типов клеток в развивающемся эмбрионе. Активность этих центов должна быть ораничена в пространстве и во времени.
Эти сигнальные молекулы включают членов семейств секретируемых факторов Hedgehog (Hh), Wnt и transforming growth factorβ (TGF-β>). Некоторые из них действуют как морфогены, они распределяются градиентно, обеспечивая различные клеточные реакции в зависимости от эффективной концентрации белка в каждой точке градиента (reviewed in [1]). Очевино, что пассивная диффузия не м. объяснить всех характеристик морфогенетического градиента. Выявлено несколько уровней регуляции. Один из них это транскрипционный контроль: морфогены продуцируются в виде ограниченного паттерна в эмбрионе так, что имеется источник морфогена (организующий центр) помимо поля клеток, которое не экспрессирует мофроген, но компетентно отвечать на его градиент. Второй уровень регуляции связан с котролем доступности рецепторов и переносчиков сигналов в чуствительную ткань. Известно и о некоторых других внутриклеточных механизмах, сязанных с Hh [2] [3], Wnt [4] [5] [6] и TGFβ [7] [8] [9] сигнальными путями
Cell 1996, 85: 951–961.
Ingham PW: Transducing Hedgehog: the story so far.
EMBO J 1998, 17: 3505–3511.
Johnson RL, Scott MP: New players and puzzles in the Hedgehog signaling pathway.
Curr Opin Genet Dev 1998, 8: 450–456.
Wodarz A, Nusse R: Mechanisms of Wnt signaling in development.
Annu Rev Cell Dev Biol 1998, 14: 59–88.
Brown JD, Moon RT: Wnt signaling: why is everything so negative?
Curr Opin Cell Biol 1998, 10: 182–187.
Dierick H, Bejsovec A: Cellular mechanisms of wingless/Wnt signal transduction.
Curr Top Dev Biol 1999, 43: 153–190.
Cho KW, Blitz IL: BMPs, Smads and metalloproteases: extracellular and intracellular modes of negative regulation.
Curr Opin Genet Dev 1998, 8: 443–449.
Massagué J: TGF-beta signal transduction.
Annu Rev Biochem 1998, 67: 753–791.
Padgett RW, Das P, Krishna S: TGF-beta signaling, Smads, and tumor suppressors.
Bioessays 1998, 20: 382–390.
Alcedo J, Ayzenzon M, Von Ohlen T, Noll M, Hooper JE: The Drosophila smoothened gene encodes a seven-pass membrane protein, a putative receptor for the hedgehog signal.
Cell 1996, 86: 221–232.
van den Heuvel M, Ingham PW: smoothened encodes a receptor-like serpentine protein required for hedgehog signalling.
Nature 1996, 382: 547–551.
Hooper JE, Scott MP: The Drosophila patched gene encodes a putative membrane protein required for segmental patterning.
Cell 1989, 59: 751–765.
Nakano Y, Guerrero I, Hidalgo A, Taylor A, Whittle JR, Ingham PW: A protein with several possible membrane-spanning domains encoded by the Drosophila segment polarity gene patched.
Nature 1989, 341: 508–513.
Marigo V, Davey RA, Zuo Y, Cunningham JM, Tabin CJ: Biochemical evidence that patched is the Hedgehog receptor.
Nature 1996, 384: 176–179.
Stone DM, Hynes M, Armanini M, Swanson TA, Gu Q, Johnson RL, Scott MP, Pennica D, Goddard A, Phillips H et al.: The tumour-suppressor gene patched encodes a candidate receptor for Sonic hedgehog.
Nature 1996, 384: 129–134.
• Chen Y, Struhl G: In vivo evidence that Patched and Smoothened constitute distinct binding and transducing components of a Hedgehog receptor complex.
Development 1998, 125: 4943–4948.
Chen Y, Struhl G: Dual roles for patched in sequestering and transducing Hedgehog.
Cell 1996, 87: 553–563.
•• Bellaiche Y, The I, Perrimon N: Tout-velu is a Drosophila homologue of the putative tumour suppressor EXT-1 and is needed for Hh diffusion.
Nature 1999, 394: 85–88.
Lin X, Gan L, Klein WH, Wells D: Expression and functional analysis of mouse EXT1, a homolog of the human multiple exostoses type 1 gene.
Biochem Biophys Res Commun 1998, 248: 738–743.
• McCormick C, Leduc Y, Martindale D, Mattison K, Esford LE, Dyer AP, Tufaro F: The putative tumor suppressor EXT1 alters the expression of cell surface heparan sulfate.
Nat Genet 1998, 19: 158–161.
•• Chuang PT, McMahon AP: Vertebrate Hedgehog signalling modulated by induction of a Hedgehog-binding protein.
Nature 1999, 397: 617–621.
Porter JA, Young KE, Beachy PA: Cholesterol modification of hedgehog signaling proteins in animal development.
Science 1996, 274: 255–259.
• Pepinsky RB, Zeng C, Wen D, Rayhorn P, Baker DP, Williams KP, Bixler SA, Ambrose CM, Garber EA, Miatkowski K et al.: Identification of a palmitic acid- modified form of human Sonic hedgehog.
J Biol Chem 1998, 273: 14037–14045.
• Rietveld A, Neutz S, Simons K, Eaton S: Association of sterol- and glycosylphosphatidylinositol- linked proteins with Drosophila raft lipid microdomains.
J Biol Chem 1999, 274: 12049–12054.
Simons K, Ikonen E: Functional rafts in cell membranes.
Nature 1997, 387: 569–572.
Brown DA, London E: Functions of lipid rafts in biological membranes.
Annu Rev Cell Dev Biol 1998, 14: 111–136.
Nusse R, Varmus HE: Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome.
Cell 1982, 31: 99–109.
• The Wnt gene homepage on
> the World Wide Web at URL:
Bhanot P, Brink M, Samos CH, Hsieh JC, Wang Y, Macke JP, Andrew D, Nathans J, Nusse R: A new member of the frizzled family from Drosophila functions as a Wingless receptor.
Nature 1996, 382: 225–230.
• Zhang J, Carthew RW: Interactions between Wingless and DFz2 during Drosophila wing development.
Cadigan KM, Fish MP, Rulifson EJ, Nusse R: Wingless repression of Drosophila frizzled 2 expression shapes the Wingless morphogen gradient in the wing.
Cell 1998, 93: 767–777.
Leyns L, Bouwmeester T, Kim SH, Piccolo S, De Robertis EM: Frzb-1 is a secreted antagonist of Wnt signaling expressed in the Spemann organizer.
Cell 1997, 88: 747–756.
Mayr T, Deutsch U, Kuhl M, Drexler HC, Lottspeich F, Deutzmann R, Wedlich D, Risau W: Fritz: a secreted frizzled-related protein that inhibits Wnt activity.
Mech Dev 1997, 63: 109–125.
Finch PW, He X, Kelley MJ, Uren A, Schaudies RP, Popescu NC, Rudikoff S, Aaronson SA, Varmus HE, Rubin JS: Purification and molecular cloning of a secreted, Frizzled-related antagonist of Wnt action.
Proc Natl Acad Sci USA 1997, 94: 6770–6775.
Salic AN, Kroll KL, Evans LM, Kirschner MW: Sizzled: a secreted wnt8 antagonist expressed in the ventral marginal zone of Xenopus embryos.
Development 1997, 124: 4739–4748.
Lin K, Wang S, Julius MA, Kitajewski J, Moos M Jr, Luyten FP: The cysteine-rich frizzled domain of Frzb-1 is required and sufficient for modulation of Wnt signaling.
Proc Natl Acad Sci USA 1997, 94: 11196–11200.
Wang S, Krinks M, Lin K, Luyten FP, Moos M Jr: Frzb, a secreted protein expressed in the Spemann organizer, binds and inhibits Wnt-8.
Cell 1997, 88: 757–766.
Rattner A, Hsieh JC, Smallwood PM, Gilbert DJ, Copeland NG, Jenkins NA, Nathans J: A family of secreted proteins contains homology to the cysteine- rich ligand-binding domain of frizzled receptors.
Proc Natl Acad Sci USA 1997, 94: 2859–2863.
Melkonyan HS, Chang WC, Shapiro JP, Mahadevappa M, Fitzpatrick PA, Kiefer MC, Tomei LD, Umansky SR: SARPs: a family of secreted apoptosis-related proteins.
Proc Natl Acad Sci USA 1997, 94: 13636–13641.
• Leimeister C, Bach A, Gessler M: Developmental expression patterns of mouse sFRP genes encoding members of the secreted frizzled related protein family.
Mech Dev 1998, 75: 29–42.
Wang S, Krinks M, Moos M Jr: Frzb-1, an antagonist of Wnt-1 and Wnt-8, does not block signaling by Wnts-3A, -5A, or -11.
Biochem Biophys Res Commun 1997, 236: 502–504.
Lescher B, Haenig B, Kispert A: sFRP-2 is a target of the Wnt-4 signaling pathway in the developing metanephric kidney.
Dev Dyn 1998, 213: 440–451.
Hoppler S, Brown JD, Moon RT: Expression of a dominant-negative Wnt blocks induction of MyoD in Xenopus embryos.
Genes Dev 1996, 10: 2805–2817.
Torres MA, Yang-Snyder JA, Purcell SM, DeMarais AA, McGrew LL, Moon RT: Activities of the Wnt-1 class of secreted signaling factors are antagonized by the Wnt-5A class and by a dominant negative cadherin in early Xenopus development.
J Cell Biol 1996, 133: 1123–1137.
•• Glinka A, Wu W, Delius H, Monaghan AP, Blumenstock C, Niehrs C: Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction.
Nature 1998, 391: 357–362.
Aravind L, Koonin EV: A colipase fold in the carboxy- terminal domain of the Wnt antagonists – the Dickkopfs.
Curr Biol 1998, 8: R477–R478.
• Hsieh J-C, Kodjabachian L, Rebbert ML, Rattner A, Smallwood PM, Harryman Samos C, Nusse R, Dawid IB, Nathans J: A new secreted protein that binds to Wnt proteins and inhibits their activites.
Nature 1999, 398: 431–436.
Binari RC, Staveley BE, Johnson WA, Godavarti R, Sasisekharan R, Manoukian AS: Genetic evidence that heparin-like glycosaminoglycans are involved in wingless signaling.
Development 1997, 124: 2623–2632.
Hacker U, Lin X, Perrimon N: The Drosophila sugarless gene modulates Wingless signaling and encodes an enzyme involved in polysaccharide biosynthesis.
Development 1997, 124: 3565–3573.
Haerry TE, Heslip TR, Marsh JL, O'Connor MB: Defects in glucuronate biosynthesis disrupt Wingless signaling in Drosophila.
Development 1997, 124: 3055–3064.
Dierick HA, Bejsovec A: Functional analysis of Wingless reveals a link between intercellular ligand transport and dorsal-cell- specific signaling.
Development 1998, 125: 4729–4738.
Hogan BL: Bone morphogenetic proteins in development.
Curr Opin Genet Dev 1996, 6: 432–438.
•• Lecuit T, Cohen SM: Dpp receptor levels contribute to shaping the Dpp morphogen gradient in the Drosophila wing imaginal disc.
Development 1998, 125: 4901–4907.
•• Haerry TE, Khalsa O, O'Connor MB, Wharton KA: Synergistic signaling by two BMP ligands through the SAX and TKV receptors controls wing growth and patterning in Drosophila.
Development 1998, 125: 3977– 3987.
•• Nguyen M, Park S, Marqués G, Arora K: Interpretation of a BMP activity gradient in Drosophila embryos depends on synergistic signaling by two type I receptors, SAX and TKV.
Cell 1998, 95: 495–506.
Smith WC: TGF beta inhibitors. New and unexpected requirements in vertebrate development.
Trends Genet 1999, 15: 3–5.
Iemura S, Yamamoto TS, Takagi C, Uchiyama H, Natsume T, Shimasaki S, Sugino H, Ueno N: Direct binding of follistatin to a complex of bone morphogenetic protein and its receptor inhibits ventral and epidermal cell fates in early Xenopus embryo.
Proc Natl Acad Sci USA 1998, 95: 9337–9342.
Sasai Y, Lu B, Steinbeisser H, Geissert D, Gont LK, De Robertis EM: Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes.
Cell 1994, 79: 779–790.
Sasai Y, Lu B, Steinbeisser H, De Robertis EM: Regulation of neural induction by the Chd and Bmp-4 antagonistic patterning signals in Xenopus.
Nature 1995, 376: 333–336.
Smith WC, Harland RM: Expression cloning of noggin, a new dorsalizing factor localized to the Spemann organizer in Xenopus embryos.
Cell 1992, 70: 829–840.
Lamb TM, Knecht AK, Smith WC, Stachel SE, Economides AN, Stahl N, Yancopolous GD, Harland RM: Neural induction by the secreted polypeptide noggin.
Science 1993, 262: 713–718.
Smith WC, Knecht AK, Wu M, Harland RM: Secreted noggin protein mimics the Spemann organizer in dorsalizing Xenopus mesoderm.
Nature 1993, 361: 547–549.
Piccolo S, Sasai Y, Lu B, De Robertis EM: Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4.
Cell 1996, 86: 589–598.
Zimmerman LB, De Jesus-Escobar JM, Harland RM: The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4.
Cell 1996, 86: 599–606.
Thomsen GH: Antagonism within and around the organizer: BMP inhibitors in vertebrate body patterning.
Trends Genet 1997, 13: 209–211.
• Hsu DR, Economides AN, Wang X, Eimon PM, Harland RM: The Xenopus dorsalizing factor Gremlin identifies a novel family of secreted proteins that antagonize BMP activities.
Mol Cell 1998, 1: 673–683.
Bouwmeester T, Kim S, Sasai Y, Lu B, De Robertis EM: Cerberus is a head inducing secreted factor expressed in the anterior endoderm of Spemann's organizer.
Nature 1996, 382: 595–601.
•• Piccolo S, Agius E, Leyns L, Bhattacharyya S, Grunz H, Bouwmeester T, De Robertis EM: The head inducer Cerberus is a multifunctional antagonist of Nodal, BMP and Wnt signals.
Nature 1999, 397: 707–710.
Nakamura Y, Ozaki T, Nakagawara A, Sakiyama S: A product of DAN, a novel candidate tumour suppressor gene, is secreted into culture medium and suppresses DNA synthesis.
Eur J Cancer 1997, 33: 1986–1990.
Stanley E, Biben C, Kotecha S, Fabri L, Tajbakhsh S, Wang CC, Hatzistavrou T, Roberts B, Drinkwater C, Lah M et al.: DAN is a secreted glycoprotein related to Xenopus cerberus.
Mech Dev 1998, 77: 173–184.
Belo JA, Bouwmeester T, Leyns L, Kertesz N, Gallo M, Follettie M, De Robertis EM: Cerberus-like is a secreted factor with neutralizing activity expressed in the anterior primitive endoderm of the mouse gastrula.
Mech Dev 1997, 68: 45–57.
Biben C, Stanley E, Fabri L, Kotecha S, Rhinn M, Drinkwater C, Lah M, Wang CC, Nash A, Hilton D et al.: Murine cerberus homologue mCer-1: a candidate anterior patterning molecule.
Dev Biol 1998, 194: 135–151.
Minabe-Saegusa C, Saegusa H, Tsukahara M, Noguchi S: Sequence and expression of a novel mouse gene PRDC (protein related to DAN and cerberus) identified by a gene trap approach.
Dev Growth Differ 1998, 40: 343–353.
Pearce JJH, Penny G, Rossant J: A Mouse Cerberus/Dan-Related Gene Family.
Dev Biol 1999, 209: 98–110.
Shawlot W, Deng JM, Behringer RR: Expression of the mouse cerberus- related gene, Cerr1, suggests a role in anterior neural induction and somitogenesis.
Proc Natl Acad Sci USA 1998, 95: 6198–6203.
Gazzerro E, Gangji V, Canalis E: Bone morphogenetic proteins induce the expression of noggin, which limits their activity in cultured rat osteoblasts.
J Clin Invest 1998, 102: 2106–2114.
Amthor H, Christ B, Patel K: A molecular mechanism enabling continuous embryonic muscle growth – a balance between proliferation and differentiation.
Development 1999, 126: 1041–1053.
• Constam DB, Robertson EJ: Regulation of bone morphogenetic protein activity by pro domains and proprotein convertases.
J Cell Biol 1999, 144: 139–149.
Suzuki A, Kaneko E, Maeda J, Ueno N: Mesoderm induction by BMP-4 and -7 heterodimers.
Biochem Biophys Res Commun 1997, 232: 153–156.
Nishimatsu S, Thomsen GH: Ventral mesoderm induction and patterning by bone morphogenetic protein heterodimers in Xenopus embryos.
Mech Dev 1998, 74: 75–88.
• Cui Y, Jean F, Thomas G, Christian JL: BMP-4 is proteolytically activated by furin and/or PC6 during vertebrate embryonic development.
EMBO J 1998, 17: 4735–4743.
Jackson SM, Nakato H, Sugiura M, Jannuzi A, Oakes R, Kaluza V, Golden C, Selleck SB: dally, a Drosophila glypican, controls cellular responses to the TGF beta-related morphogen, Dpp.
Development 1997, 124: 4113–4120.
Barbara NP, Wrana JL, Letarte M: Endoglin is an accessory protein that interacts with the signaling receptor complex of multiple members of the transforming growth factor-beta superfamily.
J Biol Chem 1999, 274: 584–594.
López-Casillas F, Payne HM, Andres JL, Massagué J: Betaglycan can act as a dual modulator of TGF-beta access to signaling receptors: mapping of ligand binding and GAG attachment sites.
J Cell Biol 1994, 124: 557–568.
Glinka A, Wu W, Onichtchouk D, Blumenstock C, Niehrs C: Head induction by simultaneous repression of Bmp and Wnt signalling in Xenopus.
Nature 1997, 389: 517–519.
•• Ashe HL, Levine M: Local inhibition and long-range enhancement of Dpp signal trans- duction by Sog.
Nature 1999, 398: 427–431.
Blader P, Rastegar S, Fischer N, Strahle U: Cleavage of the BMP-4 antagonist chordin by zebrafish tolloid.
Science 1997, 278: 1937–1940.
Marqués G, Musacchio M, Shimell MJ, Wunnenberg-Stapleton K, Cho KW, O'Connor MB: Production of a DPP activity gradient in the early Drosophila embryo through the opposing actions of the SOG and TLD proteins.
Cell 1997, 91: 417–426.
Piccolo S, Agius E, Lu B, Goodman S, Dale L, De Robertis EM: Cleavage of Chordin by Xolloid metalloprotease suggests a role for proteolytic processing in the regulation of Spemann organizer activity.
Cell 1997, 91: 407–416.
Bier E: A unity of opposites.
Nature 1999, 398: 375–376.
Perrimon N, McMahon AP: Negative feedback mechanisms and their roles during pattern formation.
Cell 1999, 97: 13–16.
Многие сигнальные пути содержат негативные петли обратной связи, которые контрролируют продолжительность сигнала и предупреждают избыточную стимуляцию. Одним из путей является снижение уровня поверхности рецепторов после того как они ангажированы своими лигандами. После активации лигандом некоторые рецепторные тирозин киназы ubiquitinated, затем интернализуются с помощью клатрин-зависимого эндоцитоза и, наконец, деградируют. Установлено, как epidermal growth-factor receptor (EGFR) и hepatocyte growth-factor receptor (HGFR) подвергаются эндоцитозу с клеточной поверхности (Nature 416, 183–187 и Nature 416, 187–190; 2002). Группа Ivan Dikic's разыскивала новых партнеров для Cbl, тогда как группа Silvia Giordano's искала новых партнеров для endophilins — но нашли они один и тот же белок: CIN85. Cbl является эффектором нескольких рецепторов факторов роста и убиквитинирует активные рецепторы посредством их RING домена, направляя их тем самым на деградацию. Endophilins являются липидными энзимами, которые влияют на изгибы мембран и регулируюти формирование ямок, одетых клатрином. Выявлены трехсоставные комплексы Cbl, CIN85 и endophilin в клетках млекопитающих. Кроме того установлено, что Cbl рекрутируется EGFR и фосфорилируется EGF-индуцируемым способом, что в свою очередь усиливает связывание CIN85 с дистальным С-концом Cbl. CIN85 связывается также с endophilins, которые ведут к его рекрутированию в активируемые рецепторы (Рис.). Кроме того, Giordano и др. показали, что в клетках, экспрессирующих постоянно активные HGFR, endophilins постоянно ассоциированы с HGFR посредством Cbl/CIN85 комплекса. Чтобы показать, что эти взаимодействия необходимы для снижения количества EGFRs на клеточной поверхности Dikic и др. создали доминантно-негаивные CIN85 конструкции, которые способны взаимодействовать с Cbl или endophilin. Избыточная экспрессия этих мутантов блокирует интернализацию EGFR, задерживает их деградацию и усиливает EGF-зависимую транскрипцию. Напротив, когда Giordano избыточно экспрессировали ту же самую конструкцию, но наблюдали пролонгированное фосфорилирование HGFR и усиление передачи сигналов HGFR. Итак, Cbl, из-за того, что он м. взаимодействовать с разными партнерами и соединять рецепторы ростовых факторов с обеими нижестоящими сигнальными молекулами и регулировать эндоцитоз, он является как эффектором. так и негативным регулятором рецепторов ростовых факторов.

The ins and outs of signalling
Nature 411, 759-762 (2001)
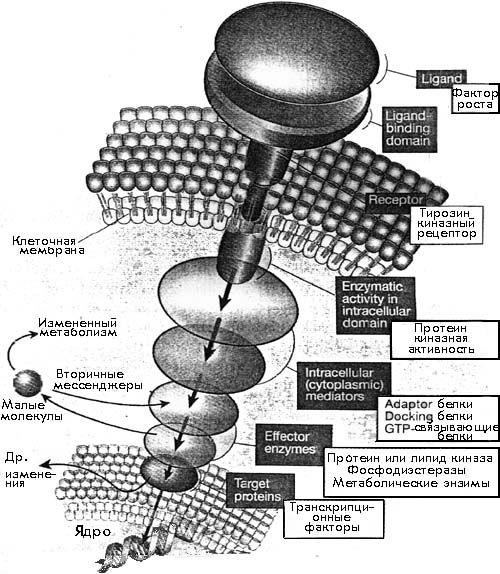
Рис. Обобщенный путь передачи сигналов. Темные квадратики показывают общие компоненты сигнального пути; белые квадратики показывают специфические примеры. С одной стороны клеточной мембраны, рецепторы соединяются с биологически активными лигандами, таким как фактор роста. В результате энзиматическая активность, связанная с внутриклеточной частью рецептора, изменяется. Это может повлиять на ассоциацию рецептора с внутриклеточными медиаторами или локализацию или функцию таких медиаторов. Они в свою очередь изменяют активность "эффекторных" энзимов. Некоторые эффекторы могут перемещаться в ядро и контролировать экспрессию генов или они могут принуждать к этому другие белки. Другие мишени - малые молекулы, или генерируют дальнейшую передачу сигнальных медиаторов (вторичных мессенджеров) или контролируют метаболическое состояние клетки. Реальные сигнальные пути могут включать весь класс этих молекул или могут иметь несколько компонентов одного или более классов, работая или серийно или параллельно.
Receptors
Intracellular mediators
Nuclear events
Signalling concepts
Specificity
Complexity
Signal Integration
Localization and translocation
Signal amplitude and duration
Extracellular modulation of the Hedgehog, Wnt and TGFβ signalling pathways during embryonic development
Javier Capdevila, Juan Carlos Izpisúa Belmonte
Current Opinion in Genetics & Development 1999, 9 No. 4:427-433.
Hedgehog signalling
Семейство интегральных мембранных белков, кодируемых генами EXT семейства , впервые выявленных при синдроме multiple exostoses у человека, также участвуют в этом процессе. Функция EXT белков в облегчении диффузии Hh выявлена для Drosophila tout-velu (ttv) гена[18••]. Клетки, у которых отсутствует ttv функция не отвечают на белок Hh за исключением тех, что непосредственно контактируют с Hh-экспрессирубющими клетками. Ttv, по-видимому, необходим клеткам, которые воспринимают Hh, но не клеткам, которые его продуцируют. EXT белки обнаружены в эндоплазматическом ретикулеме [19] [20•], где они, по-видимому, контролируют синтез гепарин сульфат гликозаминогликаны клеточной поверхности [20•] (GAGs), которые участвуют в рецепции некоторых сигнальных молекул. Отсутствие EXT функции ( и следовательно, GAG функции), м. вызывать или подавление интернализации белка Hh или нарушение его транслокации сквозь поверхность чувствительных клеток или оба процесса. Два других гена, родственных ttv идентифицированных у Drosophila м.б. необходимы для контроля синтеза других типов GAGs, которые могут асистировать другим сигнальным молекулам.
У позвоночных описан Hh-interacting protein (Hip) [21••]. Hip является мембранным гликопротеином , который соединяется со всеми тремя описанными у млекопитающих Hh белками и который ослабляет передачу сигналов Hh. Hip является транскрипционной мишенью для гена Hh и экспрессируется рядом с клетками, которые экспрессируют Hh гены, следовательно, снова действует механизм ограничения пределов действия сигналов Hh.
Активность Hh может меняться и в результате пост-трансляционных модификаций. Показано, что во время биосинтеза белка Hh аутокаталитический процессинг дает cholesterol-modified amino-терминальный фрагмент [22], который за всю известную Hh-сигнальную активность. Установлено, что белок Sonic hedgehog (Shh) у человека имеет palmitoyl группу, соединенную с amino концом белка [23•]. Lipid-tethered формы Hh обнаруживают 30-кратное увеличение потенции по сравнению с немодифицированными растворимыми белками.
Более того у Drosophila, the cholesterol-modified Hh amino-терминальный фрагмент ассоциирует специфически с sphingolipid/cholesterol-обогащенными множественными (raft) микродоменами на клеточной поверхности [24•]. Эти структуры играют важную роль в сортировке поляризованных белков и в передаче сигналов [25]. Липидные rafts действуют, по-видимому, как платформы для локальной концентрации и активации сигнальных молекул и их рецепторов, таких как Ephrins, immunoglobulin E, T-клеточные рецепторы и др. ([25]; reviewed in [26]). Таким образом, стерольная модификация Hh м.б. новым механизмом таргетинга сигнального белка в raft мембран (оболочек). Предполагается, что и передача сигналов Hh и поляризованный внутриклеточный транспорт должны
обеспечиваться с помощью этих липидных паромов (rafts), где Hh должен ассоциировать с GAGs (которые необходимы для диффузии Hh, опосредованной rafts). Согласуются с этой идеей эксперименты на Drosophila, которые показали, что ttv функция необходима для диффузии cholesterol-модифицированного Hh amino-терминального фрагмента
Wnt signalling
В противоположность взаимодействию Hh–Ptc, где рецептор ограничивает диффузию лиганда, связывание Drosophila Wnt белка Wingless (Wg) со своим рецептором, Drosophila frizzled 2 (Dfz2) [29] [30•], стабилизирует Wg в крыловом имагинальном диске. Эта стабилизация позволяет Wg диффундировать дальше от своего источника [31••], которым является дорсо-вентральная граница имагинального диска. Интересно, что Wg репрессирует Dfz2 транскрипцию, создавая тем самым градиент Wg нестабильности , где Wg становится все более нестабильным, чем дальше от своего источника. Это взаимодействие оформляет Wg градиент [31••], который отвечает за спецификацию дорсо-вентрального паттерна в имагинальном диске. Таким образом, лиганд (Wg) по-видимому, контролирует свои собственные пределы действия путем репрессии экспрессии рецептора (Dfz2), который его стабилизирует. Рецептор, по-видимому, влияет на скорость диффузии Wg и тем самым обеспечивает дифференциальную стабильность Wg белка.
Ингибирование передачи сигналов Wnt с помощью внеклеточных факторов обеспечивается секретируемым семейситвом Frizzled-related protein (sFRP)[32] [33] [34] [35] [36] [37] [38] [39] [40•], члены которого имеют amino-терминальный CRD домен с высокой гомологией с лиганд-связывающим доменом белков Frizzled. sFRPs содержит также область сходную с нетринами (netrins), семейством секретируемых факторов, участвующих в ведении аксонов. Разные sFRPs имеют разное сродство к специфическим Wnts [41], а некоторые Wnts индуцируют экспрессию sFRPs, которые могут специфически их ингибировать [42]. Более того, описана доминантная негативная форма Wnts [43]и некоторые естественно возникшие формы могут действовать как ингибиторы других членов семейства, или в результате конкуренции за одни и те же рецепторы или действуя через более косвенные механизмы [44].
Описаны два других внеклеточных антогониста пути Wnt. Ген dickkopf-1 (dkk-1) кодирует секретируемый фактор, который достаточен и необходим для индукции головы у Xenopus [45••]. Dkk-1 является мощным антогонистом сигнального пути Wnt . dkk-1 ген является членом вновь идентифицированного семейства [46], которое включает, по крайней мере, 3 гена у Xenopus и которое присутствует и у других организмов. Связь Dkk-1 с Wnt белками или Wnt рецепторами пока не установлена, однако эксперименты по ко-экспрессии с др. компонентами Wnt пути показывают, что Dkk-1, по-видимому, блокирует Wnt путь путем взаимодействия с Wnt или его рецепторами. Другой белок, Wnt-inhibitory factor-1, соединяется с Wnt белками (по крайней мере Drosophila Wg и Xenopus Wnt-8), и ингибирует их активность [47•]. Wnt-inhibitory factor-1 обнаружен у рыб, амфибий и млекопитающих.
Wnt лиганды проходят секреторный путь и ассоциируют с компонентами внеклеточного матрикса. Эксперименты на Drosophila показали, что протеогликаны могут модулировать передачу сигналов Wg [48] [49] [50], возможно контролируя его диффузию и облегчая связывание его с рецепторами. Ген Drosophila division abnormally delayed (dally) кодирует член glypican семества интегральных мембранных протеогликанов и действует как ко-рецептор Wg, вместе с Dfz2 .
Добавочный способ регуляции осуществляется на уровне контроля движения Wg. Белок Wg активно транспортируется между и поперек клеток с помощью процесса, нуждающегося в endocytic компонентах. Эта форма движения называется трансцитоз (transcytosis) и направляется латерально в плоскости поляризованного эпидермального эпителия и, следовательно, отличается от ранее охарактеризованного apical–basal трансцитоза через поляризованные эпителиальные клетки [51].
Некоторые рецепторы TGFβ модулируют концентрационные градиенты своих лигандов. Напр., в крыловых имагинальных дисках Drosophila высокий уровень Dpp редуцирует экспрессию своего рецептора типа I, Thick veins (Tkv), который последовательно экспрессируется на все более высоком уровне, чем дальше от источника Dpp. Tkv ограничивает распространение Dpp, модулируя тем самым градиент Dpp [53••] [54••], который организует формирование передне-заднего паттерна крылового диска. В этом отношении пара Dpp–Tkv ведет себя сходно с Hh–Ptc (оба рецептора и трансдуцируют сигнал и ограничивают его распространение). Другой рецептор типа I, Saxophone (Sax), синергично усиливает передачу сигналов Tkv у ранних эмбрионов [55••] и в имагинальных дисках [54••].
Активность факторов TGFβ регулируется негативно различными секретируемыми белками, которые предупреждают их взаимодействие с их рецепторами (reviewed in [56]). Гликопротеин Follistatin предупреждает связывание Activin с его рецептором и способен также antagonize передачу сигналов BMP [57]. Chordin [58] [59] и Noggin [60] [61] [62], хотя структурно несходны, однако оба связывают BMPs (а не TGFβ или Activin), предупреждая их взаимодействие с рецепторами клеточной поверхности [63] [64]. Chordin и Noggin продуцируются Шпемановским организатором (reviewed in [65]), сигнальным центом на дорсальной губе Xenopus бластопора гаструлы и также играют важную роль в развитии других организмов. Описано новое семейство секретируемых белков, которые antagonize активность BMP, включая Gremlin [66•], Cerberus [67] [68••], Dan [69] [70],и др. [70] [71] [72] [73] [74]. Эти факторы блокируют передачу сигналов BMP с помощью белков, связывающих ВМР, [66•] [68••] а их домен экспрессии в эмбрионе включает места, где ингибирование ВМР важно для развития [71] [72] [75]
В некоторых системах BMPs, по-видимому индуцируют экспрессию некоторых из своих внеклеточных ингибиторов в соседних клетках [76] [77], которые образуют петлю обратной связи, которая ограничивает активность BMPs для спецификации регионов эмбриона.
Так, продукт гена dally необходим для нормальной передачи сигналов Dpp во время развития [82]. Эктопическая экспрессия dally может усиливать паттерн-формирующую активность Dpp, указывая на роль dally в модулировании силы пераваемых сигналов Dpp. Неизвестно как glypicans взаимодействуют с Dpp; они могут связываться с Dpp прямо или влиять на активность внеклеточных ферментов, которые регулируют его. Белок сходный с Dally, димерный интегральный мембранный гликопротеин Endoglin/CD105, который соединяется в некоторыми TGFβ лигандами и который может действовать как акцессорный белок множественного киназного рецепторного комплекса TGFβ сверхсемейства [83], облегчая связывание лиганда или накопление лиганда вблизи рецепторов.В целом, эндоглин и beta-glycans рассматриваются как рецепторы типа III, которые скорее всего не выполняют сигнальной функции, а регулируют доступность TGFβ для сигнальных рецепторов. При добавлении twist вся внеклеточная область beta-glycan м.б. shed в среду и м. действовать как TGFβ антогонист, ингибируя связывание в мембранными рецепторами [84].
Second, the Drosophila ортолог Xenopus гена chordin, idd short gastrulation (sog) — который кодирует модулятор Drosophila TGFβ лиганды Dpp и Screw — оказывает противоположные эффекты на малом и большом удалении [86••]. На коротком расстоянии Sog белок супрессирует локальную активность Dpp путем связывания ее, но на длинной дистанции Sog усиливает Dpp активность с помощью процесса,
нуждающегося в metalloprotease Tolloid. Tolloid выступает антогонистом Sog активности протеолитически расщепляя ее [87] [88] [89]. Т.о., один и тот же внеклеточный фактор (Sog) может или
супрессировать или усиливать активность Dpp в зависимости от молекулярного окружения. [86••] [90].
Conclusions
Анализ паттернов транскрипции генов, кодирующих сигнальные молекулы недостаточен для понимания сложности механизмов, которые контролируют эти сигналы.
Наконец, все рассмотренные сигнальные молекулы участвуют в канцерогенезе и других патологиях человека.