Всплеск активности в большинстве возбуждающих синапсов является результатом активации лиганд-нагруженных ионотропным нейротрансмиттером рецепторов и voltage-sensitive calcium channels (VSCC), расположенных в постсинаптических мембранах, и последующего притока Ca2+ в постсинаптический нейрон. Глютамат, основной возбуждающий нейротрансмиттер в ЦНС, активирует ionotropic и metabotropic рецепторы в постсинаптических клетках. Активация ионотропных глютаматовых рецепторов и последующих приток Ca2+ в постсинаптический нейрон необходимы для глютамат-обусловленных изменений в синаптической efficacy (действенности), включая long-term potentiation (LTP) и long-term depression (LTD), которые являются клеточными феноменами, лежащими в основе обучения и памяти. Поддержание фазы этих форм долговременных изменений в синаптической действенности нуждается в транскрипции новых генов, включая те, что выстраивают пути передачи сигналов от ионотропных глютаматовых рецепторов, расположенных в дендритах пост-синаптических нейронов до ядра, которыя обязательны для активность-зависимой пластичности.
CREB и ПЕРЕДАЧА СИГНАЛОВ ОТ СИНАПСОВ В ЯДРО
Ahn et al., (2000)
Регуляция глютаматом экспрессии генов
Активация глютаматергических синапсов in vivo м. запускать изменения в экспрессии генов в постсинаптических нейронах в течением минуты. Такие сигналы, которые купируют активацию NMDA рецепторов и ангажируют транскрипционную инициирующую машинерию, очень быстры. Это важно, когда возбужденные синапсы удалены от ядра. Например, типичные Schaffer collateral-CA1 синапсы в гиппокампе отстоят на 400 микронов от тела клетки постсинаптического СА1 нейрона. Возбуждающий нейротрнасмиттерный сигнал поступает в ядро с помощью быстро распространяющегося сигнального каскада.
CREB является медиатором экспрессии генов, зависящей от активности
во-первых, синаптическая стимуляция, так же как и применение возбуждающих нейротрансмиттеров, включая глютамат, запускает фосфорилирование Ser133 CREB.
Во-вторых, многие гены, которые вновь транскрипбируются в результате всплеска нейрональной активности, включая c-fos, zif/268, somatostatin и BDNF, содержат CREB связывающие сайты в своих вышестоящих регуляторных регионах.
В-третьих, активация глютаматергических синапсов усиливает транскрипцию CRE-lacZ трансгена in vivo.
Наконец, CREB активность является критической для образования определенных форм долговременой памяти.
Т.обр., нейротрансмиттеры активируют CREB-зависимую транскрипцию, и CREB активность является критической для повышения и понижения долговременной активность-зависимой синаптической силы, а также некоторых форм обучения.
Увеличение постсинаптического Ca2+ является инициальным триггером, ведущим к фосфорилированию CREB в глютаматергических синапсах
Активация глютаматергических синапсов ведет к фосфорилированию CREB Ser133 в течение нескольких сек. Фосфорилироваие зависит от притока внеклеточного Ca2+, поскольку оно предупреждается с помощью chelaton внеклеточного Ca2+ с помощью EGTA. При стимуляции возбудимых синапсов внеклеточный Ca2+ может поступать в нейроны через NMDA рецепторы и через VSCCs. Кроме того Ca2+ высвобождается из внутриклеточного пула, включая эндоплазматический ретикулем. Поступление Са через NMDA рецепторы и VSCCs необходимо для индукции c-fod в striatal нейронах, приток только через NMDA рецепторы необходим для индукции IEG c-fos в нейронах гиппокампа. Эти отличия с вовлечением или нет L-каналов м.б. связаны с очень большой плотностью NMDA рецепторов в нейронах гиппокампа. Последние экспреименты указывают, что и для CREB фосфорилирования в нейронах гиппокампа необходим приток Са через NMDA рецепторы и L-тип VSCCs. Итак, увеличение Ca2+ происходит во всем нейроне, включая и ядро.
Ca2+-калмодулин и CaMKIV как медиаторы синаптических сигналов для CREB
Из потенциальных CREB киназ CaMKIV привлекает наибольшее внимание. Она широко экспрессируется в нервной системе и CREB Ser133 является для нее превосходным субстратом in vitro. Более того CaMKIV, подобно CREB, располагается в основном в ядре. Но как локальное увеличение submembranous Ca2+ запускает активацию CaMKIV в ядре? Возможно, что увеличение подмембранного Ca2+ активирует активатор CaMKIV, который м. транслоцироваться из латентного пула, расположеного вблизи плазменной мембраны, в ядро. Было установлено, что электрическая стимуляция или 3-х минутная деполяризация 90mM KCl запускает транслокацию калмодулина из цитозоля в ядро. Более того эта транслокация зависит от активации как NMDA рецепторов, так и L-типа Ca2+ каналов. Так как ядерный калмодулин, по-видимому, необходим для зависимой от активности фосфориляци CREB, то остается определить является ли транслокация калмодулина обязательной для этого события фосфорилирования.
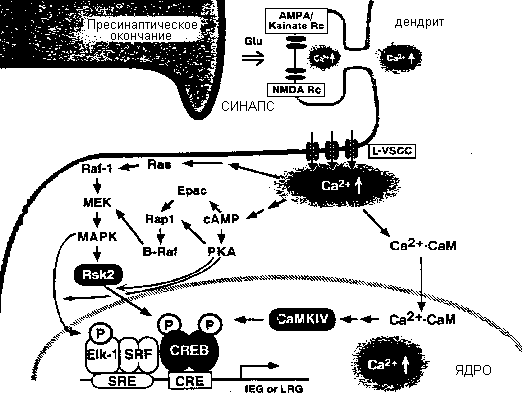
Ras/ERK путь и Ras2 как медиаторы передачи сигналов Ca2+ к CREB

Передача сигналов от возбужденных глютаматергических синапсов к СКУИ в ядре нейрона. После своего высвобождения их пре-синаптических окончаний, глютамат соединяется и активирует non-NMDA рецепторы. Последующая деполяризация мембраны вызывает высвобождение блока magnesium и активацию NMDA рецептров, лкализованных в spines дендритов. Активация NMDA рецепторов ведет к продолжительной деполяризации мембраны и активации L-типа VSCC, которые преимущественно локализованы в проксимальных частях дендритов и теле клетки постсинаптического нейрона. В результате уровень Ca2+ возрастает внутри spines, теле клетки и возможно в ядре постсинаптического нейрона. Сигнал Ca2+ проникает к CREB в ядро через транслокацию калмодулина и членов ERK-Rak пути из цитоплазмы в ядро. Кроме того ядерный Ca2+ может регулировать фосфорилирование CREB более непосредственно путем активации ядерного калмодулина и CaMKs, таких как CaMKIV. Обозначение: Epac (exchange protein directly activated by cAMP).
Помимо активации СаМК приток кальция иницирует верию событий ведущих к активации Ras-ERK пути и подобно CaMKIV пути этот путь также связан с притоком Ca2+ и фосфорилированием CREB в нейронах гиппокампа. Этот путь в первичных нейронах гиппокампа ведет к деполяризации мембраны с помощью KCl. Эта деполяризация и приток Ca2+ способствуют транслокации CREB киназы Rsk2 в ядро, которая является основной Ca2+-регулируемой CREB киназой в нейронах гиппокампа. РКА, по-видимому, модулирует активность Ras-ERK пути, способствуя поступлению в ядро ERK или Rsk2 или путем усиления активации ERK с помощью B-Raf.
Как и транслокация калмодулина, транслокация ERKs и Rsk киназ в ядро м.б. критической ступенью, связанной с субмембранозным повышением Ca2+ и фосфорилированием CREB. Предполагается, что транслокация калмодулина и активация CaMKIV в ядре необходимы для форсфорилирования CREB в течение нескольких секудн посли притока Ca2+, тогда как транслокация ERK/Rsk комплекса обеспечивает форсфорилирование CREB в течение последующего времени, после 5 мин. после притока кальция.
РЕТРОГРАДНАЯ ПЕРЕДАЧА СИГНАЛОВ ФАКТОРОВ РОСТА к CREB в НЕЙРОНАХ
Нейротрофиновые сигналы распространяются от окончаний аксонов к ядру
NGF, который поддерживат жизнеспособность и рост симпатических и кожных нейронов малого диаметра. Cholinergic differentiation factor (CDF) является инструктивным сигналом, который способствует переключению фенотипа нерйротрансмиттеров в субпопуляциях постганглиолярных симпатических нейронов из адренергических к холинергическим. Свойством мишенью-продуцируемых ростовых факторов является их способность инициировать сигнал внутри окончаний аксона, который распространяется ретроградно в тело клетки, которое м.б. расположено на расстоянии сантиметра и боьлее от окончаний аксона. И NGF и CDF могут действовать на дистальные аксоны, контролируя ключевые регуляторные события далеко в теле клетки, включая транскрипцию генов в ядре. Как биохимический сигнал, сгенерированный в кончиках дистальных аксонов достигает тела клетки и ядра нейрона
Нейротрофины осуществляют свои эффекты путем взаимодействия с членами семейства Trk рецепторных тирозин киназ и структурно несвязанного рецептора р75LNGFR. TrkA является критическим сигнальным рецептором для NGF.
После связывания NGF рецппторы TrkA гомодимеризуются и аутофосфорилируют многие остатки тирозина. Автофорсфорилирование выполняет 2 функции: (а) автофорсфорилирование тирозиновых остатков в каталитической петле усиливает всю киназную активность рецепторов, (б) TrkA фосфотирозиновые остатки являются docking сайтами для TrkA эффекторов, которые рекрутируются на внутренней поверхности мембраны (оболочки). После связывания доменов SH2 или РТВ фосфорилированных ЕклФ рецепторов с внутриклеточными сигнальными белками, такими как PLC-γ, Shc, SH2-B и rAPS. Некоторые из Trk эффекторов обладают ферментативной активностью, тогда как другие, такие как Shc, являются адапторами, которые привлекают добавочные эффекторы, включая Gbr2 к плазменной мембране. Таким образом, ряд различных Trk эффекторных молекул распространяет внутриклеточные сигналы, которые поддерживают рост и жизнеспособность.
Реакция ядер на NGF-зависимые ретроградные сигналы
Неожиданным оказалось, что CREB является критической мишенью нейротрофиновых сигналов. Фосфорилирование CREB при этом нуждается в NGF активации транскрипции immediatele early gene (IEG) c-fos. Так как большинство нейротрофином регулируемых генов содержат сайты связывания CREB в вышестоящих регулятоных областях, то CREB скорее всего является медиатором общего ответа ядер на нейротрофины. NGF активация CREB- зависимой транскипции необходима для выживания симпатических нейронов, по крайней мере частично, через регуляцию экспрессии генов выживания, таких как, bcl-2. Более того, NGF, действуя на его рецепторы, расположенные на дистальных аксонах инициирует сигнал, который ретроградно распространяется в ядро, где он запускает фосфорилированеие Se133 CREB и экспрессию CREB-подчиненных генов.
Некоторые модели ретроградной передачи сигналов в развивающихся нейронах
Согласно одной модели NGF связывается с рецепотрами на окончаниях аксонов, которые ретроградно распространяются в ядро. Согласно другой модели, NGF интернализуется в дистальной части аксона и ретроградно транспортируется в тело клетки, где активирует свои рецепторы, при этом оказывает влияние на путь передачи сигналов, который способствует росту и выживанию. Третья модель базитуется на том, что NGF-TrkA рецепторный комплекс, формируется в дисталных частях акснонов, интернализуется и подвергается ретроградному транспорту в тело клетки. Предпочтение отдается последней модели сигнальных эндосом.
Подтверждение модели сигнальных эндосом
Установлено, что NGF ретроградно транспортируется в нейрон со скоростью примерно 2.5 мм/ч; однако in vitro выявлена скорость транспорта в 20мм/ч. Кроме того инъекции антител против NGF в тело нейрона не блокируют передачи сигналов NGF. Следовательно, если NGF и является компонентом передачи сигнала, то он один не может объяснитеть ретроградной педачи сигналов.
TrkA также транспортируется ретроградно. Фосфорилированные Trk рецепторы накапливаются дистальнее перевязки. Предполагается, что он перемещяется в бысто транспортируемых пузырьках или с помощью независимого от пузырьков механзма.
Получены доказательства в пользу идеи ретроградного транспорта NGF-TrkA комплекса.
1) NGF ковалентно связывается с кусочки большого диаметра, которые не могут быть интернализованы и ретроградно транспортироваены.
2) Установлено, что фосфорилированный TrkA рецептор интернализуется сам в дистальных частях акснонов и ретроградно транспортируется в тела симпатических нейронов при этом он физически ассоциирован с транспортируемым NGF.
3) интернализованный P-TrkA ко-локализуется с с везикулярными белками, такими как клатрин.
4) фармакологическое ингибирование каталитической активности TrkA в теле клетки, хотя в дистальной части аксона она сохраняется нормальной, полностью блокирует ретроградную передачу сигналов к CREB.
Механизм ретроградного везикулярного транспорта в нейронах
PI3K м. вность вклад в лиганд-зависимую интернализацию TrkA. Кроме того рецептолр низкого сродства р75 м. играть роль в формировании и интернализации комплекса NGF-TrkA. Так как LIF м. ретроградно транспрортироваться в нейронах и т.к. он способствует сдвигу от адренергического к холинергическому фенотипу при воздействии на дистальную часть аксона симпатического нейрона, то остается определить м. ли LIF или CNTF ретроградно котранспортироваться с NGF-TrkA рецепторным комплексом с помощью везикулярного транспортного механизма.
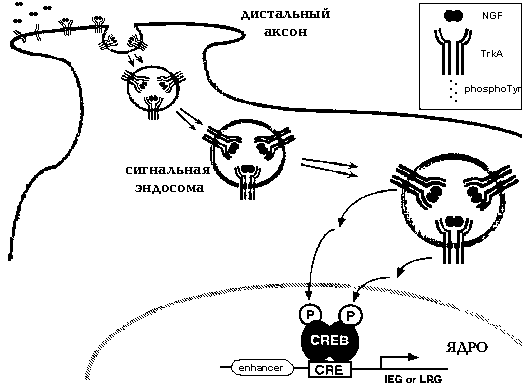

Ретроградная передача сигналов с нейротрофиновых рецепторов на дистальных частях аксонов к СКУИ в яджре нейрона. Происходящие из мишени ростовые факторы<, такие как NGF, связываются со своими рецепторами, расположенынми на поверхности дистальной части аксона. Модель передачи сигналов с помощью эндосом предполагает, чт о продуцируемый мишенями ростовые факторы соединяяясь с рецепторынм комплексом интернализуется (втягивается внутрь) и ретроградно транспортируется в тело клетки. Достигнуь тела клетки лиганд-рецепторный комплекс передает сигналы к CREB и другими ядерными мишеням. Доказательства, представленные в тексте подтвердаютс эту модель.