Посещений:  СПЕЦИФИЧНЫЕ ДЛЯ БЕРЕМЕННОСТИ ГЛИКОПРОТЕИНЫ
СПЕЦИФИЧНЫЕ ДЛЯ БЕРЕМЕННОСТИ ГЛИКОПРОТЕИНЫ
Регуляция взаимодействий плод-мать
|
|
Pregnancy-specific glycoproteins: complex gene families
regulating maternal-fetal interactions TOM MOORE
and GABRIELA S. DVEKSLER  Int. J. Dev. Biol. 58: 273-280 (2014)
doi: 10.1387/ijdb.130329gd |
The pregnancy-specific glycoproteins (PSGs) are the most abundant trophoblastic proteins in maternal blood during human pregnancy and they appear to be exclusive to species with hemochorial placentation. There are ten protein-coding human PSG genes (PSG1 - PSG9, PSG11) and also multiple PSG genes in non-human primates, rodents and bats. Several studies indicate that PSGs have immunoregulatory, pro-angiogenic, and anti-platelet functions. Some PSGs have been shown to bind different moieties on the surface of cells, including the tetraspanin CD9, heparan sulphate, and specific integrins. Recently, PSG1 was shown to associate with and activate the anti-inflammatory cytokines transforming growth factor (TGF)-b1 and TGF- b2 making PSG1 one of the few known biological activators of these important cytokines. TGF-bs regulate many biological processes essential for pregnancy success including trophoblast invasion and proliferation, angiogenesis, extracellular matrix formation and tolerance to the fetal semi-allograft. As summarized in this review, progress has been made in recent years towards a better understanding of the functions of these proteins which were originally described in the early 1970s, but more research will likely contribute to demonstrate their importance for a successful pregnancy.

|
Семейства генов Pregnancy-specific glycoprotein (PSG) и близко родственные Carcinoembryonic antigen cell adhesion molecule (CEACAM) являются членами сверхсемейства иммуноглобулинов (Ig) (Kammerer & Zimmermann, 2010). Родоначальный ген для CEACAM/PSG, как полагают, является общим приматам и грызунам, но последующие удвоения генов привели к существенным различиям структуры, экспрессии и функции белка (Kammerer & Zimmermann, 2010, Rudert et al., 1992). CEACAMs преимущественно это белки, закрепленные на клеточной мембране, тогда как все PSGs секретируются (Kammerer & Zimmermann, 2010). Однако, CEACAMs и PSGs обладают некоторыми общими структурными свойствами. И CEACAMs, и PSGs кодируются мультигенными семействами и оба семейства белков имеют N-терминальный домен, подобный вариабельному Ig, и варьирующее количество доменов подобных константным Ig (Kammerer & Zimmermann, 2010, McLellan et al., 2005a, Rudert et al., 1992). Имеется 12 у человека и 15 у мышей генов CEACAM, которые широко экспрессируются в нормальных и опухолевых тканях (Hammarstrom, 1999, Kuespert et al., 2006, Zebhauser et al., 2005). Структурный и функциональный анализ показал, что внеклеточные домены CEACAM участвуют в гомотипической и гетеротипической адгезии, а цитоплазматические домены участвуют в сигнальной трансдукции (Huang et al., 2013, Kammerer & Zimmermann, 2010, Obrink, 1997). Благодаря их экспрессии в эпителии и иммунных клетках члены семейства CEACAM действуют как рецепторы патогенов, которые могут оказывать существенное влияние на эволюцию семейства CEACAM (Chang et al., 2013, Kammerer & Zimmermann, 2010).
Сегодня известны 10 и 17 кодирующих белки PSG генов у человека и мыши, соотв. (Kammerer & Zimmermann, 2010, McLellan et al., 2005a). Филогенетическое распределение и экспрессия PSGs более ограничена, чем у CEACAMs, и эволюционное селективное давление, управляющее экспансией и диверсификацией семейства, д. быть отличным от такового для CEACAMs (Ball et al., 2004, McLellan et al., 2005a, Wynne et al., 2006, Zhou et al., 1997).
PSG locus, gene and protein structure
PSG гены собраны в кластер на хромосоме 19q13 у человека и на проксимальной части хромосомы 7 у мыши. 10 белок-кодирующих PSG генов человека, PSG1 - PSG9, и PSG11 (PSG10 является некодирующим псевдогеном), выстраиваются внутри геномного региона в 0.55 Mb (www.ensembl.org, Teglund et al., 1994). Мышиный локус примерно в 1.74 Mb и содержит 6 Psg генов на диске A2 хромосомы и 11 генов на диске A3, последний фланкирован неродственными генами Mill1 и Mill2; мы отметили, что последовательность генов в Psg локусе, описанная McLellan et al., (2005a) не аккуратна и корректировали карту, которая доступна на www.ensembl.org.
Человеческие и мышиные локусы содержат разные CEACAM и PSG псевдогены и некодирующие РНК (Kammerer & Zimmermann, 2010, www.ensembl.org). Взаимоотношения ортологов не могут быть определены между человеческими и мышиными PSG генами, это указывает на то, что эти кластеры генов развиваются независимо из общего родоначальника (McLellan et al., 2005a), хотя связи ортологов могут быть определены для субнаборов мышиных и крысиных PSGs (T. Moore & colleagues, unpublished). Человеческие PSG гены, по-видимому, обладают высоким уровнем вариаций в числе копий, быстрым расхождением кодирующих последовательностей и относительно высокой частотой трансформаций генов между членами разных PSG семейств по сравнению со средней в геноме (Chang et al., 2013, Dumont & Eichler, 2013).
Организация доменов в человеческих и мышиных PSG белках обнаруживает выраженную дивергенцию (see Fig. 1). Человеческие PSGs содержат один Ig variable-like домен (N) и обычно три Ig constant-like домена (Ig C2-подобных домена типа A или B), и относительно гидрофильный хвост (www.carcinoembryonic-antigen.de, McLellan et al., 2005a). Особенно на С-конце. Однако, многие из них плохо охарактеризованы и могут отражать cloning and annotation редкие, не относящиеся к делу функциональные варианты. Напротив, крысиные PSGs обычно имеют три или более Ig variable-like (N) доменов, сопровождаемых одиночным Ig constant-like (A) доменом (McLellan et al., 2005). Все 8 PSGs крыс, за исключением PSG36 (N1-N2-N3-N4-N5-A), являются состоящими из N1-N2-N3-A доменов (McLellan et al.,
2005b). Семейство белков Psg мыши имеет 17 членов, 14 из которых с тремя N-доменами и одиночным A-доменом (N1-N2-N3-A) и три - Psg24, Psg30 и Psg31, которые имеют расширенную структуры, создаваемую удвоениями доменов, такие как: Psg24 (N1-N2-N3-N4-N5-A), Psg30 (N1-N2-N3-N4-N5-N6-N7-A) и Psg31, который имеет недавно удвоенный N1 домен и расположение доменов N1-N1-N2-N3-N4-N5-N6-N7-A) (McLellan et al., 2005a). Однако, несмотря на эти структурные различия, имеются доказательства, что человеческие PSG N-домены и
мышиные N1-домены имеют консервативную структуру, как показывает ветвление мышиных N1-доменов и человеческого N-домена, с предпочтением к мышиным N2 и N3-доменам в филогенетическом древе (McLellan et al., 2005b). Это согласуется с очевидной консервацией функций человеческих и мышиных PSG белков в регуляции иммунной и сосудистой систем (see below). Общий родоначальник человеческих и мышиных CEACAMs и PSGs скорее всего сходен с CEACAM1, единственным членом семейства с гомологичной структурой гена у человека, крысы и мыши, который кодирует все типы внеклеточных доменов, присутствующих у CEACAM и PSG белков (McLellan et al., 2005a, Rudert et al., 1992, Teglund et al., 1995).
PSG expression pattern
PSGs могут быть наиболее многочисленными из белков трофобласта в материнской крови во время беременности женщины. В материнской сыворотке их уровень увеличивается по ходу беременности до 200-400 mg/ml при родах, намного превосходя уровни др. хорошо известных плацентарных гормонов, таких как chorionic gonadotropin у человека (Lee et al., 1979, Lin et al., 1974, Towler et al., 1976). Мышиные Psg не обладают, по-видимому, сходными высокими уровнями экспрессии (J. Baensinger, Pers. Commun.). В первой половине беременности у мыши экспрессия Psg мРНК представлена почти полностью Psg22 экспрессируемым в гигантских клетках трофобласта (Blois et al., 2012, Wynne et al., 2006); однако субнабор мРНК Psg экспрессируется на высоком уровне в спонгиотрофобласте во время второй половины беременности у мышей, при этом Psg16, Psg21 и Psg23 мРНК оказывались особенно многочисленными (Ball et al., 2004, Kromer et al., 1996, Wynne et al., 2006). Принимая во внимание большие количества PSG генов у человека и доказательства быстрой эволюции в этом локусе (Chang et al., 2013, Dumont et al., 2013), паттерн экспрессии PSG, по-видимому, удивительно постоянен в индивидуальных выборках: в серии выборок плаценты при беременности двумя самцами и двумя самками, PSG1 и PSG3 предоставляли большую часть экспрессии в конце первого триместра, тогда как PSG1, PSG3, PSG4, PSG5 и PSG6 экспрессировались приблизительно одинаково при родах с относительно низкой экспрессией др. PSGs (Shanley et al., 2013). Человеческие PSG транскрипты и белки увеличивались в клетках трофобласта, подвергающихся дифференцировке (Aronow et al., 2001, Camolotto et al., 2010). Однако сообщения, что PSGs секретируются культивируемыми преимплантационными эмбрионами человека, д. быть поставлено под сомнение, учитывая очевидное отсутствие PSG
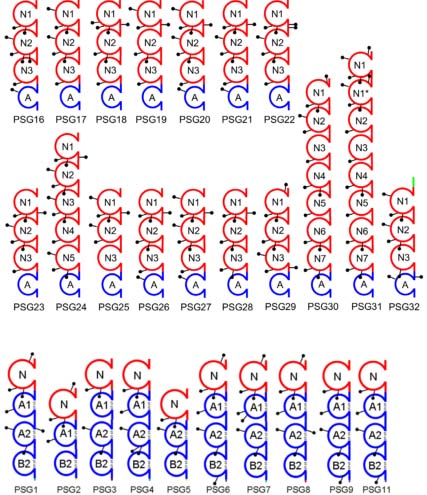 Fig. 1. Structures of mouse (PSG16 - PSG32) и human (PSG1 -
PSG9, PSG11) PSG proteins. (Adapted from McLellan et al., 2005, and
http://www.carcinoembryonic-antigen.de/index.html). Red color-coded 'N'
domains are Ig variable-like domains, и blue 'A' и 'B' domains are Ig
constant-like domains. Black 'lollipops' indicate potential N-linked glyco-
sylation sites. Note that atypical amino и carboxy terminal sequences
are also color-coded.
Fig. 1. Structures of mouse (PSG16 - PSG32) и human (PSG1 -
PSG9, PSG11) PSG proteins. (Adapted from McLellan et al., 2005, and
http://www.carcinoembryonic-antigen.de/index.html). Red color-coded 'N'
domains are Ig variable-like domains, и blue 'A' и 'B' domains are Ig
constant-like domains. Black 'lollipops' indicate potential N-linked glyco-
sylation sites. Note that atypical amino и carboxy terminal sequences
are also color-coded.
транскриптов в недавней базе данных RNA-seq по эмбрионам человека преимплантационной стадии (Dimitriadou et al., 1992, T. Moore & K. Niakan,
unpublished observations). Мы подтвердили, что антитела, используемые в некоторых ранних исследованиях экспрессии PSG были не специфическими для PSGs и что экспрессия начинается с дифференцировки синцитиотрофобласта, как подтверждают исследования дифференцировки цитотрофобластов in vitro, и линия клеток JEG-3 (Aronow et al., 2001, Camolotto et al., 2010). Имеются некоторые доказательства экспрессии PSG в не трофобластных тканях; однако большинство старой литературы переоценивает степень экспрессии PSG во взрослых тканях из-за технических причин, таких как использование плохо оцененных антител или сообщений о редких или аберрантных транскриптах из библиотеки кДНК.
Напротив, более недавнее исследование сообщило о усилении активности PSG9
в колоректальном канцерогенезе (Salahshor et al., 2005), а использование панели новых хорошо охарактеризованных моноклональных антител к PSG1, обнаружило экспрессию PSG в кишечном эпителии (T. Moore & colleagues, unpublished observations).
Мышиные Psg17, Psg18 и Psg19 мРНК были найдены с использованием RT-PCR в плаценте и объединенных эмбриональных тканях, но не в тканях взрослых (Kromer et al., 1996). Однако, Psg18 мРНК и белок были впоследствии найдены в эпителии, ассоциированном с фолликулами, лежащим поверх Peyer's участков у мышей (Kawano et al., 2007), a специфичных для головного мозга Psg16 транскрипт описан (Phillips et al., 2012), подтверждая, что некоторые PSGs может выполнять специфическую функцию во взрослых тканях.
PSG gene transcriptional regulation
Относительно мало известно о регуляции экспрессии PSG. Регион, стоящий выше гена PSG5 является сайтом старта транскрипции он был охарактеризован и учитывая сходство с регионом паралогом до PSG генов, эти исследования могут быть приложимы к пониманию регуляции всего семейства (Blanchon et al., 2006, Chamberlin et al., 1994, Nores et al., 2004). Промоторы человеческих PSG генов лишены обычного TATA бокса, типичного элемента инициатора, или регионов, богатых ГЦ (Frangsmyr et al., 2000, Panzetta-Dutari et al., 1992). Экспрессия PSG5 зависит от сайта связывания повсеместного specificity protein 1 (Sp1) в минимальном регионе сердцевины промотора всех PSGs человека. Этот SP1 сайт активирует конструкцию промотора PSG5 и SP1 экспрессируется совместно с PSGs в синцитиотрофобласте (Nores et al., 2004). используя трансфекции PSG5 промотор-репортер и ChIP анализ, было показано, что Kruppel-like factor 4 (KLF4) является активатором промотора PSG5 путем соединения с консенсусным сайтом сердцевины промотора (Blanchon et al., 2006). Kruppel-like factor 6 (KLF6), как было установлено, промоторы PSG3 и PSG5 генов в клетках
JEG-3, это ещё больше подтверждает важность роли семейства KLF транскрипционных факторов в регуляции генов PSG (Racca et al., 2011). Кроме того, retinoic acid response element (RARE)/CACCC box composite element высоко законсервирован в стержневой части промотора всех PSG генов человека. В соответствии с ролю этого элемента в экспрессии PSG, было установлено, что RXRα соединяется с сердцевиной промотора PSG5, а 9-cis retinoic acid (RA) индуцирует экспрессию PSG5 в JEG-3 клетках (Lopez-Diaz et al., 2007). Сходным образом, RARE сайт в промоторе PSG3 необходим для базовой активности промотора (Camolotto et al., 2010). Эти наблюдения согласуются с известной ролью производных ретиноевой кислоты (RA) и их рецепторов (RAR и RXR) в развитии плаценты (Sapin et al., 1997, Yan et al., 2001). Промотор PSG3 содержит также предполагаемый сайт связывания для из Ets семейства транскрипционных факторов GA-binding protein (GABP). Этот сайт связывания, как было установлено, участвует в активации гена PSG3 во время дифференцировки трофобласта (Camolotto et al., 2010). Др. член семейства Ets (PEA3) сходным образом участвует в экспрессии многих PSGs человека (Chamberlin et al., 1994).
Было предположено, что PSG5, и возможно все PSGs, могут регулироваться путем освобождения от транскрипционной репрессии. Стержневая часть промотора PSG5 управляет транскрипцией репортеров в разных типах клеток, тканеспецифичная экспрессия может быть обусловлена с помощью репрессивных факторов, соединяющихся с дальнейшими вышестоящими последовательностями по отношению к точке старта транскрипции (Panzetta-Dutari et al., 2000). Интересно, что индукция репликативного старения клеток HeLa путем воздействия 5-bromodeoxyuridine приводит к усилению активности всех PSGs; скорее всего, нормальные фибробласты человека подвергаются репликативному старению (Minagawa et al., 2005, Endoh et al., 2009). Мы подтвердили, что репликативное старение может воспроизводить некоторые аспекты окончательно дифференцированных клеток клона трофобласта, такого как синцитиотрофобласт, приводя в результате к экспрессии PSG.
Транскрипционная регуляция мышиных Psg генов действительно не изучена. Однако экспрессия и Ceacam и Psg генов существенно ослаблена в плацентах мышей, нокаутных по Inositol requiring enzyme-1a (IRE1a) и X- box binding protein 1 (XBP1), которые участвуют в стрессовых реакциях эндоплазматического ретикулума (ER) и в развитии плаценты (Oikawa et al., 2010). Воздействие на SM10 клетки трофобласта с помощью thapsigargin, ER stressor, активирующего путь IRE1a-XBP1, или избыточная экспрессия IRE1a или XBP1 дикого типа, усиливает активность Psg18 и Psg28. Используя делецию промотора Psg28 идентифицировали два региона, чья делеция снижает ответную реакцию, но специфический сайт связывания для XBP1 не был идентифицирован (Oikawa et al., 2010).
PSG receptors
Поскольку клеточные рецепторы для всех членов семейства PSG ещё предстоит идентифицировать, достигнут некоторый прогресс в идентификации молекул, которые связывают PSGs на клеточной поверхности некоторые мышиные PSGs и человеческий PSG1. Мышиные PSG17 и PSG19 соединяются с CD9 (Ha et al., 2008, Waterhouse et al., 2002). CD9 является членом семейства tetraspanin, который состоит из 4-х трансмембранных доменов, заканчивающихся двумя внеклеточными петлями или доменами (Charrin et al., 2009). Более 30 разных tetraspanins идентифицированы у человека и мыши. Пока только взаимодействие между PSG и семейством tetraspanin было описано, для мышиных PSG17 и PSG19 с внеклеточным доменом 2 в CD9 (Ellerman et al., 2003). Пока мы не нашли доказательств взаимодействия между мышиными PSG22 и PSG23 или человеческим PSG1 с CD9, но взаимодействуют ли др. члены семейства PSG с CD9 или др. tetraspanins предстоит выяснить. Экспрессия CD9 в макрофагах необходима для способности белка, состоящего из N-терминального домена PSG17, индуцировать секрецию цитокинов этими клетками, указывая, что взаимодействие PSG17-CD9 имеет физиологические последствия (Ha et al., 2005).
Недавно человеческий PSG1 и мышиные PSG17, PSG22 и PSG23, как было установлено, взаимодействуют с heparan sulfate (Blois et al., 2012, Lisboa et al., 2011, Sulkowski et al., 2011). Эти взаимодействия были продемонстрированы методом в твердой фазе с помощью affinity chromatography и анализа FACS с использованием клеток Chinese hamster ovary (CHO), лишенных поверхностной экспрессии glycosaminoglycans (GAGs) heparin или chondroitin sulfate. Кроме того, эти PSGs соединялись с pre-B линией клеток Namalwa только, когда клетки линии были трансфицированы syndecans или glypican-1, белками клеточной поверхности, которые содержат GAG цепочки (Lisboa et al., 2011). Недавно мы также определили, что человеческий PSG9 соединяется с трансфицированными синдеканом клетками Namalwa, но не с родительской линией клеток, указывая, что подобно PSG1 и мышиным PSGs-17, 22 и 23, PSG9 соединяется с GAGs (Dveksler, unpublished data).
Помимо связывания heparan и chondroitin sulfate, недавнее исследование показало, что PSG1 взаимодействует с членами семейства интегринов. Трипептидная последовательность Arg/Gly/Asp (RGD) найдена в N домене большинства человеческих PSGs, это ведет к предположению, что PSGs, подобно дезинтегринам змеиного яда, могут соединяться с интегринами и разрушать взаимодействия между клетками и внеклеточным матриксом или модифицировать др., обеспечиваемые интегринами функции, облегчая тем самым инвазию трофобласта в материнскую ткань (Rutherfurd et al., 1995). Гипотеза disintegrin была подтверждена эволюционным анализом, подтвердившим консервацию RGD-подобных трипептидов в гомологичной позиции мышиных Psg N1 доменов (McLellan et al., 2005b).
В частности мышиные Psg N1 домены не обладают RGD трипептидным мотивом, но содержат последовательность RGD-подобного мотива, которая не обнаруживается в N2 и N3 доменах (Rudert et al., 1992, McLellan et al., 2005b). Кроме того, PSG1 содержит KGD трипептидный мотив, перекрывающийся с одним из остатков вне фазы с 'RGD' позицией, подтверждая аналогию с дезинтегином змеиного яда barbourin, который специфически ингибирует связывание fibrinogen с α IIbβ3 интегрином тромбоцитов, обеспечиваемое с помощью мотива KGD (Scarborough et al., 1991). Все протестированные PSGs (PSG1, PSG9 и мышиный Psg23) ингибируют взаимодействия тромбоцитов с фибриногеном, подтверждая анти-тромбоцитарную функцию PSGs (Shanley et al., 2013). PSG1 соединение с интегрином α IIbβ3 не приводит к передаче сигналов, указывая, что единственной функцией связывания PSG, по-видимому, является ингибирование связывания фибриногена (Shanley et al., 2013). Однако способ связывания PSG1 с интегрином сложен и мутации последовательности KGD или делеция всего N домена не устраняет эту функцию, подтверждая, что более чем один белковый домен PSG1 могут независимо обеспечивать связывание (Shanley et al., 2013).
Предварительные исследования Dveksler лаб. показали, что β1 integrin обеспечивает слипчивость эндотелиальных клеток и линии трофобластных клеток (HTR-8) с покрытыми PSG1 ямками (wells). Некоторые члены семейства интегринов, включая α5β1, α vβ3 и α IIbβ3 участвуют в модуляции миграции, инвазии и адгезии трофобластов и также регулируют взаимодействие внутрисосудистых трофобластов с эндотелиальными клетками (Harris et al., 2009, Rout et al., 2004). Необходимы дальнейшие исследования, чтобы идентифицировать интегриновые цепочки, которые вместе с β1 субъединицей интегрина участвуют в адгезии с PSG1, и физиологическое значение этого взаимодействия. Др. человеческие PSGs д. потенциально взаимодействовать с интегринами, это предполагается, исходя из присутствия RGD трипептидной последовательности в N-домене некоторых человеческих PSGs, за исключением PSG1, 4 и 8. Сегодня, однако нет доказательств взаимодействия N-терминального домена, содержащих RGD, PSGs с интегринами. Более того, мы не имеем доказательств, что N-терминальный домен участвует во взаимодействии PSG1-b1 integrin, которое наблюдается с рекомбинантным PSG1, содержащим все 4 домена, а также рекомбинантный белок, содержащий just 3 домены (N, A2, и B2).
PSGs и angiogenesis
Успешность беременности у млекопитающих базируется на пространственно-временной координации нескольких сосудистых процессов на границе раздела между плодом и матерью. Во время нормальной беременности увеличение кровотока в плаценте является критическим для роста и жизнеспособности плода. Этот повышенный кроваток обеспечивается ангиогенезом, расширением сосудов и ремоделированием сосудов. Плацентарные трофобласты являются ключевыми регуляторами функции эндотелия плаценты. Мы установили, что PSG1 и мышиные PSG22 и PSG23 индуцируют формирование эндотелиальных трубок на Matrigel и типа I коллагене. Ферментативное удаление GAGs с поверхности эндотелиальных клеток устраняет способность PSG1, индуцировать образование трубок, демонстрируя важность взаимодействия PSG1-heparan/chondroitin sulfate. С др. стороны, эндотелиальные клетки, лишенные Vascular endothelial growth factor (VEGF) kinase insert domain receptor образуют трубки в ответ на воздействие PSG1, указывая, что передача сигналов VEGF не нужна для реакции на PSG1 (Lisboa et al., 2011). Поскольку PSG22 и PSG23 также индуцируют образование эндотелиальных трубок и соединяются с GAGs, но потребность во взаимодействии этих PSGs с GAGs для образования трубок не была изучена (Blois et al., 2012 и G. Dveksler, unpublished data). Кроме того, способны ли PSG17 или др. PSGs индуцировать образование трубок эндотелиальными клетками, остается неизвестным. VEGF-A является ключевым медиатором васкулогенеза и ангиогенеза (Ferrara and Davis-Smyth, 1997). TGF-β1, как было установлено, регулирует продукцию VEGF-A (Jeon et al., 2007, Pertovaara et al., 1994). Мы установили, что воздействие PSG1 на линию клеток человеческих трофобласты не из ворсинок и первичные моноциты приводит к повышению секреции VEGF-A (Ha et al., 2010). PSG1-обеспечиваемое увеличение секреции VEGF обеспечивается с помощью TGF-β поскольку нейтрализующие Ab к TGF-β ингибируют секрецию VEGF из обработанных PSG1 неворсинчатых трофобластов. Следовательно, по крайней мере, некоторые PSGs обладают проангиогенными свойствами, которые опосредуются с помощью двух различных механизмов; TGF-β-обусловленная индукция VEGF-A, и прямое взаимодействие PSGs с GAGs на поверхности эндотелиальных клеток. Вклад взаимодействия PSG1-integrin b1 в проангиогенную активность этого белка предстоит исследовать, т.к. эндотелиальные клетки экспрессируют высокие уровни этого интегрина.
PSGs и TGF-β
Взаимоотношение между PSGs и TGF-β впервые было описано in vitro в Dveksler лаб. (Snyder et al., 2001). Воздействие на моноциты человека рекомбинантными PSG1, PSG6 и PSG11, генерированными в клетках насекомых, вызывает секрецию TGF-β1 зависимым от дозы способом. Кроме того, белок, состоящий из N-терминального домена PSG17, PSG17N, сгенерированный у насекомых или в клетках CHO-K1 и очищенный с помощью SDS-PAGE электрофореза в денатурирующих условиях, как было установлено, вызывает секрецию TGF-β1 с помощью макрофагов, происходящих с костного мозга мыши и клеточной линии мышиных макрофагов RAW 264.7 (Ha et al., 2005). Последующее исследование с использованием препаратов рекомбинантных PSG1, состоящих из N-A2-B2 доменов, слитых с метками FLAG, V5 и His (PSG1-FLAG-V5- His) или с порцией Fc из IgG1 тяжелой цепи (PSG1-Fc), и двух мышиных PSGs, состоящих из N1 и A-доменов, слитых с His и FLAG метками (PSG22N1A-His-FLAG и PSG23N1A-His-FLAG) показали индукцию секреции TGF-β1 некоторыми клетками, включая дендритные клетки, линию клеток неворсинчатых трофобластов, эндотелиальных клеток и NK клеток (Blois et al., 2012, Ha et al., 2010, Wu et al., 2008).
Недавно мы установили, что рекомбинантные PSG1-Fc, PSG1-FLAG-V5-His, мышиные PSG22N1A-His-FLAG и PSG23N1A-His-FLAG, очищенные от супернатанта, трансфицировали в CHO-K1 клетки оказались ассоциированы с TGF-β1, который обычно продуцируется клетками этой линии (Blois et al., 2013; G.Dveksler, unpublished results). Следовательно, т.к. всё ещё возможно, что эти PSGs индуцируют TGF-β1 в клетках, перечисленных выше, то необходимо проведение новых экспериментов с препаратами этих белков, лишенных ассоциации с TGF-β1 для получения окончательного вывода относительно способности индуцировать секрецию этого цитокина.
Важно, что белки, генерируемые в клетках насекомых или после разделения с помощью SDS-PAGE, не ассоциируют с TGF-β1, указывая, что первоначальные сообщения о способности некоторых человеческих PSGs и PSG17N индуцировать TGF-β1 не ставятся под угрозу нашими недавними открытиями. Поскольку нативные PSG1, очищенные из сыворотки беременных женщин, и рекомбинантный PSG1 не были обнаружены ассоциирующими с TGF-β1, мы задались вопросом, не является ли PSG1 новым TGF-β1 связывающим белком и не обладает ли он потенциалом активировать латентный TGF-β. Большинство клеток секретируют, по крайней мере, одну из изофром TGF-β (TGF-β1, -2 и -3) в биологически неактивной или латентной форме (Annes et al., 2003). Не ковалентное взаимодействие зрелого TGF-β изоформ-специфическим latency-associated peptide (LAP) блокирует связывание зрелых TGF-β s со специфическими рецепторами. Следовательно, активация латентного TGF-β нуждается в агентах, которые разрушат ассоциацию LAP со зрелым доменом или путём отщепления LAP или путем изменения его конформации (Shi et al., 2011). Экспериментальный подход с использованием бесклеточной системы, показывает, что PSG1 способен активировать small latent complex (SLC) TGF-β1 зависимым от дозы способом (Blois et al., 2013). Поскольку малые латентные формы TGF-β2 коммерчески недоступны, то используя методы репортеров, строго подтверждено, что PSG1 может также активировать и эту изоформу (Blois et al., 2013). Может ли PSG1 активировать латентный TGF-β3 изоформу ещё предстоит определить.
В лаб. Dveksler сегодня проверяется могут ли др. члены семейства человеческих PSG обладать сходной с PSG1 способностью активировать TGF-β1 и TGFβ -2.
Повышенная пригодность биологически активного TGF-β, опосредованная за счет использования PSG1 имеет биологические последствия in vivo. Применение PSG1 защищает мышей от индуцируемого dextran sulfate колита и обнаруживаемый защитный эффект PSG1 подавляется совместным приемом нейтрализующих анти-TGF-β антител (Blois et al., 2013). Обработанные PSG1 мыши, экспрессируют низкие уровни про-воспалительных цитокинов TNF-α и IFN-γ по сравнению с мышами, обработанными контрольным белком. Кроме того, мыши, получающие PSG1 обнаруживают повышенные количества FoxP3+ LAP+ регуляторных T клеток (Tregs)
в lamina propria толстой кишки. Повышенные количества Tregs после воздействия PSG1 наблюдались также в разных экспериментальных системах in vivo. Мыши, которым вводили вирусную вакцину, экспрессирующую PSG1 и нагруженную Listeria моноцитогенами, обнаруживали повышенные количества CD25+ Foxp3+ клеток по сравнению с мышами, обработанными контрольной вирусной вакциной (Martinez et al., 2012). Мы и др. установили, что кондиционированная среда, полученная от линии неворсинчатых клеток трофобласта HTR-8, содержит активную форму TGF-β (Graham and Lala, 1991). Механизм, с помощью которого TGF-β активируется в среде после этих клеток, неизвестен, но HTR-8 клетки экспрессируют мРНК PSG и PSG1 может быть обнаружен в супернатанте после этих клеток с помощью ELISA (G. Dveksler, unpublished data). Следовательно, возможно, что описанная HTR-8-обусловленная индукция индуцибельных Tregs ассоциирует с продукцией PSG1 с помощью этой клеточной линии (Ramhorst et al., 2012).
Действие PSG1 на клетки врожденной и благоприобретенной иммунной системы недавно было рассмотрено в обзоре Martinez et al., (2013). IL-10 и TGF-β являются цитокинами супрессорами, которые которые взаимосвязаны (Kitani et al., 2003, Li et al., 2006, Moore et al., 2001). PSG1, как было установлено, вызывает секрецию IL-10 и альтернативно активацию макрофагов (Motran et al., 2002). Являются ли эти функции PSG1 и описанная модуляция созревания дендритных клеток с помощью PSG1 результатом его вновь открытой способности активировать TGF-β, предстоит выяснить (Martinez et al., 2012).
Кроме того, поскольку некоторые описанные активности человеческих PSG1, -6 и -11 , такие как способность индуцировать секрецию IL-10 и IL-6 моноцитами, были описаны и для мышиного PSG17; механизм и сигнальные пути в основе реакций на человеческие PSGs пока не выяснены и могут отличаться от сигнальных событий, участвующих в реакции на мышиные PSGs, также как отличающиеся рецепторы и/или сигнальные механизмы могут развиваться независимо, обеспечивая сходные функции (Ha et al., 2005, Snyder et al., 2001, Wessells et al., 2000).
PSGs и pregnancy pathologies
Несколько сообщений указывают на то, что более низкие, чем в норме концентрации в сыворотке PSGs ассоциируют с ограничением роста плода (Grudzinskas et al., 1983, Pihl et al., 2009, Salem et al., 1981, Towler et al., 1977, Wurz et al., 1981). Кроме того, корреляция между аномально низкими уровнями PSG и preeclampsia была обнаружена в некоторых исследованиях, но не в др. (Bersinger и Odegard, 2004, Pihl et al., 2009, Silver et al., 1993, Towler et al., 1977). Критическая оценка опубликованных исследований ассоциации с уровнями PSG и осложнениями беременности необходима, исходя из сложности семейства CEACAM/PSG. Во-первых, все измерения PSGs, описанные в цитируемых публикациях осуществлены с помощью поликлональных анти-PSG антител, неспособных различать отличия между продуктами разных генов и измерения уровней PSG временами отличались по триместрам беременности, в которых они проводились. Кроме того, исследования in vitro использовали сиквенс специфические праймеры для отличающихся членов семейства PSG, указывая, что PSGs экспрессируются на разных уровнях
(Camolotto et al., 2010), это подтверждено различиями в последовательностях промоторов (Chamberlin et al., 1994). Следовательно, измерения концентрации всех PSGs может не аккуратно отражать возможную ассоциацию аномальных концентраций некоторых членов семейства с патологией беременности. Помимо этих осложнений новая информация указывает, что имеется большой диапазон того, что может рассматриваться как "normal PSG levels". Количества копий генов PSG являются полиморфными в популяциях человека и варьирует от 12 до 30 у нормальных индивидов (Chang et al., 2013). Недавно, Dewan с сотр. сообщили, что делеция количества копий PSG11 и его альтернативно сплайсированных вариантов могут повышать риск preeclampsia, но необходимы дальнейшие исследования, чтобы подтвердить их находку (Zhao et al., 2012). Экспрессия некоторых PSGs была описана molar трофобластической ткани (Hagiwara et al., 1986, Leslie et al., 1990), а дифференциальная экспрессия PSGs при внутриматочной беременности и внематочной беременности недавно была подтверждена, как имеющая диагностическую ценность, как часть теста на множественные биомаркеры (Rausch et al., 2011). Итак, поскольку низкие концентрации PSG, по-видимому, ассоциируют с некоторыми осложнениями беременности, исследования со многими специфическими реагентами необходимы, т.к. уровни PSG могут быть потенциально использованы в качестве пригодных маркеров функции плаценты.
Conclusions
Further studies are required to understand the functions and
characterize the receptors и modes of action of the different
PSGs expressed in humans, non-human primates, и rodents. In
addition, the recently discovered association between PSG1 and
TGF-b suggests that PSGs may play a role in the well-established
beneficial effects of pregnancy in patients suffering from autoim-
mune diseases such as multiple sclerosis и rheumatoid arthritis.
This indicates that administration of PSG1 should be explored as a
novel therapeutic agent in diseases related to undesired immune
activation in non-pregnant individuals.
|
