Посещений:  АДГЕЗИЯ НЁБНЫХ ПОЛОВИН
АДГЕЗИЯ НЁБНЫХ ПОЛОВИН
Роль киназ
|
|
Palatal adhesion is dependent on Src family kinases
and p38MAPK YUKIKO KITASE and CHARLES F. SHULER
 Int. J. Dev. Biol. 58: 335-341 (2014) doi: 10.1387/ijdb.130289yk
|
During secondary palate development, palatal shelves adhere to each other in the midline to form a midline epithelial seam leading to palatal closure. Cell-cell and cell-extracellular matrix adhesions, which are mediated by cell adhesion receptors, E-cadherin and integrins, are implicated in the process of adhesion of the palatal shelves. Src family kinases (SFK) function downstream of both receptors. In this study, we focused on the role of SFK in the process of palatal adhesion. During palatal adhesion, the expression of SFK mRNA, as well as localization and quantitation of the protein in the activated form, were examined by real-time qPCR and immunofluorescence. Palatal organ cultures were performed to identify the effect of pharmacological inhibition of SFK on palatal adhesion. Activated SFKs were found to be co-localized with adhesion receptors, E-cadherin and integrins in the palatal medial edge epithelium. Src, Fyn and Yes subfamily members were expressed in the palatal tissue. The expression of SFK mRNA and the quantity of the activated form of the protein were upregulated during palatal adhesion. An SFK inhibitor, PP2, blocked palatal adhesion, but another SFK inhibitor, SU6656 was not inhibitory. However, the combination of SU6656 and either of the p38MAPK inhibitors, SB203580 or BIRB0796, showed similar inhibitory effects on palatal adhesion compared to PP2 alone. The p38MAPK inhibitors alone did not alter palatal adhesion. Real-time qPCR revealed that p38MAPK a and d were elevated during palatal adhesion. This study indicates that palatal cell adhesion is dependent on signaling from integrin receptors and E-cadherin through SFK and p38MAPK.

|
Развитие вторичного нёба происходит в несколько ступеней; инициация, вертикальные выросты, переориентация, адгезия и слияние (Bush and Jiang, 2012). Нарушения на любой из этих стадий могут приводить к расщеплению нёба. На ст. адгезии нёбные половинки приближаются др. к др., контактируют по срединной линии, позволяя слипаться по срединной линии противоположным medial edge epithelia (MEE) и в конечном счете формировать midline epithelial seam (MES), чтобы полностью закрыть пробел между нёбными половинками (Bush and Jiang, 2012). Слипание и след. ст. слияние происходят в течение короткого временного промежутка. Много исследований было сфокусировано на молекулярных механизмах спецификации судеб клеток MEE вовремя ст. слияния половинок (Bush and Jiang, 2012), но мало исследований по молекулярным механизмам, регулирующим процесс слияния нёбных половин.
Вовремя ст. слипания происходит слипание как между клетками, так и между клетками и внеклеточным матриксом (ECM), как показывают эффекты внутриклеточных сигнальных путей, способствующих слипанию нёбных половин (Huveneers and Danen, 2009, van Roy and Berx, 2008). E-cadherin является основной кадгериновой молекулой, экспрессирующейся в эпителиальных клетках, включая и MEE (Sun et al., 1998). E-cadherin в первую очередь ответственен за инициацию слипания клеток MEE и образование зависимых от кальция слипчивых соединений (van Roy and Berx, 2008). Мутантный E-cadherin, лишенный внеклеточного домена, необходим для межклеточной адгезии, т.к. он связан с появлением расщепления губ и нёба (Frebourg et al., 2006). Интегрины регулируют слипание клеток с ECM (Huveneers and Danen, 2009). Делеция интегрина α V приводит к отсутствию α Vβ1, α Vβ3, α Vβ5, α Vβ6 и αVβ8 интегринов и связана с фенотипом расщепления нёба (Munger and Sheppard, 2011). Анти-интегриновые α5 блокирующие антитела вызывают достоверное уменьшение слипчивости нёбных половин до 70% (Martinez-Sanz et al., 2008). Ферментативное переваривание chondroitin sulphate proteoglycan, который взаимодействует с интегринами, чтобы обеспечить передачу сигналов, приводит ингибированию слипания нёбных половин (Gato et al., 2002). Данное исследование показало критическую роль обоих рецепторов адгезии: E-cadherin и integrins, в процессе нёбной адгезии. Нижестоящие молекулярные механизмы, регулирующие слипание MEE нёбных половин, не были выяснены до конца.
Нерецепторные тирозин киназы, Src family kinases (SFK), как известно, также накапливаются в слипчивых соединениях как между клетками, так и между клетками и
внеклеточным матриксом (Huveneers and Danen, 2009, McLachlan et al., 2007). SFK состоит из 9 членов, включая Src, Fyn, Yes и Fgr (Thomas and Brugge, 1997). Src, Fyn и Yes экспрессируются повсеместно во всех типах клеток, но др. члены семейства, включая Fgr обычно экспрессируются в гематопоэтических клонах клеток (Thomas and Brugge, 1997). Сигнал myristoylation в Src homology (SH) 4 домене доставляет SFK на плазматическую мембрану, где SFK регулируют фокальные адгезии и межклеточные адгезии нижестоящих интегринов и E-cadherin (Patwardhan and Resh, 2010). Взаимодействие интегрина с ECM вызывает активацию SFK за счет непосредственного взаимодействия с SH3 доменом посредством интегринового β цитоплазматического хвоста, это приводит к фосфорилированию Tyr-418 в киназном домене (Arias-Salgado et al., 2003). Src и Fyn избирательно соединяются с integrin β3, тогда как Yes может связывать integrin β1, β2 и β3 (Arias-Salgado et al., 2003). E-cadherin также активирует SFK межклеточных контактов и позитивно поддерживает cadherin-обеспечиваемую адгезию (Calautti et al., 1998, Tsukita et al., 1991). Мы предположили, что функция SFK, ассоциированная с E-cadherin- и integrin-обеспечиваемой адгезией MEE может играть важную роль в нёбной адгезии.
p38MAPK имеет 4 изоформы, p38MAPK α β γ и δ которые обеспечивают передачу сигналов к нижестоящим интегринам посредством активации Rho GTPases/MAPK kinases и FAK/SFK (Aikawa et al., 2002, Han et al., 2002). Хотя p38 MAPK, как было установлено, регулирует процесс слияния нёбных половин, роль p38MAPK не была изучена на ст. адгезии небных MEE (Xu et al., 2008). В данной работе основное внимание обращено на ст. слипания MEE в развитии нёба и на роль SFK и p38MAPK во время этой стадии. Совместная локализация активных SFK с рецепторами адгезии в MEE привела нас к проверке паттерна экспрессии мРНК SFK и активированных киназ во время нёбной адгезии. Органные культуры нёбных половин плодов были использованы для оценки роли SFK и p38MAPK путем применения фармакологического ингибирования активности киназ.
Discussion
В данном исследовании мы показали функциональное перекрывание SFK и p38MAPK для облегчения процесса адгезии нёбных MEE в органной культуре нёба. Фармакологическое конкурентное ингибирование обеих киназ приводило к неспособности адгезии нёбных MEE.
E-cadherin и integrins играют важную роль в процессе адгезии нёбных половин (Frebourg et al., 2006, Martinez-Sanz et al., 2008, Munger and Sheppard, 2011). Чтобы исследовать участие SFK в E-cadherin- и integrin-обеспечиваемой адгезии нёбных половин, осуществляли двойное иммунофлюоресцентное мечение. Мы идентифицировали совместную локализацию активной SFK с E-cadherin и интегринами в межклеточных контактах, где слипались нёбные половинки, это указывает на потенциальную роль функции SFK вовремя ст. нёбной адгезии. Real time QPCR выявило паттерн экспрессии SFK во время нёбной адгезии и идентифицировало Fyn как наиболее высоко активируемый ген среди трех повсеместно экспрессирующихся членов семейства SFK. Fyn участвует в позитивной регуляции E-cadherin обеспечивающей межклеточную адгезию кератиноцитов in vitro (Calautti et al., 1998, Calautti et al., 2002). In vivo, однако, делеция Fyn и Src была необходима, чтобы вызывать нарушение адгезии клеток кератиноцитов (Calautti et al., 1998). Fyn, по-видимому, наиболее подходящая среди трех SFK, но может существовать функциональное перекрывание в регуляции нёбной адгезии. Каждый отличающийся член может по-разному активироваться в ходе культивирования органа в течение 48 ч, это может приводить к непрерывной экспрессии фосфорилированной формы. Последовательность активации SFK предоставляет доказательство умеренного уровня активации, происходящего даже перед адгезией противостоящих MEE, это может быть результатом инициальных изменений молекул клеточной адгезии, чтобы подготовить MEE к адгезии. Максимум активации SFK не наблюдался вплоть до наступления адгезии противостоящих MEE. В предыдущих публикациях выявлена парадоксальная роль SFK в становлении адгезии клеток. Клеточная адгезия нуждается в активной SFK, но избыточная активация SFK приводит к разрушению адгезии, как это наблюдается на трансформированных онкогеном или митогенами стимулированных клетках (McLachlan et al., 2007). Следовательно, дифференциальная интенсивность phospho-SFK в MEE перед и после нёбной адгезии может указывать на разные роли SFK на разных ст. Позитивные эффекты нёбной адгезии и негативные эффекты во время слияния нёбных половин, где была нарушена E-cadherin обеспечиваемая межклеточная адгезия в MEE, т.к. шов по срединной линии был разорван, и мезенхима оказывалась неразрывной между обеими нёбными половинами.
Мы осуществили органную культуры нёба с PP2, который является обычно используемым ингибитором SFK. PP2 блокирует нёбную адгезию во всех трех регионах срединной линии, подтверждая, что SFK позитивно регулирует процесс нёбной адгезии. Однако, мы неожиданно установили, что др. ингибитор SFK, SU6656, оказывает очень ограниченный эффект на нёбную адгезию, несмотря на то, что может ингибировать фосфорилирование SFK, также, как и PP2. Мы полагаем, что это обусловлено разными неспецифическими эффектами как PP2, так и SU6656 на др. киназы (See Fig. 4A). Киназы ингибирующиеся более чем на 50 % с помощью PP2, но не SU6656 - это p38MAPK, CK1, CSK, RIP2 и GAK (Bain et al., 2007). Т.к. p38MAPK стоит ниже интегринов (Aikawa et al., 2002, Han et al., 2002), то мы полагаем, что p38MAPK также участвует в процессе нёбной адгезии. Поэтому мы попытались осуществить органную культуры нёба с комбинациями ингибиторов, используя SU6656 в комбинации с ингибиторами p38MAPK, или SB203580 или BIRB0796. SB203580 ингибировал CK1, RIP2 и GAK более чем на 50%, но не BIRB0796 (Fig. 4A). Разная специфичность между ними позволяет нам исключить потребность в CK1, RIP2 и GAK для адгезии. Оба p38MAPK ингибитора, также, как и SU6656 не ингибируют CSK, как это делает PP2 (Bain et al., 2007, Fig. 4A), это указывает, что CSK не нужна для процесса нёбной адгезии. Использование по одиночке или SU6656, или p38MAPK ингибиторов не ингибирует нёбную адгезию, но конкурентное ингибирование SFK и p38MAPK вызывает неспособность к нёбной адгезии (Fig. 4A and B). Т.о., SFK и p38MAPK обнаруживают перекрывание для облегчения необходимых событий фосфорилирования, важных для нёбного слияния (Fig. 4C).
PP2 и комбинации SU6656 и p38MAPK ингибиторов обнаруживают разные эффекты на адгезию в заднем регионе. Все три региона срединной линии нёба после воздействия PP2 были отнесены к неадгезивной группе (Median: 0, 0.3 and 1.0 в переднем, среднем и заднем регионах, соотв. Однако задний регион нёба, обработанный как SU6656, так и p38MAPK ингибиторами, был отнесен к группе с частичной адгезией (Median: 1.5 и 2.1 в SU6656/30 µ M BIRB0796 и SU6656/SB203580 соотв.). В отличие от комбинации SU6656 и p38MAPK ингибиторов, PP2 обнаруживал дополнительное умеренное ингибирование в отношении PKA и S6K (Bain et al., 2007, Fig. 4A). Обе передачи сигналов интегринов стоят ниже (Lim et al., 2008, Malik and Parsons, 1996). PKA регулирует также интегрин, обеспечивающий клеточную адгезию (Whittard and Akiyama, 2001). Следовательно, эти киназы могут играть роль в региональной регуляции развития нёба вдоль переднезадней оси. Мы не можем исключить участие др. киназ, чувствительных к PP2 и специфических для заднего региона, приводящих определённому региональному ответу на ингибиторы.
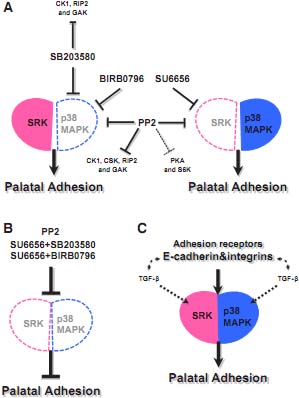 Fig. 4. A diagram of signaling pathways regulating palatal adhesion and kinases targeted by the inhibitors used in this study. (A) Single use of SU6656 and p38MAPK inhibitors did not inhibit palatal adhesion. Kinases inhibited more than 50 % by PP2 but not SU6656 are p38MAPK, CK1, CSK, RIP2 and GAK. SB203580 inhibits CK1, RIP2 and GAK more than 50%, but not BIRB0796. PP2 also showed additional moderate inhibition against PKA and S6K. (B) Concurrent inhibition of both SFK and p38MAPK caused a failure of palatal adhesion. (C) The process of palatal adhesion mediated by E-cadherin and integrins is dependent on SFK and p38MAPK. Fig. 4. A diagram of signaling pathways regulating palatal adhesion and kinases targeted by the inhibitors used in this study. (A) Single use of SU6656 and p38MAPK inhibitors did not inhibit palatal adhesion. Kinases inhibited more than 50 % by PP2 but not SU6656 are p38MAPK, CK1, CSK, RIP2 and GAK. SB203580 inhibits CK1, RIP2 and GAK more than 50%, but not BIRB0796. PP2 also showed additional moderate inhibition against PKA and S6K. (B) Concurrent inhibition of both SFK and p38MAPK caused a failure of palatal adhesion. (C) The process of palatal adhesion mediated by E-cadherin and integrins is dependent on SFK and p38MAPK.
Базируясь на результатах органной культуры и в реальном времени QPCR,
p38MAPK α и δ оказались главными изформами, действующими совместно с членами семейства SFK, Src, Fyn и Yes во время нёбной адгезии. В данном исследовании показана функциональная перекрываемость SFK и p38MAPK в облегчении процесса нёбной адгезии, обеспечиваемой с помощью E-cadherin и integrin (Fig. 4C). TGF-β играет важную роль в нёбной адгезии (Kaartinen et al., 1995). Он активирует SFK и p38MAPKs (Pechkovsky et al., 2008, Wendt and Schiemann, 2009), а общение между TGF-β и адгезивными рецепторами наблюдается также в др. системах (Galliher and Schiemann, 2006, Galliher-Beckley and Schiemann, 2008, Kim et al., 2009). Было бы интересно проверить взаимоотношения между TGF-β адгезивными рецепторами и киназами во время нёбной адгезии. Необходимы дальнейшие исследования, чтобы уверенно продемонстрировать, какие из членов семейства SFK и изоформы p38MAPK участвуют в этом процессе и идентифицировать вышестоящие и нижестоящие сигнальные молекулы, регулирующие стадию адгезии. Возможно участие др. связанных с интегринами нижестоящих сигнальных молекул, таких как FAK и из Rho семейства GTPases в процессе адгезии.
|
 Fig. 4. A diagram of signaling pathways regulating palatal adhesion and kinases targeted by the inhibitors used in this study. (A) Single use of SU6656 and p38MAPK inhibitors did not inhibit palatal adhesion. Kinases inhibited more than 50 % by PP2 but not SU6656 are p38MAPK, CK1, CSK, RIP2 and GAK. SB203580 inhibits CK1, RIP2 and GAK more than 50%, but not BIRB0796. PP2 also showed additional moderate inhibition against PKA and S6K. (B) Concurrent inhibition of both SFK and p38MAPK caused a failure of palatal adhesion. (C) The process of palatal adhesion mediated by E-cadherin and integrins is dependent on SFK and p38MAPK.
Fig. 4. A diagram of signaling pathways regulating palatal adhesion and kinases targeted by the inhibitors used in this study. (A) Single use of SU6656 and p38MAPK inhibitors did not inhibit palatal adhesion. Kinases inhibited more than 50 % by PP2 but not SU6656 are p38MAPK, CK1, CSK, RIP2 and GAK. SB203580 inhibits CK1, RIP2 and GAK more than 50%, but not BIRB0796. PP2 also showed additional moderate inhibition against PKA and S6K. (B) Concurrent inhibition of both SFK and p38MAPK caused a failure of palatal adhesion. (C) The process of palatal adhesion mediated by E-cadherin and integrins is dependent on SFK and p38MAPK.