Посещений:  СБОРКА КРАНИАЛЬНЫХ ПЛАКОД
СБОРКА КРАНИАЛЬНЫХ ПЛАКОД
механизмы
|
|
Mechanisms of cranial placode assembly
MARIE ANNE BREAU* and SYLVIE SCHNEIDER-MAUNOURY
 Int. J. Dev. Biol. 58: 9-19 (2014)
doi: 10.1387/ijdb.130351mb
|
Cranial placodes are transient ectodermal structures contributing to the paired sensory organs and ganglia of the vertebrate head. Placode progenitors are initially spread and intermixed within a continuous embryonic territory surrounding the anterior neural plate, the so-called panplacodal region,which progressively breaks into distinct and compact placodal structures. The mechanisms driving the formation of these discrete placodes from the initial scattered distribution of their progenitors are poorly understood,and the implication of cell fate changes,local sorting out or massive cell movements is still a matter of debate.Here, we discuss different models that could account for placode assembly and review recent studies unraveling novel cellular and molecular aspects of this key event in the construction of the vertebrate head.
|
Краниальные плакоды временные эмбриональные структуры эктодермального происхождения, образующие важные части головы позвоночных. Наиболее передние плакоды дают аденогипофиз, обонятельный сенсорный эпителий и глазные хрусталики. Наиболее задние плакоды включают слуховую плакоду, которая дает всё внутреннее ухо и статоакустический ганглий, тройничную и эпибранхиальные плакоды, которые вносят вклад в ряд ганглиев, связывающих ощущения лица и органов с головным мозгом, вновь идентифицированные плакоды дают paratympanic organ и дополнительные плакоды механосенсорной боковой линии у водных позвоночных (O'Neill et al., 2012; Schlosser, 2010).
Несмотря на разную морфологию и функции, плакоды и их производные возникают из предшественников, диспергированных в общем подковообразном эктодермальном домене, наз. пан-плакодным или пре-плакодным регионом (PPR), окружающим переднюю часть нервной пластинки в конце гаструляции (Fig. 1) (Bailey and Streit, 2006; Schlosser, 2010; Streit, 2008). Непрерывность этого PPR, выявляется с помощью картирования судеб и профилей экспрессии, в противоположность с раздельным паттерном плакодных производных, обнаруживаемым на поздних стадиях, когда самостоятельные плакодные образования занимают специфические позиции вдоль передне-задней оси по соседству с нервной трубкой (Fig. 1) (Bailey and Streit, 2006; Schlosser, 2010; Streit, 2008).
Как область PPR подразделяется на индивидуальные плакоды, всё ещё известно недостаточно и относительный вклад в изменения клеточных судеб, апоптоз, локальная сортировка клеток и крупномасштабные морфогенетические перемещения остаются открытым вопросом. Здесь мы суммировали современное понимание клеточных и молекулярных механизмов, участвующих в сборке плакод, используя примеры исследований на эмбрионах кур, Xenopus и рыбок данио. Мы сконцентрировались на инициальном формировании дискретных и индивидуальных плакодных структур. Миграция на длинные расстояния плакод боковой линии и лежащие в основе механизмы были уже описаны (Aman and Piotrowski, 2011; Ma and Raible, 2009) и не будут здесь рассматриваться, также, как и сложное морфогенетическое ремоделирование сенсорных органов, возникающих на поздних стадиях, такие как инвагинация эпителия обонятельных и слуховых плакод.
Исходя из информации экспериментов по картированию судеб, мы полагаем, что сборка плакод использует две последовательные ступени во время развития, инициальную сегрегацию своих предшественников и вторично слияние.
Fate mapping suggests a two-step placode assembly
Definition of the pre-placodal region
Эмбриональное происхождение краниальных плакод первоначально анализировали с помощью картирования судеб, исходя из трансплантационных экспериментов (rev. Schlosser, 2010). Сравнительно недавно мечение краской отслеживаемых клонов было осуществлено на рыбах (Kozlowski et al., 1997; Whitlock and Westerfield, 2000; Dutta et al., 2005), амфибиях (Pieper et al., 2011) и птицах (Bhattacharyya et al., 2004; Bhattacharyya and Bronner, 2013; Streit, 2002; Xu et al., 2008). Чтобы генерировать эти карты судеб
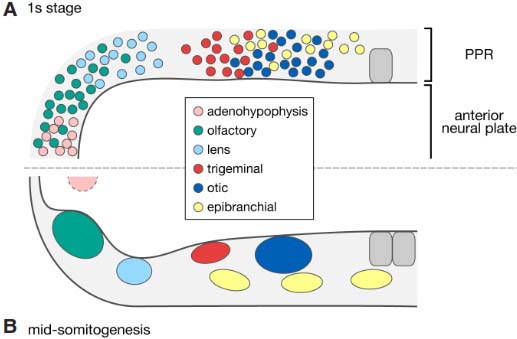 Fig. 1. Position of placodal precursors and placodal structures before and after placode assembly. (A) Schematic view of placode progenitors scattered and intermixed within the pan-placodal region (PPR) surrounding the anterior neural plate at the one stage (dorsal view of a theoretical vertebrate). (B) Compact and individualized placodes occupying specific positions along the anteroposterior axis of the embryo from mid-somitogenesis stages onwards (the dotted line surrounding the placode indicates dorsal view, the ventral position of the adenohypophysis). Anterior to the left.
Fig. 1. Position of placodal precursors and placodal structures before and after placode assembly. (A) Schematic view of placode progenitors scattered and intermixed within the pan-placodal region (PPR) surrounding the anterior neural plate at the one stage (dorsal view of a theoretical vertebrate). (B) Compact and individualized placodes occupying specific positions along the anteroposterior axis of the embryo from mid-somitogenesis stages onwards (the dotted line surrounding the placode indicates dorsal view, the ventral position of the adenohypophysis). Anterior to the left.
краска вводилась или высвобождалась в одиночные клетки или небольшие участки головной эктодермы на разных ст. развития от гаструляции до позднего сомитогенеза. Судьба и расположение предшественников оценивались на поздних стадиях, когда плакоды можно было идентифицировать по их положению и морфологии. Эти исследования показали, что сенсорные плакоды возникают из серпообразной эктодермальной территории, окружающей переднюю часть нервной пластинки на ст. поздней гаструляции и ранней нейруляции. Этот непрерывный регион совпадает с доменом экспрессии транскрипционных факторов, таких как Eya1, Six1/2 и Six4/5, которые являются критическими для формирования плакод и, как полагают, составляют плакодную основу этого домена (Lleras-Forero and Streit, 2012; Pieper et al., 2011; Schlosser, 2010). Эти наблюдения вместе с уникальными свойствами, общими клеткам внутри этой территории (Bailey et al.,2006; Martin and Grooves, 2006), указывают, что она представлена общим доменом возникновения всех плакод, т.наз. пан-плакодным или пре-пракодным регионом (PPR) (Bailey and Streit, 2006; Schlosser,
2010; Streit, 2008).
Initial segregation and secondary coalescence
Хотя информация всё ещё неполная у некоторых видов о субнаборах плакод, общераспространённые исследования по картированию судеб продемонстрировали первоначальное перекрывание между доменами источников разных плакод (степень перекрывания недавно обсуждалась и оспаривалась Pieper et al., 2011; Schlosser, 2010), которое постепенно снижается по ходу развития. Т.е., предшественники данной плакоды, по-видимому, разбросаны внутри домена PPR и частично перемешаны с предшественниками соседних плакод, а также с др. эктодермальными клетками, такими как эпидермальные, нервной трубки и нервного гребня клетки (NCC), и со временем подвергаются постепенному расхождению, становясь характерными для определенного региона (Fig. 1) (Kozlowski et al., 1997; Bhattacharyya et al., 2004; Bhattacharyya and Bronner, 2013; Dutta et al., 2005; Pieper et al., 2011; Streit, 2002; Whitlock and Westerfield, 2000; Xu et al., 2008). Эта инициальная сегрегация приводит к образованию различающихся плакодных компартментов, которые всё ещё смыкаются др. с др. на ранних ст. сомитогенеза (Fig. 2). Однако сборка плакод всё ещё не полностью завершена на этой стадии. С середины до конца сомитогенеза плакодные структуры становятся более компактными и четко отделены др. от др. неплакодными областями (Figs. 1 and 2) (Schlosser, 2010; Schlosser and Ahrens, 2004; Streit, 2008). Этот паттерн расщепления и физического разделения контрастирует с тесной близостью плакодных доменов, наблюдаемой сразу после их инициальной сегрегации (Fig. 2).
Эти наблюдения подтверждают двухступенчатую последовательность образования плакод: инициальную сегрегацию плакодных предшественников на соседние плакодные области, сопровождаемую дальнейшей компакцией, чтобы сформировать раздельные и самостоятельные плакодные структуры (Fig. 2, и табл. показывают стадии развития, соответствующие двум ступеням у эмбрионов рыбок данио, Xenopus и эмбрионов кур).
Ступень компакции, обозначаемая как вторичное объединение, прекрасно иллюстрируется ранним морфогенезом обонятельных плакод у рыбок данио. Whitlock and Westerfield (2000) осуществили картирование судеб передней части нервной пластинки на ст. 4-5 сомитов (4-5s), которое показало, что парные обонятельные плакоды возникают из двух удлиненных в форме полос клеточных полей, фланкированных нервной пластинкой. Важно, что не было предшественников хрусталиков в нервной пластинке. Важно, что не было предшественников хрусталиков обнаружено перемешанными с предшественниками обонятельных плакод на ст. 4-5s, подтверждая, что ступень сегрегации уже достигнута на этой стадии для этих двух плакод у рыбок данио. Сравнение формы двух инициальных доменов на ст. 4-5s с таковой двух сферических обонятельных плакод, наблюдаемых на ст. 20s показывает. что процесс объединения произошел между этими двумя стадиями после сегрегации от предшественников хрусталика и перед дальнейшим моделированием ткани за счет инвагинации эпителия (Whitlock and Westerfield, 2000). Это согласуется с картированием судеб обонятельных и хрусталиковых предшественников у эмбрионов кур, которое выявило перемешивание вплоть до ст. 4-5s, когда два плакодных домена всё ещё наложенными др. на др., это сопровождалось последующим пространственным разделением двух популяций клеток на более поздних стадиях (Bhattacharyya et al., 2004; Bhattacharyya and Bronner, 2013). Движущие силы, контролирующие инициальную сегрегацию и вторичное объединение плакод, всё ещё плохо охарактеризованы. Обе ступени могут регулироваться сходными механизмами (дифференциальной адгезией или хемотаксисом, которые могут обеспечивать сегрегацию и затем компакцию плакод) или использовать разные клеточные процессы. Недавние исследования открыли новые аспекты фазы вторичного объединения (see part C). Однако, инициальная сегрегация всё ещё нерешенный вопрос, а лежащие в основе механизмы активно обсуждаются.
Mechanisms driving the initial segregation of placodal precursors
Как предшественники плакод образуют раздельные эмбриональные домены из их рассеянных и смешанных распределений внутри непрерывного PPR? После краткой презентации двух основных моделей, объясняющих эту инициальную сегрегацию, мы обсудим старые и новые доказательства, поддерживающие каждый из сценариев.
Two possible scenarios
Model 1: Large-scale sorting out of early-specified intermingled placodal precursors
Согласно этой модели спецификация предшественников разных плакод д. предшествовать сегрегации и наделять их свойствами, позволяющими им рассортировываться др. от др., приводя к образованию несмешивающихся соседних плакодных областей. Возможные механизмы для обеспечения такой сортировки включают дифференциальную межклеточную адгезию, с помощью которой случайно перемещающиеся клетки специфически слипаются и агрегируют с подобными плакодными клетками (Model 1a, Fig. 3), и активируют направленную миграцию, управляемую с помощью локальных источников секретируемых или связанных с матриксом сигналов, которые привлекают или отталкивают отличающиеся субпопуляции плакодных клеток (Model 1b, Fig. 3).
Model 2: Random movements preceding specification of placodal identities by surrounding signalling centers
Согласно этому сценарию мультипотентные предшественники подвержены действию локальных градиентов сигналов окружающей среды, запускающих их спецификацию в определенные плакодные качественные особенности вдоль переднезадней оси. Ниже этой передачи сигналов находятся паттерн-формирующие механизмы, такие как перекрестная репрессия транскрипционных факторов, как это наблюдается в ЦНС, и будет гарантировать образование острой границы между плакодными доменами. Инициальное перемешивание, наблюдаемое при картировании судеб, подразумевает случайные перемещения и смешивание мультипотентных предшественников внутри территории PPR перед их спецификацией за счет внешних сигналов (Model 2, Fig. 3).
Confrontation of the models with experimental evidence
Are placodal precursors specified before their segregation?
Чтобы рассортировываться др. от др. перемешанные предшественники будущих соседних плакод, д. отличаться, т.е. проходить событие ранней спецификации, которое наделяет их характеристиками
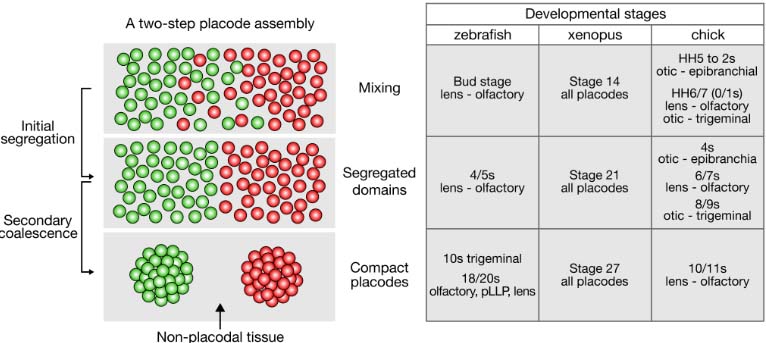 Fig. 2. Placode assembly seen as a two-step developmental process. Fate map studies suggest two sequential steps in placode formation: segregation of intermingled placodal precursors into immiscible but still juxtaposed placodal domains (initial segregation), and further compaction resulting in discrete and condensed placodes separated by non-placodal tissues (secondary coalescence). The table indicates the corresponding developmental stages reported in studies using zebrafish, Xenopus and chick embryos (Data compiled from Kozlowski et al., 1997; Bhattacharyya and Bronner, 2013; Bhattacharyya and Bronner-Fraser, 2004; Breau et al., 2012; Dutta et al., 2005; Harden et al., 2012; Knaut et al., 2005; Kwan et al., 2011; Pieper et al., 2011; Streit, 2002; Whitlock and Westerfield, 2000; Xu et al., 2008). In the upper panel, the colored dots represent progenitors of adjacent placodes, whether or not they are specified.
HH: Hamburger Hamilton. pLLP: posterior lateral line placode. s: somite.
Fig. 2. Placode assembly seen as a two-step developmental process. Fate map studies suggest two sequential steps in placode formation: segregation of intermingled placodal precursors into immiscible but still juxtaposed placodal domains (initial segregation), and further compaction resulting in discrete and condensed placodes separated by non-placodal tissues (secondary coalescence). The table indicates the corresponding developmental stages reported in studies using zebrafish, Xenopus and chick embryos (Data compiled from Kozlowski et al., 1997; Bhattacharyya and Bronner, 2013; Bhattacharyya and Bronner-Fraser, 2004; Breau et al., 2012; Dutta et al., 2005; Harden et al., 2012; Knaut et al., 2005; Kwan et al., 2011; Pieper et al., 2011; Streit, 2002; Whitlock and Westerfield, 2000; Xu et al., 2008). In the upper panel, the colored dots represent progenitors of adjacent placodes, whether or not they are specified.
HH: Hamburger Hamilton. pLLP: posterior lateral line placode. s: somite.
позволяющие им расходиться. Каковы доказательства такой ранней спецификации? В экспериментах по картированию судеб, описанных выше, одиночные меченные клетки наиболее часто давали потомство только одной специфической плакоды, даже когда мечение происходило перед сегрегацией (Bhattacharyya and Bronner, 2013; Dutta et al., 2005; Xu et al., 2008). Это наблюдение подтвердило, что предшественники плакод клонально ограничены перед их пространственной сегрегацией (Bhattacharyya and Bronner, 2013; Dutta et al., 2005; Toro and Varga, 2007), хотя это нуждается в более непосредственной проверке. Классический подход к подсчету времени спецификации для данной популяции клеток состоит в иссечении небольших кусочков ткани на разных стадиях и культивирования их в изоляции, чтобы оценить, могут ли эти клетки дифференцироваться в соответствии с их нормальной судьбой в нейтральной среде. В целом исход этих экспериментов позволил выделить суб-регионы PPR в которых начало спецификации плакод приблизительно совпадает со снижением перекрывания между предшественниками плакод, это не позволяет уверенно сделать заключение о точной временной последовательности, связывающей два события (Baker et al., 1999; Groves and Broner-Fraser, 2000; Baker and Bronner-Fraser, 2001; Bhattacharyya and Bronner-Fraser, 2008). Смешивание рано специфицированных предшественников плакод д. отражаться в в профиле экспрессии соль-и-перец специфичных для плакод маркеров. Образование разошедшихся зачатков плакод коррелирует по времени с активацией транскрипционных факторов, специфически экспрессирующихся в индивидуальных или группах плакод (Bailey and Streit, 2006; Pieper et al., 2011; Schlosser, 2010; Streit, 2008). Pax2 и Pax8 экспрессируются в предшественниках отической и эпибранхиальных плакод (в плакодах латеральной линии рыб и амфибий), обнаруживая экспрессию типа соль-и-перец у кур (Groves and Bronner-Fraser, 2000; Streit, 2002), Xenopus (Pieper et al., 2011; Schlosser and Ahrens, 2004), рыбок данио (Bhat et al., 2013; Bhat and Riley, 2011; Hans and
Westerfield, 2007; McCarroll et al., 2012; Padanad et al., 2012) и мышей (Ohyama and Groves, 2004). Pax6, транскрипционный фактор, экспрессирующийся в хрусталиковой плакоде, обнаруживает мозаичную экспрессию у рыбок данио (Dutta et al., 2005; Hans and Westerfield, 2007). Важно понять механизмы, способные генерировать такой мозаичный паттерн, такую стохастическую активацию экспрессии генов, пороговые эффекты или латеральное ингибирование в PPR. Однако, экспрессия соль-и-перец д. также отражать прогрессивные активацию или подавление специфичных для плакод маркеров в непрерывном плакодном домене, и это не составляет прямого доказательства ранней спецификации и смешивания предшественников плакод. Двойная гибридизация in situ для маркеров соседних плакод мола бы предоставить строгие доказательства, но почти отсутствует в литературе, за исключением двойной гибридизации in situ, осуществленной на эмбрионах рыбок данио на ст. зачатка, которая подтвердила смешивание между Pitx3 -позитивными предшественниками аденогипофиза и обонятельными предшественниками, экспрессирующими Dlx3 (Dutta et al., 2005). Т.о., имеющиеся данные не решают вопрос, когда специфицируются судьбы плакод.
Do placodal precursors undergo directional movements during segregation?
Если инициальная ступень сегрегации управляется направленными клеточными перемещениями, то это может быть обнаружено при наблюдениях вживую. Первые попытки отследить динамическое поведение предшественников плакод во время расхождения были сделаны на эмбрионах кур, меченных краской crystal spots в презумптивных регионах отических/эпибранхиальных (Streit,2002) и хрусталик/обонятельная плакод (Bhattacharyya et al., 2004). В обоих сообщениях движения начинались на ст., когда плакодные предшественники были всё ещё смешаны, соотв. картирование судеб осуществлялось в том же самом исследовании (Bhattacharyya and Bronner-Fraser, 2004; Streit, 2002). В первые часы time-lapse съемки показаны Streit, 2002,
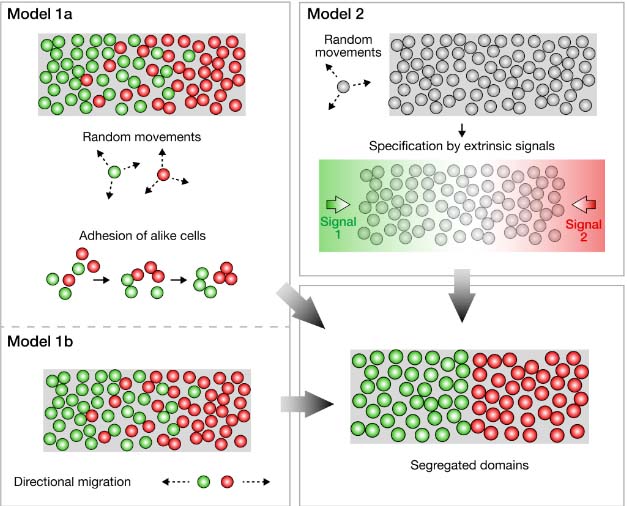 Fig. 3. Two scenarios for the initial segregation of placodal precursors. (Model 1). Large-scale sorting out of early-specified intermingled placodal precursors. Specified placodal precursors initially present a high degree of intermixing and actively sort-out from each other by differential adhesion (Model 1a) or directional migration (Model 1b). (Model 2). Random movements preceding specification of placodal identities by surrounding signalling centers. Unspecified progenitors undergo random movements within the PPR before being specified by environmental signals. Further patterning mechanisms (cross-repression of transcription factors) lead to the formation of a sharp boundary between placodal domains. Grey and colored dots represent unspecified and specified placodal progenitors, respectively.
Fig. 3. Two scenarios for the initial segregation of placodal precursors. (Model 1). Large-scale sorting out of early-specified intermingled placodal precursors. Specified placodal precursors initially present a high degree of intermixing and actively sort-out from each other by differential adhesion (Model 1a) or directional migration (Model 1b). (Model 2). Random movements preceding specification of placodal identities by surrounding signalling centers. Unspecified progenitors undergo random movements within the PPR before being specified by environmental signals. Further patterning mechanisms (cross-repression of transcription factors) lead to the formation of a sharp boundary between placodal domains. Grey and colored dots represent unspecified and specified placodal progenitors, respectively.
в виде скоординированных конвергентных движений, направленных в направлении срединной линии и затрагивающие эмбрион в целом могли наблюдаться, при этом меченные краской клетки оставались вместе. Поразительно, меченные клетки начинали распространяться и мигрировать прочь из их инициального кластера только, когда были сформированы первые 6/7 сомиты, т.e. когда инициальная сегрегация предшественников уже была достигнута (Fig. 2). Сходные наблюдения были сделаны во втором сообщении: общая конвергенция в направлении срединной линии сопровождалась разделением презумптивных обонятельных и хрусталиковых клеток со ст. 5s, это соответствовало времени фазы вторичного объединения в соответствии с картированием судеб, осуществленном в том же исследовании (Bhattacharyya
et al., 2004). Т.о., в обоих исследованиях задокументированы клеточные перемещения, скорее всего, представляющие процесс вторичного объединения, которое происходит на более поздних стадиях скорее, чем направленная миграция во время ранней сегрегации популяций плакод. Недавнее исследование изображений вживую поведения плакодных клеток вовремя ст. сегрегации было осуществлено на Xenopus (Pieper et al., 2011). Авт. осуществили детальный анализ клеточных движений и обмена соседями и не нашли доказательств, подтверждающих мнение направленных перемещений. Эта работа свидетельствует против обширных направленных перемещений клеток на дальнее расстояние, но не исключает возможности локальных направленных перестроек, которые д. обострять границы между соседними плакодными доменами.
Is the initial segregation driven by adhesion-mediated sorting-out?
Анализ изображений у живых не подтверждает мнение о крупномасштабных направленных перемещениях, обеспечивающих инициальную сегрегацию предшественников плакод. Одним из объяснений может быть то, что она, скорее всего, базируется на дифференциальной обеспечиваемой адгезией сортировке, которая может происходить без направленных перемещений (Model 1a, Fig. 3). Это подтверждается функциональными исследованиями транскрипционных факторов Pax6 и Dlx5, соотв. маркеров предшественников хрусталиковых и обонятельных плакод.
В мышиных химерах, содержащих смесь Pax6-/- и дикого типа клеток, Pax6 мутантные клетки исключаются из хрусталиков (Collinson et al., 2000). Это подтверждает способность Pax6-позитивных и Pax6- негативных популяций сегрегировать др. от др., хотя потеря Pax6-/- клеток за счет апоптоза в ткани хрусталика не исключена. Предполагается, что Pax6 регулирует экспрессию молекул межклеточной адгезии, ответственных за этот процесс сортировки (Collinson et al., 2000), но недавнее исследование на мышах скорее подтвердило, что Pax6 контролирует формирование хрусталика, регулируя экспрессию компонентов внеклеточного матрикса (ECM), включая фибронектин (Huang et al., 2011). У рыбок данио принудительная экспрессия Dlx5, обычно присутствующая в домене переднем и соседнем с Pax6+ регионом (презумптивный домен обонятельной плакоды), приводя к образованию кластеров из клеток с избыточной экспрессией Dlx5 и их исключения из хрусталиковой плакоды. Несмотря на отсутствие данных по потере функции, это подтверждает, что Dlx5 может контролировать клеточную сортировку путем регуляции адгезивных свойств плакодных клеток (Bhattacharyya et al., 2004).
Towards a reconciliation of the two models
Реальная ситуация д. соответствовать объединенному сценарию, примиряющему модели 1 и 2, в котором внешние сигналы специфицируют соседние плакодные территории с размытыми границами, которые в дальнейшем будут очищены и станут более четким за счет локальных маломасштабных активных перестроек, как это недавно было описано для формирования дорсо-вентрального паттерна спинного мозга у рыбок данио (Xiong et al., 2013). В этой ситуации степень смешивания ограничена, это согласуется с идеей, что такое перекрывание преувеличено из-за ошибок в экспериментах по картированию судеб (Pieper et al., 2011; Schlosser, 2010).
Гибридная модель подтверждается исследованиями локальной сегрегации между отическими и эпибранхиальными предшественниками плакод у рыбок данио (McCarroll et al., 2012). Авт. использовали Kaede картирование судеб, чтобы показать отическая и субнабор эпибранхиальных предшественников первоначально занимают соседние регионы в домене экспрессии Pax2 латеральнее заднего мозга, в т. наз. PPA (Posterior Placodal Area). Основной источник эпибранхиальных предшественников располагается вне PPA, в соседней, более латеральной не нейральной эктодерме (Bhat and Riley, 2011; Padanad and Riley, 2011). Авт. наблюдали гетерогенную экспрессию Pax2 в PPA, и задались вопросом, могут ли эти различия в уровнях экспрессии Pax2 управлять или влиять на формирование отических, в противоположность эпибранхиальным, плакод. Клетки избыточно экспрессирующие Pax2 преимущественно включаются в отческую плакоду и вносят меньший вклад в эпибранхиальные плакоды по сравнению с контрольными клетками. Более того, они наблюдали перемещение в направлении отического поля в экспериментах с получением изображений вживую. Получение потери функции оказалось более сложным из-за потребности в Pax2 для развития нормальных эпибранхиальных плакод (Padanad and Riley, 2011), и функционального перекрывания между Pax2 и Pax8 в домене PPA. Тем не менее частичный двойной нокдаун Pax2 и Pax8 привел к увеличению количества клеток эпибранхиальных плакод, одновременно с уменьшением (хотя и статически не достоверным) размера отического пузырька. Итак, эти результаты подтвердили, что отические и субнабор эпибранхиальных предшественников, обнаруживаемые в PPA локально сегрегируют др. от др. в соответствии с уровнями экспрессии Pax2/8, при этом высоко и низко экспрессирующие клетки преимущественно вносили вклад в отические и эпибранхиальные плакоды, соотв. Авт. далее показали, что передача сигналов Wnt индуцирует высокий уровень экспрессии Pax2 в PPA и способствует формированию отических плакод. Они предложили модель, согласно которой спецификация с помощью внешних сигналов (Wnt секретируется нервной трубкой) приводит к появлению двух соседних клеточных популяций (отических и эпибранхиальных предшественников) разделенных размытой границей, которые локально отделяются одна от др., чтобы внести вклад в разные плакоды (McCarroll et al., 2012). Эта модель нуждается в подтверждении с помощью недвусмысленной визуализации локального смешивания между двумя популяциями клеток в PPA, и в детальной характеристике их поведения и судеб во время сегрегации отической и эпибранхиальных плакод. Т.о., несмотря на важный прогресс, вопрос инициального разделения всё ещё нуждается в дальнейшем исследовании. Для решения этого фундаментального вопроса необходимо отслеживание судьбы отдельных клеток до и после сегрегации и обнаружение связи между клеточными движениями и изменениями в экспрессии генов. Это может быть достигнуто с помощью трансгенных линий, специфически метящих соседние популяции плакодных предшественников разными цветами. Конструирование таких инструментов теперь осуществимо с помощью knocking-in с использованием техники сконструированных нуклеаз (Auer et al., 2013). Потенциальным затруднением является то, что сегрегация плакод происходит во время всеобщих перемещений конвергенции в направлении срединной линии эмбриона (Bhattacharyya and Bronner-Fraser, 2004; Streit, 2002). Было бы заманчиво отловить потенциальные направленные смещения клеток на короткие расстояния в этих полях конвергенции клеток, но это требует тщательного анализа изменений у соседей.
Morphogenetic movements involved in secondary placode coalescence
Как только плакодные клетки занимают определённые области с отсутствием или слабым перемешиванием по краям, то как достигается физическое разделение плакод?
Многие механизмы могли бы объяснить конденсацию и физическое разделение плакод, включая переходы клеточных судеб, клеточную гибель и изменения в форме клеток и пассивные или активные движения клеток. Однако нет экспериментальных данных, подтверждающих вклад изменений клеточных судеб в фазу вторичного объединения. Апоптические клетки обнаруживаются на границах между плакодами во время разделения между отической и эпибранхиальными областями и позднее во время выделения эпибранхиальных плакод в дискретные кластеры у млекопитающих (Knabe et al., 2009; Washausen and Knabe, 2012; Washausen et al., 2005), но их функциональное значение в разделении плакод не было оценено. Изменения в форме клеток, такие как переход от уплощенной к эпителиальной морфологии (переход от мезенхимы к эпителию) или уменьшение объема плакодных клеток, оба приводят к общей компакции плакодных областей, но такие морфологические переходы не были описаны в подробности. Плакодные клетки могут пассивно подталкиваться или притягиваться к своему финальному местоположению за счет крупномасштабных перемещений, образования складок или роста окружающей ткани. Напр., рост сетчатки может вносить вклад в отделение обонятельных и хрусталиковых предшественников, хотя это нуждается еще в экспериментальной проверке.
Здесь мы сфокусировались на недавних сообщениях, подчеркивающих важный вклад активных морфогенетических движений для вторичного объединения плакод.
Diverse behaviours and movements
Delamination
Тройничная и эпибранхиальные (geniculate, petrosal и nodose) плакоды являются нейрогенными участками, включенными в поверхностную эктодерму, которая продуцирует нейроны, которые встречаются и объединяются с NCC, чтобы сформировать краниальные ганглии в подлежащей мезенхиме (D'Amico-Martel and Noden, 1983). Ганглии, т.о., конденсируются на расстоянии от плакодной эктодермы, подтверждая участие отсоединения от эктодермы (отслоение) и миграцию внутрь плакодных клеток. Мы рассматриваем эти процессы как участвующие во вторичном объединении плакод, т.к. они стартуют вскоре после завершения сегрегации плакодных предшественников (Xu et al., 2008; Stark et al., 1997) и вносят вклад в образование дискретных и сконденсированных происходящих из плакод ганглиев
в конце сомитогенеза. В отической плакоде, др. нейрогенной плакоде, нейробласты также отсоединяются от эпителия, чтобы сформировать статоакустический ганглий, но эта ступень отсоединения затрагивает только часть клеток отических плакод (Schneider-Maunoury and Pujades, 2007).
Процесс отсоединения тройничной и эпибранхиальных плакод первоначально наблюдали на срезах фиксированных тканей у эмбрионов млекопитающих и кур (напр., see Blentic et al., 2011; Graham et al., 2007; Knabe et al., 2009; McCabe et al., 2009; Shiau et al., 2008; Xu et al., 2008), и с помощью мечения DiI поверхностной эктодермы у кур (Stark et al., 1997; Begbie, 2001a; McCabe et al., 2009). Однако отсоединение клеток тройничной и эпибранхиальных плакод от эктодермы, по нашему мнению, не наблюдалось непосредственно у эмбрионов рыбок данио или амфибий. Позднее была разработана система культур поперечных срезов, позволяющая прослеживать поведение клеток во время отсоединения тройничных нейробластов у эмбрионов кур (Shiau et al., 2011). Фильм показывает нейроны, отделяющиеся от поверхностной эктодермы как одиночных клеток или цепочек клеток, соединенных с помощью аксон-подобных выпячиваний. Отсоединение тройничных/эпибранхиальных клеток, которые появляются после инициации нейрогенеза в плакодных областях (Begbie, 2002; McCabe et al., 2009), по-видимому, отличается от канонического эпителиально-мезенхимного перехода (EMT), которому подвергаются NCC, возникающие в нервной трубке, поскольку плакодные клетки, по-видимому, покидают эктодерму в качестве нейронов и , по крайней мере, в эпибранхиальных плакодах, не экспрессируют транскрипционный фактор Snail, как известно, контролирующий EMT (Fig. 4) (Graham et al., 2007).
Directional cell movements
Как мы упоминали ранее, значительные перемещения наблюдаются при получении изображений вживую у эмбрионов кур, это, скорее всего, соответствует фазе объединения (Bhattacharyya and BronnerFraser, 2004; Streit, 2002). Однако в отсутствии разрешения на уровне одиночных клеток трудно сделать вывод отражают ли перемещения точек краски настоящую направленную миграцию клеток или это пассивные перемещения вследствие морфогенеза окружающей ткани.
Разрешение на уровне одиночных клеток поведения клеток хрусталика получено при динамическом анализе морфогенеза оптического бокала у рыбок данио (Kwan et al., 2011), в котором регион глаза отслеживался со ст. 6s, после разделения хрусталиковой и обонятельной плакод. Отслеживание показало, что хрусталиковые предшественники конвергируют в направлении верхушки сетчатки с помощью направленных переднезадних и заднее-передних перемещений, прежде чем подвергнуться изменениям формы, приводящим к инвагинации хрусталиковой плакоды. Интересно, что переднезадняя миграция хрусталиковых клеток осуществляется в координации с подлежащими клетками сетчатки, подтверждая возможное взаимодействие между двумя популяциями клеток (Kwan et al., 2011). Два др. недавних сообщения выявили конвергентные движения во время объединения обонятельной и отической плакод у рыбок данио. Всеобщие переднезадние конвергентные перемещения предшественников плакод сопровождают объединение плакод между ст. 4s и 18s (Harden et al., 2012), тогда как комбинированные конвергентные перемещения по трем направлениям (latero-medial, antero-posterior и postero-anterior) приводят к образованию отической плакоды рядом с задним мозгом между ст. 4s и 11s (Bhat and Riley, 2011). Как было описано выше, форма и поведение клеток тройничной и эпибранхиальных плакод были безупречно установлены вовремя и вскоре после отделения клеток в мезенхиму, но их поведение во время миграции и агрегации в ганглии не было задокументировано. Возможное объяснение в том, что объединение в ганглии нуждается в перемещениях вдоль переднезадней оси, которое не может быть обнаружено на поперечных срезах или методом культивирования срезов. В самом деле, получение изображений вживую на целых эмбрионах рыбок данио, открывает важные переднезадний компонент в миграции клеток тройничной плакоды перед её конденсацией в ганглий. У рыбок данио предшественники тройничных нейронов, по-видимому, первоначально рассредоточены в двух удлиненных доменах вдоль головного мозга (Bhat and Riley, 2011; Knaut et al., 2005). Получение Time-lapse изображений выявило, что между 4s и 10s ст., передние предшественники тройничных нейронов мигрируют направленно, т.к. изолированные клетки или в виде паттерна цепочек обнаруживаются в направлении менее подвижных задних клеток и сливаются с ними, чтобы сформировать компактный кластер рядом с границей между средним и задним мозгом (Fig. 4) (Bhat and Riley, 2011; Knaut et al., 2005).
Хотя эти исследования с получением изображений вживую показали, что вторичное объединение некоторых краниальных плакод использует направленные движения клеток. Но связь между миграцией клеток и отсоединением остается неуловимой в некоторых случаях. В то время как миграция trigeminal/epibranchial клеток в направлении места агрегации ганглия четко сопровождает отсоединение у млекопитающих и кур, остается неясным, мигрируют ли плакодные клетки свободно в подлежащую мезенхиму или наползают на или даже движутся внутри эктодермального слоя во всех др. ситуациях, описанных выше. Более того, у млекопитающих и кур нуждается в прояснении вопрос, подвергаются ли клетки trigeminal/epibranchial плакод движениям объединения в поверхностной эктодерме перед процессом отсоединения. Это требует тщательной проверки позиции плакодных клеток в отношении эктодермы во время их движений объединения.
Cell retention
Др. клеточный процесс участвует в объединении в плакоду - это удержание клеток, в результате которого клетки удерживаются в месте образования плакоды и предохранены от движения прочь за счет активных механизмов, таких как хемотаксис или адгезия между клетками и матриксом.
Такой сценарий, напр., описан для объединения задних плакод боковой линии у рыбок данио. Эти плакоды обнаруживаются в водных позвоночных, генерируют группы клеток (зачатки), которые мигрируют из головы к хвосту вдоль сомитной мышечной перегородки (myoseptum), чтобы отложиться в поверхностные сенсорные органы, наз. neuromasts (Aman and Piotrowski, 2011; Ma and Raible, 2009). Мы наблюдали (Breau et al., 2012), что перед началом этой переднезадней миграции компактное состояние примордия не устанавливается, т.к. изолированные клетки с характеристиками плакод боковой линии представлены впереди зачатка. Хотя эти изолированные клетки выглядят статичными, мы показали, что они активно удерживаются в позиции с помощью хемотаксического механизма, в отсутствие которого они мигрируют прочь от зачатка (Fig. 4). Такое удержание клеток облегчает слияние изолированных плакодных клеток с примордием по мере его развития (Breau et al., 2012). Сходным образом, тройничные нейробласты также, по-видимому, активно удерживаются с помощью хемотаксиса в месте агрегации ганглия у рыбок данио (Knaut et al., 2005).
Исследования на курах и мышах выявили, что образование хрусталиковой плакоды коррелирует с увеличением плотности в эктодерме, покрывающей сетчатку, тогда как область контакта между сетчаткой и окружающей эктодермой оставалась неизменной. Во время этого процесса хрусталиковые клетки изменяют свою форму с кубовидной на столбчатую, но более не пролиферирую и становятся меньше в объеме, сем преплакодные эктодермальные клетки (Huang et al., 2011). Было предположено, что такое локальное увеличение плотности клеток при продолжающейся пролиферации хрусталиковых клеток обеспечивается из закреплением на подлежащем ECM, механизм закрепления, который действует против экспансии плакодной эктодермы. Однако группировка клеток на месте сборки хрусталиковой плакоды д. также происходить из прибывающих мигрирующих клеток, как это описано у рыбок данио (Kwan et al., 2011).
Т.о., объединение в плакоду может использовать разные типы перемещений и поведений, включая отсоединение, направленную миграцию одиночных и цепочек клеток, коллективную конвергенцию или активное удержание клеток. What are the underlying molecular mechanisms?
Cellular interactions and molecular cues
Interaction between placodal and neural crest cells
Накапливаются доказательства, показывающие, что взаимодействия между плакодными и краниальными NCC направляют trigeminal/epibranchial плакодные клетки во время их отсоединения, их миграцию внутрь и объединение. Тесная близость между двумя типами клеток продемонстрирована в ряде исследований на нескольких ст. ганглиогенеза (напр., см. Begbie, 2001; Shiau et al., 2008; Shigetani et al., 2008; Theveneau et al., 2013), совсем недавно в одном сообщение сделано интригующее наблюдение, что NCC формируют коридоры вокруг мигрирующих эпибранхиальных нейробластов у эмбрионов кур и мышей (Freter et al., 2013). Противоположные результаты получены в экспериментах по удалению клеток в попытке выявить функциональные взаимодействия между двумя популяциями клеток. В то время как истощение NCC не сказывалось на развитии лицевого (geniculate) ганглия у мышей (Coppola et al., 2010), устранение NCC у кур нарушало объединение в краниальные ганглии без нарушения отсоединения плакодных клеток (Shiau et al., 2008), или приводило к ранним дефектам отсоединения в др. исследовании (Begbie, 2001). Недавнее сообщение продемонстрировало, что генетическое удаление субтипов NCC, которые являются хондрогенными NCC, но не дающими глию NCC, необходимы для инициального формирования эпибранхиальных ганглиев у рыбок данио (Culbertson et al., 2011). Это подтверждает, что противоречивые результаты, получаемые в разных контекстах истощения NCC могут быть обусловлены различиями в природе субпопуляций NCC, затрагиваемых процедурой устранения (Culbertson et al., 2011).
У кур система Slit/Robo обеспечивает, по крайней мере, частично взаимодействие между NCC и клетками тройничной плакоды. NCC экспрессируют Slit1 лиганд, тогда как плакодные клетки экспрессируют его известный рецептор Robo2, а функциональные нарушения этой пары лиганд-рецептор приводят к дезорганизованным тройничным ганглиям (Shiau et al., 2008). Те же авт. далее показали, что N-Cadherin действует в кооперации с передачей сигналов Slit1/Robo2, обеспечивая объединение в тройничный ганглий (Shiau and Bronner-Fraser, 2009).
Объединение в дискретные эпибранхиальные плакоды из инициального эпибранхиального плакодного домена, как было установлено, использует оригинальный механизм реципрокных взаимодействий между NCC и плакодными клетками у Xenopus (Theveneau et al., 2013). Это исследование четко продемонстрировало, что клетки эпибранхиальных плакод мигрируют
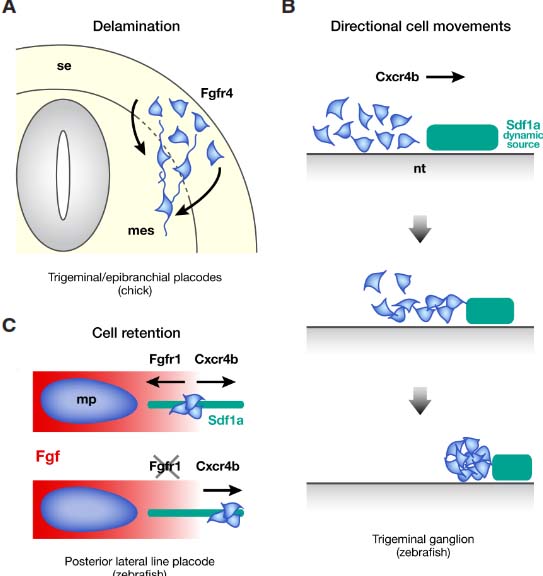 Fig. 4. Examples illustrating active morphogenetic mechanisms that drive secondary placode coalescence.
Fig. 4. Examples illustrating active morphogenetic mechanisms that drive secondary placode coalescence.
(A) Delamination. Trigeminal and epibranchial placodal cells delaminate from the surface ectoderm (se) as neurons before migrating in the underlying mesenchyme (mes) and coalescing into sensory ganglia. In chick, this process depends on the function of the Fgfr4 receptor expressed by placodal cells (Lassiteret al., 2009). Dorsal to the top. nt: neural tube.
(B) Directional cell movements. In zebrafish, Cxcr4b-expressing trigeminal neurons undergo an antero-posterior migration before condensing into ganglia. They move as isolated cells or with a chain-like pattern towards a dynamic source of Sdf1a cue (Knaut et al., 2005;
Lewellis et al., 2013). Anterior to the left. nt: neural tube.
(C) Cell retention. In zebrafish, before the migration onset of the posterior lateral line primordium, the compact state of the primordium is not fully established, as isolated cells with lateral line placode identity are present ahead of the main primordium (mp). The static position of these cells results from two opposing chemotactic signals. Cxcr4b/Sdf1a signalling attracts the cells away from the primordium, whereas Fgf ligands secreted by the main primordium attract them in the opposite direction, thereby retaining them in the vicinity of the placode. Thus, upon inhibition of Fgf signalling, the cells move away in a Cxcr4b/Sdf1a-dependent manner. This chemotactic cell retention mechanism facilitates the coalescence of the isolated cells with the main primordium into a compact group of migrating cells (Breau et al., 2012). Anterior to the left.
вентрально и разделяются на самостоятельные потоки, как только контактируют с соседним и более дорсальным краниальным NCC. Это результат поведения chase-and-run, при котором NCC привлекаются плакодными клетками, а плакодные клетки в свою очередь отталкиваются с помощью NCC (Theveneau et al., 2013). Cell/matrix adhesion
Морфогенетические перемещения чаще всего базируются на взаимодействиях между клетками и компонентами ECM, которые в основном обеспечиваются интегриновыми рецепторами. Bhat and Riley предприняли функциональный анализ у рыбок данио itga5, гена, кодирующего субъединицу альфа интегрина, экспрессируемую в PPR домене со ст. 1s и в плакодах во время их объединения (Bhat and Riley, 2011). Morpholino-обусловленный нокдаун приводил к дезорганизации задних плакод (тройничной, эпибранхиальных и отической плакод), а получение изображений вживую показало. что поведение клеток более беспорядочное во время движений конвергенции, сопровождающих объединение в отическую плакоду и переднезаднюю миграцию тройничных нейробластов (Bhat and Riley, 2011). Itga5- содержащие интегрины т.о. необходимы для собственно объединения в задние плакоды и было бы интересно идентифицировать лиганды, которые обеспечивают этот эффект. Более того, передние плакоды не подвержены влиянию у itga5 -дефицитных эмбрионов, подтверждая, что сборка передних плакод базируется на др. интегриновых рецепторах и др. системах адгезии.
У эмбрионов мыши увеличение плотности клеток, наблюдаемое во время формирования хрусталика, коррелирует с накоплением фибронектина, основного компонента ECM между сетчаткой и лежащей поверх плакодной эктодермой (Huang et al., 2011). Knocking-out гена фибронектина нарушает сливной рост клеток в хрусталиковой плакоде, которая, по-видимому, крупнее, чем в контроле (Huang
et al., 2011). Этот результат подтверждает, что фибронектин работает как сигнал удержания и закрепления для клеток хрусталика, расположенных выше сетчатки (как полагают авт.). Альтернативно фибронектин может действовать как сигнал наведения направленной миграции хрусталиковых предшественников в направлении места образования плакоды.
Chemokine signalling
Путь хемокинов Cxcr4b/Sdf1a(Cxcl12a), который управляет перемещениями многих типов клеток во время развития, во взрослой жизни и при патологических состояниях, таких как рак, контролирует сборку обонятельной, тройничной и эпибранхиальных плакод.
У рыбок данио Cxcr4b рецептор экспрессируется в предшественниках обонятельной плакоды, окружённой телэнцефалоном, продуцирующим Sdf1an. У мутантов cxcr4b субнабор клеток обонятельных плакод занимает аберрантную переднюю позицию в конце процесса объединения (Miyasaka et al., 2007). Предполагается, что Cxcr4b/Sdf1a работает как сигнал удержания против всеобщего направленного кпереди морфогенетического потока, который обнаруживается в головном регионе на этой ст. (Miyasaka et al., 2007). Однако получение изображений вживую недавно выявило, что клетки обонятельных плакод вместо того, чтобы удерживаться в определенной позиции, движутся в направлении задней зоны обонятельного поля, чтобы сформировать две компактные плакоды (Harden et al., 2012), подтверждая, что их передняя неправильная позиция у мутантов cxcr4b может быть результатом их нарушенных переднезадних перемещений. Это было подтверждено с помощью получения time lapse изображений. Более того, т.к. сборка плакод затронута только частично у мутантов cxcr4b (Miyasaka et al., 2007), др. молекулярные механизмы д. работать и остается их идентифицировать.
Передача сигналов Cxcr4b/Sdf1a хемокинов также управляет переднезадней миграцией и объединением тройничных нейронов у рыбок данио. Cxcr4b экспрессируется тройничными нейронами, тогда как сигнал Sdf1a, продуцируемый окружающими клетками с неизвестными характеристиками, позади сенсорных нейронов, вблизи места сборки ганглиев (Fig. 4). У Cxcr4b/Sdf1a -дефицитных эмбрионов передние нейроны неспособны мигрировать соответственно в направлении и сливаться с более задними клетками, а нейроны, покидающие небольшие кластеры, подтверждают, что путь Cxcr4b/Sdf1a не только управляет переднезадней миграцией тройничных нейронов, но и также поддерживает их в ганглиолярных кластерах, действуя как сигнал удержания. Важно, что эти механизмы привлечения и удержания, по-видимому, работают против передних морфогенетических перемещений окружающих тканей, как показывает мечение клеток в окружении плакодных клеток (Knaut et al.,2005). Второе исследование далее показало, что передний рецептор для Sdf1a, Cxcr7b, необходим для миграции тройничных нейронов (Lewellis et al., 2013). В соответствии с его экспрессией вблизи окружения мигрирующих нейронов, Cxcr7b необходим вблизи нейронов скорее, чем в самих нейронах (Lewellis et al., 2013), в отличие от Cxcr4b, который действует клеточно-автономно (Knaut et al., 2005). Двойные мутанты Cxcr4b/Cxcr7b обнаруживают дефекты миграции, которые не столь значительны по сравнению с таковыми у одиночных мутантов, подтверждая, что два рецептора работают в одном и том же пути. Избыточная экспрессия Cxcr7b вблизи нейронов нарушает их миграцию. Более того, используя интернализацию Cxcr4b-GFP слитого белка для считывания активной передачи сигналов Sdf1/Cxcr4b, авт. продемонстрировали, что Cxcr7b снижает эту передачу сигналов. Эти результаты подтверждают, что Cxcr7b инактивирует Sdf1, действуя как слив для этого хемокина, как показывают др. системы (Boldajipour et al., 2008; Dona et al., 2013; Venkiteswaran et al., 2013). Авт. предложили модель, согласно которой Cxcr7b работает синергично с мРНК Sdf1 в системе очистки, обеспечиваемой с помощью microRNA, miR-430; вместе они динамически формируют источник Sdf1 и таким образом, что он всегда тесно ассоциирован с и впереди мигрирующих тройничных нейронов, следовательно, направляет их вдоль переднезадней оси (Fig. 4, Lewellis et al., 2013). Т.о., если Cxcr7b
и Cxcr4b, скорее всего, конкурируют за связывание Sdf1a лиганда на молекулярном уровне, то они действуют совместно, способствуя миграции тройничных нейронов. Тонкий пространственно-временной контроль источников хемокинов д. предупреждать тройничные нейроны от реакции на др. соседние источники аттрактанта Sdf1a, такие как телэнцефалон между двумя обонятельными плакодами (Lewellis et al., 2013).
Наконец передача сигналов Cxcr4b/Sdf1a хемокинов обеспечивает поведение преследования в реципрокных взаимодействиях NCC и эпибранхиальных плакод, описанные Theveneau and colleagues (Theveneau et al., 2013). В этой ситуации плакодные клетки играют роль источника Sfd1a, которые привлекают экспрессирующие Cxcr4b NCC. В свою очередь контакты между NCC и плакодными клетками, отталкивающими плакоды, это процесс, нуждающийся в передаче сигналов Wnt-PCP и N-cadherin. Такой механизм гарантирует постоянное смещение источника Sdf1a и скоординированные перемещения двух соседних популяций, которые приводят к разделению домена эпибранхиальных плакод на самостоятельные пальцеобразные потоки клеток (Theveneau et al., 2013).
Fgf signalling
Помимо известной роли в индукции, спецификации и дифференцировке плакод (Bailey et al., 2006; Freter et al., 2008; Ladher, 2005; Maier et al., 2010; Martin, 2006; Nechiporuk et al., 2006; Nikaido et al., 2007; Sun et al., 2007), передача сигналов Fgf контролирует некоторые аспекты перемещений и поведения, управляющих объединением в плакоды.
Рецептор Fgfr4 временно экспрессируется в клетках тройничной плакоды во время процесса отсоединения у эмбрионов кур. Экспрессия доминантно негативных форм Fgfr4 предупреждает отсоединение плакодных клеток, которые в конечном итоге теряют свои характерные тройничные особенности и способность дифференцироваться в сенсорные нейроны (Fig. 4) (Lassiter et al., 2009). Природа и локализация сигналов Fgf, контролирующих этот процесс, неизвестны.
Ранее мы упоминали, что у рыбок данио изолированные плакодные клетки, располагаются впереди зачатков задней части боковой линии перед началом миграции. Мы показали, что после ингибирования передачи сигналов Fgf, эти изолированные клетки движутся прочь от зачатка, демонстрируя, что активность Fgf необходима для их поддержания вблизи плакод. Далее мы установили, что это удержание обеспечивается с помощью Fgf хемотаксических лигандов, секретируемых зачатком (Fig. 4) (Breau et al., 2012). Этот механизм облегчает объединение в плакоды путём образования компактной группы из мигрирующих клеток. Передовая миграция изолированных клеток, наблюдаемая в отсутствие передачи сигналов Fgf, обусловлена Cxcr4b/Sdf1a-обеспечиваемым привлечением, которое позднее контролирует переднезаднюю миграцию зачатка (Fig. 4) (Aman and Piotrowski, 2011; Ma and Raible, 2009). Т.о., поскольку передача сигналов Cxcr4b/Sdf1a необходима для объединения некоторых плакод, она работает против инициальной компакции плакод задней части боковой линии, для этого необходим противодействующий эффект сигналов
Fgf.
Conclusions and future directions
In conclusion, we propose to see placode assembly as a sequence of two events, the early segregation of placodal precursors and their subsequent coalescence into discrete placodal derivatives. This view provides a comprehensive framework that facilitates our interpretation and understanding of old and novel experimental data obtained in the field of cranial placode development.
A better knowledge of the mechanisms underpinning both steps of placode assembly will require to revisit fate map studies with state-of-the-art lineage tracing tools, such as those available in the zebrafish model (Cre/Lox technology, local protein photoactivation), combined with high-resolution live imaging of behaviour, polarity/shape changes, and intracellular dynamics of placodal cells.
There is increasing evidence supporting the importance of cell movements and active retention during the secondary placode coalescence phase. Cxcr4b/Sdf1a chemokine signalling appears to be commonly used by different placodal cell types during coalescence.It will be interesting to determine whether the Fgf pathway, mostly known for its implication in early placode induction/specification or late remodelling of placodal-derived tissues (Lecaudey et al., 2008; Sai and Ladher, 2008), also plays a common role in the morphogenetic mechanisms driving placode assembly. A major challenge will be to identify the intracellular regulators that translate these signals into cell shape changes and migratory behaviours, as the diversity of placode morphologies may come from differences in their way of interpreting and transducing these common cues. The discovery of new molecular players will benefit from techniques such as RNA sequencing, chemical and genetic screens, and emerging
genome editing approaches using engineered endonucleases.
Finally, during neurogenic placode formation, placodal-derived neurons not only have to find their proper location, but also face the challenge of establishing appropriate connections with their peripheral and central target tissues to form functional neuronal circuits relaying sensory information to the brain. How the assembly of placodal-derived structures is coordinated with the initiation of this innervation represents another fascinating, yet unexplored question in the developmental biology of sensory organs and ganglia.
|
 Fig. 1. Position of placodal precursors and placodal structures before and after placode assembly. (A) Schematic view of placode progenitors scattered and intermixed within the pan-placodal region (PPR) surrounding the anterior neural plate at the one stage (dorsal view of a theoretical vertebrate). (B) Compact and individualized placodes occupying specific positions along the anteroposterior axis of the embryo from mid-somitogenesis stages onwards (the dotted line surrounding the placode indicates dorsal view, the ventral position of the adenohypophysis). Anterior to the left.
Fig. 1. Position of placodal precursors and placodal structures before and after placode assembly. (A) Schematic view of placode progenitors scattered and intermixed within the pan-placodal region (PPR) surrounding the anterior neural plate at the one stage (dorsal view of a theoretical vertebrate). (B) Compact and individualized placodes occupying specific positions along the anteroposterior axis of the embryo from mid-somitogenesis stages onwards (the dotted line surrounding the placode indicates dorsal view, the ventral position of the adenohypophysis). Anterior to the left.  Fig. 2. Placode assembly seen as a two-step developmental process. Fate map studies suggest two sequential steps in placode formation: segregation of intermingled placodal precursors into immiscible but still juxtaposed placodal domains (initial segregation), and further compaction resulting in discrete and condensed placodes separated by non-placodal tissues (secondary coalescence). The table indicates the corresponding developmental stages reported in studies using zebrafish, Xenopus and chick embryos (Data compiled from Kozlowski et al., 1997; Bhattacharyya and Bronner, 2013; Bhattacharyya and Bronner-Fraser, 2004; Breau et al., 2012; Dutta et al., 2005; Harden et al., 2012; Knaut et al., 2005; Kwan et al., 2011; Pieper et al., 2011; Streit, 2002; Whitlock and Westerfield, 2000; Xu et al., 2008). In the upper panel, the colored dots represent progenitors of adjacent placodes, whether or not they are specified.
HH: Hamburger Hamilton. pLLP: posterior lateral line placode. s: somite.
Fig. 2. Placode assembly seen as a two-step developmental process. Fate map studies suggest two sequential steps in placode formation: segregation of intermingled placodal precursors into immiscible but still juxtaposed placodal domains (initial segregation), and further compaction resulting in discrete and condensed placodes separated by non-placodal tissues (secondary coalescence). The table indicates the corresponding developmental stages reported in studies using zebrafish, Xenopus and chick embryos (Data compiled from Kozlowski et al., 1997; Bhattacharyya and Bronner, 2013; Bhattacharyya and Bronner-Fraser, 2004; Breau et al., 2012; Dutta et al., 2005; Harden et al., 2012; Knaut et al., 2005; Kwan et al., 2011; Pieper et al., 2011; Streit, 2002; Whitlock and Westerfield, 2000; Xu et al., 2008). In the upper panel, the colored dots represent progenitors of adjacent placodes, whether or not they are specified.
HH: Hamburger Hamilton. pLLP: posterior lateral line placode. s: somite.  Fig. 3. Two scenarios for the initial segregation of placodal precursors. (Model 1). Large-scale sorting out of early-specified intermingled placodal precursors. Specified placodal precursors initially present a high degree of intermixing and actively sort-out from each other by differential adhesion (Model 1a) or directional migration (Model 1b). (Model 2). Random movements preceding specification of placodal identities by surrounding signalling centers. Unspecified progenitors undergo random movements within the PPR before being specified by environmental signals. Further patterning mechanisms (cross-repression of transcription factors) lead to the formation of a sharp boundary between placodal domains. Grey and colored dots represent unspecified and specified placodal progenitors, respectively.
Fig. 3. Two scenarios for the initial segregation of placodal precursors. (Model 1). Large-scale sorting out of early-specified intermingled placodal precursors. Specified placodal precursors initially present a high degree of intermixing and actively sort-out from each other by differential adhesion (Model 1a) or directional migration (Model 1b). (Model 2). Random movements preceding specification of placodal identities by surrounding signalling centers. Unspecified progenitors undergo random movements within the PPR before being specified by environmental signals. Further patterning mechanisms (cross-repression of transcription factors) lead to the formation of a sharp boundary between placodal domains. Grey and colored dots represent unspecified and specified placodal progenitors, respectively.  Fig. 4. Examples illustrating active morphogenetic mechanisms that drive secondary placode coalescence.
Fig. 4. Examples illustrating active morphogenetic mechanisms that drive secondary placode coalescence.