Посещений: 
ВЫБОР КЛЕТОЧНЫХ СУДЕБ
Satb1 регулирует клеточные судьбы посредством передачи сигналов Fgf
The chromatin modifier Satb1 regulates cell fate through Fgf signalling in the early mouse embryo
Mubeen Gool am and Magdalena Zer nicka-Goetz  Development (2017) 144, 1450-1461 doi:1 0.1242/dev .144139
|
The separation of embryonic from extra-embryonic tissues within the inner cell mass to generate the epiblast (EPI), which will form the new organism, from the primitive endoderm (PE), which will form the yolk sac, is a crucial developmental decision. Here, we identify a chromatin modifier, Satb1, with a distinct role in this decision. Satb1 is differentially expressed within 16-cell-stage embryos, with higher expression levels in the inner cell mass progenitor cells. Depleting Satb1 increases the number of EPI cells at the expense of PE. This phenotype can be rescued by simultaneous depletion of both Satb1 and Satb2, owing to their antagonistic effect on the pluripotency regulator Nanog. Consequently, increasing Satb1 expression leads to differentiation into PE and a decrease in EPI, as a result of the modulation of expression of several pluripotency- and differentiationrelated genes by Satb1. Finally, we show that Satb1 is a downstream target of the Fgf signalling pathway, linking chromatin modification and Fgf signalling. Together, these results identify a role for Satb1 in the lineage choice between pluripotency and differentiation and further our understanding of early embryonic lineage segregation.

|
Ранние эмбрионы млекопитающих д. быть правильно специфицированы на три самостоятельные клеточные линии: эпибласт (EPI), который дает собственно эмбрион, и два внеэмбриональных клона, трофэктодерма (TE) и примитивная энтодерма (PE), которые необходимы для критических поддерживающих структур, плаценты и желточного мешка, соотв. На ст. 16 клеток, мышинные эмбрионы состоят из популяции внешних и внутренних клеток с разными судьбами. Внешние клетки дают TE, тогда как внутренние клетки формируют плюрипотентную inner cell mass (ICM) бластоциста. PE и EPI происходят из ICM раннего бластоциста. Предыдущие исследования показали, что в раннем бластоцисте ICM содержит смешанную популяцию предшественников PE и EPI в виде мозаичного ' соль-и-перец' распределения, которые рассортировываются сами собой на самостоятельные слои к моменту, когда бластоцист готов имплантироваться [день эмбриогенеза (E) 4.5)] за счет активных клеточных перемещений ( Chazaud et al., 2006; Kurimoto et al., 2006; Meilhac et al., 2009; Plusa et al., 2008). Хотя они и составляют смешанную популяцию, но индивидуальные клетки в раннем бластоцисте различаются достаточно, чтобы смогли сформировать или PE, или EPI, но редко оба (Morris et al., 2010). Показано, что предшественники EPI экспрессируют маркер плюрипотентности Nanog, секретируют Fgf4 лиганд в ICM, который может инициировать сигнальный каскад в Gata6 позитивных предшественниках PE, которые содержат высоко экспрессируемый рецептор Fgfr2 на своих мембранах (Frankenberg et al., 2011; Kurimoto et al., 2006; Morris et al., 2013; Ohnis hi et al., 2014). Эта передача сигналов Fgf является критической для предупреждения Nanog от ингибирования Gata6 и от выбора клетками PE клеточной судьбы (Frankenberg et al., 2011; Kang et al., 2013; Krawchuk et al., 2013; Sc hrode et al., 2014). В самом деле, когда передача сигналов Fgf подавляется, то все клетки ICM направляются по пути развития в направлении Nanog-позитивных EPI клеточных судеб без образования какой-либо PE, тогда как избыточная экспрессия приводит к противоположному фенотипу, при этом все клетки превращаются в Gata6- и Sox17-позитивную PE ( Chazaud et al., 2006; Feldman et al., 1995; Frankenberg et al., 2011; Nich ols et al., 2009; Yamanaka et al., 2010). Хотя роль передачи сигналов Fgf хорошо известна, но всё ещё остается неизвестным, как происходит выбор судьбы между PE и EPI.
Когда мы проанализировали уже имеющиеся данные о наборах генов, дифференциально экспрессирующихся у первых предшественников ICM (внутренние клетки) и TE (внешние клетки) на ст. 16 клеток (Graham et al., 2014), то наше внимание было привлечено к Satb1 , модификатору хроматина, которые в 3 раза больше экспрессируется во внутренних клетках по сравнению с внешними, в принципе указывая на роль в ICM. Хотя роль Satb1 в ранних мышиных эмбрионах неизвестна, было показано, что он регулирует плюрипотентность в мышиных эмбриональных стволовых клетках (mESCs; Savarese et al., 2009), чтобы регулировать самообновление и плюрипотентность гематопоэтических (Will et al., 2013) и трофобластных стволовых клеток ( Asano ma et al., 2012) и способствовать дифференцировке гематопоэтических стволовых клеток (Satoh et al., 2013).
DISCU SSION
Спецификация трех разных клеточных клонов у эмбрионов мышей происходит во время выбора двух судеб клетками. Первое решение о клеточной судьбе разделяет популяции ICM и TE клеток, тогда как второй судьбоносный выбор далее специфицирует ICM на PE и EPI. Это является критическим, что все три клона правильно специфицируются, чтобы сформировать бластоцист, способный имплантироваться в стенку матки и развиваться далее. С целью идентификации новых регуляторов, контролирующих выбор клетками во время пред-имплантационного развития, мы установили, что модификатор хроматина Satb1 является важным игроком. Satb1 впервые был идентифицирован в тимоцитах, где он, как известно, регулирует экспрессию генов путем организации в петлевые домены высокого порядка хроматина и путем действия в качестве платформы для приземления ' landing platform ' для ферментов, моделирующих хроматин (Cai et al., 2006; Yasui et al., 2002). В mESCs, Satb1, как было установлено, регулирует плюрипотентность посредством прямого подавления Nanog; Satb1 нокаутные mESCs сохраняют экспрессию Nanog даже когда помещены в соеду для дифференцировки (Savares e et al., 2009). Однако, роль Satb1 у пре-имплантационных эмбрионов оставалась неизвестной. Мы установили, что экспрессия Satb1 специфически усиливается на уровне мРНК и белка во внутренних клетках на 16-клеточной стадии, когда впервые специфицируется ICM, указывая на его потенциальную роль в спецификации этих клеток. Далее мы установили, что Satb1 специфически усиливает свою активность в предшественниках PE, подчеркивая его потенциальное значение для спецификации PE. Мы подтвердили эту гипотезу путем подавления активности Satb1, которая, как было установлено, приводит к редукции количества PE клеток и к увеличению количества EPI клеток на ст. бластоциста. Избыточная экспрессия Satb1 обнаруживает противоположный эффект на спецификацию клонов и способствует появлению PE клона в ICM. Наш клональный нокдаун и избыточная экспрессия подтвердили эти находки, т.к. мы обнаружили, что бластомеры с редуцированным Satb1 преимущественно дают EPI, а те, что с повышенным Satb1 преимущественно дают PE. Мы установили, что Satb1 не оказывает эффекта на 16-32-клеточной стадии у эмбрионов, когда спецификация PE инициирована. Скорее всего, он играет роль в детерминации клеток внутри бластоциста в PE клон. Мы также установили изменения в клеточных судьбах обусловливаются модуляцией экспрессии серии клон-специфичных генов, стоящих ниже передачи сигналов Fgf.
Мы установили, что хотя модуляция экспрессии Satb1 четко влияет на детерминацию клеточной судьбы у пре-имплантационных эмбрионов, оно редко приводит к полному устранению или PE или EPI клонов. Это важно, если рассматривать в контексте нокаута Satb1 у мышей, которые выживают во время эмбрионального развития, но погибают спустя 3 недели после рождения (Alvarez et al., 2000). Если Satb1 важен для регуляции баланса между плюрипотентностью и дифференцировкой, как это было установлено здесь, то как это можно примирить с отсутствием пре-имплантационного фенотипа у нокаутных мышей? Ранее было показано, что минимальная потребность для успешного развития составляет три-четыре плюрипотентные клетки к моменту имплантации (Morri s et al., 2012; Sori ano and Jaenisch, 1986). Если Satb1-/ - эмбрионы погибают, обнаруживая фенотипические отклонения, то они, скорее всего, д. обладать ICM с более высокими количествами EPI клеток и низкими количествами PE клеток. Сходные фенотипические отклонения были найдены у Fgf4+/ - и Gata6+/- эмбрионов и в обоих случаях эмбрионы были способны к восстановлению на ст. E4.5 (Besso nnard et al., 2014; Krawchuk et al., 2013). Следовательно, возможно, что хотя Satb1 и помогает организовывать и специфицировать правильные количества PE и EPI клеток в ICM, это может быть не абсолютно существенным для жизнеспособности эмбриона и может быть скомпенсировано в соответствии с высоко регулируемой природой развития млекопитающих.
Satb1 тесно связан с др. членом семейства, Satb2, это заставило нас исследовать, может ли Satb2 также действовать в пре-имплантационном развитии. Мы установили, что хотя само по себе подавление Satb2 не оказывает эффекта на развитие, истощение обоих генов, однако, частично способно восстанавливать Satb1 RNAi фенотип. Это согласуется с результатами на mESCs, поскольку нокдаун обоих Satb1 и Satb2 устраняет нарушения дифференцировки, наблюдаемые у Satb1-/ - mES Cs (Savarese et al., 2009). Наши результаты показали, что, скорее всего, нокдаун Satb2 снижает количество мРНК Nanog, противоположный эффект редукции Satb1. В соответствии с этим избыточная экспрессия Satb2 способна увеличивать экспрессию Nanog, подтверждая, что Satb2 является позитивным регулятором Nanog . Satb1 и Satb2, следовательно, оказывают противоположные эффекты на экспрессию Nanog. Поэтому мы полагаем, что если Satb1 в отдельности редуцирован, то снижает (releases) свою репрессию и Nanog, и Satb2 , и этого оказывается достаточно, чтобы склонить выбор клеточных судеб в направлении EPI. Эта склонность строго подтверждается тем фактом, что Satb1 действует также как позитивный регулятор факторов дифференцировки PE, Sox17 и Gata6. Нокдаун и Satb1, и Satb2 устраняет как репрессию, так и активацию экспрессии Nanog, при этом свреднем происходит нормализация уровней экспрессии Nanog. Представленные результаты, демонстрирующие эффект Satb2 на Nanog, могут помочь объяснить, почему невозможно получить Satb2-/ - mESCs (Savares e et al., 2009), поскольку без соотв. уровня экспрессии Nanog , было бы невозможно получить функциональные клоны ESC.
Эффект Satb2 на экспрессию Nanog ставит вопрос, почему снижение уровней Satb2 в эмбрионе не влияет на развитие в той же самой степени, что и модуляция Satb1. Одним из объяснений является то, что хотя Satb2 si RNA способна снижать уровни Nanog, но всё ещё более 65% мРНК Nanog присутствует после RNAi . Хотя Nanog является критическим фактором в детерминации клеточной судьбы, в высоко регулятивных мышиных эмбрионах 35% снижение уровня Nanog может оказаться недостаточным, чтобы управлять изменениями в клеточных судьбах. Кроме того, наши результаты подтверждают, что хотя Satb2 может влиять только на экспрессию Nanog у эмбрионов, Satb1 оказывает эффекты на экспрессию многих генов, включая Cdx2 , Gata6 , Id2 и Sox 17. Тот же самый паттерн, хотя и с противоположными эффектами на экспрессию, был отмечен при избыточной экспрессии Satb1 и Satb2 . Комбинированные эффекты Satb1, на многочисленные гены, достаточны для управления изменениями в клеточных судьбах в ICM. Модуляции Satb2, однако, лишь умеренно влияют на Nanog. Это может также объяснить, почему двойной нокдаун Satb1 и Satb2 приводит только к частичному восстановлению Satb1 siRNA фенотипа, поскольку, хотя уровни экспрессии Nanog могут быть сохранены, эффекты на др. гены, регулируемые с помощью Satb1 - нет.
Наконец, наши результаты показывают, что экспрессия Satb1 контролируется с помощью передачи сигналов Fgf, т.к. мы установили, что подавление передачи сигналов Fgf подавляет экспрессию Satb1, которая может быть восстановлена путем добавления экзогенной мРНК Satb1. Мы также попытались устранить пертурбации в судьбах клеток, возникающие после подавления передачи сигналов Fgf ( Nichols et al., 2009; Schrode et al., 2014; Yamanaka et al., 2010) с помощью избыточной экспрессии мРНК Satb1, но оказались неспособны восстановить экспрессию PE маркеров на ст. бластоциста (data not shown). Мы полагаем, что это из-за того путь передачи сигналов Fgf имеет многочисленные и разнообразные мишени у эмбрионов мышей и восстановление одной из них
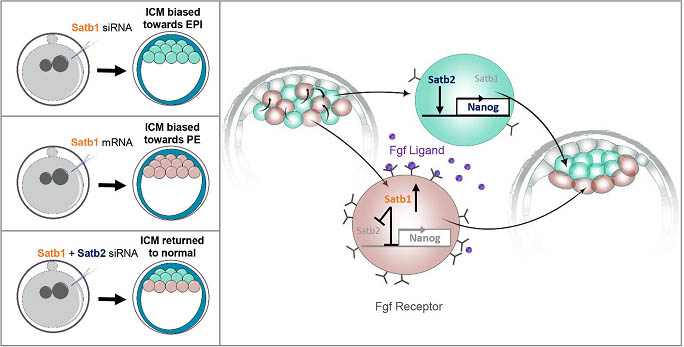 Fig. 7. Mode l for the role of Satb1 in ICM lineage segregation. A 'salt -and-pepper ' distribution of Fgfr2 by the 64-c ell stage mea ns that different cells have different responses to Fgf4 signalling. Cells with lower levels of Fgfr2 are less susceptible to Fgf4 signalling and do not upregulate Satb1. Nanog is therefore more highly expressed, promoting the formation of EPI. When Satb1 is knocked down using a specific siRNA there is an increase in Nanog and therefore an increase in the number of EPI cells present in the embryo. Converse ly, cells that are more susceptible to Fgf4 signalling have higher levels of Satb1. H igher expression of Satb1 leads to the inhibition of Nanog and Satb2 . This in turn leads these cells to differentiate into PE. O verexpression of Satb1 with an mRNA is likewise able to bias cell fate towards the PE linea ge. Reducing both Satb1 and Satb1 simultaneo usly is able to restore the balance in PE and EPI by remov ing both an act ivator and repressor of Nanog.
Fig. 7. Mode l for the role of Satb1 in ICM lineage segregation. A 'salt -and-pepper ' distribution of Fgfr2 by the 64-c ell stage mea ns that different cells have different responses to Fgf4 signalling. Cells with lower levels of Fgfr2 are less susceptible to Fgf4 signalling and do not upregulate Satb1. Nanog is therefore more highly expressed, promoting the formation of EPI. When Satb1 is knocked down using a specific siRNA there is an increase in Nanog and therefore an increase in the number of EPI cells present in the embryo. Converse ly, cells that are more susceptible to Fgf4 signalling have higher levels of Satb1. H igher expression of Satb1 leads to the inhibition of Nanog and Satb2 . This in turn leads these cells to differentiate into PE. O verexpression of Satb1 with an mRNA is likewise able to bias cell fate towards the PE linea ge. Reducing both Satb1 and Satb1 simultaneo usly is able to restore the balance in PE and EPI by remov ing both an act ivator and repressor of Nanog.
недостаточен, чтобы преодолеть множественные эффекты подавления передачи сигналов Fgf. Соотв., репрессия передачи сигналов Fgf приводит к сходным, но более тяжелым фенотипам, по сравнению с тем, что при подавлении Satb1 , при этом все ICM клетки экспрессируют маркеры EPI клонов (Frankenb erg et al., 2011; Yamanaka et al., 2010). Это указывает на то, что Satb1 может быть одной из связей между передачей сигналов Fgf и её нижестоящими мишенями у ранних эмбрионов мыши. В соответствии с этим передача сигналов Fgf и Satb1 обе способствуют пролиферации и поддержанию стволовых клеток и подавляют дифференцировку трофобластных стволовых клеток (Asanoma et al., 2012; Tanaka et al., 1998). Итак, наши результаты подтверждают, что Satb1 может действовать как модификатор хроматина, модулируя экспрессию нижестоящих генов по сравнению с передачей Fgf, подчеркивая критическую недостающую ступень ремоделирования хроматина, которая может служить становлению предшественников для двух самостоятельных клонов в ICM. Мы полагаем. что Satb1 может потенциально действовать двумя способами, чтобы управлять судьбами ICM клеток. Во-первых, т.к. Satb1 был обнаружен в экспериментах по ко-иммунопреципитации, который соединялся непосредственно с 5 ' фланкирующей последовательность Nanog в mESCs (Savarese et al., 2009), поэтому мы полагаем, что Satb1 должен также соединяться непосредственно с вышестоящим Nanog, чтобы репрессировать его транскрипцию у эмбрионов мыши. Во-вторых, мы установили, что Satb1 может регулировать экспрессию многочисленных генов у эмбрионов мыши, поэтому мы предполагаем, что это является функцией, отражающей его способность действовать как ' landing platform', которая способна рекрутировать ферменты, ремоделирующие хроматин, чтобы активировать или репрессировать экспрессию генов (Yasui et al., 2002).
Итак, можно предположить, что клетки внутри ICM обладают разными уровнями рецептора Fgf, Fgfr2, на своих мембранах (Guo et al., 2010; Krupa et al., 2014; Kurimoto et al., 2006; Morri s et al., 2013; Ohnis hi et al., 2014). Клетки с большим количеством рецепторов более чувствительны к лиганду Fgf (который секретируется на этой стадии внутренними клетками) и поэтому имеются более высокие уровни Satb1 (Fig. 7). Более высокая экспрессия Satb1 д. приводить к подавлению факторов плюрипотентности Nanog и Satb2, которое в свою очередь д. приводить к инициации дифференцировки в PE клон (Fig. 7). Клетки, которые менее чувствительны к передаче сигналов Fgf4 обнаруживают пониженные уровни Satb1, что в сою очередь приводит к большей экспрессии Nanog и, следовательно, склоняет выбор клеточных судеб в направлении плюрипотентного EPI клона. Кроме того, потеря Satb1 и Satb2 устраняет и активаторы и репрессоры Nanog, вызывая образование нормального ICM (Fig. 7). Эта гипотеза баз ируется на результатах, представленных здесь, помогает пониманию механизма, который приводит к возникновению ' salt-and-pepper ' распределению Gata6- и Nanog-экспрессирующих предшественников в ICM.
|
