Посещений: 
АНАЛИЗ ОДИНОЧНЫХ КЛЕТОК
Сенсорные органы внутреннего уха
Single cell analysis of the inner ear sensory organs OFER YIZHAR-BARNEA and KAREN B. AVRAHAM  Int. J. Dev. Biol. 61: 205-213 (2017)
doi: 10.1387/ijdb.160453ka
|
The inner ear is composed of a complex mixture of cells, which together allow organ-
isms to hear and maintain balance. The cells in the inner ear, which undergo an extraordinary process of development, have only recently begun to be studied on an individual level. As it has recently become clear that individual cells, previously considered to be of uniform character, may differ dramatically from each other, the need to study cell-to-cell variation, along with distinct transcriptional and regulatory signatures, has taken hold in the scientif c community. In conjunction with high-throughput technologies, attempts are underway to dissect the inter- and intracellular variability of different cell types and developmental states of the inner ear from a novel perspective. Single cell analysis of the inner ear sensory organs holds the promise of providing a signif cant boost in building an omics network that translates into a comprehensive understanding of the mechanisms of hearing and balance. These networks may uncover critical elements for trans-differentiation, regeneration and/or reprogramming, providing entry points for therapeutics of deafness and vestibular pathologies.

|
Внутреннее ухо позвоночных передает сенсорную информацию о звуках, движениях, равновесии и пространственной ориентации. Эти критические способности обеспечиваются сенсорными эпителиальными органами, находящимися во внутреннем ухе (Fig. 1). Баланс и восприятие вертикального положения обеспечивается 5 сенсорными участками в вестибулярной части внутреннего уха, тогда как звуки воспринимаются улитковой частью внутреннего уха, участка наз. органом Корти. Оба типа сенсорных участков присутствуют в очень небольшой, но чрезвычайно сложной ткани. состоящей из смеси клеточных популяций, возникающих и располагающихся точно в местах предназначения, что позволяет органу функционировать соотв. образом. Потеря любого приводит к нарушению функции сенсорных органов и нарушает соотв. ощущения. Из этих специализированных типов клеток, механосенсорные волосковые клетки ответственны за возникновение небольших движений или изменения в давлении волн, чтобы электрический сигнал посылался в мозг и воспринимался как звук или как угловое или линейное ускорение (Groves and Fekete, 2012).
Всё внутреннее ухо возникает из одной краниальной плакоды, дающей большую часть черепно-лицевых сенсорных органов. Развитие каждой плакоды контролируется во времени и пространстве постепенно поступающими сигналами, это заставляет плакоду обеспечивать качественные особенности и морфогенез, и поддерживать баланс между важными клетками предшественниками, внедренными в ткань, ограничивать клоны и финальную дифференцировку клеточных типов (Lleras-Forero and Streit, 2012; Schlosser, 2010). Отические плакоды развиваются во внутреннее ухо, воспринимающее многие сенсорные сигналы. Как только событие бифуркации делает отличимой оптическую плакоду от остального пре-плакодного домена, то образуется пустотелая сферической морфологии структура и с этого момента начинается движение вперед к формированию отоциста в функциональное внутреннее ухо. Этот процесс зависит от расположения вдоль трех осей этой сферы и, наконец, устанавливаются сенсорные и не сенсорыне структуры в их четко обозначенных местах и в точном соответствии положения относительно др. др. (Kelley, 2006) (Fig. 1).
В последние годы наше понимание генетических модулей и ключевых регуляторов формирования механо-сенсорных органов расширилось благодаря использованию next-generation sequencing (NGS) и ultra-sensitive and low-input методологии вместе с достижениями компьютерной обработки.
Как и в случае др. процессов органогенеза в теле многоклеточных организмов, развитие внутреннего уха управляется сложным паттерном экспрессируемых генов и не кодирующими регуляторными элементами.
Следующей фазой в мире молекулярной генетики после NGS, возник анализ одиночных клеток. NGS революционизировало область исследований генетики и эпигенетики, когда каждый анализ требовал пула из многих клеток, дающих усредненный результат для популяции клеток (Fig. 2). Сегодня многие высокопроизводительные подходы доступны также для генерального исследования сообщества на уровне одиночных клеток (Cusanovich et al., 2015; Jin et
al., 2015; Klein et al., 2015; Macosko et al., 2015; Nagano et al.,
2013; Rotem et al., 2015; Saliba et al., 2014; Smallwood and Ren,
2013).
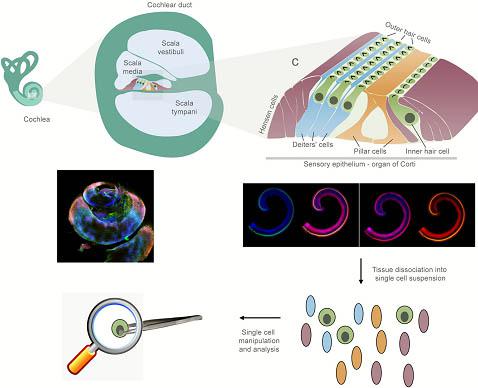 Fig. 1. Schematic illustration and immunof uorescence of the inner ear, demonstrating the cells that may be analyzed on a single cell level. The sensory epithelium of the cochlea is composed of one row of inner hair cells and three rows of outer hair cells, the sensory cells of the inner ear, and supporting cells. Adapted from (Dror and Avraham, 2009). Whole-mount cochlear preparations derived from newborn mice labeled with antibodies. Myosin VI labels the cytoplasm of the inner and outer hair cells, NF200 labels the neurofilaments and phalloidin labels the actin-filled stereocilia (for experimental
details, see Elkan-Miller et al., 2011).
Fig. 1. Schematic illustration and immunof uorescence of the inner ear, demonstrating the cells that may be analyzed on a single cell level. The sensory epithelium of the cochlea is composed of one row of inner hair cells and three rows of outer hair cells, the sensory cells of the inner ear, and supporting cells. Adapted from (Dror and Avraham, 2009). Whole-mount cochlear preparations derived from newborn mice labeled with antibodies. Myosin VI labels the cytoplasm of the inner and outer hair cells, NF200 labels the neurofilaments and phalloidin labels the actin-filled stereocilia (for experimental
details, see Elkan-Miller et al., 2011).
Анализ генома и эпигенома одиночных клеток во внутреннем ухе обладает потенциалом изменять существующие онтогенетические данные. Картирование изменчивости от клетки к клетке и отсортировывание редких клеточных популяций позволяет выявлять новые клональные субструктуры. Высокое разрешение межклеточной изменчивости продвигает наше понимание внешних и внутренних клеточных процессов и их эффекты на транскриптом, эпигеном и фенотип, каждый из которых был невозможен до разрешения, достигаемого сегодня с помощью разных высокопроизводительных подходов к одиночным клеткам.
Single cell analysis
Анализ одиночных клеток на уровне эпигенетической регуляции, транскрптома или динамики трансляции белка, привел к парадигме сдвига определения регуляторного и генетического плана для каждого типа клеток. В частности, насколько уникален и высоко специализирован тип клетки, определяемый заново. Используя анализ одиночных клеток, ученые начали менять форму клеточных клонов путем картирования межклеточной изменчивости на всех уровнях регуляции и экспрессии генов, с разрешением о котором только мечтали (Burns et al.,
2015; Ealy et al., 2016; Schultze and Beyer, 2016; Zeisel et al., 2015). Using the whole 2015). Используя целый орган или даже отобранную клеточную популяцию, отсортированную по одиночному маркеру, чтобы анализировать специфичную для типа клеток генетическую регуляторную сеть , получали в среднем транскриптомный и эпигенетический профиль, не касался одной из субпопуляций клеток. Данные транскрипции, полученные от этих критических клеток, часто терялись в результате усреднения (Fig. 2). Анализ одиночных клеток тех же самых клеточных популяций, классически определяемой как униформный тип клеток, выявлял межклеточную гетерогенность. Униформное определение клеточных типов было заменено на разнообразный репертуар путем выделения субпопуляций и более ранних клеток предшественников.
Одним из таких примеров сложности ткани с широким спектром клеток является головной мозг. Головной мозг состоит из чрезвычайно разнообразных популяций специализированных типов клеток, ответственных за, но не ограниченных этим, память, сенсорно-моторную функцию и межперсональное поведение. Описания разных классов клеток и суб-классов является критическим для понимания того, как специализированные популяции клеток и клеточные ниши в структуре крупного органа выполняют разные цели.
Классификация клеточных типов была осуществлена на коре головного мозга мышей с помощью single cell RNA sequencing (scRNA-Seq) из 3005 клеток из двух определенных регионов головного мозга (Zeisel et al., 2015) (Fig. 2). Результатом scRNA-Seq стала связь с физической клеточной информацией, с использованием BiClustering стратегии, которая привела к подразделению транскриптома на 9 крупных классов соматосенсорного S1 кортекса, каждый из которых был скоррелирован со специфическими маркерами, как известно, играющими роль в функционировании типа клеток. Выявление информации и отличий между классами позволило исследователям повторить BiClustering анализ внутри каждого из этих 9 классов, что привело к дальнейшей классификации 47 подклассов, распределенных среди более классических кластеров клеток. Это подразделение оказалось не случайным и было выявлено у многих мышей, это может указывать на существование эволюционных сил, удерживающих разнообразие между классами клеток. Кроме того, специфические субклассы оказались ассоциированными с набором индивидуальных транскрипционных факторов или с целыми генетическими модулями, предоставляющих как регуляторные, так и молекулярные объяснения функциональной специализации субклассов типов клеток.
В др. широко используемой и хорошо охарактеризованной области клеточных популяций, костного мозга и дифференцированных эритроцитов, и белых клеток крови, анализ одиночных клеток разорвал границы известных типов клеток, выявив определенные межклеточные отличия, ассоциированные с различиями в типе клеток и функции подтипов. Транскриптомика одиночных клеток скорее, чем методология оценки поверхностных маркеров клеток, позволила расширить древо миелоидной дифференцировки, выявив новые подгруппы предшественников (Paul et al., 2015). Более того, профили транскриптома одиночных клеток показали транскрипционную детерминацию в направлении выбора судьбы клетками мишенями. Ключом из работы стала комбинация Massively Parallel RNA-Seq (MARS-Seq) и информации, полученной разными методами, такими как fluorescence activated cell sorting (FACS) по маркерам клеточной поверхности анализируемых клеток, профилям гистонов, функциональному анализу и экспериментам с пертурбациями
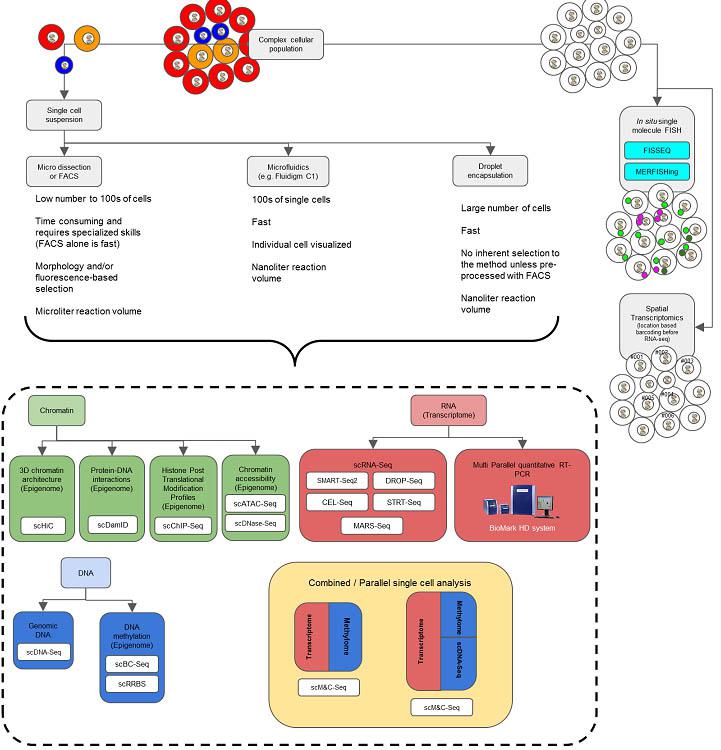 Fig. 2. Methods for single cell analysis includes separation of single cells and
subsequent processing. A complex cellular population may be separated into single
cells for transcriptomics and epigenomics by microdissection or FACS, micro?uidics or
droplet encapsulation, as described in more detail in the text. These same cells may be
viewed from a spatial perspective by FISH or spatial transcriptomics, which may then be
combined to achieve coupling of the single cell with spatial orientation. Adapted from
(Clark et al., 2016; Kolodziejczyk et al., 2015).
Fig. 2. Methods for single cell analysis includes separation of single cells and
subsequent processing. A complex cellular population may be separated into single
cells for transcriptomics and epigenomics by microdissection or FACS, micro?uidics or
droplet encapsulation, as described in more detail in the text. These same cells may be
viewed from a spatial perspective by FISH or spatial transcriptomics, which may then be
combined to achieve coupling of the single cell with spatial orientation. Adapted from
(Clark et al., 2016; Kolodziejczyk et al., 2015).
(Fig. 2). Исследовательская глубина анализа одиночных клеток позволяет воспроизвести кластер-специфическую gene-regulatory network(GRN). Высокое разрешение транскриптома и формирование кластер-специфических GRNs показали, что многие primed клеточные состояния, как традиционно полагали, объясняющие ранние события бифуркации клонов (Miyamoto et al., 2002), являются или чрезвычайно редкими или существуют в виде быстропроходящих событий (Paul et al., 2015).
The inner ear: towards the single cell
Сенсорный эпителий внутреннего уха, содержащий механо-сенсорные волосковые клетки, способен выполнят две разные функции, а именно слух и баланс (Fig. 1). Улитковый и вестибулярный сенсорные органы базируются на своих волосковых клетках, чтобы выполнять свои функции. Помимо функциональных отличий и грубых транскриптомных отличий между улитковыми и вестибулярными волосковыми клетками (Elkan-Miller et al., 2011; Rudnicki et al., 2014; Scheffer et al., 2015; Shen et al., 2015), отсутствуют дифференциальные данные высокого разрешения для тонких транскриптомных и регуляторных различий между специализированными типами клеток сенсорных органов внутреннего уха. Более того, отсутствует информация о внутри-улитковых и внутри-вестибулярных клеточных отличиях, объясняющие, напр., восприятие постепенно меняющихся частот звуковых волн вдоль органа Корти и иные цели вестибулярных органов, соотв.
На ранних стадиях развития сенсорных органов внутреннего уха был проведен недавно анализ с использованием техники одиночных клеток, позволивший исследователям различать первичные ткани, которые позднее станут сенсорным органом внутреннего уха, в краниальной плакоде сенсорных органов и др. нейро-эктодермальной ткани (Durruthy-Durruthy et al., 2014; Durruthy-Durruthy and Heller, 2015). Они использовали высокопараллельный quantitative real-time PCR (qRT-PCR) для 382 одиночных клеток, чтобы воспроизвести развивающийся мышиный отоцист и ранние клоны нейробластов. Они сфокусировались на 96 генах (92 отических маркерах и 4 контрольных генах), которые и стали основой для мультивариантного анализа и формирования кластеров клетками в соответствии с общими профилями генной экспрессии. Был использован репортерный трансген мыши, Pax2Cre/-;Gt(ROSA26)SortdTomato,mEGFP чтобы сначала разделить Pax2-driven EGFP экспрессирующие клетки и чтобы получить очищенный отоцисты и деламинирующие клетки нейробластов в противовес не-отическим окружающим клеткам на день эмбриогенеза (E)10.5 развивающегося эмбриона мыши (Hartman et al., 2015) . Используя два независимых беспристрастных алгоритма группировки, были получены две основные группы, отоцисты и нейробласты, которые в свою очередь были подразделены на 6 кластеров с разными профилями транскрипции, использовав BiClustering метод (Durruthy-Durruthy and Heller, 2015). Хотя исследователи были очень адекватными, способными показать образование кластеров с разными профилями экспрессии нейробластов в противовес отоцистам, они не предоставили каких-либо определенных взаимоотношений в контексте процесса развития. Несмотря на отсутствие временной и пространственной информации, чтобы понять клетки отслеживаемых клонов, авт. высказали идею, используя фазовое сходство сети чтобы трансформировать данные одиночных временных точке в динамическую сеть, исходя из предположения, что спектр клеточных кластеров, представленный ранее, тип клеточных предшественников на одном конце и на др. конце, является более дифференцированным. Тщательный анализ представленных результатов по разделению ранних и поздних клеток нейробластов выявил промежуточное состояние. Наконец, они сконструировали 3D сферическую модель для отоциста, базируясь на дифференциальной экспрессии генов, ассоциированных с тремя главными осями тела - дорсо-вентральной, медиа-латеральной и передне-задней (Durruthy-Durruthy et al., 2015). Эта 3D модель, подтвержденная данными по экспрессии, предоставляет возможность для презентации сигнальных путей и влияний морфогенетического градиента на развития отоциста.
Чтобы понять ключевые регуляторы отических клонов, были предприняты прямые подходы путем анализа популяций отических сенсорных клонов путем микро-рассечений отического пузырька на ст. E10.5 и улитки и поддерживающих клеток на постнатальный день (P)3 (Hartman et al., 2015). Хотя подход с микромассивами РНК давал низкое разрешение, эта работа представила строгую основу для будущих экспериментов, базирующихся уже на высокопараллельном секвенировании одиночных клеток qRT-PCR или scRNA-Seq.
Пригодность и надежность ранее описанных инструментов (Durruthy-Durruthy et al., 2014; Durruthy-Durruthy et al., 2015; Durruthy-Durruthy and Heller, 2015; Hartman et al., 2015; Ronaghi et al., 2014) были использованы для разработки различных новых аспектов клеточных популяций органа Корти. Субнабор из 192 генов был проверен в серии из 960 отсортированных одиночных клеток, представляющих собой 9 ранее определенных типа клеток от media l до латеральной оси (Waldhaus et al., 2015). Помимо подтверждения заключений, сделанных в предыдущих работах и разработки базы данных транскриптомов одиночных клеток органа Корти, они представили новую информацию о молекулярных механизмах, ведущих по пути более глубокого понимания репрограммирования, управляемого in vivo, или регенерации клеток кортиева органа, в основном путем использования присутствующих поддерживающих клеток и их потенциала транс-дифференцировки. Ведущая концепция была отслежена по очень сильно отличающейся экспрессии генов между внутренними и наружными столбчатыми (pillar) клетками апикального региона, принимая во внимание, что внутренние столбчатые клетки в противоположность наружным столбчатым клеткам, обладают способностью к регенерации (Cox et al., 2014; Li et al., 2015; Liu et al., 2014; White et al., 2006). Этот анализ выявил, что основным (primed) клеточным состоянием внутренних столбчатых клеток является присутствие канонического Wnt пути с низким количеством Notch эффекторов. Др. ключевой информацией их анализа стало разрешение на уровне одиночной клетки, чтобы различать между волосковыми клетками вдоль апико-базальной оси, лежащей в основе возникающей tonotopy. Они идентифицировали субнабор генов, ассоциированных с созреванием волосковых клеток, которые обнаруживали градиент своей экспрессии между анализируемыми верхушечными, срединными и базовыми участками органа Корти.
Coupling the single cell with spatial orientation
Кстати анализ одиночных клеток при исследовании области внутреннего уха не объединял дифференциальную экспрессию генов с пространственной ориентацией высокого разрешения. На сегодня имеется ассортимент опубликованных техник, позволяющих проводить параллельный или последовательный анализ как транскриптома, так и морфологических и простанственных характеристик клеток, такие как fluorescent in situ RNA sequencing (FISSEQ) (Lee et al., 2014; Lee et al., 2015),
in situ sequencing for RNA analysis by sequential hybridization (Ke et al., 2013; Lubeck et al., 2014) и Multiplexed Error-Robust FISH (MERFISH) (Shalek and Satija, 2015) (Fig. 2). Эти техники предоставляют пространственную информацию по каждой проанализированной клетке, делая возможным для каждой одиночной клетки увидеть сотни молекул РНК на уровне одинчных молекул. Эти техники пока лишены аспектов высокой производительности, характерных для scRNA-Seq, но вместо этого, работают с заданными наборами генов в пробах.
Этот вопрос был рассмотрен в недавней работе, описавшей "пространственную транскриптомику", которая предоставляет пространственную информацию путем мечение специфичных для клеток транскриптомов из тканевых срезов (Stahl et al., 2016). Этот метод базируется на внесении молекулярных штриховых кодов в синтезируемые кДНК в виде штрихового кода из массива олиго-дТ (captured over a dense barcoded oligo-dT array), что сопровождается отсоединением ткани, но не ранее фиксации изображения гематоксилинои и эозином (H&E)-окрашенной структуры ткани по всему массиву. Штриховые коды используются, чтобы переносить информацию касательно локализации клеток в ткани, помечая массив данных специфического транскриптома и делая возможным анализ экспрессии в контексте изначальной тканевой структуры. Захваченные РНК проходят через T7-based in vitro transcription (IVT) для предварительной амплификации, которая позднее используется как источник для RNA-Seq. Авт. оказались способны продемонстрировать, что 95% генов, обнаруживаемых с помощью RNA-Seq в суспензии из большого числа клеток, были описаны методологией "пространственный транскриптом", выявляющей даже низко экспрессирующиеся мРНК. Этот метод оказался подходящим для изучения тканевых срезов рака груди человека и ткани обонятельных луковиц мыши, характеризующихся отличающейся морфологической структурой. В результате было предсказано, что этот метод предоставляет решение по сцеплению транскриптомов одиночных клеток и их пространственного контекста для органа Корти.
Др. решения могут быть найдены в области вычислений в комбинации с уже полученными данными, такими как гибридизация in situ с вновь разработанным беспристрастным scRNA-Seq, как это было продемонстрировано на головном мозге морских кольчатых червей (Achim et al., 2015).
Re-thinking tissue developmental lineages
Обнаружение клеточной гетерогенности на уровне одиночных клеток приводит к пересмотру тканевой информации и процессов клеточной дифференцировки. Изучение клеточных клонов и генетического программирования объясняет детерминацию клеточного типа в сердце (Bruneau, 2013), печени (Si-Tayeb et al., 2010), легочном эпителии (Roos et al., 2012) и системе гематопоэза (Seita and Weissman, 2010), в результате обнаруживаются более детальные схемы дифференцировки и дерев клонов клеток. В результате генетические программы и картирование судеб клеточных клонов достигло успехов в областях in vitro -управляемой дифференцировки эмбриональных стволовых клеток (ESC) и индуцированных плюрипотентных стволовых клеток (iPSC), что обогащает регенеративную медицину (Atala, 2015; Azadeh et al., 2016; Costa et al., 2015; Jessop et al., 2016; Sasai, 2013; Wobma and Vunjak-Novakovic, 2016; Wu and Hochedlinger, 2011).
Следующая фаза вычленения клеточных клонов стала возможна в результате данных "omics" высокого разрешения, с помощью Multiplexed Parallel qRT-PCR, scRNA-Seq и др. типов анализа одиночных клеток. Многие выборки для каждой временной точки, с очень маленьким интервалом между временными точками для тестирования процессов дифференцировки, связаны с перспективами одиночных клеток, дают в результате данные более высокого разрешения, а тонкое картирование процессов развития предоставляет тканевое древо клонов и клеточных типов, детерминированных драйверами и регуляторами. Критическим вопросом на сегодня является не необходимость цепочки событий одиночных типов бифуркации от ESC до детерминированных ранних предшественников, а скорее контроль постепенной, почти непрерывной прогрессии мультипотентных клеток через различные предшественники вместе с их отличающимися клонами вплоть до образования полностью функциональной сложной ткани. Клональное древо, продуцируемое с использованием данных высокого разрешения на уровне одиночных клеток, более развесистое с большим количеством веток от раннего ствола к верхушке древа.
Одним из крупных преимуществ данных высокого разрешения для одиночных клеток является освобождение от необходимости знания a priori стадио-специфических характеристик клеток. Как результат асинхронные клеточные популяции могут быть подразделены на базе кластерного анализа одиночных транскриптомов, без необходимости предварительного отбора клеток с известными поверхностными клеточными маркерами. Напр., анализ транскриптома одиночной клетки для 198 клеток, представленный 4 временными точками в ходе формирования эпителия дистальных частей легких (Treutlein et al., 2014). Исходные выборки клеток и кластеров не базировались на a priori знании специфических маркеров типов клеток. Их подход очистил ранее известную классическую модель развития эпителия дистальной части легких, при этом данные высокого разрешения на одиночных клетках привели к открытию ранее неизвестных онтогенетических состояний и клеточных типов, внедренных в классическую модель. Их база данных позволила им продвинуться на одну ступень дальше и проанализировать значение совместной экспрессии генов внутри кластеров и описать функцию каждого специфического кластера клеток и типа клеток, базируясь на их профиле экспрессии генетического модуля. Завершая круг традиционного способа использования специфического клеточного типа, scRN A-Seq привело ко многим новым специфическим маркерам типов клеток, предлагая более тонкое подразделение между очень близкими типами клеток, и предоставляя основу для более точной работы по идентификации промежуточных состояний в иерархии с помощью massively multiplexed single cell qRT-PCR.
Анализ одиночных клеток использован многими недавними работами по пересмотру кальки эмбриогенеза у мышей и людей на уровне как транскриптома, так и эпигенома (Blakeley et al., 2015; Klein et al., 2015; Tang et al., 2010). Анализ одиночных стволовых клеток и динамики генома во время событий бифуркации открывает окно на роль гетерогенности реакции на внеклеточные стимулы стволовых клеток и позднее линий предшественников как главной части эмбриогенеза и органогенеза многоклеточных организмов (Junker and van Oudenaarden, 2015; Klein et al., 2015; Semrau et al., 2015; Semrau and van Oudenaarden, 2015).
Попытки определить дифференцировку плюрипотентных клеток в функциональный орган Корти пока не использовали беспристрастное RNA-Seq. Траектория развития отических клонов человека была установлена, используя модель in vitro, чтобы очистить протоколы ведения стволовых клеток (Fritzsch et al., 2015; Kelley, 2007; Koehler et al., 2013; Koehler and Hashino, 2014; Li et al., 2016).
Набор из 90 предварительно отобранных генов, измерялся с помощью multiparallel qRTPCR, что облегчало дискриминацию между ранней Non-Neuronal Ectoderm (NNE), Pre-Placodal Ectoderm (PPE) и переденей и задней частями краниальных плакод, последние давали отическую плакоду (Ealy et al., 2016). Используя Monocle algorithm (Trapnell et al., 2014), профили транскрипции одиночных клеток были распределены вдоль псевдо0временной траектории, воспроизводя процессы дифференцировки в попытке объяснить динамические изменения во врем дифференцировки in vitro. То же самое было проделано, используя человеческие ESCs (hESCs) линии клеток H9 и линию iPSC. Данные, полученные на этих клетках были сравнены с таковыми относительно E10.5 наивных отоцистов от модельных мышей. Сравнение 23 генов показало, что обе линии клеток спутся 12 дней после дифференцировки in vitro были близко родственными к наивному отоцисту мыши. Авт. предположили, что результаты демонстрируют значение использования анализа экспрессии генов одиночных клеток, чтобы предоставить ключевые различия, которые могут быть внесены в клеточные культуры, чтобы получить желаемый клон.
Микроокружение in vitro культивируемых клеток, скорее всего, лишено передачи межклеточных сигналов и морфогенов, управляющих образованием отического клона. Чтобы преодолеть это затруднение последующие работы были выполнены непосредственно на внутреннем ухе новорожденных. P1 мыши, экспрессирующие Lfng-управляемый GFP и Gfi1 Cre, управляющий dTomato fluorescent маркерами, были использованы для отделения поддерживающих клеток маточки и улитки от остальной ткани внутреннего уха (Burns et al., 2015). scRNA-Seq разделенных клеток на базе маркеров и последующее образование кластеров и анализ транскриптомов на псевдо-временной территории привел к идентификации нового про-сенсорного домена на крают сенсорного эпителия слуховой улитки, где клетки находились всё ещё в фазе транскрипции на ст. P1, готовых к принятию или сенсорной или не-сенсорной судьбы. Представление о развитии сенсорного эпителия и картирования судеб сенсорных волосковых клеток в противоположность не-сенсорным, поддерживающим клеткам ранее базировалось на суммарных RNA-Seq транскриптомах и отсутствии этой уникальной небольшой, но очень важной, субпопуляции. Др. крупным изменением в нашем знании древа клонов внутренннего уха стала перестройка вестибулярной и кохлеарной ветвей, сравнимая одна с др. Различия между сенсорными и не-сенсорными типами клеток, как было установлено, теперь значительно больше, чем различия в генетических программах сенсорных волосковых клеток маточки и улитки, сводя части вестибулярной и кохлеарной ветвей транскрипционно ближе др к др., чем это считалось ранее.
Re-inventing time to explain the inner ear developmental trajectory
Высоко разрешения транскриптом в результате анализа одиночных клеток, в частности scRNA-Seq, делает возможным анализ клеток развивающихся тканей, как если бы производился снимок линейно протекающих процессов, которые прирожденно асинхронны. Если мы определим различные клетки развивающихся тканей со всеми характеристиками, как промежуточные точки маршрута на траектории в направлении стабильно и окончательно дифференцированных типов клеток, тогда каждый снимок клеток мы будем воспринимать как введение scRNASeq, включая транскриптомные профили с разных точек на предварительно определенной траектории. Эта методология, называемая "псевдовременное" упорядочение, посредством которой транскриптомы одиночных клеток оказываются упорядоченно расположенными вдоль синтетической временной оси, сопряженной с вектором траектории биологических процессов (Reid and Wernisch, 2016). Биологическими процессами могут быть дифференцировка и/или ветвление судеб многих клеток, происходящих от уникальной клетки предшественника, или постепенной реакции на внеклеточные стимулы или морфогены. Псевдо-временной метод уже широко используется, когда использование микромассивов широко распространено (Magwene et al., 2003). Соединение псевдо-временного метода с NGS исследует весь транскриптом вместо субнабора генов, делая возможным высокое разрешение и чувствительность при картировании сложных процессов.
Тканевая асинхронность генетического плана и транскриптомов сходных клеточных состояний становится всё более значимым с возрастом multi-parallel qRT-PCR и scRNA-Seq, т.к. предоставляемое количество данных и разрешение их увеличиваются. Имеется несколько свободно доступных in silico инструментов, разработанных, чтобы адаптировать технологии к получению данных высокого разрешения, таких как Monocle (Trapnell et al., 2014). Этот инструмент был использован в области внутреннего уха, чтобы определить траекторию как процесс постепенной дифференцировки от плюрипотентных hESC к отической плакоде (Ealy et al., 2016). Использование псевдо-временного анализа позволяет обрабатывать межклеточную гетерогенность и переносить эту информацию на онтогенетическую динамику органов, тканей и популяций стволовых клеток у взрослых. Оба процесса являются главным препятствием в классических экспериментальных разработках усредненных популяций клеток, т.к. стволовые клетки взрослых в меньшинстве внутри сложной и гетерогенной ткани. Др. широко используемый инструмент был разработан под названием 'Водопад', для изучения транскриптомов одиночных клеток в гиппокампе взрослых с помощью quiescent neural stem cells (qNSC) , чтобы выявить ключевые факторы, лежащие в основе активации qNSC, и в конечном счете в нейрогенезе (Shin et al., 2015). Tools for Single Cell Analysis (TSCAN), др. более продвинутый инструмент, пригодный для псевдо-временной реконструкции, использовал несколько уроков от ранее разработанных инструментов, описанных выше, и попытался сделать этот процесс более доступным пользователям за счет сначала переноса на GUI-базирующуюся рабочую среду вместо базирующейся на командной линии среды, уменьшая сложность древа клеточных клонов с помощью разных способов (Ji and Ji, 2016).
Принимая во внимание высокую гетерогеннось одиночных клеток, ранее рассматриваемых униформной популяцией, невозможно получить ряд клеток, необходимых для получения выборок и анализа порядка, чтобы полностью охарактеризовать все клеточные популяции ткани и субпопуляции с надежным разрешением. Получение выборок с повышенными количествами клеток ведет к более высокому разрешению разложения клонов; однако, глубине секвенирования, каждого транскриптома мешают современные технологии. Если стандартная глубина удерживается при крупной количественной выборке, чтобы покрыть как можно больше клеток данной ткани, цена становится чрезмерной. Однако, понижение глубины для каждой клетки до настолько низкой как 50000 считываний может всё ещё обеспечивать выявление кластеров уникальных типов клеток, напр., как это было сделано для первичных нервных клеток с целью обнаружения новых кандидатов биомаркеров в развивающемся кортексе (Pollen et al., 2014). Новые методы, делающие возможными манипуляции с одиночными клетками в nanoliter объеме капель, такие как inDrop (Klein et al., 2015) и Drop-Seq (Macosko et al., 2015) позволят, скорее всего, увеличить производительность и снизить цену, позволяя исследовать большее количество одиночных транскриптомов, представлять большее количество клеток из солидных тканей, не вступая в компромисс с глубиной считывания.
Несмотря на прогресс, описанный выше настоящие измерения для оценки и сравнения разных инструментов и алгоритмов для псевдо-временной реконструкции всё ещё неуловимы.
The single transcriptome and the single epigenome
В течение жизни специализированная клетка взрослых, экспрессия генов регулируются частично с помощью эпигенетических модификаций, таких как метилирование ДНК, завладение нуклеосомами, гистоновые post translational modifications (PTMs), и структура хроматина, все они выведены на свет в недавние годы (Bernstein et al., 2010; Kundaje et al., 2015; Neph et al., 2012; Xie et al., 2013; Yue et al., 2014). Как и в случае транскриптомики, следующий скачок эпигеномных исследований был сделан в область анализа одиночных клеток. Ожидается, что если нижестоящий уровень транскрипции РНК очень сильно изменяется и динамичен при сравнении между клетками, то уровень регуляции процесса транскрипции д. обладать уровнем изменчивости таким же, делая возможным тонкое регулирование транскриптомов. Изучение эпигеномики на уровне одиночных клеток сможет уловить легкую динамику, полностью ускользающую при анализе массы клеток (Macaulay and Voet, 2014). В последние 2 года эпигенетические технологии одиночных клеток появились в виде метилирования ДНК одиночных клеток (Farlik et al., 2015; Guo et al., 2013; Smallwood et al., 2014), scChIP-Seq (Cusanovich et al., 2015; Jin et al., 2015; Klein et al., 2015; Macosko et al., 2015; Nagano et al., 2013; Rotem et al., 2015; Saliba et al., 2014; Smallwood and Ren, 2013), и методов доступности нуклеосом, таких как scDNasISeq (Jin et al., 2015) или scATAC-Seq (Buenrostro et al., 2015). Картирование конформаций хроматина на длинных расстояниях с помощью разрешения
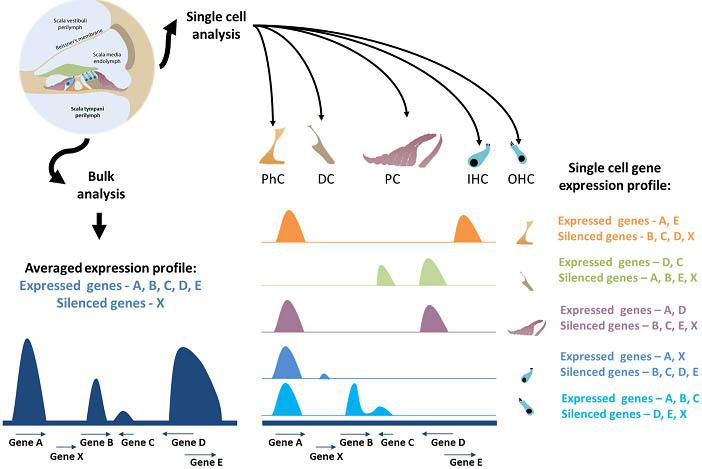 Fig. 3. The current and future state of single cell analysis in the mammalian inner ear. scRNA-Seq has been used for averaged gene expression profiles in inner ear research, providing data regarding gene expression and gene silencing for a subset of genes. As separation techniques improve for the organ of Corti and other portions of the inner ear, a more robust separation of the sensory inner (IHC) and outer hair cells (OHC) and non-sensory supporting cells, including pillar cells (PC), Deiters' cells (DC) and inner phalangeal cells (PhC), may be made. The cell-specific genetic features will define which genes are expressed and which are silenced during different stages of development, and increase our knowledge regarding cellular function and mechanisms.
Fig. 3. The current and future state of single cell analysis in the mammalian inner ear. scRNA-Seq has been used for averaged gene expression profiles in inner ear research, providing data regarding gene expression and gene silencing for a subset of genes. As separation techniques improve for the organ of Corti and other portions of the inner ear, a more robust separation of the sensory inner (IHC) and outer hair cells (OHC) and non-sensory supporting cells, including pillar cells (PC), Deiters' cells (DC) and inner phalangeal cells (PhC), may be made. The cell-specific genetic features will define which genes are expressed and which are silenced during different stages of development, and increase our knowledge regarding cellular function and mechanisms.
цис- и транс-регуляторных взаимодействий, которые имеют место в геноме (Libbrecht et al., 2015; Rao et al., 2014) также движутся в направлении анализа одиночных клеток с одиночной клеткой HiC (Nagano et al., 2013; Nagano et al., 2015). Сила этих техник базируется на мультипараметрическом анализе одиночных клеток, прямо коррелируя с легкими изменениями в регуляторном эпигеноме и возникающем в результате транскриптоме специализированных клеточных фенотипов. Эти усилия всё ещё на начальном этапе, демонстрируются пионерскими работами, связывающими межклеточную изменчивость как профилей генной экспрессии, так и связанного с этим эпигенома путем секвенирования транскриптом и метилома одной и той же одиночной клетки (Angermueller et al., 2016; Hou et al., 2016). Эта работа привела к заключению, что эпигенетическая гетерогенность является ключевым компонентом переключателей в флюктуирующей плюрипотентности сывороточных ESCs. Базируясь на этой работе логично сделать вывод, что др. типы тканей, такие как очень сложный сенсорный эпителий внутреннего уха, с признаками дифференцировки, развития и созревания, чтобы достичь функции, управляются межклеточной изменчивости транскриптома, эпигенома и их фенотипов.
Despite some progress in single cell analysis of cell-to-cell variation in the inner ear in recent years, major progress in the field will come from making a transition from a pre-selected group of genes to performing robust scRNA-Seq to map out the entire transcriptome. Future experimental designs should focus on two main points: scRNA-Seq and a priori knowledge on the cell that includes spatial localization in the tissue, cell surface markers and/ or reporter gene models. Examining transcriptomes of single cells of the inner ear sensory organs, instead of averaged gene expression profiles, will reveal cell-spec ific genetic features important for specific cellular functions and driving forces for organogenesis (Fig. 3). Similar strategies, as presented in this review on non-inner ear cells, can be pursued in virtually any inner ear cell type, bridging cell-to-cell transcriptome variabi lity to function. Moreover, these strategies may be used to fully characterize the set of developing cell types comprising the inner ear sensory organs’ lineage hier archy. Understanding the finite differences and dynamic changes among the cells of the inner ear present the greatest promise for regenerative therapy, as it will enable reconstruction of the cell lineage roadmap of the auditory and vestibular systems.
|


