Посещений: 
АКТИВНОСТЬ ГЕМАТОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК И ВЗАИМОДЕЙСТВИЯ С НИШАМИ
Генетический контроль
Haematopoietic stem cell activity and interactions with the niche " Sandra Pinho &
" Paul S. Frenette
. Nature Reviews Molecular Cell Biologyvolume 20, pages303-320 (2019)
| |
|
Гематопоэз является процессом, c помощью которлого клеточный состав крови постоянно восполняется в течение всей жизни организма. Гематопоэтическая система состоит из разных популяций высоко специализированных клеток с уникальными функциями, такими как транспорт кислорода и иммунная защита1. Подсчитано, что взрослый человек генерирует ~4-5 х 1011 гематопоэтических клеток ежедневно2. Непрерывная продукция большинства типов клеток крови нуждается в системе надежной регуляции. В организации гематопоэза у млекопитающих редкие гематопоэтические стволовые клетки (HSCs) находятся на вершине иерархии. У взрослых HSCs обнаруживаются преимущественно в костном мозге bone marrow (BM) и характеризуются способностью самообновления и продукых типов предшественников, которые пролиферируют и дифференцируются в зрелые клетки крови3. HSCs существенны для восполнения гематопоэтической системы после трансплантации реципиентам с уменьшением костного мозга4,5 или после его повреждения или инфекции6-9. Напротив, предшественники обладают ограниченной способностью к самообновлению, ограниченным потенциалом к дифференцировке клонов и исчерпываются в течение нескольких недель после трансплантации3. В стабильном состоянии HSCs хозяина являются молчащими, это защищает их от генотоксических воздействий10-13, в то время как основная масса гематопоэза обеспечивается нижестоящими предшественниками14-16. Некоторые исследования с использованием трансплантаций одиночных клеток и in vitro дифференцировки поставили под вопрос классическую иерархию древа дифференцировки гематопоэтических предшественников, вместо генерации клон-ограниченных предшественников (ограниченных только одним или двумя клонами) , они могут проходить через стадию мультипотентных предшественников или генерироваться непосредственно из HSCs17-19.
Чтобы обеспечить гематопоэтический гомеостаз в течение всей жизни необходим баланс между дифференцировкой и самообновлением: избыточность дифференцировки или недостаточность самообновления истощают пул HSC, тогда как недостаточность дифференцировки или неограниченное самообновление могут приводить к миелопролиферативной болезни или лейкемии. Активность HSC регулируется c помощью внутренне присущего взаимодействия внутренних клеточных факторов, таких как регуляторы транскрипции и эпигенетические регуляторы и метаболические пути и внешние для клеток сигналы, включая дальнодействующие гуморальные и нервные сигналы или локальные сигналы от микроокружения BM, которое обозначаются 'ниша стволовых клеток'.
Концепция ниш предложена R. Schofield в 1978 (ref.20) и означает регуляторную единицу, которая поддерживает и управляет самообновление и дифференцировку HSC. Ниша HSC сегодня считается сложной многоклеточной сетью, предоставляющей молекулярные сигналы и физические взаимодействия, которые существенны для локализации, поддержания и дифференцировки HSC. С момента открытия опубликовано более 2000 статей20; более 85% из этих статей опубликовано в последние 10 лет. Хотя определенные составные ниш BM уже идентифицированы, преимущественно у мышей, и включают как HSC потомков, так и не гематопоэтические типы клеток21, полученные знания привели к парадоксальной ситуации, при которой почти все клеточные составляющие BM, как полагают, вносят вклад в ниши, большинство из которых действует перекрывающимся способом. Ситуация усложняется ещё больше тем фактом, что пул HSC сам по себе функционально и молекулярно гетерогенен6,19,22-29, возникает возможность, что существуют определенные 'специализированные' ниши для определенных субпопуляций HSCs30-32.
HSCs являются основой для трансплантаций BM - терапевтического вмешательства при гематопоэтических болезнях, используемых для замещения индивидуальных гематопоэтических и иммунных систем трансплантируемым донорским BM 33,34. Количество доступных донорских HSCs часто недостаточно для восстановления костного мозга, необходимы ex vivo умножение HSCs, что остается серьезной проблемой. Т.к. популяция HSC д. расширяться постоянно в своей нативной нише, то понимание механизмов поддержания HSC является обязательным условием для разработки протоколов, позволяющих существенно увеличивать популяции HSC ex vivo для трансплантаций.
Bone marrow architecture
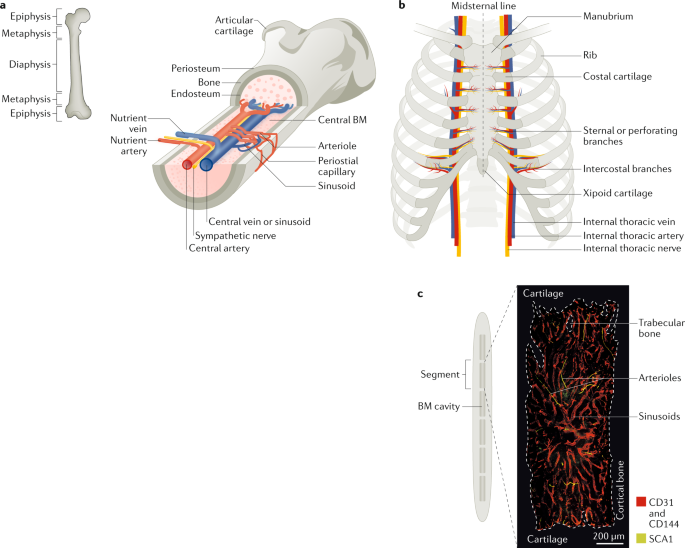 Fig. 1: Microarchitecture of the adult mouse femur and sternum bone marrow.
Fig. 1: Microarchitecture of the adult mouse femur and sternum bone marrow.
Postnatally, the bone marrow (BM) is the primary site of haematopoietic stem cell (HSC) maintenance and haematopoiesis. a | Longitudinal view of a femur illustrating the arrangement of blood vessels and nerves (marked in yellow) that accompany the arteries within the BM cavity. The periosteal layer covers the outer surface of the bone, and the endosteal layer is at the interface of bone and BM. Branching arteries (red) run parallel to the long axis of the marrow cavity, often close to the endosteum. These vessels feed into the sinusoidal network, which is distributed evenly throughout the marrow cavity and then coalesces to form the venous circulation (blue). b | Anterior view of the adult human sternum with attached ribs. Unlike the long bones, which mostly contain adipocytes in adult humans, the sternum has rich haematopoietic activity in both mice and humans, which makes it a suitable site to study haematopoiesis. The blood supply to the sternum originates from sternal or perforating branches located in the intersegmental spaces (between the ribs) from internal thoracic arteries that extend along the inside of the ribcage parallel to the sternum. c | Midsagittal section of the mouse sternum illustrating the six BM compartments (the human sternum comprises two bones, the manubrium and the body) with the representative image of a sternal segment showing the vasculature, which is labelled using intravenously injected antibodies against CD31 and CD144 (red) and stem cell antigen 1 (SCA1; green). Arterioles can be distinguished from the sinusoidal network by their SCA1highexpression.
Table 1 Transgenic mice for labelling of adult bone marrow HSPCs
https://www.nature.com/articles/s41580-019-0103-9/tables/1
Box 1 The localization of HSCs in the niche
Анатомическое расположение гематопоэтических стволовых клеток (HSCs) и их близость к клеткам кандидатам на роль ниш являются основными критериями для определения bona fide ниш240, а их оценка является основным предметом споров в этой области. Прямая визуализация косного мозга (BM) является важной для полного понимания того, как HSCs поддерживаются и регулируются in situ. Однако это является главной проблемой благодаря отсутствию исключительных маркеров для идентификации и отслеживания эндогенных HSCs и клеток ниш, и благодаря кальцифицированной природе костей. Первоначальные исследования отслеживали возвращение домой экзогенно меченных или GFP-маркированных гематопоэтических стволовых клеток и клеток предшественников (HSPCs) , транспортируемых в BM реципиентных мышей, используя классические гистологические или прижизненные microscopy-imaging техники. Эти исследования показали, что HSPCs обнаруживают тесное взаимоотношение с надкосницей38-40. Однако, необходимы затруднительные манипуляции, чтобы очистить HSCs, чтобы противостоять возможным эффектам от анестезии или хирургических стрессов во время трансплантаций и ограничения глубины получаемых изображений.
Открытие семейства рецепторов для signalling lymphocytic activation molecule (SLAM) (таких как CD150, CD48 и CD244) в качестве маркеров для HSPC, в исследованиях с использованием тонких срезов BM, показало, что CD150+CD48-CD41- клон-негативные HSCs широко распределены в тесной близости от эндотелиальных клеток и nestin (Nes)-GFP+ около-сосудистых клеток54,65. У мышей, экспрессирующие GFP с гематопоэтического промотора Gata2, GFP+SCA1+ клетки оказались обогащенными в активных HSC, располагаясь вблизи надкостницы44. Эндогенные HSCs, как было установлено, также располагаются в около-сосудистых нишах, которые многочисленны вблизи надкостницы 43,241,242. Однако, использование гистологических срезов ограничено из-за ограничения в z-глубину. Дополнительные технологические улучшения сделали возможной 3D визуализацию эндогенных HSCs in situ, раскрывая значительную ассоциацию между субнаборами молчащих HSCs и малыми артериолами, которые сами по себе обнаруживают высокую плотность в endosteal регионе30. После активации и пролиферации этот субнабор HSC распространяется прочь от артериол. При анализе 3D-изображений препаратов было установлено, что субнабор молчащих HSCs располагается по соседству с мегакариоцитами в нишах, которые, по-видимому, отличаются от arteriolar ниш156. Хотя такие 'non-arteriolar niche' часто обозначаются как 'sinusoidal ниши', важно подчеркнуть, что синусоиды обнаруживаются по всему BM и что большинство их, если не все, являются гематопоэтическими клетками - включая HSCs - располагаются в тесной близи к синусоидам. Однако, распределение HSC в периваскулярных нишах может быть неслучайным и может испытывать влияние со строны специфических микроусловий.
Конечно, др. исследования, использующие разные тканевые преобразования для улучшения прозрачности и использующие трансгенных мышей с избирательной экспрессией HSC репортеров (Table 1) , подтвердили, что HSCs униформно распределены в perisinusoidal нишах. Исследования с использованием KIT иммуноокрашивания делает оптически более прозрачным BM у Ctnnal1-GFP репортерных мышей, которые обнаруживают, что эти GFP+ HSCs не ассоциированы с артериальными сосудами, а вместо этого широко и случайно распределены в BM (способом, неотличимым от случайно расположенных точек) 47. Более того, отсутствует концентрация молчащих HSCs в областях артериол. В в др. исследовании установлено, что b5 (HOXB5)-mCHERRY+ HSCs (видимые после химической очистки) гомогенно ассоциированы с VE-cadherin-позитивными эндотелиальными клетками 243. В будущем интересно было бы оценить более детально локализациюHOXB5+ HSCs в контексте сосудистых компартментов. Хотя техника очистки делает возможным полкучение глубоких изображений костного мозга, она также нуждается в декальцификации ткани или экстракции закупоривающей ткани костного мозга и дополнительных ступенях переработки, которые могут нарушать архитектуру костного мозга и экспрессию поверхностных маркеров 244. Напротив, в подтверждение существования множественных ниш, др. исследования выявили arteriolar ниши и/или megakaryocyte ниши, содержащие молчащие HSCs с низкими уровнями реактивных видов кислорода 31, покоящиеся HSCs в тесной близи к ассоциированным в артериолами Шванновскими клетками 136 и HSCs, ассоциированным с преходящими сосудистыми эндотелиальными клетками, связанными с артериолами и синусоидами 58. Tie2-GFP+HSCs, которые сильно обогащены активными HSC, также обнаруживают строгую ассоциацию с артериолами 245, как и субнабор CD82+ HSC , которые обладают длительным потенциалом HSC 169. Получение изображений, склонных давать миелоидные клетки, HSCs с использованием von Willebrand factor (Vwf)-GFP обнаруживают существование отдельных BM ниш для Vwf-GFP+ HSCs и Vwf-GFPх HSCs, которые регулируются с помощью ассоциированных с мегакариоцитами и ассоциированными с артериолами клетками ниш, соотв. 32. Т.о., эти исследования использовали разные маркеры для HSC, поэтому получили отличающиеся результаты по локализации HSC в BM; эти расхождения из-за разных использованных методологий или отражали существование действительно отличающихся субпопуляций HSC необходимо было исследовать
Constituents of the HSC niche
 Fig. 2: Cellular and molecular constituents of the HSC niche.
Fig. 2: Cellular and molecular constituents of the HSC niche.
Various cell types have been implicated in regulating haematopoietic stem cell (HSC) activity, including perivascular mesenchymal stem cells (MSCs), endothelial cells, osteoblasts, adipolineage cells, sympathetic nervous system (SNS) nerves, nonmyelinating Schwann cells, macrophages, megakaryocytes and regulatory T (Treg) cells. The target plot illustrates how bone marrow niche cells contribute to HSC regulation indirectly or directly by synthesizing niche factors in the form of cell-bound or secreted molecules. The colour of the radial spokes indicates the HSC activity that is affected. Asterisks (*) indicate molecules involved in bone marrow regeneration after ablation. Bold type indicates those molecules for which there are functional data using cell-specific genetic evidence. CXCL, CXC-chemokine ligand; DARC, duffy antigen receptor for chemokines; FGF1, fibroblast growth factor 1; gp130, glycoprotein 130; IL-10, interleukin-10; SCF, stem cell factor; TGF?, transforming growth factor-?; VCAM1, vascular cell adhesion molecule 1.

Fig. 3: The adult bone marrow HSC niche in homeostasis.
Schematic representation of the adult bone marrow haematopoietic stem cell (HSC) niche in homeostasis, showing various cell types and niche factors that directly or indirectly regulate HSC activity. Emerging evidence highlights the vasculature and associated stromal cells, such as periarteriolar nestin (Nes)-GFPhigh cells, neural-glial antigen 2 (NG2)-positive cells, myosin heavy chain 11 (MYH11)-positive cells, perisinusoidal Nes-GFPlow cells, CXC-chemokine ligand 12 (CXCL12)-abundant reticular (CAR) cells and leptin receptor (LEPR)-positive cells, as key regulators of HSC maintenance. Sympathetic nervous system (SNS) nerves regulate HSC mobilization, and nonmyelinating Schwann cells may contribute to HSC quiescence. Osteoblasts have been implicated in HSC regulation, but the precise molecular signals have not been clearly elucidated; however, they may have a role in regulating lymphoid progenitors. Adipocytes may negatively affect HSC maintenance. Haematopoietic cells, such as macrophages, neutrophils, regulatory T (Treg) cells and megakaryocytes, are examples of HSC-derived progeny that can feed back and contribute to HSC maintenance or mobilization. Regional localization of HSC subsets has shown that platelet-biased or myeloid-biased von Willebrand (Vwf)-GFP+ HSCs and Vwf-GFP? HSCs may be located in and regulated by separate bone marrow niches containing megakaryocytes and arterioles, respectively. DARC, duffy antigen receptor for chemokines; IL-7, interleukin-7; OPN, osteopontin; OSM, oncostatin M; SCF, stem cell factor; TGF?, transforming growth factor-?; TNF, tumour necrosis factor.
Box 2 The identification of HSC niche cells
Regulation by non-haematopoietic cells
Различные стромальные клетки и др. типы клеток костного мозга участвуют в регуляции активности HSC, включая mesenchymal stem cells (MSCs), адипоциты и глиальные клетки.
Osteolineage cells
Кдетки остеогенных клонов оказываются первой популяций клеток BM, связанной с регуляцией HSPCs. Ранние исследования до концепции ниш Schofield's указывали на то, что HSPCs обогащены в endosteal регионе костей67,68. Кроме того, исследования с популяциями, обогащенными HSC, трансплантировали реципиентам без myeloablation, подтверждая, что HSPCs преимущественно расположены вблизи поверхности костей40. Присутствие остеобластов в endosteal регионе, вместе с их способностью поддерживать экспансию клеток гематопоэтических предшественников in vitro69, привело к гипотезе, что остеобласты являются кандидатами на роль клеток ниш. Поздние исследования in vivo с использованием маркеров, которые широко определяли HSPCs (клоны негативных SCA1+KIT+ (LSK) клеток) выявили корреляцию между количествами остеобластов и клеток LSK70-72. Обусловленное внешними факторами удаление остеобластов с помощью воздействия ganciclovir у мышей, экспрессирующих укороченную форму гена herpesvirus thymidine kinase (TK) под контролем фрагмента в 2.3 kb в промоторе крыс α1 type I коллагена, индуцировали острые альтерации гематопоэза, включая снижение количества лимфоидных, эритроидных и миелоидных предшественников72. Усиление передачи сигналов посредством паратироидного гормона, мощного регулятора оборота кости, за счет увеличения количества остеобластных клеток, приводило к экспансии HSC, обусловленное, по крайней мере, частично Notch ligand Jagged 1 (ref.70). Сходным образом, вызываемая условиями инактивация bone morphogenetic protein receptor type IA (BMPRIA) с использованием Cre recombinase (Cre), экспрессирующейся с Mx1 промотора (Mx1-Cre) увеличивала количество N-cadherin-позитиных остеобластов, что также приводило к экспансии HSC71. Этот эффект, как полагают, является результатом взаимодействий между HSCs и остеобластами, обеспечиваемого за счет адгезивных молекул N-cadherin, хотя функциональные доказательства участия N-cadherin в этом взаимодействии всё ещё отсутствуют71. В самом деле, последующие исследования с использованием новых маркеров, более специфичных для HSCs подвергли сомнению эти находки73=75.
Два наиболее изученных цитокина, которые необходимы для поддержания HSC - CXC-chemokine ligand 12 (CXCL12;известен также как SDF1)76-79 и stem cell factor (SCF; известен также как KIT ligand)80,81 - соединяются с CXC-chemokine receptor 4 (CXCR4) и KIT на HSCs, соотв.82,83. Делеция Cxcl12 или Scf в зрелых остеобластах мыши или предшественниках остеобластов с использованием Col.2.3-Cre, Bglap-Cre (Bglap кодирует osteocalcin) или Osx-Cre (Osx кодирует osterix известен также как Sp7) оказывают незначительные эффекты на HSCs, подтверждая, что эти osteolineage клетки не поддерживают непосредственно HSCs, по крайней мере, не через посредство CXCL12 или SCF84-86. Остеобласты могут также продуцировать др. молекулы, участвующие в поддержании HSCs, включая osteopontin (OPN), негативный регулятор размера пула HSC87,88, и thrombopoietin (THPO)89,90 и angiopoietin 1 (ANGPT1; известен также как ANG1)12, которые соединяются со своими рецепторами myeloproliferative leukaemia protein (MPL; известен также как THPOR), и tyrosine kinase с иммуноглобулином и EGF homology domains 2 (TIE2), соотв., и регулируют молчание HSC. Однако, физиологический вклад происходящих из остеобластов THPO и ANGPT1 iв регуляцию HSC спорный91,92. Гепатоциты не являются клетками ниш локального костного мозга, по-видимому, большинство функциональных источников THPO необходимо для поддержания HSC92. HSPCs, megakaryocytes и позитивные по leptin receptor(LEPR+) стромальные клетки, по-видимому, являются основным источником ANGPT1 у мышей в BM91. Это исследование также подтвердило, что ANGPT1 не прямо воздействует на функцию HSC, а скорее регулирует регенерацию ниш после облучения.
Хотя остеобласты были первой популяцией в BM, связанной с регуляцией HSC, получение 3D-изображений показало, что эндогенные HSCs несущественно ассоциируют с остеобластами30,43. Итак, эти исследования подтвердили, что зрелые остеобласты не играют непосредственной роли в регуляции активности HSC. Однако, osteolineage клетки, по-видимому, поддерживают сохранение более детерминированных гематопоэтических предшественников, в частности, лимфоидного клона72,85,86,93,94. Регуляция клон-детерминированных предшественников с помощью ниш BM рассмотрена в статье 66.
Perivascular cells
Открытие, что мышиные BM HSCs у взрослых и клетки гематопоэтических предшественников по-разному экспрессируют рецепторы для семейства signalling lymphocytic activation molecule (SLAM) (включая CD150, CD48 и CD244) существенно облегчило получение изображений высоко очищенных HSCs в их нативном микроокружении. D150+CD48-D41-клон-негативные HSC находятся в относительно тесной близости к синусоидам скорее, чем ограничены endosteum, указывая на существование сосудистых ниш65. Последующие исследования установили, что около-сосудистые клетки в BM человека и мыши сильно обогащены фактором экспрессии ниш и активностью MSC54,95.
Происходящие из BM MSCs являются редкими поддерживающими гематопоэз стромальными клетками, обладающими потенциалом самообновления и способностью дифференцировки в кость, жир и хрящи. Они тесно оборачиваются вокруг артериол и более рыхло вокруг синусоидальных кровеносных сосудов. MSCs формируют colony-forming unit-fibroblasts (CFU-Fs) или mesenspheres (неслипающиеся мезенхимные сферы in vitro) и когда они трансплантируются, то вносят вклад в эктопическое образование организованных гематопоэтических ниш, в которых могут быть обнаружены стромальные клетки BM и активный гематопоэз96. Более того, человеческого BM CD146+ мезенхимные клетки и клетки предшественники (MSPCs), трансплантированные подкожно мышам могут генерировать гетеротопические гематопоэтические ниши с происходящими от хозяина HSCs и происходящими от донора периваскулярными CD146+ MSPCs95. CD105+CD51+ MSPCs, выделенные из костей плодов мышей и трансплантированные в почечную капсулу взрослых мышей, способны индуцировать эктопический гематопоэтический костный мозг97. Следовательно, MSPCs могут организовывать HSC ниши.
HSCs, высвобождают в кровообращение циркадным способом в ответ на адренергические сигналы из симпатической нервной системы (SNS), регулирующие синтез CXCL12 (refs98,99,100). Отслеживая стромальные клетки, нацеленные с помощью нервов SNS, удалось их идентифицировать как перваскулярные клетки, маркированные экспрессией GFP с регуляторных элементов Nes промотора. Nes-GFP+ клетки тесно ассоциируют с нервами и HSCs и характеризуются активностью MSC, указывая, что BM ниши могут содержать две популяции стволовых клеток, MSCs и HSCs54. Nes-GFP+ перваскулярные клетки экспрессируют высокие уровни ключевых факторов, участвующих в поддержании HSC, таких как CXCL12 и SCF, а также др. регуляторных факторов, таких как ANGPT1, OPN, interleukin-7 (IL-7) и vascular cell adhesion molecule 1 (VCAM1). Сходная популяция клеток может так же быть выделена из BM не трансгенных мышей и из BM плодов человека, используя поверхностные маркеры platelet-derived growth factor receptor-α (PDGFRα) и CD51 (ref.101). Knock-in GFP репортера в Cxcl12 локусе выявляет существование CXCL12-abundant reticular (CAR) стромальных клеток, являющихся адипо-остеогенными предшественниками, распределенными в основном вокруг синусоидов79,102. CAR клетки являются также основным производителем SCF102; IL-7, который необходим для поддержания лимфоидных предшественников и зрелых B клеток103; и транскрипционных факторов forkhead box C1 (FOXC1) и early B cell factor 3 (EBF3), необходимых для само-поддержания CAR клеток104,105.
Последующие исследования на мышах с GFP knock-in по локусу Scf показали, что экспрессия GFP эндотелиальными клетками и периваскулярными клетками, маркирована с помощью адипо-остеогенного регулятора Lepr84,106. Приблизительно 90% Lepr-Cre+ клеток перекрывается клетками CAR107 и представляют собой крупный субнабор (~80%) Nes-GFP+ клеток30,108. Делеция Scf или pleiotrophin gene (Ptn) с использованием Lepr-Cre приводит к истощению HSCs в BM84,109,110. Однако, кондиционная делеция Cxcl12 с использованием Lepr-Cre моблизует HSCs из BM в кровообращение и селезенку, но не оказывает эффекта на их количества или локализацию в костном мозге85,109. У Nes-CreER трансгенных мышей, экспрессирующих tamoxifen-inducible Cre-oestrogen receptor (ER) слитый белок, делеция Cxcl12 или Scf несущественно меняет количество HSC84,85, хотя клетки Nes-GFP+ существенно перекрываются с LEPR+ клетками в BM30,101,108. Когда были сгенерированы Nes-кодирующие трансгенные репортеры и отобраны, чтобы метить нервные стволовые клетки, их экспрессия в BM варьировала и зависела от трансгенной линии. Соотв., эффективность Nes-CreER рекомбинации в Nes-GFP+ клетках была очень низкой и Nes трансген, по-видимому, не отражал в точности эндогенную экспрессию Nes, возможно из-за неполноты регуляторных элементов Nes-промотора в Nes-GFP конструкции и медленного оборота GFP. Использование Nes-CreER может оказаться более подходящим для раннего развития исследований, поскольку когда применяется tamoxifen в течение первых трех недель после рождения, то делеция Cxcl12 истощает HSCs в раннем постнатальном BM111.
Получение общих 3D изображений BM выявило гетерогенность среди периваскулярных клеток - редкие Nes-GFPhigh клетки экспрессировали маркер перицитов NG2 (ref.30) или маркер гладких мышц myosin heavy chain 11 (MYH11) (ref.109) были ассоциированы с артериолами и субнабором молчащих HSCs, тогда как Nes-GFPlow стромальные клетки перекрывались с LEPR+ клетками и CAR клетками и повсеместно распределялись вблизи синусоидов30. В противовес Lepr-Cre, делеция Cxcl12 с использованием Ng2-Cre, которая вызывает высокую эффективность Cre-обусловленной рекомбинации почти во всех Nes-GFP+ клетках и у более 80% LEPR+ клеток и CAR клеток, приводит к тяжелой редукции количества HSCs в BM, HSC выходят из молчащего состояния и перераспределяются в субнаборе HSCs вдали от артериол109. Кондиционная делеция Cxcl12 с использованием paired-related homeobox 1 (Prx1)-Cre также истощает HSCs в BM, скорее всего, потому, что PRX1 экспрессируется в мезодерме зачатков конечностей во время развития и широко в клетках мезенхимных предшественников BM85,86.
Используя Nes-GFP и индуцибельный Ng2-CreER вместе с репортерной линией, ~30% Nes-GFPhigh клеток были мечены репортером, но метка отсутствовала в Nes-GFPlow клетках. Хотя эффективность рекомбинации Ng2-CreER-inducible diphtheria toxin receptor (DTR) была достаточной, чтобы снизить количества клеток Nes-GFPhigh клеток и популяцию HSC в костном мозге после применения tamoxifen и diphtheria toxin30, кондиционная делеция Cxcl12 или Scf с использованием Ng2-CreER оказывалась неэффективной для BM HSCs, когда использовался протокол применения tamoxifen47. Однако, при избытке периода применения tamoxifen, начиная с 2-3 недельного возраста увеличивало дол максимума эффективность истощения, избирательная делеция Cxcl12, но не Scf, в клетках Ng2-CreER снижала количества HSC в BM и изменяла локализацию HSC109. Эти исследования подтвердили, что разные импульсы цитокинов необходимы для поддержания HSC, происходящие из разных периваскулярных ниш (LEPR+ клетки в противовес NG2+ клеткам), хотя всё ещё неясно, действительно ли этот дифференциальный вклад является простым отражением различий в количестве ниш (чтобы объяснить отсутствие эффекта делеции Scf) или отражением критической роли цитокинов в локализации HSC (чтобы объяснить строгий эффект делеции Cxcl12). Поскольку в BM артериальные эндотелиальные клетки секретируют SCF112, то также возможно, что фенотипические различия монут быть обусловлены вкладами от др. типов стромальных клеток. Недавнее исследование также подтвердило мнение о гетерогенности ниш - молчание и локализация von Willebrand factor (Vwf)-GFP - HSCs регулируются с помощью NG2+ периваскулярных клеток, тогда как те, что базируются на myeloid-biased Vwf-GFP+ HSCs избирательно регулируются мегакариоцитами32 (see below).
Теперь ясно, что существует существенное перекрывание между популяциями BM MSPC взрослых, которые были идентифицированы с использованием Nes-GFP, Ng2-Cre, CAR, Scf-GFP, Lepr-Cre и Prx1-Cre101,106,108,113,114. Кроме того, две популяции костных MSCs были идентифицированы на базе экспрессии PDGFRα и stem cell antigen-1 (SCA1) (ref.115) или Cd73-GFP116, и две популяции из стволовых клеткок скелетных мышц, выделенные из костей целиком и идентифицированные на базе экспрессии CD51 и CD200 (ref.117) или gremlin 1 (ref.118). Вклады этих популяций клеток в регуляцию устойчивого состояния HSCs и их точные клональные взаимоотношения с ранее описанными популяциями MSPC пока не установлены.
При выяснении взаимоотношений между разными популяциями MSPC, идентифицированными с использованием маркеров клеточной поверхности или генетических репортеров или при сравнительных исследованиях, важна техника тканевого преобразования, используемая для изоляции клеток. Разные ферментативные воздействия или методы преобразования кости, такие как раздавливание или вымывание костного мозга, могут приводить к фенотипически и функционально разным субнаборам клеток, что мешает прямому их сравнению в разных исследованиях. Напр., SCA1 и gremlin 1, по-видимому, экспрессируются в основном ассоциированными с костями MSPCs (напр., в periosteum), которые не имеют непосредственного контакта с гематопоэтическими клетками. Клетки, выделенные из костей, обладают отличающимся профилем экспрессии и более высокой продукцией колоний, ростом и способностью к дифференцировке по сравнению с теми из BM 96,119,120. Анализ масс клеток показал, что активность ниш, измеряемая по экспрессии факторов ниш для HSC , коррелирует с активностью MSC в BM плодов мышей и человека 101. Однако, лишь часть Nes-GFP+, CAR, LEPR+ и Prx1-Cre клеток содержит CFU-F и способность к мультиклональной дифференцировке, подтверждая, что существует гетерогенность в популяции стромальных клеток. Однако, гомогенность популяции стромальных клеток может быть существенно улучшена с помощью рутинного включения в анализ CD51 в качестве маркера 121. Интересно, что большинство BM CD45-TER119-CD31- стромальных клеток происходит из HSC и содержит ранее непонятные популяции из CD45- эритроидных и B лимфоидных предшественников 121. Хотя иерархическая организация bona fide стромальных типов клеток может быть сложной как гематопоэтическое клональное древо, на сегодня отсутствуют доказательства подтверждающие эту идею; в настоящее время характеризация стромальных типов клеток с использованием техники одиночных клеток безусловно предоставит более подробную информацию.
Adipocytes
У людей старение ускоряет ожирение BM, которое особенно очевидно в длинных костях, где места гематопоэза прогрессивно замещаются жирным желтым костным мозгом с пониженной гематопоэтической активностью 36. Adiponectin (ADIPOQ), секретируемый адипоцитами белок нарушает пролиферацию гематопоэтических предшественников in vitro122. Более того, богатый адипоцитами костный мозг (такой как в хвостовых позвонках мышей) содержит меньше HSPCs, чем бедный адипоцитами костный мозг (такой как в торакальных позвонках). У A-ZIP/F1 'fatless' мышей приживление в костном мозге HSCs ускоряется 123. Более того, BM восстанавливается быстрее после трансплантации или химиотерапии, когда мышей лечат антагонистом peroxisome proliferator-activated receptor γ (PPARγ), который подавляет адипогенез 123,124. Эти результаты указывают на то, что адипоциты являются негативными регуляторами функции HSC function; однако, альтерации в MSPCs могут также косвенно вносить вклад а этот результат. Новая популяция MSC (CD45-CD31-SCA1+CD24+), регулируемая диетой и старением, может приводить к появлению остеохондрогенных и адипогенных предшественников 125. В соответствии с негативным влиянием адипоцитов, совместная трансплантация адипогенных предшественников с помощью intratibial инъекции подавляет приживление HSPC и заживление переломов благодаря негативному регулятору dipeptidyl peptidase 4 (ref.124). Напротив, предшественники адипоцитов, происходящие из Adipoq-CreER-меченных клеток, временно поддерживают регенерацию HSCs благодаря продукции SCF 126.
Neural regulation
Иннервация в скелетной системе, как полагают, регулирует гематопоэз в костях и BM49,98,127. В то время как парасимпатические нервы только иннервируют кости и не проникают полностью в костный мозг52,128, симпатические нервы50,51 и сенсорные нервы51,129 иннервируют и кости и BM. Симпатические волокна высвобождают нейротрансмиттер noradrenaline, передающий сигналы посредством аденергических рецепторов. Мобилизация HSPC из костного мозга в периферические органы зависит от интактного градиента CXCL12. Granulocyte colony-stimulating factor (G-CSF) снижает крутизну градиента за счет избирательного уменьшения уровней CXCL12 в BM, приводя к быстрому выходу HSPC из BM77,130. SNS играет роль в мобилизации HSC в ответ на воздействие G-CSF98, т.е. фармакологическое или генетическое устранение адренергической нейротрансмиссии супрессирует миграторную реакцию HSC на стимуляцию G-CSF, это указывает на то, что передача адренергических сигналов контролирует вызываемую G-CSF супрессию остеобластов и и подавление CXCL1298. Более того, интактная сеть остеоцитов, регулируемая с помощью волокон и SNS, также необходима для вызываемой G-CSF мобилизации HSPC131.
BM Nes-GFP+ MSCs подвергаются целенаправленному воздействию SNS; в устойчивом состоянии, адренергические сигналы передаются с помощью β3-adrenergic receptor (ADRβ3), экспрессируемого Nes-GFP+ стромальными клетками, обеспечивая циркадные осцилляции экспрессии CXCL12 и выход HSC у мышей54,99 и возможно у людей100.Важно, что G-CSF-индуцируемая мобилизация ассоциирует с супрессией MSC и функции клеток остеогенного клона98,99,131-133.
Передача сигналов SNS также важна для гематопоэтической регенерации после генотоксического стресса134,135. Химиотерапией обусловленная и/или облучением обусловленная токсичность может способствовать симпатической нейропатии в BM и избыточной пролиферации MSCs и эндотелиальных клеток, что приводит к редукции способности поддерживать их ниши. Использование защищающих нервы135 или регенерирующих нервы лекарств134 восстанавливает симпатические нервные волокна и способствует жизнеспособности клеток ниш и восстановлениею гематопоэза после генотоксического инсульта, подчеркивая потенциальную пользу от использования этих лекарств по защите гематопоэтических ниш от терапевтических повреждений.
Не-миелинизирующие Шванновские клетки, являющиеся глиальными клетками, экспрессирующими маркер glial fibrillary acidic protein (GFAP), изолируют симпатические и сенсорные нервы вдоль артерий и способствуют молчанию HSC путем активации transforming growth factor-β (TGFβ) и передачи сигналов SMAD136. Хирургическая симпатэктомия путем перерезки пост-ганглиолярного симпатического нерва приводит к потере клеток BM GFAP+ и HSCs за счет усиления пролиферации. Однако, менее инвазивные методы симпатэктомии не вызывают уменьшения количества HSC98,99,134, пока неясно, как нервы SNS передают сигналы Schwann клеткам и до какой степени денервация костного мозга вносит вклад в эффекты HSCs.
Могут ли нервы непосредственно влиять на функцию HSC, изучено плохо. Адренергические сигналы могут действовать непосредственно на гематопоэтические предшественники людей, которые экспрессируют β2-adrenergic receptor (ADRβ2), способствуя их миграции и приживлению 137. Более того, BM иннервируется также сенсорными нервами 51,129; однако, очень немногие исследования были посвящены им в связи с гематопоэзом 138,139. Сходным образом, очень мало известно роли передачи парасимпатических сигналов в регуляции активности HSC или микроокружения HSC. Однако, type 1 muscarinic receptor (CHRM1), являющийся одним из рецепторов парасимпатического нейротрансмиттера acetylcholine в гипоталамусе, как было установлено, регулирует G-CSF-индуцированную мобилизацию HSC из BM посредством высвобождения гормона glucocorticoid 140.
Endothelial cells
BM является хорошо васкуляризированной тканью, обладающей несколькими типами кровяных клеток, включая HSCs, способных проникать и покидать кровоток. Эндотелиальные клетки BM выстилают внутренность всех кровеносных сосудов, продуцируя разные факторы, такие как Notch лиганды, CXCL12, SCF и pleiotrophin, которые регулируют активность HSCs и клеток предшественников58,84,86,110,141-143. Эндотелиальные клетки играют также критическую роль после myelosuppressive повреждений за счет продукции факторов, способствующих регенерации гематопоэза110,141-147. In vivo исследования показали, что делеция gp130 (ref.148), Scf84, Cxcl12 (refs85,86) или Jag1 (ref.145) с использованием специфичных для эндотелиальных клеток линий Cre (Tie2-Cre или Cdh5-Cre (Cdh5 кодирует VE-cadherin)) ухудшают поддержание HSC в устойчивом состоянии и подтверждают роль эндотелиальных клеток как регуляторов ниш. Эндотелиальные клетки артериол (AECs) и синусоидные эндотелиальные клетки (SECs) могут быть различены по своей дифференциальной экспрессии SCA1 и podoplanin (PDPN); AECs являются CD45-TER119-SCA1highPDPN-, тогда как все SECs являются CD45-TER119-SCA1+PDPN+. Интересно, что AECs секретируют почти все обнаружимые, происходящие из SCF в BM, т.к. генетическая делеция Scf в AECs, но не в SECs, существенно уменьшает количество функциональных HSCs112. Интересно, что хотя общее количество эндотелиальных клеток в BM сравнимо с таковым для MSPCs149, уровни CXCL12 и SCF в эндотелиальных клетках BM значительно ниже, чем в MSPCs109. Т.о., остается возможность, что extramedullary Tie2-Cre+ клетки могут влиять на ниши BM. Кроме того, благодаря структурной целостности и функции эндотелиальных клеток и около-сосудистых клеток, они являются интимно связаны и поэтому оказывается возможным, что делеция специфических ниш или потеря специфических факторов могут оказывать вредные эффекты на др. ниши. Фактически, истощение LEPR+ клеток с использованием системы индуцибельного дифтирийного токсина, возникают альтерации в VEGFR3+ синусоидах, которые становятся более извилистыми, расширенными и протекающими150. Сходным образом, кондиционная делеция Angpt1 в околососудистых клетках и гематопоэтических клетках приводит к усилению сосудистой протекаемости91.
Хотя гипоксия, как было установлено, является наследуемым признаком HSPCs, не зависимым от их пространственного расположения в архитектуре BM43, недавнее исследование показало, что проницаемость разных сосудов (артериол в противовес синусоидам) к плазме крови влияет на уровни реактивных видов кислорода (ROS) в соседних HSCs и поэтому на их расположение в костном мозге. HSPCs вблизи менее-проницаемых AECs содержат низкие уровни ROS и являются поэтому молчащими, тогда как те, что ближе к протекающим SECs имеют повышенные уровни ROS, что приводит к их активации и усилению их дифференцировки и миграции31. Пока неясно, действительно ли эти различия возникают в результате их метаболических профилей. Необходимо в дальнейшем сфокусироваться на получении изображений более очищенных популяций HSC, т.к. более высокая толерантность к ROS загрязняющих предшественников может запутывать анализ. Большое количество исследований, изучавших метаболические потребности для активности HSC рассмотрены в др. месте151.
При углубленном анализе сосудистой сети BM у мышей разных возрастов выявило разные подтипы кровеносных сосудов, обладающих уникальными молекулярными метками 57,59,152 и ассоциированных с разными типами около-сосудистых клеток 31,58,60. Передача сигналов Notch в эндотелиальных клетках BM способствует остеогенезу и экспансии типа H и артериальных сосудов и их охвату около-сосудистыми PDGFRβ+ мезенхимными клетками 58,152, это сопровождается повышенными уровнями SCF и количества HSC в BM58. Итак, эти исследования подчеркивают сложность ниш BM, выявив существование молекулярных путей , связанных с поведением эндотелиальных клеток и около-сосудистых мезенхимных клеток.
Regulation by HSC descendants
Стромальные компоненты ниш, потомки HSCs также могут регулировать активность HSC с помощью петель обратной связи.
Megakaryocytes
Предлагаемые модели гематопоэза показывают, что имеются тесные взаимоотношения между клоном мегакариоцитов и HSCs. Клон мегакариоцитов может даже обходить дифференцировку из мультипотентных предшественников и вместо этого дифференцироваться непосредственно из HSCs 16,18,19,29,153-155. Фактически существует субпопуляция HSCs, склонная давать мегакариоциты и экспрессировать маркеры тромбоцитов, такие как CD41 и vWF 19,29, и мегакариоциты непосредственно регулируют молчание HSC 156-159. Исследования 3D-изображений расположения HSC вместе с компьютерным анализом рандомизации показало, что субнабор HSCs, специально ассоциированных с мегакариоцитами и что истощение мегакариоцитов приводят к пролиферации HSC 156. Мегакариоциты могут регулировать молчание HSC c помощью нескольких механизмов, включая секрецию хемокина CXCL4 (известен также как PF4) 156, TGFβ (передача сигналов, которая у HSCs, требует SHP1 (известен также как PTPN6)) 157,160 и THPO (обеспечиваемый c помощью C-type lectin-подобного рецептора 2) 158,159. Однако избирательная делеция Thpo в гематопоэтических клетках (включая мегакариоциты) с использованием Vav1-Cre мышей не вызывала изменений в количестве HSC в BM 92. В противовес в устойчивом состоянии мегакариоциты способствуют ремоделированию ниш HSC после облучения летальной дозой за счет экспансии клеток остеогенного клона 161,162 и секреции fibroblast growth factor 1 (FGF1) 157. Во время возникновения миелопоэза продукция TGFβ 1 и CXCL4 мегакариоцитами, окружающими кластеры гранулоцитов или клеток предшественников макрофагов могут быть важным механизмом по восстановлению молчания HSC и ограничению продолжительности регенеративной реакции 163. Т.о., эти исследования подтвердили, что существуют отдельные ниши HSC , способствующие молчанию - мегакариоциты и артериолы с клетками NG2+ и GFAP+ нервами 30,136. Vwf-GFP+ HSCs, имеющие склонность становиться тромбоцитами и миелоидным клоном, тесно ассоциируют с и регулируются мегакариоцитами, демонстрируя тем самым, что HSCs регулируются по типу петли обратной связи в отношении их потомства 32. Более того, истощение мегакариоцитов избирательно увеличивает Vwf-GFP+ HSCs, тогда как истощение NG2+ клеток артериолярных ниш избирательно истощает Vwf-GFP- HSCs. Т.о., эти исследования продемонстрировали существование двух пространственно и функционально отличающихся ниш для субпопуляций HSC, которые обладают разными онтогенетическими потенциалами.
Phagocytic cells
Изучение механизма G-CSF-индуцированной мобилизации HSC показало, что фагоцитарные клетки в BM регулируют миграцию HSC. Макрофаги в BM способствуют удержанию HSC путем регуляции клеток остеогенного клона и MSCs, противодействуя тем самым SNS-вызываемому подавлению удержания HSC в BM133,164,165. Макрофаги красной пульпы селезенки играют важную роль в удержании HSC в селезеночной нише путём обеспечения адгезии посредством VCAM1166. Истощение in vivo макрофагов с использованием генетических моделей или clodronate-нагруженных липосом способствует мобилизации HSPCs в кровь164. Более того, BM CD169+ макрофаги способствуют сохранению HSCs в BM благодаря индукции экспрессии CXCL12 и др. факторов удержания HSC посредством Nes-GFP+ MSCs165. Кроме того, передача сигналов G-CSF рецепторов в моноцитах BM выполняет важную роль в обеспечении мобилизации HSPC133. Взаимодействия между макрофагами и Nes-GFP+ MSCs может обеспечиваться посредством происходящего из макрофагов oncostatin M167. Макрофаги могут также непосредственно регулировать HSCs168,169. Редкая популяция макрофагов, которые позитивны по α-гладкомышечному актину, располагаются по соседству с HSCs в BM, может защищать HSPCs от истощения путем ограничения продукции ROS при стрессах168. Субнабор макрофагов, экспрессирующих duffy antigen receptor для хемокина (DARC; известен также как ACKR1) регулирует молчание HSC посредством передачи сигналов TGFβ -SMAD3169. Однако, являются ли макрофаги, которые непосредственно влияют на HSCs и те, что осуществляют свои эффекты косвенно посредством ниш, являются одними и теми же, неизвестно.
Гомеостатическая очистка в старых CD62L lowCXCR4 high нейтрофилов из кровообращения также регулирует ниши HSC 170. Ежедневное высвобождение и очистка от нейтрофилов регулируется циркадным способом, меняя функцию клеток CAR и способствуя циркадному выходу HSPCs в кровообращение. Модуляция ниш в конечном итоге обеспечивается фагоцитарными макрофагами BM (которые ответственны за очистку от нейтрофилов) посредством передачи сигналов liver X receptor 170. В то время как изучение механизма лихорадочной мобилизации у моделей показало, что G-CSF-индуцированные симпатические изменения (tone) стимулируют продукцию prostaglandin E2 посредством нейтрофилов, которые могут целенаправленно воздействовать на клетки остеогенного клона, чтобы способствовать удержанию HSPC 171. Tumour necrosis factor (TNF), продуцируемый нейтрофилами, улучшает восстановление сосудов после иррадиации посредством TNF рецепторов на эндотелиальных клетках хозяина, это приводит к усилению гематопоэтического приживления 172. Это исследование подчеркивает потенциал нового подхода по улучшению трансплантаций BM за счет усиления восстановления компартмента ниш . Итак, эти результаты демонстрируют, что макрофаги и нейтрофилы прямо и косвенно регулируют активность HSC.
Regulatory T cells
Первые исследования показали, что субнабор T лимфоцитов может быть благоприятным для приживления аллогенных HSC (allo-HSC) после трансплантации BM 173,174. Улучшение техники прижизненной микроскопии позволило исследователям показать, что allo-HSCs локализуются совместно с FOXP3+ регуляторными T (Treg) клетками в endosteal области после трансплантации 175. Treg клетки способствуют выживанию донорских allo-HSCs путем секреции иммунорегуляторного цитокина IL-10. Более того, трансплантированные, происходящие от доноров, HSCs могут сохраняться в необлученных мышах реципиентах 30 дней без иммуносупрессии. Однако, истощение FOXP3+ Treg клеток быстро приводит к потере allo-HSCs, подтверждая, что Treg клетки способны наделять HSC ниши иммунными привилегиями. BM CD150 high Treg клетки, по-видимому, локализуются совместно с HSCs и способствуют их молчанию ы устойчивом состоянии (потенциально за счет CD39-катализируемой продукции аденозина), облегчая тем самым приживление allo-HSC 176. Прямые и косвенные роли клеток Treg в HSC нишах могут устанавливать иммуно-привелегированную 'sanctuary' благодаря иммунной атаке не только для здоровых HSPCs, но и также для злокачественных клеток.
The ageing niche
Старение млекопитающих характеризуется прогрессирующим тканевым изнашиванием, которое связано с дегенеративными болезнями и повышенными показателями многих типов рака. В гематопоэтиеской системе связанные с возрастом альтерации в иммунном ответе, которые приписываются снижению функции HSC, увеличивают восприимчивость к инфекциям, аутоиммунитету, анемии и миелопролиферативным болезням177. Хотя абсолютное количество фенотипически идентифицируемых HSCs увеличивается с возрастом у мышей, регенеративный потенциал старых HSCs снижается178-181. Однако, эти изменения в количестве HSC не обнаруживаются у всех линий мышей; Фактически, количество функциональных HSCs у BALB/c мышей снижается с возрастом182. Более того, старые HSCs обнаруживают склонность к миелоидной дифференцировке после трансплантации180-185, усиливая мобилизацию в кровообращение и уменьшая возвращение обратно в BM178,186,187. Старые HSCs располагаются также в местах довольно удаленных от endosteum у мышей в определенных условиях188 и перераспределяются в направлении прочь от arteriolar и мегакариотических ниш в устойчивом состоянии189 по сравнению с молодыми HSCs, подтверждая, что распределение старых HSC является дополнительным признаком старения.
Функциональные нарушения старых HSCs по сравнению с их молодыми аналогами, трансплантированными молодым реципиентам 178,180,181 подтверждают, что старение HSC является следствием присущих клеткам альтераций. В самом деле, многие, присущие клеткам, механизмы участвуют в старении и HSC, включая дефекты клеточной полярности, измененные транскрипционные и эпигенетические профили и нарушения метаболизма и повреждения ДНК (rev.190,191). Однако, трансплантированные молодые HSCs приживляются с низкой эффективностью у старых реципиентов 180,192, демонстрируя роль внешних по отношению к клеткам механизмов в старении HSC (Fig. 4a). Интересно, что субпопуляция старых, предназначенных стать миелоидными клетками, HSCs ведет себя как 'латентная' мультипотентная популяция HSCs, поскольку они обладают myeloid-ограниченным потенциалом при первичной трансплантации, но не при вторичной трансплантации 193. Эти исследования подтверждают, что омоложение HSCs и восстановление их мультиклонального потенциала является сложным, но достижимым и подчеркивают возможную роль микроокружения HSC в этом процессе 194 (Table 2). Напр., усиление секреции pro-inflammatory хемокинового CC-chemokine ligand 5 (CCL5; известен также как RANTES) может вносить вклад в склонность к миелоидной дифференцировке старых HSCs 192. Ex vivo воздействие на HSCs CCL5 приводит к меньшему количеств T клеток, а делеция Ccl5 у мышей восстанавливает склонность к миелоидной дифференцировке. Экспрессия OPN стромальными клетками BM снижается с возрастом, а инъекция thrombin-cleaved OPN ослабляет функциональный дефицит старых HSCs после трансплантации 195. MSCs также обнаруживают отклонения дифференцировки по время старения, что приводит к снижению формирования кости и усилению адипогенеза 196,197. Накопление адипоцитов в BM может вносить вклад в гематопоэтические альтерации у старых мышей благодаря своим негативным эффектам на гематопоэз 123,125 и сопутствующей экспансии миелоидного клона 198,199. Связанная с возрастом потеря кости у мышей также была ассоциирована с изменениями в сосудистой сети BM 58,189,200. Количество преходящих сосудов, артериол и osterix-позитивных клеток существенно уменьшается у стареющих мышей и может быть восстановлено путем активации эндотелиальной передачи сигналов Notch, хотя функция HSC не омолаживается 58. Более того, сосудистая сеть BM обладает повышенной протекаемостью, повышенными уровнями ROS и пониженной экспрессией CXCL12, SCF и Jagged 1 с возрастом 200. Совместное культивирование молодых HSPCs со старыми эндотелиальными клетками, также как и инъекции эндотелиальных клеток мышам после myelosuppressive повреждений, демонстрируя, что старые эндотелиальные клетки обнаруживают нарушения функции и повышенную склонность к миелоидной дифференцировке молодых HSCs. Напротив, молодые эндотелиальные клетки могут восстанавливать способность к repopulation у старых HSCs, но не способны к возвращению их склонности к миелоидной дифференцировке 200.
 Fig. 4: The adult bone marrow HSC niche in ageing and malignancy.
Fig. 4: The adult bone marrow HSC niche in ageing and malignancy.
a | Schematic representation of the aged haematopoietic stem cell (HSC) niche. Aged HSCs are very proliferative and exhibit increased myeloid-biased differentiation and reduced regenerative capacity. Ageing-related alterations of the bone marrow niche that influence HSC ageing include alterations in the vasculature and mesenchymal stem and progenitor cells (MSPCs), increased adipogenesis and reduced osteogenesis, altered secretion of niche factors and a reduced number of adrenergic nerves. b | HSC niche alterations that promote cancer. Epigenetic or genetic lesions (lightning bolt) in stromal niche regulators can lead to the loss of inhibitory signals that control the growth of pre-malignant clones and ultimately promote myeloid malignancies. These lesions include alterations in the expression of recombination signal binding protein for immunoglobulin-? J region (RBPJ) in endothelial cells; ?-catenin in osteoblasts; Dicer 1, Shwachman-Bodian-Diamond syndrome protein (SBDS) and tyrosine-protein phosphatase non-receptor type 11 (PTPN11) in MSPCs; and deletion of Rarg (which encodes RAR?, retinoic acid receptor), Rb (which encodes RB protein) or Mib1 (which encodes mind bomb 1 protein) in undefined stromal cells. c | Cancer promotes niche remodelling. The majority of myeloid malignancies are caused by epigenetic and/or genetic mutations in haematopoietic stem and progenitor cells (HSPCs), which lead to bone marrow niche remodelling that supports cancer cell growth at the expense of normal haematopoiesis. Alterations produced by different malignancies can lead to a pro-inflammatory environment characterized by impaired MSPC differentiation, fibrosis, vascular remodelling, neuropathy and reduced production of HSC niche factors by stromal cells. Leukaemic stem cells (LSCs) can also upregulate the expression of CXC-chemokine receptor 4 (CXCR4), very late antigen 4 (VLA4) and CD44 to hijack the mechanisms of adhesion used by healthy HSPCs. ADRβ3, β3-adrenergic receptor; AML, acute myeloid leukaemia; CCL, CC-chemokine ligand; CML, chronic myeloid leukaemia; CXCL12, CXC-chemokine ligand 12; IL-1β, interleukin-1?; MDS, myelodysplastic syndrome; MPN, myeloproliferative neoplasm; NG2, neural-glial antigen 2; OPN, osteopontin; ROS, reactive oxygen species; SCF, stem cell factor; SNS, sympathetic nervous system; T-ALL, T cell acute lymphoblastic leukaemia; TGFβ, transforming growth factor-β; THPO, thrombopoietin.
Table 2. Niche alterations associated with ageing in the mouse bone marrow
Старение также приводит к заметному преобразованию сосудистой сети BM, включая укорочение артериолярных сегментов и потерю иннервации артериол 189. Хирургическая денервация костей у молодых мышей приводит у всех к главным признакам старения HSC, таким как экспансия склонных к миелоидной дифференцировке HSCs, что сопровождается уменьшением репопуляционной активности, приобретению дефектов клеточной полярности и повышенному количеству γH2AX фокусов (маркер повреждений ДНК) в HSCs. Денервация также вызывает ремоделирование микроусловий BM, которые напоминают таковые у старых мышей, включая укорочение артериолярных сосудов и экспансию MSCs, что уменьшает клоногенную способность и экспрессию факторов ниш HSC, таких как CXCL12 и SCF. Важно, что использование ADRβ3-избирательного агониста у старых мышей существенно омолаживает функцию in vivo старых HSCs путем воздействия на стромальные клетки BM 189. Дальнейшие исследования позволят смягчить обусловленное возрастом снижение работы гематопоэтической системы.
The haematopoietic stem cell niche in cancer
В соответствии с регуляцией гематопоэза с помощью ниш (Fig. 3), появляются доказательства, подтверждающие, что составляющие ниш могут также управлять возникновение опухолей (Fig. 4b) или могут быть ремоделированы для поддержания злокачественных клеток (Fig. 4c).
Niche-driven malignancies
Одним из первых указаний, что измененные ниши BM могут вносить вклад в злокачественные трансформации обнаружены в исследованиях 201,202, которые показали, что дефицит retinoic acid receptor-γ (RARγ) запускает возникновение myeloproliferative neoplasm (MPN)-подобного фенотипа. Этот фенотип обнаруживается даже когда клетки дикого типа трансплантируются RARγ-нокаутным мышам201, демонстрируя, что экспрессия RARγ в стромальных клетках скорее, чем гематопоэтические клетки, вызывают новообразования. Кроме того, делеция в гене, кодирующем RB-ассоциированный белок (Rb1) как в стромальном, так и миелоидном компартментах вызывают MPN-подобную болезнь202. Сходным образом, делеция гена, кодирующего ген mind bomb 1 (Mib1), важный компонент эндоцитоза Notch лиганда, в не-гематопоэтических клетках, вызывает MPN-подобную болезнь, которая может быть устранена путем активации Notch в микроокружении203. Эти находки показали, что сигналы от микроокружения могут влиять на злокачественные преобразования.
Происходящие из мезенхимы стромальные клетки также участвуют в управлении злокачественности. Делеция гена, кодирующего фермент преобразования РНК Dicer 1 в MSPCs при использовании Osx-Cre вызывает myelodysplastic syndrome (MDS), которые может спорадически трансформироваться в acute myeloid leukaemia (AML). Однако, делеция Dicer1 в зрелых остеобластах с использованием Bglap-Cre не приводит к озлокачествлению 204. Потеря Dicer 1 в клетках MSPCs также приводит к снижению экспрессии Sbds, гена, мутантного у людей с синдромом Shwachman-Bodian-Diamond, который ассоциирует с недостаточностью BM и предрасположенностью к лейкемии. Делеция Sbds в MSPCs стимулирует передачу сигналов p53 и секрецию воспалительных молекул 100A8 и S100A9, которые нарушают гематопоэз и способствуют возникновению лейкемии путем индукции генотоксического стресса в HSPCs 205. Обусловленная специфическими условиями экспрессия мутантного белка protein tyrosine phosphatase non-receptor type 11 (Ptpn11), позитивного регулятора передачи сигналов RAS, в MSCs и предшественниках костей также может управлять развитием и прогрессированием MPN 206. Дополнительное подтверждение этой роли osteolineage клеток в возникновении лейкемии получено в исследованиях мышей со специфической экспрессией в остеобластах постоянно активного β-catenin, это приводит к MDS и AML в результате усиления передачи сигналов Notch в HSCs 207. Интересно, что активация рецептора паратироидного гормона в мышиных остеобластах усиливает миелоидно/лимфоидную или смешанную лейкемию (MLL) (известна также как lisine N-methyltransferase 2A)-AF9 oncoprotein-driven AML, в то время как она редуцирует BCR-ABL chronic myelogenous leukaemia (CML)-подобную болезнь, подтверждая специфическую роль её в клетках остеогенного клона при возникновении лекемии (eukaemogenesis) 208. Др. клетки из микроокружения также могут влиять на злокачественную трансформацию, т.к. генетическое нарушение передачи сигналов Notch в эндотелиальных клетках нарушает экспрессию miR-155, активирует передачу сигналов NF-κB и усиливает продукцию цитокинов, способствующих воспалению, это может запускать MPN-подобную болезнь 209. В целом эти исследования предоставляют доказательства, что микроокружение может вызывать и/или поддерживать гематологическое озлокачествление у мышей (Fig. 4b). Однако, остается неясным, действительно ли сходные альтерации, происходящие у людей только нишах, могут вызывать у людей злокачественные новообразования, хотя имеются анекдотичные сообщения о новообразованиях, возникающих из донорских клеток после аллогенной трансплантации стволовых клеток от здоровых доноров 210. Является ли это результатом не обнаруженных злокачественных клонов в донорской выборке или результатом измененных микроусловий у реципиента, предстоит решить.
Niche remodelling by malignancies
В то время как здоровые HSPCs могут модулировать ниши91, что также и могут лейкемические стволовые клетки (LSCs) в порядке конкуренции за ниши BM211 а их ремоделирование далее будет создавать поддерживающие рак условия. Лейкемические клетки усиливают экспрессию некоторых молекул, включая CXCR4 (refs 212-215), VLA4 (известен также как α4β1 integrin)216 и glycoprotein CD44 (refs217,218); эти молекулы обеспечивают лейкемические клетки слипчивостью и жизнеспособностью, что обеспечивает им химиорезистентность и используется в качестве терапевтических мишеней. BCR-ABL CML клетки могут индуцировать дифференцировку MSCs в измененные остеоклональные предшественники за счет непосредственных межклеточных контактов и секреции THPO и CCL3, которые могут нарушать их способность поддерживать здоровые HSCs и вместо этого способствовать росту лейкемических клеток219. Сходные наблюдения были описаны для разных мышиных моделей острой лейкемии, такой как MLL-AF9-управляемой модели AML220,221, BCR-ABL-управляемой модели blast-crisis CML222 и модели T cell acute lymphoblastic leukaemia (T-ALL)223,224. Более того, исследования первичных выборок AML от пациентов показали, что лейкемические клетки супрессируют адипогенез в BM в пользу AML-поддерживающих osteolineage дифференцировку MSCs225,226. Др. регуляторы HSC ниш, такие как сосудистые эндотелиальные клетки, также нарушены при лейкемии. При AML у мышей и людей наблюдается общее увеличение сосудистой сети BM220,227; однако, наблюдается избирательная редукция в количестве endosteal кровеносных сосудов при прижизненной микроскопии221. В последнем исследовании ремоделирование сосудов приводило к накоплении локальных способствующих воспалению и антиангиогенных цитокинов, продуцируемых endosteal AML клетками. Интересно, что химическое или генетическое восстановление дефектов endosteal сосудов предупреждает потерю здоровых HSCs и повышает эффективность химиотерапии221. Сходным образом, подавление происходящего из эндотелия nitric oxide нормализует текучесть сосудов в BM, наблюдаемую у AML ксенотрансплантатам и улучает реакцию на химиотерапевтический агент cytarabine228, подтверждая, что сосудистая регуляция с помощью злокачественных клеток является ключевым компонентом резистентности к химиотерапии.
Появившиеся данные указывают на то, что нервы, которые преимущественно ассоциированы с кровеносными сосудами в тканях могут регулировать солидные опухоли 229-231 и гематологические озлокачествления 220,232. У модельных мышей MLL-AF9 инфильтрация лейкемических клеток в BM приводит к дегенерации волокон симпатических нервов вокруг артериол, что еще больше способствует AML 220. В соответствии с этим наблюдением, воздействие на этих мышей нейротоксином 6-hydroxydopamine, который специфически повреждает катехоламинергические нейроны 98,99, увеличивает количество фенотипических LSCs. Нейропатия сопровождается пролиферацией Nes-GFP+ MSPCs, которые прежде всего склонны к остеобластной дифференцировке и снижению количества HSC-содержащих NG2+ клеток ниш вокруг артериол. Блокировка β2-адренергических рецепторов усиливает AML инфильтрацию в BM, тогда как β2-адренергический агонист задерживать прогрессирование болезни 220. У мышей, моделирующих MPN , вызываемых экспрессией мутантной формы Janus kinase 2 (JAK2V617F), количества симпатических волокон и Шванновских клеток также уменьшаются в результате продукции способствующего воспалению цитокина IL-1β мутантными HSPCs 232. В противоположность его эффекту на MLL-AF9 модельных мышей, нейропатия в этой модели MPN вызывает апоптоз Nes-GFP+ MSCs. Прогрессирование MPN замедляется при воздействии β3-адренергического агониста, который восстанавливает симпатическую регуляцию MSCs и косвенно снижает количество LSCs 232. Др. исследование MPN миелофиброза установило, что аномальные мегакариоциты секретируют способствующие воспалению паракринные сигналы, такие как TGFβ 233, тогда как аберрантная дифференцировка LEPR+ MSPCs 234 и/или GLI1+ MSPCs 235 вызывает избыток миофибробластов, что способствует фиброзу BM. В целом эти исследования показывают, что хотя разные гематопоэтические озлокачествления имеют общие пути онкогенеза, скорее всего, их взаимодействия с микроусловиями BM могут быть специфичными дл субтипов лейкемии. Солидные опухоли не-гематопоэтического происхождения, такие как рак простаты и молочных желез, может метастазировать в BM и модулировать HSC ниши, чтобы поддерживать рост опухоли 236. Метастатические раковые клетки простаты человека могут связываться с происходящими из ниш CXCL12 и конкурировать с донорскими HSCs за занятие ниш 237,238. Т.о., манипуляции с неопластическими нишами в комбинации с химиотерапией могут быть благоприятны для терапевтической стратегии, особенно при озлокачествлении, когда обычная терапия безуспешна.
Conclusions and future perspectives
The past 10 years have seen extraordinary growth in the understanding of BM niches and the specific cellular and molecular components that regulate HSC activity. A range of genetically modified mouse strains combined with reporters and sophisticated imaging techniques associated with computational analyses have enabled the study of the dynamics of endogenous HSCs in their native environments. These studies support the idea that the niches for HSCs and their progeny consist of complex arrangements of cellular constituents whose contributions remain to be fully elucidated. Accumulating data have identified a major role for vascular and perivascular cells in HSC niche regulation. However, the most purified candidate niche cells (for example, CAR cells, Nes-GFP+ cells or LEPR+ cells) far outnumber HSCs, which suggests that these mesenchymal-derived populations require further fractionation or that establishment of a bona fide niche requires the participation of other cellular constituents66. Ongoing studies using single-cell approaches should provide new insights about the heterogeneity of stromal cells in the HSC niche. Although conditional gene deletions or cellular depletions are powerful tools to investigate the factors and cellular participants that are involved in establishment and/or regulation of the HSC niche, the specificity of promoter and Cre recombinase excision activity is an important consideration for the interpretation of experiments in these models. Studies in which single factors are deleted in niche cells must be cautiously interpreted, as there may be compensatory production of the factor by other cells or long-range signals from outside the BM (Box 2).
The fact that 'space' must be made in the BM niche, using preparative myeloablative regimens, to enable HSCs to engraft has led to the notion that niches are saturated at steady state. However, a recent study suggested that the BM may contain numerous unoccupied niches at steady state239, which raises a number of important questions, such as how vacant niches can be unlocked, whether they form reservoirs for haematopoietic emergencies and whether leukaemia cells take advantage of these reservoirs to promote disease progression. These important questions also raise the basic, yet important, issue of how HSC numbers are regulated in the BM. As current imaging approaches to localize endogenous HSCs in fixed tissues may underestimate niche availability, improvements in intravital microscopy methods and genetic reporters to image HSC-niche interactions in real time may bypass this limitation.
Studies suggest that haematopoietic progenitors have a major role in the regulation of steady-state haematopoiesis; therefore, further studies are needed to carefully evaluate the structure of putative niches established by haematopoietic progenitors and to identify novel factors that regulate stemness and the maintenance of specific types of progenitor. RNA sequencing and gene-targeting approaches may help with the discovery of these factors and their specific role in HSC and progenitor function, but ultimately proteomics-based and lipidomics-based methods will be necessary to investigate more thoroughly the various secreted factors that are presumably required to sustain haematopoiesis. These advances would enable the development of improved, chemically defined, culture systems and the design of ex vivo HSC expansion protocols to improve gene editing and transplantation efficiency. The development of novel mouse models with a humanized microenvironment that is more permissive for human HSC niche studies would be beneficial, as currently it is difficult to recapitulate certain haematological malignancies in mice.
The underlying changes in the BM niches that promote the development of leukaemia suggest that different leukaemia subtypes can induce specific niche abnormalities and may differ in their niche dependence. Other important questions about niche involvement in malignancy include whether LSCs reside in specific niches, and if they do, whether LSCs of different classes (for example, myeloid versus lymphoid) localize in different niches, and what the role of these niches is in transformation from pre-leukaemia to acute leukaemia. As the incidence of haematological malignancies increases with age, understanding the mechanisms of HSC and niche ageing and their contribution to malignant transformation may help in the design of therapeutic approaches to rejuvenate an aged haematopoietic system or prevent or treat haematological malignancies.
|



