Посещений: 
ПЕРЕХОД ОТ МАТЕРИНСКОЙ К ЗИГОТИЧЕСКОЙ ТРАНСКРИПЦИИ
Генетические и эпигенетические изменения
Dynamics of the epigenetic landscape during the maternal-to-zygotic transition • Melanie A. Eckersley-Maslin,
• Celia Alda-Catalinas &
• Wolf Reik
 Nature Reviews Molecular Cell Biology volume 19, pages436–450 (2018)
| |
|
Пре-имплантационное развитие у мышей соответствует ст. развития о оплодотворения до имплантации в матку матери на 4.5 день эмбриогенеза (E4.5) (rev.1). В течение этих первых дней развития происходят важные эпигенетические изменения, обеспечивающие правильный ход развития. После оплодотворения транскрипционно неактивное яйцо завершает второе мейотическое деление и формируются одноклеточный эмбрион или зигота, содержащие по отдельности отцовский и материнский пронуклеусы. После репликации ДНК и сингамии пронуклеусов тотипотентная зигота подвергается серии делений дробления, приводящих в конечном итоге к формированию бластоциста, содержащего плюрипотентные клетки (rev.1-4) (Fig. 1). В это время контроль развития переходит от гамет к эмбриону, это maternal-to-zygotic transition (MZT). MZT связан с истощением материнских РНК и белков и с активацией транскрипции генома зиготы (rev.refs5-7) (Fig. 1). Активация генома зиготы) сильно скоординированный процесс, в котором первоначально молчащий зиготический геном становится транскрипционно активным. Время ZGA варьирует у разных видов позвоночных (rev. in refs 8-10).
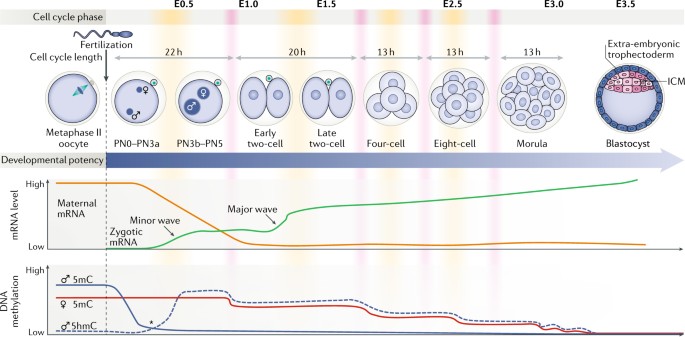 Fig. 1: Overview of transcription and DNA methylation dynamics during mouse preimplantation development.
Fig. 1: Overview of transcription and DNA methylation dynamics during mouse preimplantation development.
Fertilization is followed by a decline in potency from the totipotent zygote through to the blastocyst, which contains pluripotent cells in the inner cell mass (ICM). Maternal mRNA stores (orange line) are rapidly depleted while two waves of transcriptional zygotic genome activation (ZGA; green line) take place: the first, minor wave predominantly in the male pronucleus (PN) in the zygote and the second, major wave in mid-two-cell to late-two-cell embryos. Paternally-derived DNA methylation is rapidly lost (5mC, blue solid line) and later converted to 5-hydroxymethylcytosine (5hmC, blue dashed line); the * denotes concurrent de novo DNA methylation and hydroxymethylation. DNA methylation of the maternal genome (red solid line) is mostly passively lost during DNA replication. Approximate cell cycle phases are represented by yellow bars for S phase and red bars for M phase. Approximate embryonic days (E) are denoted. У мыши и человека ZGA происходит в виде двух взрывов транскрипции, наз. малой и крупной волной (Fig. 1). У мышей первая, минорная волна происходит беспорядочно на низком уровне в S - G2 фазе, преимущественно в мужском пронуклеусе зиготы. За этим следует более крупная и более регулируемая большая волна транскрипции в G1 to S у двух-клеточного эмбриона11-22. У человека обнаруживается низкий уровень транскрипции от зиготы до 4-клеточного эмбриона14,23, но на ст. 8 клеток происходит большая волна транскрипции14-27, которая совпадает с более продолжительным пре-имплантационным развитием у человека (rev. refs28,29). Помимо белки кодирующих транскриптов, происходит и волна транскрипции не кодирующих РНК, включая и small non-coding RNAs (sncRNAs), long non-coding RNAs (lncRNAs) и эндогенные ретровирусы или повторяющиеся элементы (повторы или транспозоны), во время раннего эмбрионального развития (rev. refs30,31,32,33), которые могут играть важную регуляторную роль.
Эпигенетические механизмы являются критическими при этом переходе от материнского к эмбриональному контролю транскрипции онтогенетических генов и для активации зиготического генома.
Global DNA demethylation
У млекопитающих метилирование 5-го углерода цитозина (5mC), которое происходит преимущественно в динуклеотидах CpG, является механизмом эпигенетической регуляции. Подобно соматическим клеткам ооциты и спермии обладают умеренными и высокими уровнями 5mC, соотв. Напротив, ранние эмбрионы подвергаются обширному глобальному деметилированию ДНК от зиготы и на ст. бластоциста, прежде чем уровни метилирования не будут поворно установлены во время гаструляции (rev. refs34-36) (Fig. 1). Эта волна деметилирования ДНК во время пре-имплантационного развития законсервирована у мышей и человека, хотя у эмбрионов человека обнаруживается более медленная кинетика (rev.ref.29).
Метилирование устанавливается с помощью DNA (cytosine-5)-methyltransferase 3A (DNMT3A) и DNMT3B и поддерживается в ходе митозов с помощью DNMT1. Устранение метилирования ДНК может происходить или пассивно, во время репликации ДНК в отсутствие DNMT энзимов или активно посредством путей репарации ДНК и/или посредством окислительных реакций, катализируемых с помощью ten-eleven translocation (TET) энзимов. У мышей большинство энзимов аппарата метилирования ДНК функционируют как гены с материнским эффектом (MEGs), включая специфичную для ооцитов изоформу DNMT1 (DNMT1o)37, DNMT3A38,39, DNA (cytosine-5)-methyltransferase 3-like (DNMT3L)40 и DNMT1 recruiting protein E3 ubiquitin-protein ligase UHRF1 (ref.41). Принимая во внимание глобальную потерю метилирования ДНК во время пре-имплантационного развития, не является неожиданным, что материнские мутации в компонентах аппарата метилирования ДНК обычно вызывают дефекты на более поздних пост-имплантационных стадиях, преимущественно в поддержании импринтинга (rev.ref.42). Однако, по-видимому, существуют и др. роли для большинства дифференциально метилируемых регионов в ооцитах, не связанных с геномным импринтингом43,44.
У зигот динамические изменения происходят в распределении и уровнях как 5mC , так и его производных. Интересно, что как анализ, базирующийся на иммуно-флуоресценции, так и анализ всего генома выявили, что материнский и отцовский геном подвергаются деметилированию ДНК не с одной и той же динамикой37,45-55 (Fig. 1). Материнское метилирование ДНК преимущественно теряется пассивно, хотя имеются также и низкие уровни активного деметилирования ДНК47,56. Исключение из ядра DNMT1 управляется частично с помощью subcortical maternal complex (SCMC)57 , а обеспечивающий цитоплазматическую локализацию DNMT1 recruiter UHRF141 является главным двигателем пассивного деметилирования ДНК, наблюдаемого в материнском геноме. Напротив отцовский геном в основном подвергается быстрому и активному деметилированию. Первоначально считали, что это управляется преимущественно с помощью TET3, который катализирует превращение 5mC в 5-hydroxymethylcytosine (5hmC) и мощно экспрессируется у ранних предимплантационных эмбрионов58-60. Материнский геном защищен от такого деметилирования благодаря предпочтительному связыванию STELLA (известен также как DPPA3) с деметилированным гистоном H3 Lys9 (H3K9me2)61,62, который не обнаруживается в отцовском геноме62, тем самым меняется структура хроматина и препятствует TET3-обусловленному деметилированию (rev. ref.35). TET3 отвечает за приблизительно 25% деметилирования отцовского генома51, и это согласуется с тем, что геномное картирование продуктов TET-катализируемого окисления 5hmC и 5-formylcytosine (5fC) (Box 1) показало, что эти производные накапливаются у двух-клеточных эмбрионов46,63,64.
Несмотря на доказательства важной роли TET3 в активном де-метилировании ДНК, особенно в отцовском геноме58-60, это может быть неполной картиной. Вообще-то до некоторой степени парадоксально, что анализ с помощью иммуно-флуоресценции и ультра-чувствительной масс-спектрометрии показал, что уровниe 5hmC только начинают повышаться в отцовском геноме со стадии пронуклеуса PN3, это происходит после основного снижения уровней 5mC, происходящего в начале ст. PN3 (refs52,53) (Fig. 1). Последовательно генерируемый вновь 5fC обнаруживается на ст.PN3-PN5 у зигот, подтверждая, что имеет место активное деметилирование на этих поздних зиготических стадиях63. Это д. согласовываться с TET3 противодействием метилированию ДНК de novo у зигот, потенциально посредством активности DNMT3A53. Более того, нокаутные мыши по материнскому TET3 всё ещё подвергаются частичному деметилированию47,51,56, подтверждая, что избыточность путей, таких как репарация ДНК, также вовлечена в этот процесс. Следовательно, механизм инициальной потери 5mC у ранних зигот остается неясным и возможно, что существует несколько параллельных путей деметилирования.
Кандидатом на роль участника в этом де-метилировании ДНК является материнский фактор gonad-specific expression gene (GSE; известен также как STPG4). Истощение GSE приводит к редукции как потери 5mC, так и избытка 5hmC в отцовском пронуклеусе, подтверждая его роль в активном де-метилировании ДНК отцовского генома на поздних зиготических стадиях65. Кроме того, механизмы деметилирования, базирующиеся на репарации ДНК, также могут быть важны для стирания метилирования с отцовского пронуклеуса52,60,66. Разрывы ДНК, маркированные с помощью γH2A.X фокусов, были обнаружены в отцовском пронуклеусе50,67. Репарация ДНК может приводить к замещению модифицированных цитозинов на не-модифицированные посредством механизмов, таких как base-excision repair52,66,67, приводит к потере метилирования ДНК.
Хотя динамика механизмов, управляющих метилированием ДНК, в общем раскрыта у ранних эмбрионов, основные вопросы остаются нерешенными: что является причиной, при любой динамике метилирования ДНК преобразований клеточных судеб во врем пре-имплантационного развития и каково взаимодействие между метилированием ДНК и динамикой др. эпигенетических модификаций во время раннего эмбриогенеза?
|
Box 1 Methods to study the regulation of the epigenome during the maternal-to-zygotic transition
Numerous low-input and single-cell transcriptomic and epigenomic methods have recently been developed (reviewed in refs189,190,191). Whereas numerous methods profile the 3'-polyadenylated fraction of the preimplantation transcriptome at single-cell resolution13,14,192,193, exciting new advances have also enabled probing repetitive elements and some non-coding transcripts164,194-196. These include microfluidic high-throughput reverse transcription-quantitative approaches164 and the profiling of small non-coding RNAs196, including circular RNAs194. Unfortunately, most sequencing-based single-cell transcriptomic approaches lose important spatial information. To address this, traditional in situ hybridization-based methods have been adapted to provide higher throughput and to measure not only abundance but also localization of hundreds of transcripts in single cells197,198 (reviewed in ref.199). It will be exciting to see these techniques applied to early embryos.
The epigenome is now accessible at single-cell resolution: DNA modifications, including methylated cytosine and its oxidized products, can be profiled at single-base resolution63,64,200-203, and chromatin organization can be analysed at different levels using variations of chromatin conformation capture91-93,204-206, assay for transposase accessible chromatin-sequencing (ATAC-seq)207,208, DNaseI hypersensitivity (DHS) mapping209, DNA adenine methyltransferase identification (Dam-ID)210 and nucleosome occupancy and methylome sequencing (NOME-seq)211 (reviewed in refs189,191). Combinations of these methods, including simultaneous DNA methylation and transcriptome measurements212, concurrent DNA methylation and chromatin organization187 and even simultaneous profiling of DNA methylation, transcriptome and chromatin organization213, should prove useful in untangling the temporal relationships between the different epigenetic layers and transcription regulation of early embryonic development. Although currently limited to histone post-translational modifications (PTMs), low-input chromatin immunoprecipitation followed by sequencing (ChIP-seq) approaches have uncovered exciting new aspects of the chromatin landscape and its regulation71,72,74,75. The possibility of mapping transcription factor binding profiles at single-cell or low-cell number resolution in the early embryo will undoubtedly yield many new insights into preimplantation development.
Профили транскрипции и геномное картирование гистоновых PTMs также могут быть использованы для открытия новых потенциальных регуляторов транскрипции. Анализ мотивов стадио-специфичных цис-регуляторных регионов, таких как промоторы и энхансеры, позволяет идентифицировать связывающие белки71-73,83. Анализ промоторов генов на ст. дробления привел к идентификации double homeobox 4 как потенциального регулятора активации зиготического генома83, а анализ промоторов на ст. двух-клеточных эмбрионов с использованием DHS картирования выявил сайт связывания cубъединицы α ядерного транскрипционного фактора Y с наиболее частым мотивом в DHS регионах73. Сходным образом, анализ сайтов histone H3 Lys27 ацетилирования выявил связывающие мотивы стадио-специфичных транскрипционных факторов, которые могут регулировать транскрипцию на этих ст. развития71.
Атестация и беспристрастная идентификация in vivo регуляторов MZT является сложной благодаря эффектам материнского вклада. Манипуляции с зиготами, такие целенаправленный скрининг RNAi214, неспособны модифицировать уровни высоко экспрессирующихся материнских белков. Разработка in vitro систем культивирования созревающих ооцитов215-219 и превращения эмбриональных стволовых клеток embryonic stem cell (ESC)-to-oocyte conversion protocols220 has enabled the depletion of such maternal-effect genes before their accumulation in mature oocytes and the performance of screens for oocyte maturation and meiosis factors221. When coupled with in vitro fertilization, candidate regulators of early development can be tested on a case-by-case basis. The development of other stem cell culture conditions that mimic preimplantation embryos222, along with two-cell-like ESCs84,223-225 (Box 2), may provide exciting new avenues for studying the MZT. Excitingly, CRISPR-Cas9-mediated gene deletions have now been performed in human embryos226, which opens up opportunities for mechanistic studies of the similarities and differences in the MZT across Mammalia. |
Chromatin remodelling
ДНК обернута вокруг октамерного стержня из гистоновых белков, которые составляют нуклеосому. Гистоны в нуклеосомах активно модифицируются после трансляции. Комбинация таких гистоновых PTMs с эффектами плотности и позиционирования нуклеосом влияет на активность транскрипции (rev. refs68-,70). Гистоновые PTMs, локальная динамика хроматина и организация генома высшего порядка играют большую роль во время MZT.
Global dynamics of histone post-translational modifications
Хотя гистоновые PTMs были изучены у эмбрионов с использованием микроскопической техники, недавние разработки техники low-input chromatin immunoprecipitation (ChIP-seq), сопровождаемой секвенированием, позволили эти модификации картировать по всему геному (Box 1). Так, триметилирование гистона H3 Lys4 (H3K4me3), которое ассоциировано с транскрипционной активностью, триметилирование гистона H3 Lys27 (H3K27me3), которое ассоцирует с неактивных хроматином и ацетилирование гистона H3 Lys27 (H3K27ac), которое ассоциирует с открытым хроматином, были профилированы у пре-имплантационных эмбрионов71-76 (Fig. 2; Supplementary Table S1).
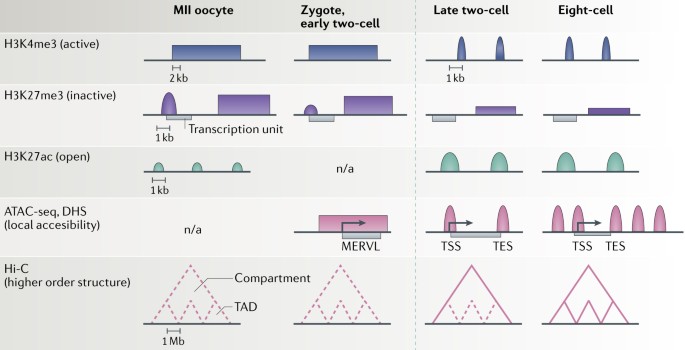 Fig. 2: Dynamics of chromatin landscapes during preimplantation development.
Fig. 2: Dynamics of chromatin landscapes during preimplantation development.
The histone post-translational modifications that have been profiled in mouse preimplantation embryos include trimethylation of histone H3 Lys4 (H3K4me3; associated with transcription activity), trimethylation of histone H3 Lys27 (H3K27me3; associated with inactive chromatin) and acetylation of histone H3 Lys27 (H3K27ac; associated with open chromatin). Broad, nonoverlapping domains of H3K4me3 (blue) and H3K27me3 (purple) are present in metaphase II (MII) oocytes, zygotes and early two-cell embryos but not in later stages after the major wave of zygotic genome activation (ZGA; dashed, green vertical line). Following major ZGA, embryos instead exhibit 'canonical' peaks at H3K4me3 domains, reminiscent of what is typically seen in pluripotent or differentiated cells. There is a gradual increase in H3K27ac (green) during preimplantation development, which correlates with the activation of transcription programmes. The local chromatin structure (pink), as measured by assay for transposase accessible chromatin-sequencing (ATAC-seq) and/or by DNaseI hypersensitivity (DHS) mapping, presents large domains of accessible chromatin covering MERVL (mouse endogenous retrovirus with leucine tRNA primer) repeats before the major wave of ZGA, and DNaseI hypersensitive sites in zygotes are mostly located at transcription start sites (TSS). Following ZGA at the late two-cell stage, an increase is found in the number of accessible regions, and peaks of accessible chromatin are present both at TSS and at transcription end sites (TES). Higher-order genome organization, measured by Hi-C-based approaches, shows that compartments and topologically associating domains (TADs) are disordered in MII oocytes and from fertilization until the early two-cell stage. Following ZGA, first the compartments and then TADs are re-established. Pink dashed lines represent disordered or unstructured features; solid pink lines represent established features. n/a, data not available. Вообще-то наиболее неожиданным открытием анализа histone ChIP-seq стал уникальный и неожиданный паттерн крупных доменов из H3K4me3 в зрелых ооцитах (Fig. 2) скорее, чем острые пики обычно наблюдаемые в местах старта транскрипции в соматических клетках. Приблизительно 22% генома метафазных II (MII) ооцитов, как было установлено, покрывается широкими блоками H3K4me3, простирающимися более, чем 10 kb (refs71,74,75,77). Становление этих доменов происходит постепенно во время оогенеза и коррелирует обратным образом с широкими доменами метилирования ДНК71,75,77. Делеция DNMT3A и DNMT3B показывает, что метилирование ДНК защищает регионы от приобретения H3K4me3 (ref.77). В целом, широкие домены H3K4me3 не ассоциированы с промоторами генов71; однако, обратное не обязательно верно, поскольку многие промоторы, включая те, что активируются большой волной ZGA, но не те, что модифицированы с помощью метилирования ДНК, оказываются предварительно модифицированными с помощью H3K4me3 как в ооцитах, так и спермиях71. Промотор H3K4me3 обычно коррелирует с транскрипцией гена, начиная со ст. двух-клеточного эмбриона75, хотя направление причинной связи между ремоделированием хроматина и ZGA остается неясным. Это указывает на то, что H3K4me3 специфицирует готовые к действию (permissive) промоторы или недавно транскрибированных генов или генов, готовых для будущей активации75. У пре-имплантационных эмбрионов встречаются нечасто H3K27me3 в большинстве эмбриональных стволовых клеток (ESC)-представляемых каноническими генами мишенями Polycomb repressive complex 2 (PRC2), включая кластеры генов Hox76. Помимо ооцитов спермии также могут передавать важную эпигенетическую информацию эмбриону (rev. ref.78); однако, необходимы дополнительные эксперименты для выявления этой роли спермиями унаследованных состояний хроматина в ZGA.
После оплодотворения широкие домены H3K4me3 поддерживаются в зиготах и ранних двух-клеточных эмбрионах, но позднее они в основном истощаются 71,74,75 (Fig. 2). Это согласуется с глобальным снижением уровней H3K4me3 у двух-клеточных эмбрионов, как это было установлено ранее с помощью иммуно-флуоресцентного окрашивания (rev. ref.79). Одновременно с этим снижением у двух-клеточных эмбрионов повышаются уровни H3K27ac 71 (Fig. 2), особенно в ZGA генах, перед этим маркированных широкими доменами H3K4me3. Репрессивная метка H3K27me3 появляется также в виде широких доменов в MII ооцитах и у двух-клеточных эмбрионов (Fig. 2),также как и во внутренней клеточной массе (ICM) E3.5 бластоцистах 76, хотя они и не перекрываются с доменами H3K4me3 или доменами метилирования ДНК в ооцитах. В дополнение к этим крупным доменам промоторы маркированы также пиками H3K27me3 в ооцитах, которые в основном исчезают перед большой ZGA 76 (Fig. 2). Взаимодействие между этими разными эпигенетическими метками в основном неизвестны у млекопитающих, хотя можно извлечь урок из др. видов: у Drosophila melanogaster, ооцитами наследуемые домены H3K27me3 необходимы, чтобы предупредить аберрантное накопление H3K27ac во время ZGA 80. Более того, у Danio rerio, недавно было установлено, что 'placeholder' нуклеосомы, содержащие вариант гистона H2A H2AFV (ортолог у рыбок данио H2A.Z) и моно-метилированный гистон H3 Lys4 (H3K4me1) предупреждают доступ к метилированию ДНК, делая тем самым невозможной транскрипцию вследствие ZGA 81. Необходимо установить, существуют ли подобные механизмы у эмбрионов млекопитающих.
Local chromatin dynamics
Ландшафт локального хроматина подвергается значительной реорганизации во время MZT. Недавно проведено профилирование всего генома путем картирования DNaseI hypersensitivity (DHS)73,82 и с помощью assay for transposase accessible chromatin-sequencing (ATAC-seq)72 пре-имплантационных эмбрионов, которые определяли доступность хроматина (Box 1; Supplementary Table S1). Как и в др. типах клеток, в зиготах, сайты DHS были в основном расположены в промоторах73,82 (Fig. 2). Ранние двух-клеточные эмбрионы перед большой ZGA, слабый и с шумами ATAC-seq профиль, с крупными доменами доступного хроматина, покрывающими гены минорной ZGA, такие как mouse endogenous retrovirus with leucine tRNA primer (MERVL) гены72(Fig. 2). Это коррелирует с разнородностью транскрипционного профиля на этой стадии и вообще отражает менее структуированный ландшафт хроматина перед ZGA. На поздней стадии двух-клеточных эмбрионов пики доступного хроматина присутствуют только на сайтах инициации транскрипции (TSS) , но что интересно, также на сайтах окончания транскрипции transcription end sites (TES)72 (Fig. 2). Этот уникальный признак двух-клеточных эмбрионов исчезает на более поздних эмбриональных стадиях, его биологическое значение остается неясным72. Признаки ландшафта хроматина отражаются на редкой субпопуляции two-cell-like (2C-like) мышиных ESCs, которые обнаруживают общее увеличение глобальной доступности хроматина, включая элементы MERVL 83,84 (Box 2).
По мере развития эмбриона хроматин становится всё более доступным (Fig. 2). Свыше 96% сайтов DHS сохраняются со стадии одной клетки в течение всего пред-имплантационного периода73, тогда как крупное увеличение избытка DHS возникает на ст. 8 клеток и на ст. морулы73. Новые сайты возникают не только на промоторах, но и также на др. регионах, включая экзоны, интроны и межгенные регионы73. Как и ожидалось, гены с сайтами DHS на своих промоторах экспрессируют более высокие уровни по сравнению с теми, которые их не содержат73, а гены внутри или вблизи регионов открытого хроматина часто функционально важны для исследуемой ст. развития72,73. В то время как большинство генов с доступными промоторами экспрессируются, неактивные гены с доступными промоторами становятся активными на более поздних стадиях развития, подтверждая. что эти промоторы готовы (primed) к активации73.
Не все гены отмечены повышенной доступностью хроматина и гистоновыми модификациями. У двух-клеточных эмбрионов многие повторы, включая короткие вкрапленные ядерные элементы и элементы MERVL, имеют ATAC-seq пики72, которые сходным образом маркированы H3K4me3 (ref.75), отражая тем самым их высокие уровни экспрессии на этой стадии.
|
Box 2
2C or not 2C? Modelling zygotic genome activation in embryonic stem cell cultures
Among the extensive cellular heterogeneity of serum-grown mouse embryonic stem cells (ESCs) are a rare subset of cells with characteristics of early two-cell embryos84,223-227. Mouse ESCs cycle through this two-cell-like (2C-like) state, which is characterized by the absence of the pluripotency transcription factor POU domain, class 5, transcription factor 1 (POU5F1; also known as OCT4)84,223,225,228. Remarkably, in these 2C-like cells, in addition to activation of the normally two-cell stage-restricted zinc-finger and SCAN domain containing 4 (ZScan4) gene cluster and mouse endogenous retrovirus with leucine tRNA primer (MERVL), the MERVL MT2_Mm promoter drives downstream transcription of several hundred genes of mostly uncharacterized function, which are organized into tight genomic clusters84,174,228, potentially reflecting a mechanism by which robust and coordinated activation of these genes occurs in vivo.
2C-like mouse ESCs undergo global DNA demethylation84,229 to levels observed in the two-cell embryo230, although this occurs through loss of DNA (cytosine-5)-methyltransferase protein 1 (DNMT1)84,229, in contrast to the two-cell embryo, where DNMT1 is expressed but excluded from the nucleus231. Similar to the two-cell embryo, the chromatin of 2C-like cells is globally decondensed83,84,225, with increased histone acetylation223,225 and higher chromatin mobility225,232. Consistently, increasing chromatin accessibility by knocking down chromatin assembly factor 1 (ref.225) or repressive chromatin complexes, such as KRAB-associated protein 1, lysine demethylase 1a, euchromatic histone-lysine N-methyltransferase 2, heterochromatin protein 1 or ring1 and YY1-binding protein174,233-235, results in expansion of the 2C-like population (reviewed in refs236,237). It remains to be determined how many of these perturbations directly activate the 2C-like transcriptional programme. For example, the microRNA miR-34a represses the transcription factor GATA binding protein 2 (GATA2), which directly binds MERVL long terminal repeats (MERVL LTRs) and is necessary but not sufficient for MERVL induction; miR-34a deficiency increases the expression of MERVL and of MERVL LTR-promoted transcripts, partially by alleviating GATA2 repression228.
In contrast to the large number of negative regulators, very few positive regulators of the 2C-like state have been identified. Most notably, the transcription factor double homeobox (DUX) has recently been identified not only as a regulator of 2C-like mouse ESCs but also as a regulator of cleavage-stage genes both in mouse and human embryos83,136,186. Dux becomes expressed during the minor wave of zygotic genome activation (ZGA) and is not maternally-inherited, which suggests it acts to enhance transcriptional changes rather than initiate them per se. What activates Dux expression and the rest of the zygotic transcriptional network, either in two-cell embryos, 2C-like cells or both, remains an exciting area of active research.
Although there are many similarities between 2C-like mouse ESCs and the two-cell embryo, the two cell types are by no means the same. There are hundreds of genes expressed in the two-cell embryo that are not expressed in 2C-like cells. Furthermore, whereas mouse ESCs cycle in and out of a 2C-like state, the developmental trajectory of the two-cell embryo is linear and transient. What is clear, however, is that these cells represent a useful in vitro experimental system for interrogating certain aspects of ZGA, which are infeasible to study in vivo. |
Higher-order genome organization
Геном в дальнейшем организуется в структуры высшего порядка. Регионы в среднем в длину в 400-500 kb формируют ~2000 дискретных topologically associating domains (TADs). Дально-действующие взаимодействия хроматина обнаруживают тенденцию более часто оказываться в TADs, чем вне границ TAD. TADs далее организуются в регионы ~5 Mb, наз. A и B компартментами, которые чередуются вдоль хромосомы и соответствуют транскрипционно активным и транскрипционно неактивным регионам, соотв. Подобно TADs, хроматин преимущественно взаимодействует с др. хроматином того же самого компартментного типа. Однако, в отличие от TADs, которые в основном постоянно встречаются в разного типа клетках, A и B компартменты относительно более динамичны между тканями (rev. refs85,86). В дополнение к TADs и компартментам, положение хроматина внутри трехмерного пространства ядра также важно (rev. refs87,88). В частности, 40 kb-15 Mb домены хроматина преимущественно взаимодействуют с ядерной ламиной, которая обычно является репрессивным окружение, которое стремится перекрываться с B компартментами (rev. ref.89). Однако, эти ассоциированные с ламиной домены пока не были описаны у предимплантационных эмбрионов.
Во время созревания ооцита осуществляются переходы хроматина от транскрипционно активного к транскрипционно неактивному состоянию. Это сопряжено с существенными перестройками и конденсацией хроматина от морфологии не окруженного ядрышка к окруженному ядрышку в зародышевом пузырьке ооцита (rev. ref.90). На молекулярном уровне, одиночных ядер Hi-C анализ (Box 1) этих двух стадий подтвердил снижение прочности TADs и компартментов во время созревания ооцита91. Более того, отсутствует связь между широкими H3K4me3 доменами и статусом компартментов92. Подобно митотическим хромосомам, TADs и компартменты отсутствуют в MII ооцитах92,93 (Fig. 2). Напротив, спермии имеют более структуированную организацию хроматина, подобной той, что в мышиных ESCs94, и высокую частоту чрезвычайно длинного ранга и меж-хромосомных взаимодействий92.
После оплодотворения геном подвергается фундаментальной реорганизации. Зиготы и ранние двух-клеточные эмбрионы обнаруживают слабые TAD структуры и компартменты (Fig. 2) и редкие удаленные взаимодействия 91,93. Сходным образом, эмбрионы D. melanogaster также имеют чрезвычайно неупорядоченную организацию хроматина перед ZGA 95, подтверждая, что это эволюционно законесервированная потребность для регуляции ZGA и правильного развития. После ZGA у мышей обнаруживается прогрессивное созревание TADs и укрепление границ TAD, которое четко выявляется со стадии 8 клеток 93 (Fig. 2). Хотя менее определяемые на более ранних стадиях компартменты A и B присутствуют со ст. поздних двух-клеточных эмбрионов и до формирования ICM 93 (Fig. 2). По мере развития и программы генной экспрессии становятся активными, происходит сдвиг генов из молчащего B компартмента в активный A компартмент 92.
Parental differences in chromatin organization
При фертилизации два родительских генома структурно и физически отличаются. Материнский геном физически длиннее чем компактный отцовский геном, который нагружен протаминами. У мышиных зигот 'крепость компартментов' в материнском геноме значительно слабее, чем в отцовском геноме91-93, отражая соотв. организацию, которая обнаруживается у зрелых гамет. Несмотря на эти морфологические различия и сохраняющиеся различия в ландшафте метилирования ДНК, с помощью PN3, структура локального хроматина материнского и отцовского геномов, как было установлено, с помощью DHS картирования, в основном неразличимы73. Однако, аллель-специфческие отличия появляются в генах, предназначенных для специфичной для родителей ZGA82. Интересно, что скорее чем метилирование ДНК, которые канонически маркирует импринтируемые гены (rev. ref.96), некоторые отцовские DHS-маркированные гены имеют H3K27me3 на материнском аллеле, удаление которых достаточно, чтобы реактивировать материнский молчащий аллель82. В целом , начиная с двух-клеточной стадии до образования морулы, материнский и отцовский геномы остаются одинаковыми в терминах профилей DHS, за исключением импринтируемых генов, которые маркированы с помощью отличающейся доступности хроматина, прежде чем начать экспрессироваться73.
Напротив, гистоны PTMs обнаруживают более динамичные специфичные для родителей изменения после оплодотворения. Материнский и отцовский геномы у зигот имеют разные профили H3K27me3, которые не зависят от особенностей занимаемых нуклеосом76. Большинство пиков H3K27me3 в спермиях теряется вследствие оплодотворения и затем они восстанавливаются в генах, которые остаются молчащими в течение всего пре-имплантационного и пост-имплантационого развития76. Напротив, промотор-дистальные пики H3K27me3 в ооцитах наследуются зиготами, тогда как с промотором ассоциированные H3K27me3 в онтогенетических генах не наследуются76. Более того, отцовский, но не материнский геном постепенно лишается H3K4me3 в зиготах75,97, это отражает замещение по всему геному протаминов на гистоны. Физиологическая важность этих различий не установлена.
Поразительно, пространственное разделение родительских геномов, наблюдаемое у ранних зигот, всё ещё обнаруживается на ст. 8 клеток, несмотря на то, что оба генома физически находятся в одном и том же ядре 93. Соотв., эксперименты с иммуно-флуоресценцией с использованием 5-bromo-2?-deoxyuridine (BrdU)-меченных спермиев, чтобы отличать ДНК отцовского и материнского геномов, четко показали, что пространственное разделение родительских геномов до ст. 8 клеток 98. Как эмбрион поддерживает такое физическое разделение, и каково его значение, остаются неизвестным.
Regulators of the MZT
Обширное ремоделирование хроматина и изменения транскрипции, возникающие во время делений дробления, нуждаются в тонкой регуляции, чтобы обеспечить соотв. эмбриональное развитие. Ряд MEGs описан у мышей (rev. in refs42,99). Сюда входят SCMC ффакторы 57,100-106, протеаз 107, структурные молекулы 108,109, энзимы, связанные с убиквитинированием 41,110,-114, аппарат (de)methylation ДНК 37,38,40,41,58,65, белки репарации повреждений ДНК 115,116, регуляторы клеточного цикла 117, белки, связанные с аутофагией 118 и факторы, участвующие в пост-транскрипционной деградации РНК 119-121, и прочии 116,122-126. Важно, что огромное большинство являются транскрипционными факторами 73,127-145, факторами, ремоделирующими хроматин, 71,75,134,146-160 и не-кодирующими РНК 145,161-164. Некоторые из них непосредственно участвуют в MZT посредством деградации материнских транскриптов и/или ZGA (Table 1).
Table 1
Factors with roles in mouse maternal-to-zygotic transition loosely grouped by function
Chromatin remodellers
Одним из первых идентифицированных хроматиновых факторов MEG, активирующих зиготическую транскрипцию у двух=клеточных эмбрионов, стал BRG1 (известен также как SMARCA4) 146, который является каталитической субъединицей хроматин-ремоделирующего комплекса SWItch-Sucrose Non-Fermentable (SWI/SNF). Специфичная для ооцитов делеция BRG1 не нарушает развития зародышевой линии и оплодотворение, но нарушает ZGA и вызывает остановку развития на двух-клеточной стадии 146. С BRG1-взаимодействующий белок, bromodomain and WD repeat-containing domain protein 1 (BRWD1), также действует во время MZT 160, хотя его мутации вызывают дефекты гаметогенеза и раннюю остановку зигот на ст. пронуклеусов. Эти первоначальные исследования продемонстрировали важность ремоделирования хроматина для эффективного перепрограммирования тотипотентности после оплодотворения, в дальнейшем было подтверждено, что происходят взаимодействия с др. хроматин-ремоделирующими комплексами, включая PRC2 каталитическую субъединицу histone-lysine N-methyltransferase EZH2 (ref.159), PRC1 компоненты E3 ubiquitin-protein ligase RING1 и E3 ubiquitin-protein ligase RING2 (ref.147), ооцит-специфический ядерный белок nucleoplasmin 2 (refs157,158), репрессор транскрипции CTCF130 и не охарактеризованный фактор ZAR1-like белок 148, приводящие к дефектам раннего эмбриогенеза.
Histone methyltransferases
Сравнительно недавно выявлено участие ряда гистон-модифицирующих энзимов в MZT. В ооцитах, histone-lysine N-methyltransferase 2B (KMT2B) является главной lysine methyltransferase, ответственной за становление широких доменов H3K4me3 и необходима для эффективной ZGA 71,77,149 (Fig. 3a). Роль KMT2C и KMT2D в ZGA была продемонстрирована посредством скрининга мутантов гистона lysine-to-methionine (K-M), они необходимы для раннего эмбрионального развития 150. Избыточная экспрессия H3.3 K4M мутации в MII ооцитах приводит к снижению жизнеспособности эмбрионов до ст. бластоциста, скорее всего, это обусловлено снижением транскрипции на ст. PN4-PN5 зиготы. Соотв., эмбрионы, возникающие в результате нокдауна KMT2C и KMT2D в ооцитах, фенокопируют избыточную экспрессию H3.3 K4M мутантов, демонстрируя снижение уровней H3K4me1 и H3K27ac, а также снижение транскрипции в отцовском пронуклеусе 150. Итак, эти находки подтверждают роль этих methyltransferases в минорной волне ZGA (Fig. 3a). Др.H3K4 methyltransferase млекопитающих, histone-lysine N-methyltransferase SETD1B, регулирует оогенез и раннее эпигенетической репрограммирование у эмбрионов, хотя на более ранних стадиях по сравнению с KMT2C и KMT2D 151 (Fig. 3a). Истощение материнских хранилищ SETD1B приводит к бесплодию самок, благодаря нарушению регуляции транскрипции в ооцитах, это, в свою очередь, приводит к неисправностям зоны pellucida и нарушениям хода мейоза. Соотв., возникающие в результате эмбрионы прекращают , однако, развитие не стадии зиготы и обнаруживают полиспермию 151.
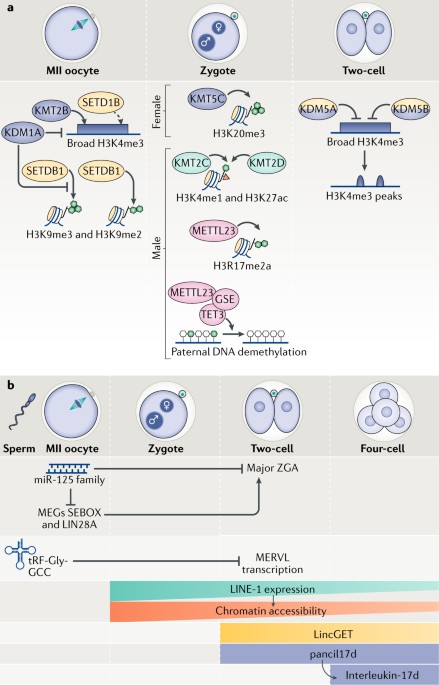 Fig. 3: Regulation of the maternal-to-zygotic transition by histone-modifying enzymes and non-coding RNAs.
Fig. 3: Regulation of the maternal-to-zygotic transition by histone-modifying enzymes and non-coding RNAs.
a | Histone-lysine N-methyltransferase 2B (KMT2B) establishes the broad histone H3 Lys4 trimethylation (H3K4me3) domains in metaphase II (MII) oocytes, which are subsequently removed by the lysine-specific demethylase 5A (KDM5A; also known as JARID1A) and KDM5B (also known as JARID1B) in two-cell embryos, leading to the formation of the canonical peaks of H3K4me3 distribution. SET domain containing 1B (SETD1B) also catalyses H3K4me3 in MII oocytes, but there is no experimental evidence that it establishes the broad H3K4me3 domains (dashed arrow). The methyltransferase SETDB1 catalyses the dimethylation and trimethylation of histone H3 Lys9 (H3K9me2 and H3K9me3, respectively) in MII oocytes. H3K9me3 is removed by the H3K4me3-specific and H3K9me3-specific demethylase KDM1A (also known as LSD1). In zygotes, KMT5C catalyses the trimethylation of histone H3 Lys20 (H3K20me3) at the maternal pronucleus; in the paternal pronucleus, KMT2C and KMT2D catalyse the monomethylation of H3K4 (H3K4me1) and support acetylation of histone H3 Lys27 (H3K27ac) enrichment. Methyltransferase-like 23 (METTL23) catalyses the asymmetric dimethylation of histone H3 Arg17 (H3R17me2a) and has a role in active DNA demethylation of the paternal pronucleus by recruiting the gonad-specific expression gene-ten-eleven translocation 3 (GSE-TET3) complex. Colours represent the role of the enzyme: yellow represents transcription during oocyte development; green represents minor zygotic genome activation (ZGA); blue represents major ZGA; and pink represents DNA (de)methylation proteins. b | Members of the microRNA miR-125 family are expressed in MII oocytes and suppress the expression of maternal-effect genes (MEGs), including SEBOX and protein lin-28 homologue A (LIN28A), and consequently suppress transcription during major ZGA. The 5? fragments of tRNA-Gly-GCC (tRF-Gly-GCC) are inherited by the zygote from the sperm under certain dietary conditions and negatively regulate the expression of murine endogenous retrovirus with leucine tRNA primer (MERVL) in two-cell embryos. Long interspersed nuclear element-1 (LINE-1) repeats are expressed from the zygote up to four-cell embryos and regulate chromatin accessibility. The long intergenic non-coding RNA LincGET is expressed in two-cell and four-cell embryos, similarly to promoter-associated non-coding RNA with interleukin-17d (pancIl17d), which promotes the expression of interleukin-17d from the four-cell stage.
Конституитивный гетерохроматин маркирован H3K20me3, который катализируется с помощью KMT5C (известен также как SUV420H2), среди прочих энзимов, он появляется только после оплодотворения в материнском пронуклеусе и не обнаруживается на поздних ст. перед имплантациeй165,166 (Fig. 3a). Избыточная экспрессия KMT5C в зиготах, вызывает повышение накопления H3K20me3 в материнском пронуклеусе, приводя к снижению транскрипционной активности при ZGA, а также к неправильной регуляции S фазы и к аресту развития на одноклеточной или двух-клеточной ст. 156. Выведение из строя (Knocking out) methyltransferase SETDB1, которая катализирует закладку H3K9me2 и H3K9me3 (Fig. 3a), приводит к нарушениям хода мейоза, вызываемым повреждениями ДНК и де-репрессией ретротранспозонов, к аресту в M фазе и дегенерации эмбрионов перед стадией морулы134. Эти исследования подтвердили, что жесткая регуляция ремоделирования хроматина связана с правильным временем наступления ZGA, затрагивает ход клеточных циклов и митотические деления в раннем эмбриогенезе дробления.
Гистоновые methyltransferases являются также критическими по время смены протаминов на гистоны, которая просходит в отцовском пронуклеусе вскоре после оплодотворения. Methyltransferase-like 23 (METTL23), которая катализирует асимметричное деметилирование гистона H3 Arg17 (H3R17me2a), играет роль в активном деметилировании ДНК отцовского пронуклеуса аутем рекрутирования GSE-TET3 комплекса 167 (Fig. 3a). Более того, вместе с гистоном шаперон HIRA, METTL23-катализируемый H3R17me2a, как было установлено, обязательны для инкорпорации H3.3 в мужской пронуклеус 167-170, это является критическим для реорганизации хроматина после оплодотворения 171,172.
Histone demethylases
На двух-клеточной стадии, lysine-specific demethylase 5A (KDM5A; известна также как JARID1A) и KDM5B (известна также как JARID1B) удаляют широкие домены H3K4me371,74,75 (Fig. 3a). Избыточная экспрессия KDM5B, но не KDM5A, снижает уровни H3K4me3 и реактивирует транскрипцию в окружении ядрышка ооцита75, тогда как morpholino-вызываемый нокдаун KDM5A и KDM5B белков у зигот снижает ZGA на двух-клеточной стадии и нарушает пред-имплантаионное развитие71. Эти эксперименты подтверждают, что эти деметилазы важны как для транскрипции, так и ZGA ооцита (Fig. 3a). Сходным образом, при истощение материнских хранилищ H3K4me3 и H3K9me3 деметилаза KDM1A (известна также как LSD1) приводит к аресту развития на одноклеточной или двух-клеточной стадии 152,153. Как и ожидалось двух-клеточные эмбрионы, происходящие от таких материнских мутантов обнаруживают повышенные уровни H3K4me3 и H3K9me3, и они не только неспособны активировать ZGA транскрипцию, но и они также содержат выcокий уровень материнских транскриптов 152,153.
Регуляция репрессивных гистонов PTMs также является критической для MZT. Специфические для H3K27me2 и H3K27me3 деметилазы KDM6A и KDM6B (известны также как UTX и JMJD3, соотв.) обладают комплементарными функциями у пре-имплантационных эмбрионов155. В то время как нокдаун KDM6B у MII ооцитов улучшает скорость развития партеногенетических эмбрионов, способствуя экспрессии POU domain, class 5, transcription factor 1 (POU5F1; известен также как OCT4) в бластоцисте, то нокдаун KDM6A ставит под угрозу развитие на ст. бластоциста. Материнский нокдаун обеих деметилаз серьезно нарушает пре-имплантационное развитие155, подтверждая, что тонкая регуляция их экспрессии существенна для нормального развития. KDM6B также ранее была описана как негативный регулятор репрограммирования173; однако, точный механизм обусловленного с помощью KDM6A и KDM6B деметилирования H3K27me3 и H3K27me2 остается неизвестным.
Др. lysine деметилаза, которая функционирует во время раннего развития - это KDM4A (известна также как JMJD2A); генетическое устранение KDM4A приводит к бесплодию самок из-за задержки пре-имплантационного развития и в конечном счете из-за неспособности к имплантации 154. Эксперименты по трансплантации эмбрионов вместе с тестами крови и анализом экспрессии генов подтвердили, что Kdm4a-/- самки неспособны поддерживать беременность из-за гормональных дефектов и неправильной регуляции транскрипции в матке 154.
Non-coding RNA and repetitive elements
Ремоделирование хроматина и изменения в транскрипции, которые возникают во время MZT управляют не только белок-кодирующими генами, но и также не-кодирующими РНК (Fig. 3b). В частности, sncRNAs, lncRNAs и повторяющиеся элементы участвуют в регуляции MZT. Двух=клеточные эмбрионы имеют высокие уровни зиготических microRNAs (miRNAs), включая кластер miR-290, чем-то напоминая плюрипотентные ESCs мышей (rev. ref.30). Семейство miR-125 негативно регулирует большую ZGA путем супрессии экспрессии MEGs SEBOX140,141 и белка lin-28 homologue A (LIN28A)145 (Fig. 3b); инъекции имитаторов (mimics) членов семейства miR-125 в зародышевом пузырьке ооцита вызывают арест на двух-клеточной стадии, тогда как инъекции членов семейства ингибиторов miR-125 усиливают ZGA. sncRNAs может также иметь отцовское происхождение: напр., при определенных условиях питания, 5' фрагменты tRNA-Gly-GCC спермиев мышей наследуются эмбрионами после оплодотворения и репрессируют элементы MERVL во время большой волны ZGA у двух-клеточных эмбрионов161(Fig. 3b).
Пре-имплантационные эмбрионы обнаруживают также динамичную стадио-специфическую экспрессию эндогенных ретровирусов или повторов. У мышей экспрессия крупной фракции транскриптов большой волны ZGA фактически управляется с помощью MERVL long terminal repeats (LTRs)174. Этот совместный вариант LTRs в качестве промоторов может отражать широкую распространенность механизма для вовлечения и/или регуляции программ экспрессии ранних эмбриональных генов175. Кроме того, паттерны их уникальной экспрессии в пре-имплантационном развитии, повторяющиеся элементы, такие как long interspersed nuclear element-1 (LINE-1) также могут регулировать MZT164 (Fig. 3b). Устойчивая экспрессия LINE-1 элементов после двух-клеточной стадии, также как и их репрессия непосредственно после оплодотворения, нарушают развитие бластоциста164,176, подтверждая, что это узкое окно экспрессии этих ретротранспозонов во время раннего эмбриогенеза является критическим для развития. Более того, продолжительная активация LINE-1 элементов приводит к увеличению чувствительности к DNaseI, тогда как преждевременное молчание редуцирует чувствительность к DNaseI164, демонстрируя, что экспрессия LINE-1 модулирует доступность хроматин (Fig. 3b). Интересно, что инъекции транскриптов LINE-1 в двух-клеточные эмбрионы не оказывает эффекта на развитие бластоциста, подтверждая, что подтверждая, что она действует на саму транскрипцию LINE-1 скорее, чем продукты транскрипции, которые регулируют ремоделирование хроматина164.
Как часть этого комплекса эпигенетической регуляции, lncRNAs влияют на экспрессию генов путем контроля ремоделирования хроматина в разнообразных клеточных процессах (rev. refs177-179).Экспрессия lncRNAs обнаружена в спермиях 180 и у пре-имплантационных эмбрионов 163,181-184,а некоторые lncRNAs, как было установлено, обладают регуляторной ролью. Истощение длинной межгенной не кодирующей РНК LincGET, которая экспрессируется у двух-клеточных и четырех-клеточных эмбрионов (Fig. 3b), нарушает развитие, начиная с двух-клеточной стадии, скорее всего, в результате гарушений двух независимых процессов: сплайсинга РНК и передачи сигналов MAPK 162. Сходным образом, нокдаун ассоциированной с промотором не кодирующей РНК с interleukin-17d (pancIl17d), которая является lncRNA, высоко экспрессирующейся во время ZGA, и способствует экспрессии interleukin-17d у четырех-клеточных эмбрионов (Fig. 3b), снижает скорость развития на ст. бластоциста посредством обеспечивающих апоптоз механизмов 163. Возможно существуют и др. не кодирующие РНК, экспрессирующиеся у ранних эмбрионов и непосредственно влияющие на ZGA, деградацию материнских транскриптов и/или ремоделирование хроматина.
Transcription factors
Ряд транскрипционных факторов был идентифицирован, которые соединяются с промоторам генов ZGA и активируют их у двух=клеточных эмбрионов. Первым был идентифицирован transcription intermediary factor 1-α (TIF1α)129. TIF1α транслоцируется из цитоплазмы в ядро у зигот на средней-поздней стадиях, когда он располагается вместе с др. ремодельерами, таким как BRG1 и каталитическая субъединица imitation switch(ISWI) комплекса SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily A member 5 (SMARCA5). Инактивация TIF1α приводит к аберрантной локализации RNA polymerase II у зигот и к аресту эмбрионов на двух-клеточной и четырех-клеточной стадии129.
STELLA является продуктом др. хорошо известного гена MEG143,144, который регулирует ремоделирование хроматина и ZGA у двух-клеточных эмбрионов132,133. Образование хромоцентра нарушено у эмбрионов после нокаута STELLA , скорее всего, из-за неспособности обеспечивать инкорпорацию H3.3 и обратную транскрипцию главных сателлитов, которые необходимы для реорганизации хроматина после оплодотворения 132,171,172. Анализ секвенирования РНК одиночных клеток и одиночных эмбрионов подтвердил, что эти фенотипы, скорее всего, связаны с неспособностью транскрипции ZGA генов, включая элементы MERVL, и с подавлением материнских транскриптов у двух-клеточных эмбрионов133. Очевидно, что ооциты самок мышей на диете с высоким содержанием жира, обнаруживают снижение уровней STELLA, приводя тем самым е незащищенности материнского генома от активного деметилирования у получаемых зигот, это приводит к задержке развития, начиная с ранней двух-клеточной стадии185.
Путем motif-enrichment анализа DHS карт (Box 1), nuclear transcription factor Y subunit-α (NFYA) был предположен, а зтем и подтвержден его частичный вклад в ZGA73. Его нокдаун зародышевого пузырька ооцита приводит к снижению на ~15% ZGA генов у двух-клеточных эмбрионов, снижению доступности хроматина и аресту развития на ст. морулы73. Сравнительно недавно, ко-активатор транскрипции YAP1 был идентифицирован как критический регулятор MZT135. YAP1 накапливается в ооцитах и после оплодотворения вносит вклад в деградацию до ~80% материнских транскриптов и в активацию ~700 ZGA генов. Когда материнские хранилища YAP1 были истощены, то переход от двух-клеточной к четырех-клеточной стадии был удлинен и скорость пре=имплантационного развития снижена у получающихся эмбрионов135.
The multicopy double homeobox (DUX) (известен также как DUX4 у человека) экспрессируется в начале зиготической транскрипции 83,136 и играет роль в ZGA 83,136,186. Анализ мотивов показал обогащение DUX4 мотивами TSS генов, специфичных для ст. дробления, а в ESCs мышей, DUX активирует ретро-транспозоны и специфически соединяется почти с 50% MERVL элементов 83. Dux является мощным индуктором редкой 2C-like субпопуляции ESCs у мышей 83,136,186 (Box 2), а CRISPR-Cas9-обусловленный нокаут Dux в зиготах мышей приводит не только к аресту пре0имплантационного развития, но и также к неспособности активации ZGA-специфичных мишеней, включая MERVL элементы 136. Однако, хотя роль DUX в регуляции, по крайней мере, частично главной волны ZGA ясна, но что регулирует самого DUX остается неизвестным.
ZGA models and future perspectives
Остается неясной иерархическая динамика событий MZT. Тесная временная связь между реорганизацией хроматина и малой и большой волнами ZGA у ранних эмбрионов действительно провоцирует деконденсацию хроматина, необходимую для активации зиготической транскрипции, или действие самой транскрипции открывает структуру хроматина? Несмотря на подавление транскрипции с помощью α-amanitin в зиготах или у двух-клеточных эмбрионов, ремоделирование H3K27me3 всё ещё происходит в материнском и отцовском геноме76, и TADs всё ещё способны формироваться92,93, подтверждая, что реорганизация хроматина не нуждается в ZGA. Сходное исследование на D. melanogaster показало, что блокирование транскрипции не препятствует становлению конформации хроматина высокого порядка, хотя свойства TADs сами по себе затронуты95. Однако, блокирование транскрипции у поздних зигот или ранних двух-клеточных эмбрионов мешает удалению широких доменов H3K4me3 и их замещению каноническими пиками H3K4me375, и это снижает доступность хроматина72 и ряда регионов истощенных по нуклеосомам187, подтверждая, что изменения локального хроматина происходят после активации транскрипции. Напротив, неспособность к удалению широких H3K4me3 доменов с помощью снижения уровней KDM5A и KDM5B приводит к подавлению ZGA генов71. Потеря H3K4me3 приводит к снижению ZGA в отцовском пронуклеусе150, гипер-ацетилирование гистонов вследствие воздействия ингибитором гистоновой деацетилазы усиливает транскрипцию двух-клеточных эмбрионов16, подтверждая, что изменения хроматина влияют на активацию транскрипции.
Эти драматические изменения в хроматине и ландшафте транскрипции происходят тогда, когда ДНК подвергается репликации. Существует тесная связь между репликацией ДНК и активацией транскрипции (rev. ref.5), но как ZGA и изменения в структуре хроматина по времени совпадают с этой картиной, остается неясным. Подавление репликации ДНК с помощью aphidicolin снижает транскрипцию во время малой волны ZGA16,188, тогда как большая волна остается в основном не затронутой72,75. Воздействие на двух-клеточных эмбрионов aphidicolin предупреждает становление структуры хроматина высокого порядка93. Напротив, aphidicolin-обработанные эмбрионы всё ещё теряют широкие H3K4me3 домены75. Необходимы дальнейшие исследования для выяснения точных взаимоотношений между ремоделированием хроматина, репликацией ДНК и активацией транскрипции у ранних эмбрионов.
Мы предложили несколько моделей, которые могли бы объяснить молекулярные процессы, приводящие к большой волне ZGA (Fig. 4). Согласно первой модели малая волна ZGA, запускаемая за счет изменений метилирования ДНК, замены протаминов на гистоны в пронуклеусе самцов, репликации ДНК, факторов. присутствующих в ооците и/или спермии или за счет комбинации всех перечисленных факторов. Действе самой транскрипции в минорной волне ZGA приводит к дальнейшему увеличению доступности хроматина в цис-положении, и тем самым к возможности возникновения большой волны ZGA (Fig. 4a). Напротив, во второй модели продукты минорной ZGA сами по себе действуют в транс-положении, чтобы индуцировать большую волну ZGA (Fig. 4b). Напротив, в третьей модели изменения хроматина могут возникать до ZGA и способствуют минорной волне ZGA, которая, в свою очередь, приводит к большой волне или непосредственно путем активности продуктов минорной волны или благодаря дальнейшему ремоделированию хроматина (Fig. 4c). Наконец, в четвертой модели разные процессы не действуют иерархически, но взаимосвязаны и взаимозависимы. Любой из них может запускать каскад событий, приводящий в конечном итоге к большой волне ZGA (Fig. 4d).
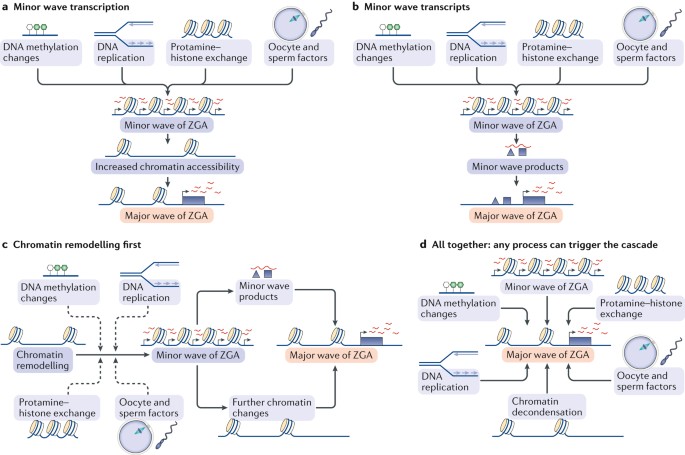 Fig. 4: Models of event hierarchies leading to the major wave of ZGA.
Fig. 4: Models of event hierarchies leading to the major wave of ZGA.
a | In model 1, the act of transcription itself in the minor wave of zygotic genome activation (ZGA) causes the chromatin to open up and become accessible, thereby enabling the major wave of ZGA to take place. b | In model 2, it is the products of the minor wave that are important in triggering the major wave. In both model 1 and model 2, the minor wave may be triggered by DNA methylation changes, DNA replication, protamine-histone exchange and/or factors present in the oocyte or sperm, among other possibilities. c | In model 3, the chromatin changes occur first, thereby enabling the minor ZGA wave, which then triggers, either through further chromatin changes or through its products, the major wave of ZGA?. d| In the final model, all processes are interconnected and occur concomitantly. Triggering any process can lead to a cascade of events that ultimately results in the major ZGA wave. Хотя многочисленные транскрипционные факторы и эпигенетические регуляторы, как полагают, регулируют MZT, некоторые, такие как STELLA и YAP1, несмотря на присутствие в хранилищах ооцитов и, следовательно, обладающие потенциалом главных регуляторов ZGA, активируют только субнабор ZGA транскриптов133,135,143,144. Более того, др. факторы, такие как DUX, начинаю экспрессироваться только во время малой волны ZGA83,136,186, но что первоначально активирует эти факторы, предстоит ещё определить. Существует ли один главный транскрипционный фактор, который регулирует всюZGA, или ZGA является следствием сети перекрывающихся и избыточных факторов, каждый из которых регулирует разные эпигенетические и хроматиновые аспекты? Существуют ли и др. важные факторы? Новые технологии и методы (Box 1) открывают горизонты для сложного глобального анализа эпигенетических и хроматиновых изменений, происходящих во время пре-имплантационного развития. Как дополнительные хроматиновые модификации, а также транскрипционные факторы и эпигенетические регуляторы изменяются во время развития, остается важной темой исследований.
|
 Fig. 1: Overview of transcription and DNA methylation dynamics during mouse preimplantation development.
Fig. 1: Overview of transcription and DNA methylation dynamics during mouse preimplantation development.  Fig. 2: Dynamics of chromatin landscapes during preimplantation development.
Fig. 2: Dynamics of chromatin landscapes during preimplantation development.  Fig. 3: Regulation of the maternal-to-zygotic transition by histone-modifying enzymes and non-coding RNAs.
Fig. 3: Regulation of the maternal-to-zygotic transition by histone-modifying enzymes and non-coding RNAs.  Fig. 4: Models of event hierarchies leading to the major wave of ZGA.
Fig. 4: Models of event hierarchies leading to the major wave of ZGA.