Посещений: 
АЦЕТИЛИРОВАНИЕ ПО ЛИЗИНУ НЕ-ГИСТОНОВЫХ БЕЛКОВ
Функции и механизмы
Functions and mechanisms of non-histone protein acetylation • Takeo Narita,
• Brian T. Weinert &
• Chunaram Choudhary
 Nature Reviews Molecular Cell Biologyvolume 20, pages156–174 (2019)
| |
|
Точный контроль за функцией белков важен для организации и функции биологических систем. Среди разных регуляторных процессов обратимые пост-трансляционные модификации (PTMs) предоставляют элегантный механизм для управления функциями белков. Ключевым преимуществом PTMs является то, что они могут динамически регулироваться со значительно большей скоростью и с меньшей затратой энергии, чем оборот белка. Протеомы эукариот содержат сотни разного типа PTM; однако, лишь немногие из них, такие как фосфорилирование, гликозилирование, метилирование, ацетилирование, убиквитинирование и сумоилирование, были тщательно исследованы.
Хотя физиологическая важность PTMs известна давно, широкое распространение проявлений PTMs только начинает проясняться с начала 21st столетия, когда успехи high-resolution mass spectrometry сделали возможной детекцию тысяч сайтов PTM с низкой распространенностью1. Стало ясно, что комбинации PTMs могут создавать разные изоформы белков с варьирующими функциями, это существенно расширило функциональное разнообразие протеома млекопитающих2.
Ацетилирование лизина эволюционно законсервированное PTM, возникшее у прокариот и эукариот. Ацетилирование было впервые открыто у гистонов Vincent Allfrey с колл. в 1964 (ref.3). Впоследствии ацетилирование было обнаружено в белках high-mobility group (HMG)4, которые являются связанными с хроматином не-гистоновыми белками и с тубулином5. В середине-конце 1990s открыты ацетилирование транскрипционного фактора p53, первые у млекопитающих histone acetyltransferases (HATs) и histone deacetylases (HDACs), bromodomain был идентифицирован как acetyl-lysine reader домен и были открыты мощные deacetylase ингибиторы (rev. 6). Эти прорывные открытия заложили основу области ацетилирования не-гистоновых белков. В данном озоре ацетилирование означает только Nε-lysine ацетилирование.
В последнюю декаду успехи масс-спектрометрии сильно расширили каталог эндогенно ацетилируемых белков, представив мнение об ацетиломе и выявив новe. информацию о воозможностях и регуляции ацетилирования не-гистоновых белков. При оценке степени ацетилирования не-гистоных белков , HATs и HDACs быоли переименованы в lysine acetyltransferases (KATs) и lysine deacetylases (KDACs), соотв. Идентификация тысяч сайтов ацетилирования вызвало огромный интерес, т.к. ацетилирование не-гистоновых белков участвует во всех основных биологических процессах.
Поскольку ацетилирование гистонов рассмотрено в недавнем обзоре 7, оно не будет рассматриваться.
The scope of non-histone acetylation
Вплоть до начала 21st столетия ацетилирование обнаруживалось в основном в индивидуальных белках с использование обычных подходов, таких как in vitro метод acetyltransferase с радиоизотопом-меченным acetyl-CoA или использовались acetyl-lysine антитела. В 2006, комбинация acetylated peptide immunoaffinity-enrichment and high-resolution mass spectrometry сделали возможной идентификацию сотен сайтов ацетилирования 8. Впоследствии осуществлена идентификация тысяч сайтов ацетилирования в линиях клеток человека 9. Такой беспристрастный протеомный анализ показал, что ацетилирование оказалось широко распространенной модификацией белков в разных клеточных компартментах. Большинство последующих исследований первоначально установило, что помимо гистонов ацетилирование происходит в десятках тысяч не-гистоновых белков у эволюционно различающихся организмов 10. В последние годы выявлены изменения в тысячах сайтах ацетилирования в ответ на генетические, химические и метаболические пертурбации и они предоставили информацию о динамичной регуляции ацетилирования лизина 11-15.
Regulation of acetylation
Ацетилирование обеспечивается с помощью KAT-катализируемого переноса ацетильной группы с acetyl-CoA на ε-amino боковую цепочки лизина и обратно с помощью KDACs (Fig. 1a). Недавнее исследование показало, что ацетилирование также происходит посредством не ферментативных механизмов и зависит от доступности acetyl-CoA (Box 1).
 Fig. 1: Regulation of reversible lysine acetylation.
Fig. 1: Regulation of reversible lysine acetylation.
a | Lysine acetylation occurs through lysine acetyltransferase (KAT)-catalysed transfer of an acetyl group from acetyl-CoA to the ε-amino side chain of lysine. Alternatively, acetyl-CoA can acetylate lysine non-enzymatically. Acetylation is reversed by Zn2+-dependent histone deacetylases (HDACs), or by the NAD+-dependent sirtuin family of deacetylases. HDAC-catalysed deacetylation generates deacetylated lysine and acetate, whereas sirtuin-catalysed deacetylation produces deacetylated lysine, nicotinamide and 2? or 3?-O-acetyl-ADP-ribose. b | In mitochondria, acetyl-CoA is generated from pyruvate by the pyruvate dehydrogenase complex (PDC), or by the β-oxidation of fatty acids. Mitochondrial acetyl-CoA feeds into the tricarboxylic acid (TCA) cycle. The TCA cycle intermediate citrate can be exported from mitochondria to the cytoplasm, where it freely diffuses into and out of the nucleus. Cytoplasmic and nuclear acetyl-CoA pools are generated by ATP-citrate lyase (ACLY), acyl-CoA synthetase short-chain family member 2 (ACSS2) and the PDC. Cytoplasmic acetyl-CoA can be converted into malonyl-CoA by acetyl-CoA carboxylase 1 (ACC1) and ACC2 and used for the synthesis of fatty acids. c | Most of the canonical mammalian KATs are classified into three major families: GCN5, p300 and MYST. The remaining (other) KATs are relatively dissimilar to each other. The subcellular localization of KATs is indicated. d | Lysine deacetylases (KDACs) are divided into two categories: the classical Zn2+-dependent HDACs and NAD+-dependent sirtuin deacetylases. KDACs can be further grouped into class I, class IIa, class IIb, class III and class IV. The transcription factors T cell-specific transcription factor 1 (TCF1) and lymphoid enhancer-binding factor 1 (LEF1) are recently reported KDACs that are unrelated to other KDACs. The subcellular localization of KDACs is indicated. In part d, the enzymes indicated with a yellow background either lack deacetylase activity or are involved in removing lysine acylations other than acetylation. CBP, CREB-binding protein; ESCO, establishment of cohesion 1 homologue; GCN5, general control of amino acid synthesis protein 5; HAT1, histone acetyltransferase 1; HBO1, histone acetyltransferase binding to ORC1; MOF, males-absent on the first protein; MORF, MOZ-related factor; MOZ, monocytic leukaemia zinc finger protein; PCAF, p300/CBP-associated factor; SIRT, sirtuin; TAT1, α-tubulin N-acetyltransferase 1; TIP60, 60 kDa Tat-interactive protein.
|
Box 1 Non-enzymatic protein acetylation
An early study showed that histones and synthetic lysine-containing peptides undergo acetylation in vitro in the presence of acetyl-CoA157. However, following the discovery of lysine acetyltransferases (KATs), the study of non-enzymatic acetylation in vivo was not pursued. Non-enzymatic acetylation was only rediscovered more than four decades later.
The scope of non-enzymatic acetylation in vivo was first appreciated when acetylation was found to be strongly increased in metabolically active but growth-arrested cells17. In yeast, manipulation of acetyl-CoA levels through genetic and nutritional perturbations led to corresponding fluctuations in acetylation levels17. Of note, acetylation at nearly all mitochondrial sites was increased uniformly and slowly in growth-arrested cells, suggesting a non-enzymatic mechanism of acetylation. In mice, experimental manipulation of acetyl-CoA levels paralleled changes in acetylation levels, further supporting the existence of non-enzymatic acetylation158,159. Although the majority of acylation in mitochondria may be caused by a non-enzymatic mechanism, the extent of non-enzymatic acetylation in other cellular compartments is less clear.
The ε-amino group of lysine is protonated at acidic and neutral pH. Because lysine must be deprotonated to allow acetylation, the rate of acetylation is influenced by the protonation state of lysine. In enzymatic acetylation, lysine is deprotonated by active site residues of KATs. However, lysine is naturally deprotonated at alkaline pH, and the deprotonated lysine acts as a nucleophile towards the electrophilic carbonyl centre of acetyl-CoA. Thus, alkaline pH increases the proportion of deprotonated lysines, resulting in an increase in non-enzymatic acetylation157. Indeed, non-enzymatic acetylation preferentially occurs at lysine residues flanked by positively charged amino acids160 and could be favoured by the higher pH environment within the mitochondrial matrix161. Acetylation is also influenced by proximal cysteine residues. Through a thiol exchange reaction, acetyl-CoA can cause non-enzymatic cysteine S-acetylation; through an intramolecular S-to-N transfer reaction, the acetyl group can migrate to the amine group of a neighbouring lysine, resulting in lysine acetylation162. Acetylation sites in proximity to cysteine have a substantially higher stoichiometry, thereby supporting the in vivo relevance of this mechanism163 (B.T.W. and C.C., unpublished observations).
In addition to acetylation, other acylations can be catalysed non-enzymatically. Lysine can be acylated by a growing number of acyl-CoAs7, and a non-enzymatic mechanism appears to be relevant to most of them17,32,134,164. Interestingly, some acyl-CoAs, such as succinyl-CoA, glutaryl-CoA and hydroxymethylglutaryl-CoA, are considerably more reactive than acetyl-CoA164. This is because the carboxylate group of these acyl-CoAs can cause an intramolecular nucleophilic attack on the CoA thioester bond, resulting in the formation of a cyclic anhydride that is much more reactive than the parental acyl-CoAs, and can more efficiently modify proteins non-enzymatically.
It is still not fully clear in what conditions non-enzymatic acylation is regulated and what its functions are. Non-enzymatic acylation is affected by the reactivities of acyl-CoAs, the reactivities of different lysine residues in a protein, the cellular concentration of acyl-CoAs and local pH, which can vary between different tissues and cellular compartments. Site-specific acetylation of many metabolic enzymes can affect specific metabolic pathways93 (Supplementary Table 1), but there is little understanding of how such site-specific regulation is carried out. Alternatively, but not mutually exclusively, stochastic non-enzymatic acylation may constitute a type of protein damage that accumulates in conditions of acyl stress or sirtuin (lysine deacetylase) dysfunction. In this model, mitochondrial sirtuins may function as repair factors to remove acyl lesions and restore correct enzyme function97,98. In addition to non-enzymatic acetylation, a few studies report that some acetylation sites in mitochondria are enzyme catalysed25,165. The challenge going forward is to develop strategies to identify enzyme-catalysed acetylation sites and to unravel the functional consequences of non-enzymatic acetylation. |
Regulation of acetyl-CoA synthesis
Acetyl-CoA является ключевым метаболитом с важной клеточной функцией, такой как генерация энергии в митохондриях и биосинтез липидов в цитоплазме. Поскольку acetyl-CoA неспособен проникать через мембраны, то митохондриальный и не-митохондриальный пулы acetyl-CoA генерируются независимо (Fig. 1b). В зависимости от питающего источника митохондриальная acetyl-CoA генерируется с помощью pyruvate dehydrogenase complex (PDC), с помощью β-oxidation жирных кислот или посредством метаболизма аминокислот. Не-митохондриальный пул acetyl-CoA гutгрируется в цитоплазме и в ядре с помощью ATP-citrate lyase (ACLY) и acyl-CoA synthetase short-chain family member 2 (ACSS2), а также с помощью ядерного PDC. Acetyl-CoA может свободно диффундировать между цитоплазмой и ядром посредством ядерных пор.
Ацетилирование прямо связано с уровнями acetyl-CoA и клеточной компартмент-специфичной генерацией acetyl-CoA, управляющей локальным ацетилированием. Напр., ядерные ACLY, ACSS2 и PDC , как полагают, регулируют ацетилирование гистонов и транскрипцию генов посредством локальной продукции acetyl-CoA 16. У дрожжей истощение митохондриальных acetyl-CoA устраняет только ацетилирование митохондриальных белков, не затрагивая ацетилирование ядерных белков 17. У мышей делеция обеих acetyl-CoA carboxylase 1 (ACC1) и ACC2, которые превращают цитоплазматические acetyl-CoA в malonyl-CoA (Fig. 1b), приводит к усилению ацетилирования белков 18, скорее всего, путем увеличения уровней acetyl-CoA. Флюктуации в уровнях acetyl-CoA с помощью генетических и пищевых манипуляций коррелируют с изменениями в уровнях ацетилирования, что также подтверждает, что acetyl-CoA является скорость-ограничивающим фактором для многих событий ацетилирования (reviewed elsewhere13).
Lysine acetyltransferases
Точное количество bona fide KATs в протеоме человека неизвестно. Среди описанных KATs, 13 хорошо охарактеризованы (канонические) и большинство из них распределены по трем семействам: GCN5, p300 и MYST19 (Fig. 1c). Остальные KATs, α-tubulin N-acetyltransferase 1 (TAT1; известнs также как ATAT1), establishment of cohesion 1 homologue 1 (ESCO1) и ESCO2, и histone acetyltransferase 1 (HAT1; известны также как KAT1), являются довольно непохожими др. на др. За исключением TAT1, все канонические KATs преимущественно расположены в ядре и ацетилируют гистоны и не-гистоновые белки. По сравнению с протеин киназами, значительно меньше известно о субстратных предпочтениях KATs. Специфичность к субстрату KATs, как полагают, определяется их специфичной субклеточной локализацией и доступностью лизина в белках субстратах. Многие KATs имеют не перекрывающиеся субстраты, но некоторые близко родственные KATs могут ацетилировать те же самые сайты и демонстрировать функциональную перекрываемость; напр., CREB-binding protein (CBP; известен также как KAT3A) и p300 (известен также как KAT3B) ацетилируют гистон H3 Lys18 (H3K18) и H3K27 (ref.20), GCN5 (известен также как KAT2A) и p300/CBP-associated factor (PCAF; известен также как KAT2B) ацетилируют H3K9 (ref.20), KAT6A и KAT6B ацетилируют H3K23 (ref.21), а ESCO1 и ESCO2 ацетилируют structural maintenance of chromosomes protein 3 (SMC3) Lys105 и Lys106 (refs22,23).
Помимо канонических KATs, растет количество белков, описываемых как функционально не-канонические KATs 19. Однако, мы не будем их обсуждать, т.к. очень мало известно о их субстратной специфичности и ферментативных механизмах. Мы полагаем, что необходима строгая демонстрация их KAT активностей, прежде чем они будут отнесены к подлинным KATs. Напр., ARD1, которая является каталитической субъединицей комплекса N-terminal acetyltransferase A, участвующей в ацетилировании лизина некоторых не-гистоновых белков (Supplementary Table 1), но их lysine acetyltransferase активность находится под вопросом 24. Делеция др. из описанных KAT, ACAT1 (ref.25), не оказывает существенного влияния на ацетилом клеток HCT116 cells (B.T.W. and C.C., unpublished observations). Более того, ацетилирование почти всех сайтов по некоторым описанным KATs - nuclear receptor co-activator 1 (NCOA1), NCOA2 и NCOA3 (ref.14) - редуцируется путем подавления CBP и p300 (ref.26), указывая, что вместо этого они возможно целенаправленно воздействуют на CBP и/или p300.
Lysine deacetylases
Геном человека кодирует 18 KDACs, которые могут быть сгруппированы в две основные категории: Zn2+-зависимые HDACs и NAD+-зависимые sirtuin deacetylases (Fig. 1d). Zn2+-зависимые HDACs обладают высоко консервативным деацетилазным доменом и часто обозначаются как классические HDACs или классические KDACs. На базе их филогенетической консервации и сходства последовательностей, классические KDACs далее подразделяются на 4 класса: class I, class IIa, class IIb and class IV27,28(Fig. 1d). Класс I и класс IV KDACs являются ядерными, класс IIb KDACs является цитоплазматическим и чувствительный к сигналам класс IIa KDACs преимущественно ядерный, но экспортируется в цитоплазму после активации передачи сигналов. Sirtuin deacetylases, которые также обозначаются как класс III KDACs, располагаются в разных клеточных компартментах, включая ядро (sirtuin 1 (SIRT1) и SIRT6), ядрышки (SIRT7), цитоплазму (SIRT2) и митохондрии(SIRT3, SIRT4 и SIRT5)29.
Конечно, почти половина деацетилаз обладает слабой или не имеет деацетилазой активности или воздействует на др. типы ацетилирования. напр., SIRT5 функционирует как desuccinylase, demalonylase и deglutarylase30-32; SIRT4 удаляет acyl частицы с methylglutaryl-lysine, hydroxymethylglutaryl-lysine и 3-methylglutaconyl-lysine33; SIRT6 функционирует как ацилаза длинно-цепочечных жирных кислот34; а класс IIa KDACs лишен заметной каталитической активности благодаря изменениям в законсервированном аминокислотном каталитическом кармане27.
Активность HDAC была недавно описана для транскрипционного фактора T cell-specific transcription factor 1 (TCF1; известен также как TCF7) и lymphoid enhancer-binding factor 1 (LEF1), которые участвуют в сигнальном пути WNT 35. TCF1 и LEF1 обнаруживают сходство с HDAC8, а мутации в законсервированных остатках их каталитического домена устраняют их деацетилазную активность. Однако, общее сходство последовательностей между TCF1, LEF1 и HDAC8 очень слабое и необходимы дальнейшие исследования для подтверждения их деацетилазной активности.
Functional acetylation networks
Чтобы получить представление о функционально разнообразии ацетилирования не-гистоновых белков, мы просмотрели список из ~550 исследований, касавшихся ~380 функционально охарактеризованных не-гистоновых белков, в основном млекопитающих (Supplementary Table 1). Мы также воспользовались информацией о сайтах ацетилирования, чувствительных к KATs и KDACs и функциональных последствиях ацетилирования. Поскольку ацетилирование некоторых белков, таких как p53 и tubulin, активно изучалось, то этот частичный список включает только ключевые публикации, связанные с инициальной идентификацией сайтов ацетилирования и их регуляторных энзимов.
Используя эти данные литературы мы построили сети функционально охарактеризованных белков, а также их связей с KATs и KDACs (Supplementary Figs 1, 2). Известное заключение, что может быть извлечено из этих сетей, что имеется диспропорционально большое количество функционально исследованных ацетилирований, сцепленных с немногими хорошо охарактеризованными KATs и KDACs. Др. интересным наблюдение стало то, что белки, участвующие в регуляции транскрипции, в большинстве своем избыточно представлены в этих сетях составляют более 40% функционально охарактеризованных субстратов KAT. Это согласуется с ядерной локализацией большинства канонических KATs.
Более двух третей сайтов ацетилирования с известными KATs являются мишенями для CBP и/или p300, и ацетилирование ~90% ацетилируемых белков катализируются с помощью пяти KATs (CBP, p300, GCN5, PCAF и TIP60 (известен также как KAT5)) (Supplementary Fig. 1). Количество функционально охарактеризованных ацетилируемых не-гистоновых белков, сцепленное с CBP и/или p300, существенно больше, чем количество CBP и/или p300 субстратов, идентифицированных при беспристрастном анализе ацетилома14. Избыточная представленность CBP и p300 в этих сетях обусловлена несколькими факторами: во-первых, благодаря из ключевой функции в регуляции транскрипции, что, скорее всего, и склоняло исследователей к исследованию их субстратов; во-вторых, CBP и p300 обладают мощной acetyltransferase вктивностью in vitro и после избыточной экспрессии в клетках, позволяя с лёгкостью идентифицировать их мишени; и в-третьих, сайты CBP-регулируемого и/или p300-регулируемого ацетилирования обладают более высокой, чем в среднем, stoichiometry14, это, скорее всего, и вносит вклад в их более легкую детекцию с помощью immunoblotting и mass spectrometry. CBP и p300 каждая сцеплена с большим количеством уникальных мишеней, чем с количеством мишеней, которые они имеют общими (Supplementary Fig. 1). Однако, многие исследования, изучавшие участие CBP и p300 в ацетилировании субстрата были протестированы только с одним из этих энзимов и, скорее всего, что CBP и p300 обычно ацетилируют значительно большую группу белков, чем представлено в Supplementary Fig. 1. Безусловно, лишь немногие или функционально не охарактеризованные не-гистоновые субстраты описаны для MYST семейства acetyltransferases, за исключением TIP60. Наконец, имеется мало или не существует не-гистоновых субстратов для плохо охараеткеризованных неканонических KATs (Supplementary Table 1).
Подобно KAT-регулируемым сетям диспропорционально боольшое количество субстратов связано с немногими KDACs, в основном с sirtuins. Более 40% сайтов ацетилирования являются мишениями для SIRT1, и более двух третей сайтов являются мишенями для sirtuin deacetylases в целом (Supplementary Fig. 2). В соответствии с разной клеточной локализацией sirtuins, мишени для SIRT1 включают многие ядерные белки, такие как регуляторы транскрипции, тогда как большинство мишеней для SIRT3 участвует в регуляции метаболизма в митохондриях (Supplementary Table 1). Возможным объяснением избыточной представленности sirtuins по сравнению с классическими HDACs является то, что химические ингибиторы, используемые для изучения классических HDACs, такие как trichostatin A, подавляют активность многих KDACs. Т.о., в этих исследованиях невозможно определить деацетилазную активность для специфического энзима или энзимов и целенаправленное воздействие KDACs на эти сайты не специфицировано. В сравнении с KAT-регулируемыми сетями, KDAC-регулируемые сети заключают в себе меньше регуляторов транскрипции, но включают большую фракцию белков, участвующих в метаболизме, которые в основном подвержены воздействию SIRT2 и SIRT3.
:Необходимо подчеркнуть, что огромное большинство функционально охарактеризованных взаимоотношений ацетилирующий энзим-субстрат открыто с помощью гипотезой-направляемых исследований и, скорее всего, относятся они к активно исследуемым белкам. В целом эти исследования представляют снимок широкого регуляторного ландшафта ацетилирования лизина.
Cellular roles of acetylation
Ацетилирование не-гистоновых белков участвует в разнообразных клеточных процессах и болезнях человека. В качестве таковых, энзимы, регулирующие ацетилирование и acetyl-lysine reader домен-содержащие белки являются привлекательными терапевтическими мишенями (Box 2).
|
Box 2 Non-histone protein acetylation in disease and as a therapeutic target
Deregulated acetylation is associated with various human diseases; thus, proteins involved in acetylation are attractive therapeutic targets. Acetylation deregulation in disease Developmental disorders. Germline mutations in several lysine acetyltransferases (KATs) and lysine deacetylases (KDACs) are involved in disorders associated with developmental delays and abnormalities and intellectual disability. Mutations in CREBBP(which encodes CREB-binding protein (CBP)) and EP300 (which encodes p300)) result in Rubinstein-Taybi syndrome; mutations in KAT6B cause Say-Barber-Biesecker-Young-Simpson syndrome (also known as Ohdo syndrome)166 and Genitopatellar syndrome167, and KAT6A mutations cause intellectual disability and global developmental delay168,169. A mutation in the gene encoding the KAT6A and KAT6B activator Peregrin (BRPF1) is associated with developmental delays, intellectual impairment and facial dysmorphisms170,171. Mutations in SMC3 (which encodes structural maintenance of chromosomes protein 3) and in HDAC8(which encodes histone deactylase 8, an SMC3 deacetylase) are associated with Cornelia de Lange syndrome, whereas mutations in ESCO2 (which encodes establishment of cohesion 1 homologue 2, an SMC3 acetyltransferase) are associated with Roberts syndrome.
Cancer and other diseases. Acetylation has been linked to cancer since the discovery of acetylation of the tumour suppressor p53 (ref.36) and since then has been implicated in diverse cancers (for example, somatic mutations in CREBBP and EP300 are frequently detected in leukaemia172,173), inflammation and immunity, and neurological and metabolic diseases such as diabetes29,174.
Therapeutic targeting of acetylation
Small-molecule inhibitors of KDACs, KATs and bromodomain proteins (acetyl-lysine readers) have emerged as attractive therapeutic candidates. Although the biological effects of KDAC, KAT and bromodomain inhibitors are often linked to histone acetylation, these drugs also regulate non-histone proteins, and thus, it is likely that non-histone proteins also contribute to their cellular effects.
KDAC inhibitors and activators. Extensive efforts in the past two decades have yielded dozens of KDAC inhibitors with varying target specificities174. At least four KDAC inhibitors (vorinostat, romidepsin, panabinostat and belinostat) are clinically approved for treating cutaneous and peripheral T cell lymphoma as well as multiple myeloma and are being tested for several other cancers. KDAC inhibitors can enhance synaptic plasticity and memory formation in mice175,176. Indeed, long before the discovery of its KDAC inhibitory activity, valproic acid was used as a mood stabilizer and an anti-epileptic drug. KDAC inhibitors have also been tested for their antiviral effects; most notably, vorinostat disrupts HIV-1 latency in individuals treated with antiretroviral therapy177.
Decreased NAD+ levels and sirtuin function are linked to ageing and cancer13,178; therefore, sirtuin activation may have therapeutic benefits. Several sirtuin-activating compounds (STACs), such as resveratrol, have been identified179, although the role of sirtuins in ageing and the beneficial effects of STACs are the subject of an ongoing debate. Recently, administration of metabolic precursors of NAD+, such as nicotinamide mononucleotide or nicotinamide riboside, has been reported to have various health-beneficial effects180. Although the beneficial effects of NAD+ precursors are often attributed to increased sirtuin activation, other functions of NAD+, for example, in redox regulation, likely contribute to these effects.
KAT inhibitors. The development of KAT inhibitors has lagged behind that of KDAC inhibitors. The recently identified CBP and p300 inhibitor A485 showed anti-proliferative effects on lineage-specific tumour cell lines26, and inhibitors of KAT6A and KAT6B induced cellular senescence and inhibited the growth of lymphoma in mice181. In the future, it would be interesting to identify potent and selective inhibitors for other KATs to understand their biological functions and to explore their therapeutic potential.
Bromodomain inhibitors. Several small-molecule inhibitors have been identified for different bromodomain proteins111,182. Of note, compounds targeting the bromodomain and extraterminal (BET) family of proteins show promising anticancer potential and are currently being clinically evaluated. |
Gene transcription
Ацетилирование белков является главным регулятором транскрипции генов. Большинство канонических KATs располагается в ядре и функциионируют как ко-активаторы транскрипции. Сходным образом, почти все acetyl-lysine-binding, bromodomain-содержащие белки располагаются в ядре и многие из них непосредственно участвуют в регуляции транскрипции. Опухолевой супрессор p53 был первым транскрипционным фактором, идентифицированным как подвергающийся ацетилированию 36. Ацетилирование p53 регулирует его связывание с ДНК, стабильность и взаимодействия с др. белками и строго коррелирует с активацией регулируемых с помощью p53 генов в ответ на клеточные стрессы 37. В целом ацетилирование участвует в регуляции более 100 не-гистоновых регулирующих транскрипцию белков, включая транскрипционные факторы и ядерные рецепторы (Supplementary Table 1). Т.о., транскрипция генов является основной ролью ацетилирование не-гистоновых белков.
Cell cycle
Во время репликации ДНК сестринские хроматиды спарены др. с др. с помощью cohesin комплексов, пока они не будут разделены в митозе. ATPase является главой SMC3, которая является ключевым компонентом cohesin комплекса, она ацетилируется по двум консервативным ДНК-определяющим остаткам, Lys105 и Lys106 (refs38-40). Как только SMC3 оказывается на ДНК o DNA, ацетилирование SMC3 замыкает кольцо cohesin, тем самым устанавливается стабильное слипание сестринских хроматид (Fig. 2a). В клетках млекопитающих SMC3 ацетилируется с помощью ESCO1 и в меньшей степени с помощью ESCO2 (ref.15). Комбинированное истощение ESCO1 и ESCO2 вызывает тяжелые дефекты в слипании хроматид и клетки оказываются нежизнеспособными 22. Интересно, что cohesin комплекс может быть высвобожден в ацетилированной форме во время профазы и анафазы, а HDAC8-зависимое деацетилирование необходимо для распада высвобожденного комплекса 41. Это указывает на то, что хотя ацетилирование SMC3 стабилизирует слипчивость хроматид, SMC3 могут быть высвобождены из хроматина с помощью независимого от деацетилирования механизма. Недавняя работа подтвердила, что ацетилирование SMC3 также важно для не-cohesive функций SMC3, напр., транскрипции генов и при повреждениях и репарациях ДНК 22,23. В самом деле, загрузка на хроматин гиперацетилированной формы cohesin, приводя к изменениям транскрипции генов в HDAC8-мутантных клетках, происходящих от индивидов с синдромом Cornelia de Lange 41. Ацетилирование также модулирует некоторые др. главные регуляторы клеточного цикла, включая протеин киназы BUBR1, Aurora kinase A, Aurora kinase B, cyclin-dependent kinase 1 (CDK1), CDK2 and PLK4 (Supplementary Table 1). Зависимая от ацетилирования регуляция разных регулирующих клеточный цикл протеин киназ открывает интересную возможность, что клеточный цикл скоординировано регулируется ацетилированием и фосфорилированием. Однако, необходимы дальнейшие исследования , чтобы понять активности KAT и KDAC во время клеточного цикла и возможное взаимодействие между ацетилированием и фосфорилированием во время кле6точного цикла.
 Fig. 2: Biological processes that are regulated by non-histone protein acetylation (I). Fig. 2: Biological processes that are regulated by non-histone protein acetylation (I).
a | Acetylation of structural maintenance of chromosomes protein 3 (SMC3) by establishment of cohesion 1 homologue 1 (ESCO1) and ESCO2 promotes closing of the cohesin ring and chromatid cohesion. SMC3 is deacetylated by histone deacetylase 8 (HDAC8). b | Upon formation of DNA double-strand breaks (DSBs), TIP60 acetylates the kinase ataxia telangiectasia mutated (ATM), causing autophosphorylation and activation of ATM. Activated ATM phosphorylates multiple proteins, including TP53-binding protein 1 (53BP1) and ATP-citrate lyase (ACLY). Acetylation and deacetylation of 53BP1 by CREB-binding protein (CBP) and HDAC2, respectively, control its association with damaged chromatin. Additionally, TIP60-catalysed acetylation of histone H2A Lys15 (H2AK15ac) prevents the binding of 53BP1 to chromatin. Generation of ACLY-dependent acetyl-CoA also promotes acetylation of histones and reduces binding of 53BP1 to chromatin. Inhibition of 53BP1 recruitment to chromatin impairs non-homologous end-joining (NHEJ)-dependent DSB repair. c | Acetylation of connector enhancer of kinase suppressor of RAS1 (CNK1) in its pleckstrin homology (PH) domain promotes its localization to the membrane, where it associates with the kinase RAF to promote phosphorylation and activation of ERK; this forms a feedback loop and stimulates CNK1 acetylation. In the insulin receptor (INSR) and insulin-like growth factor 1 receptor (IGF1R) signalling pathways, deacetylation of insulin receptor substrate 2 (IRS2) enhances its phosphorylation and activates ERK signalling. PI3K phosphorylates phosphatidylinositol (3,4)-diphosphate (PIP2) to generate phosphatidylinositol (3,4,5)-trisphosphate (PIP3), whereas the phosphatase PTEN converts PIP3 into PIP2. Membrane-associated PIP3 recruits the kinases PDK1 and AKT through their PH domains. Site-specific acetylation of PTEN promotes its interaction with PDZ domain-containing proteins, such as membrane-associated guanylate kinase inverted 2 (MAGI2), which enhance PTEN activity and promote its recruitment to signalling complexes. Acetylation of PDK1 and AKT in their PH domains inhibits their membrane recruitment and activation. Acetylation of the mTORC2 subunit rapamycin-insensitive companion of mTOR (RICTOR) increases the kinase activity of mTORC2 towards its substrate AKT.
DNA damage repair
Киназа ataxia telangiectasia mutated (ATM) является ключевым регулятором репарации двойных разрывов ДНК (DSB) . TIP60 ацетилирует и активирует ATM в ответ на повреждения ДНК, а инактивация TIP60 сенсибилизирует клетки к ионизирующей радиации42 (Fig. 2b). Более того, ацетилирование регулирует выбор пути репарации DSB между non-homologous end-joining (NHEJ) и homology-directed repair (HDR), регулируя рекрутирование способствующего NHEJ фактора TP53-binding protein 1 (53BP1) с сайтами повреждений ДНК. Катализируемое TIP60 ацетилирование гистона H4 предупреждает связывание Tudor домена из 53BP1 с диметилированным H4K20 (H4K20me2)43, а катализируемое TIP60 активирование H2AK15 предупреждает убиквтилирование этого остатка (H2AK15ub) и тем самым подавляет рекрутирование 53BP1 на H2AK15ub посредством его ubiquitylation-dependent recruitment (UDR) домена44. Индуцированное поврежддениями ДНК фосфорилирование ACLY с помощью ATM повышает продукцию в ядре acetyl-CoA, приводя к повышению ацетилирования гистонов и нарушению расположения на хроматине 53BP1 (ref.45). Непосредственное ацетилирование 53BP1 с помощью CBP также мешает рекрутированию 53BP1 на поврежденный хроматин46 (Fig. 2b). Т.о., ацетилирование 53BP1 и гистонов взаимодействует с рекрутированием 53BP1 и способствует HDR , а не NHEJ.
Ацетилирование также регулирует белки, привлекая пути base excision repair (BER) и nucleotide excision repair (NER). Вызываемое повреждениями ДНК ацетилирование apurinic/apyrimidinic endonuclease 1 (APE1; известна также как APEX1), которая является важным компонентом BER, подавляет взаимодействие с XRCC1 и снижает активность APE1; SIRT1-катализируемок деацетилирование восстанавливает функцию APE147. Ацетилирование также подавляет каталитическую активность и связывание с ДНК BER (и репликацию) фактора flap endonuclease 1 (ref.48).
Функции NER фактора xeroderma pigmentosum group A-complementing protein (XPA) и replication factor A protein 1 (RPA1) регулируются обратным образом с помощью ацетилирования. XPA деацетилируется с помощью SIRT1 вследствие облучения УФЛ и это способствует его взаимодействию с RPA1 и хроматином 49. Напротив, RPA1 ацетилируется вследствие облучения УФЛ, чтобы увеличить его удержание на хроматине 50. Proliferating cell nuclear antigen (PCNA) также ацетилируется вследствие повреждений ДНК, индуцируемых облучением УФЛ. После завершения NER, ацетилированный PCNA удаляется с хроматина и деградируется с помощью протеосом 51. Т.о., зависимое от ацетилирования удаление PCNA предупреждает его избыточное пребывание на хроматине, что может мешать геномной стабильности. Итак, ацетилирование гистоновых и не-гистоновых белков, по-видимому, регулирует репарацию разного типа повреждений ДНК.
Cellular signalling
CBP-обеспечиваемое ацетилирование pleckstrin homology domain (PH domain) из connector enhancer of kinase suppressor of RAS1 (CNK1; известен также как CNKSR1) управляет его локализацией на плазматической мембране, где он взаимодействует с serine/threonine киназой RAF, чтобы фосфорилировать и стимулировать ERK-зависимую пролиферацию и миграцию клеток52 (Fig. 2c). Активация передачи сигналов ERK формирует петлю обратной связи, которая усиливает ацетилирование CNK1. SIRT1-катализируемок деацетилирование insulin receptor substrate 2 (IRS2), который является ключевым адаптором инсулина и передачи сигналов insulin-like growth factor 1 (IGF1), увеличивает его фосфорилирование и активацию передачи сигналов ERK signalling53. Подавление SIRT1 увеличивает ацетилирование IRS2 и подавляет передачу сигналов IGF1, возможно способствуя дефосфорилированию IRS2.
Уровни plasma membrane-associated signalling messenger phosphatidylinositol (3,4,5)-trisphosphate (PIP3) регулируются с помощью kinase PI3K и phosphatase PTEN. PCAF ацетилирует PTEN внутри его каталитического домена и тем самыа ингибируют его54. Напротив, ацетилирование PTEN по его carboxy концу с помощью CBP способствует его взаимодействию с PDZ домен-содержащими белками, такими как membrane-associated guanylate kinase inverted 2 (MAGI2)55, которая усиливает активность липидной фосфатазы PTEN и рекрутирует его на сигнальные комплексы на мембранах56 (Fig. 2c). Ацетилирование киназ AKT и PDK1 по их PH доменам с помощью PCAF и p300 предупреждает их зависимую от PIP3 локализацию на мембране и активацию57. Напротив, деацетилирование с помощью SIRT1 усиливает их связывание с PIP3 и способствует их киназной активности.
Ацетилирование mTORC2 субъединицы rapamycin-insensitive companion of mTOR (RICTOR) с помощью p300 увеличивает mTORC2-обеспечиваемое фосфорилирование AKT (Fig. 2c). Сходным образом, подавление sirtuin деацетилаз усиливает ацетилирование RICTOR и IGF1-индуцированное фосфорилирование AKT 58. Ацетилирование RICTOR повышается путем добавления глюкозы или acetate 59, возможно за счет увеличения синтеза acetyl-CoA. У условиях повышенных уровней глюкозы ацетилирование RICTOR поддерживает устойчивую активацию mTORC2 даже в отсутствие вышестоящей передачи сигналов с помощью рецепторов ростовых факторов. Поскольку AKT киназы являются ключевыми драйверами клеточной пролиферации и жизнеспособности, то зависимая от ацетилирования активация mTORC2-AKT, скорее всего, способствует этим процессам.
Protein folding
С помощью шаперонов осуществляемая укладка белков является чрезвычайно важной для достижения функционально зрелого состояния белка. Heat shock proteins (HSPs), которые образуют большой класс шаперонов у эукариот, подвергаются целенаправленному ацетилированию; сюда входячт HSP10, HSP70, HSP90 и HSPA5 (Supplementary Table 1). Ацетилирование HSP90 нарушает его ассоциацию с важным co-chaperone, p23, приводя к потере активности шаперона 60. HSP90 деацетилируется с помощью HDAC6, а генетическая делеция или фармакологическое подавление HDAC6 нарушает созревание глюкокортикоидного рецептора, который является клиентомHSP90 60. HSP90 важен для укладки многих связанных с передачей сигналов белков, а его ингибирование действует синергично с KDAC ингибиторами, мешая пролиферации клеток, экспрессирующих онкогенные киназы 61,62.
Cytoskeleton organization
Микротрубочки, которые образуются путем полимеризации α-tubulin и β-tubulin, являются главным компонентом цитоскелета клеток эукариот. α-Tubulin ацетилируется по Lys40 с помощью цитоплазматической acetyltransferase TAT1 (ref.63) и деацетилируется с помощью цитоплазматической deacetylase HDAC6 (refs64,65) (Fig. 3a). TAT1, как полагают, проникает в микротрубочки через концы микротрубочек или посредством breathing (stretching) боковой стенки микротрубочек и использует необычный механизм, чтобы ацетилировать α-tubulin внутри просвета микротрубочек 66,67. Делеция TAT1 вызывает нарушения миграции в кортикальных проекций нейронов и промежуточных нейронов; dистощение HDAC6 или избыточная экспрессия acetylation-mimetic α-tubulin (K40Q) уменьшает фенотип дефицита TAT1 68, указывая, что тубулин является ключевой мишенью TAT1. Деплеция TAT1 увеличивает частоту вызываемых механическими стрессами разрывов микротрубочек, указывая тем самым, что ацетилирование увеличивает механическую эластичность микротрубочек, обеспечивая продолжительное существование микротрубочек 67. В T клетках ацетилирование тубулина регулирует организацию иммунных синапсов и антиген-специфическую переориентацию центра организации микротрубочек 69.
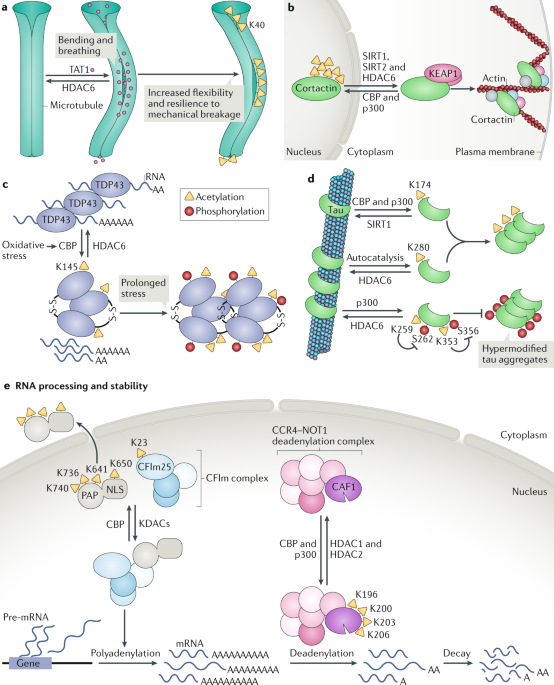 Fig. 3: Biological processes that are regulated by non-histone protein acetylation (II). Fig. 3: Biological processes that are regulated by non-histone protein acetylation (II).
a | γ-Tubulin is acetylated and deacetylated at Lys40 by α-tubulin N-acetyltransferase 1 (TAT1) and histone deacetylase 6 (HDAC6), respectively. TAT1 enters microtubules though their ends or thorough bending and breathing of the microtubule sidewall and stochastically acetylates α-tubulin within the microtubule lumen. Acetylation increases mechanical resilience and prevents mechanical breakage of long-lived microtubules. b | Cortactin is acetylated at multiple residues in the nucleus by CREB-binding protein (CBP) and deacetylated by sirtuin 1 (SIRT1), SIRT2 and HDAC6. Deacetylated cortactin binds to KEAP1 and promotes cytoskeleton reorganization. c | During oxidative stress, CBP-catalysed acetylation of the RNA-binding protein TDP43 causes its dissociation from RNA and promotes its aggregation. Oxidative stress causes formation of disulfide bonds (S-S) in TDP43, and in conditions of prolonged stress, TDP43 accumulates in a hyperphosphorylated form. d | Acetylation of tau at Lys174 by CBP and p300 and at Lys280 through autocatalysis promotes tau aggregation, which is reversed by deacetylation of these residues by SIRT1 and HDAC6. Tau acetylation at Lys259 and Lys353 inhibits its phosphorylation at Ser262 and Ser356, respectively, and its aggregation. e | CBP acetylates cleavage factor Im 25?kDa subunit (CFIm25) and poly(A) polymerase (PAP), thereby inhibiting their interaction and promoting the cytoplasmic localization of PAP through acetylation of its nuclear localization signal (NLS). Acetylation by CBP and p300 of CCR4-associated factor 1 (CAF1), a catalytic subunit of the CCR4-NOT1 deadenylase complex, promotes mRNA decay. Inhibition of HDAC1 and HDAC2 increases CAF1 acetylation and enhances mRNA decay. KDAC, lysine deacetylase. Part a adapted with permission from ref.67, AAAS.
Ацетилирование также регулирует др. крупный цитоплазматический белок, cortactin, который соединяется с F-actin и вносит вклад в организацию актинового скелета и миграции клеток (Fig. 3b). Cortactin ацетилируется с помощью CBP и p300 (refs70,71). Ацетилированный cortactin в основном располагается в ядре 71. Ацетилирование снижает связывание cortactin с KEAP1 и подавляет миграцию клеток 71, тогда как HDAC6-зависимо, SIRT2-зависимое и SIRT1-зависимое деацетилирование способствует подвижности клеток 70,72.
Protein aggregation
Накопление агрегатов белков связано с разными нейрологическими патологиями. Некоторые склонные к агрегации белки ацетилируются , включая Huntingtin, tau, superoxide dismutase 1 (SOD1) и TDP43, и это влияет на их агрегацию. Ацетилирование TDP43, который участвует в возникновении amyotrophic lateral sclerosis, нарушает связывание его РНК и способствует накоплению нерастворимой, гиперфосфорилированной формы TDP43 (ref.73) (Fig. 3c). Acetylation-mimetic мутант TDP43-K145Q способствует фосфорилированию, убиквитилированию и агрегации TDP4374.
Белок, связывающий микротрубочки tau ацетилируется по многим остаткам с помощью CBP и p300 (refs75,76) и посредством своей собственно аутокаталитической активности 77. Ацетилирование tau внутри её мотива, связывающего микротрубочки, нарушает взаимодействия tau-микротрубочки и способствует агрегации патологической tau 75,78 (Fig. 3d). Ацетилирование Tau по Lys174 является ранним маркером болезни Альцгеймера. Подавление p300 снижает ацетилирование tau, усиливает оборот tau, ослабляет вызываемый tau дефицит памяти и предупреждает повреждения нейронов 76. Ацетилирование tau по Lys259 и Lys353 в KXGS мотивах подавляет фосфорилирование проксимальнее Ser262 и Ser356 и тем самым предупреждает формирование гиперфосфорилированных tau агрегатов 79 (Fig. 3d). Подавление HDAC6 усиливает ацетилирование tau, редуцирует фосфорилирование tau и способствует очистке от tau 79. Эти исследования показывают, что определенные места ацетилирования могут по-разному влиять на агрегацию tau.
RNA processing and stability
Ацетилирование регулирует разные ступени пост-транскрипционного процессинга РНК, включая сплайсинг пре-РНК и полиаденилирование и деградацию полиаденилоированных мРНК (mRNA decay). Ацетилирование субъединицы фактора расщепления Im 25 kDa (CFIm25), которая является компонентом комплекса фактора расщепления Im (CFIm), и polyadenylation enzyme poly(A) polymerase (PAP), супрессирует полиаденилирование мРНК посредством двух механизмов 80 (Fig. 3e). Во-первых, CFIm25 и PAP непосредственно взаимодействуют др. с др., а ацетилирование с помощью CBP по их взаимодействующим регионам подавляет их ассоциацию. Во-вторых, ацетилирование PAP вызывает его экспорт в цитоплазму. Более того, CBP и p300 способствуют распаду мРНК путем ацетилирования и активации CCR4-associated factor 1 (CAF1; известен также как CNOT7), который является каталитической субъединицей CCR4-NOT1 (известна также как CNOT1) deadenylase комплекса 81. Во время дифференцировки адипоцитов экспрессия CBP и p300 снижается, вызывая увеличение стабильности полиаденилированной мРНК . Напротив, подавление HDAC1 и HDAC2 вызывает широко распространенный распад мРНК в клетках млекопитающих и Drosophila melanogaster, возможно за счет ацетилирования белков.
Autophagy
Ацетилтрансферазы CBP, p300 и TIP60 и деацетилазы HDAC6 и SIRT1 являются важными регуляторами аутофагии. В зависимости от белка мишени ацетилирование может усили вать или подавлять аутофагию. Напр., пищевое голодание вызывает активацию glycogen synthase kinase 3 (GSK3), которая фосфорилируeт и активирует TIP60 (Fig. 4). TIP60 ацетилирует и стимулирует киназуULK1, которая необходима для аутофагии 82.
 Fig. 4: Regulation of autophagy by non-histone protein acetylation. Fig. 4: Regulation of autophagy by non-histone protein acetylation.
In conditions of nutrient starvation, glycogen synthase kinase 3 (GSK3) phosphorylates and activates TIP60, which promotes autophagy by acetylating the kinase ULK1. In nutrient-rich conditions, mTORC1 phosphorylates and activates p300, which inhibits autophagy and instead promotes lipogenesis. p300 acetylates beclin 1, vacuolar protein sorting 34 (VPS34), ATG5, ATG7, microtubule-associated protein light chain 3 (LC3; Atg8 in yeast) and ATG12. Acetylation of ATG proteins inhibits the formation of autophagosomes. Acetylation of beclin 1 promotes the recruitment of Run domain beclin 1-interacting and cysteine-rich domain-containing protein (Rubicon) to the UVRAG complex and inhibits autophagosome maturation. Sirtuin 1 (SIRT1) deacetylates the ATG proteins and beclin 1. SIRT1-catalysed deacetylation of LC3 promotes its association with diabetes and obesity-regulated gene (DOR) and export from the nucleus, and deacetylation of beclin 1 promotes autophagosome maturation. Histone deacetylase 6 (HDAC6) promotes clearance of protein aggregates by facilitating their microtubule-based transport to autophagosomes. Additionally, HDAC6 deacetylates cortactin and promotes cortactin-dependent assembly of the F-actin network, which stimulates autophagosome-lysosome fusion. Активность CBP и p300 регулируется с помощью mTORC1. В условиях богатого питания, mTORC1 фосфорилирует p300 по остаткам carboxy-терминального серина, тем самым облегчает его аутоингибирование, супрессирует аутофагию и способствует липогенезу83. p300 ацетилирует главные факторы аутофагии ATG5, ATG7, microtubule-associated protein light chain 3 (LC3; Atg8 у дрожжей) и ATG12, ингибируя тем самым аутофагию84 (Fig. 4). Комплекс UVRAG, который состоит из vacuolar protein sorting 34 (VPS34; известен также как PIK3C3), VPS15 (известен также как PIK3R4), beclin 1 и UVRAG, играет важную роль в созревании аутофагосом, способствуя слиянию аутофагосом и лизосом; взаимодействие с Run доменом в beclin 1-interacting and cysteine-rich domain-containing protein (Rubicon) подавляет функцию UVRAG комплекса85. Ацетилирование VPS34, который является класса III PI3K, препятствует связыванию с его субстартом, phosphatidylinositol, и подавляет взаимодействие VPS34-beclin 186. Ацетилирование beclin 1 способствует рекрутированию Rubicon на комплекс UVRAG и тем самым подавляет созревание аутофагосом87.
SIRT1 взаимодействует с и непосредственно деацетилирует ATG5, ATG7 и LC3, а его каталитическая активность необходима для аутофагии88. В частности, LC3 снует между ядром и цитоплазмой, а во время пищевого голодания он избирательно деацетилируется с помощью SIRT1 (ref.89) (Fig. 4). Деацетилированный LC3 взаимодействует с diabetes and obesity-regulated геном (DOR; известен также как TP53INP2) и транслоцируется в цитоплазму, ult он взаимодействует с ATG7, чтобы способствовать аутофагии. Повышение экспрессии SIRT1 усиливает базовую аутофгию, а SIRT1-дефицитные мышиные эмбриональные фибробласты неспособны полностью активировать аутофагию88.
HDAC6 является единственной деацетилазой у млекопитающих, которая содержит ubiquitin-связывающий домен и умело взаимодействует с ubiquitylated белками. Наконец, HDAC6 играет ключевую роль в обеспечении зависимой от аутофагии деградации белка, когда нарушена ubiquitin-proteasome система90. HDAC6 также облегчает зависимый от микротрубочек транспорт белковых агрегатов и поврежденных митохондрий в аутофагосомы и способствует слиянию лизосом и аутофагосом с помощью деацетилирования cortactin, который вносит вклад в формирование сети F-actin91,92(Fig. 4).
Возникающая картина показывает, что ацетилирование регулирует разные белки, которые встречаются на разных ступенях аутофагии. Координирует ли ацетилирование разные регуляторы аутофагии?
Other regulatory functions
В дополнение к основным биологическим процессам, ацетилирование не-гистоновых белков участвует во все большем количестве др. процессов, включая ацетилирование белков, участвующих в репликации ДНК (TOPBP1 и MCM10), апоптозе (Ku70 (известен также как XRCC6) и p53), хранении и разрушении липидов (CAVIN1 и CIDEC), делении и слиянии митохондрий (MFN1, MFN2 and OPA1), синтезе белков (eIF2A and eIF5A), транспорте ионов (AMPAR (известен также как CACN), KCNA5 и KCNAB2) и регуляции redox (PRX1 (известен также как PRRX1) и PRX2 (известен также как PRRX2); Supplementary Table 1). Ацетилирование также активно участвует в регуляции метаболизма; см. обзоры 13,29,93.
Functional mechanisms of acetylation
Позитивно заряженные лизиновые остатки часто участвуют в межбелковых взаимодействиях и в каталитической активности белков. Ацетилирование нейтрализует позитивный заряд лизина и тем самым влияет на разные аспекты белковой функции, иакие как стабильность, ферментативная активность, субклеточная локализация и взаимодействия с др. макромолекулами в клетке.
Regulation of enzymes
Посредством разных механизмов ацетилирование регулирует активности более 40 ферментов, расположенных в разных компартментах клетки (Supplementary Table 1).
Inhibition of catalytic activity
Ацетилирование инактивирует ферментативную активность acetyl-CoA synthetase 1 (AceCS1; известна также как ACSS1) и AceCS2 (известна также как ACSS2) 94,95, которые находятся в цитоплазме и митохондриях, соотв. Деацетилирование AceCS1 и AceCS2, с помощью SIRT1 и SIRT3, соотв., восстанавливает их ферментативные функции (Fig. 5a). KAT9 (известен также как ELP3) - катализирует ацетилирование glucose-6-phosphate dehydrogenase (G6PD), ингибируя образование активных G6PD димеров, приводя к потере ферментативной активности 96 (Fig. 5a). SIRT2-катализируемое деацетилирование восстанавливает функцию G6PD и защищает клетки от оксидативных повреждений. Ацетилирование подавляет многие митохондриальные энзимы 93, а sirtuin деацитилазы восстанавливают их каталитическую активность 97,98. Напр., ацетилирование ингибирует каталитическую активность длинно-цепочечных acyl-CoA дегирдрогеназ, которая восстанавливается деацетилированием с помощью SIRT3 (ref.99).
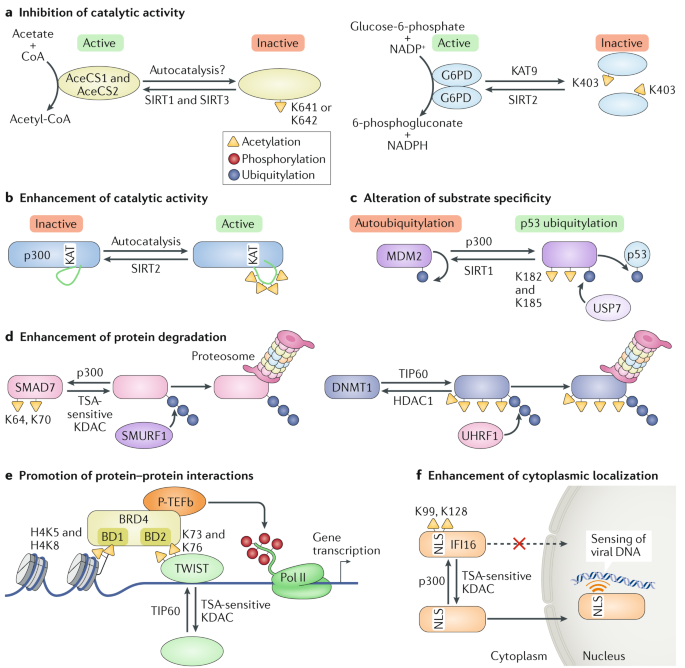 Fig. 5: Functional mechanisms of acetylation. Fig. 5: Functional mechanisms of acetylation.
a | The cytoplasmic acetyl-CoA synthetase 1 (AceCS1) and the mitochondrial AceCS2 are acetylated - possibly through autocatalysis - at Lys641 and Lys642, respectively, and deactivated. Deacetylation of AceCS1 and AceCS2 by sirtuin 1 (SIRT1) and SIRT3, respectively, restores their enzymatic function. Glucose-6-phosphate dehydrogenase (G6PD) is acetylated at Lys403 by lysine acetyltransferase 9 (KAT9) and deacetylated by SIRT2. G6PD acetylation prevents its dimerization and results in its inactivation. b | Non-acetylated p300 is autoinhibited by interaction of the activation loop with the lysine acetyltransferase (KAT) domain. Multisite autoacetylation of the activation loop displaces it from the KAT domain and enhances the catalytic activity of p300. c | Non-acetylated E3 ubiquitin-protein ligase MDM2 can ubiquitylate itself. MDM2 acetylation by p300, at Lys182 and Lys185, recruits the deubiquitinase USP7, which deubiquitylates MDM2 and redirects the MDM2 activity towards its substrate, p53. d | SMAD7 acetylation by p300 at Lys64 and Lys70 prevents its ubiquitylation by SMAD ubiquitylation regulatory factor 1 (SMURF1) and subsequently its ubiquitylation-dependent proteasomal degradation. Conversely, TIP60-catalysed multisite acetylation of DNA (cytosine-5)-methyltransferase 1 (DNMT1) promotes the recruitment of E3 ubiquitin-protein ligase UHRF1, which targets DNMT1 for ubiquitin-proteasome-dependent degradation. e | Acetylation of histone H4 Lys5 (H4K5) and H4K8 promotes bromodomain-containing protein 4 (BRD4) binding through its first bromodomain (BD1). The second bromodomain (BD2) of BRD4 interacts with the transcription factor TWIST acetylated at Lys73 and Lys76. BRD4 then recruits the positive transcription elongation factor b (P-TEFb) complex, which phosphorylates the carboxy-terminal domain of RNA polymerase II (Pol II) and activates gene transcription. f | Viral infection triggers p300-dependent acetylation of the viral-DNA sensor ?-interferon-inducible protein 16 (IFI16) at Lys99 and Lys128, within its nuclear localization signal (NLS). Acetylation inhibits nuclear translocation, thereby preventing recognition of viral DNA in the nucleus by IFI16. KDAC, lysine deacetylase; TSA, trichostatin A. Помимо метаболических ферментов ацетилирование нарушает каталитические активности многих др. энзимов. Напр., киназы, регулирующие клеточный цикл CDK1, CDK2 и CDK5, ацетилируются по законсервированному лизину, который непосредственно участвует в связывании АТФ; соотв., ацетилирование предупреждает связывание АТФ и подавляет киназную активность 9,100.
Enhancement of catalytic activity
Автоацетилирование усиливает активность некоторых KATs, включая p300, PCAF и MOF (известен также как KAT8)101. Автоацетилирование p300 внутри её мотива активационной петли снижает аутоингибирование и активирует фермент 102 (Fig. 5b). Этот механизм напоминает активацию протеин киназ с помощью аутофосфорилирования в их регионах акивационной петли. Стимуляция макрофагов с помощью липосахаридов вызывает p300-обусловленное ацетилирование MAPK phosphatase 1 (MKP1) внутри её субстрат-связывающего домена 103. Ацетилирование увеличивает активность фосфатазы MKP1 и усиливает её взаимодействие с MAPK p38, ингибируя тем самым передачу сигналов MAPK. Напротив ацетилирование самого p38 в его ATP-связывающем кармане, повышает сродство p38 к АТФ и усиливает его киназную активность 104.
Alteration of enzyme-substrate specificity
Ацетилирование может переключать специфичность субстрата s E3 ubiquitin-protein лигазы MDM2 с autoubiquitylation на убиквитилирование её основного субстрата p53. MDM2 ацетилирование по Lys182 и Lys185 с помощью p300 позволяет ей соединяться с deubiquitinase USP7, которая сдвигает активность убиквитилирования MDM2 в направлении убиквитилирования p53, увеличивая тем самым также стабильность MDM2 (ref.105) (Fig. 5c). После генотоксических стрессов SIRT1 деацетилаза MDM2, тем самым способствует ей само-убиквитилированию и деградации; это уменьшает убиквитилирование p53, повышает стабильность p53 и способствует апоптозу.
Regulation of protein degradation
Lysine acetylation can regulate both proteasome-dependent and proteasome-independent protein degradation.
Ubiquitylation and proteasome-dependent degradation
Общераспространенный механизм зависимой от ацетилирования стабильности белка является предупреждением убиквитилирования белка и тем самым подавления зависимой от протеосом деградации (Supplementary Table 1). Это может быть обусловлено прямой конкуренцией между ацетилированием и убиквитинированием для модификации одного и того же лизинового остатка. Напр., p300-обеспечиваемое ацетилирование SMAD7 по Lys64 и Lys70 предупреждает из убиквитилирование с помощью SMAD ubiquitylation regulatory factor 1 (SMURF1), предупреждая тем самым деградацию SMAD7 (ref.106) (Fig. 5d). Ацетилирование может также способствовать деградации белка, усиливая убиквитинировение. PEPCK1 (известен также какPCK1) ацетилирование рекрутирует E3 ubiquitin-protein ligase UBR5, приводя PEPCK1 к убиквитилированию и деградации 107. Сходным образом, ацетилирование DNA (cytosine-5)-methyltransferase 1 (DNMT1) способствует её убиквитилированию с помощью E3 ubiquitin-protein лигазы UHRF1, тем самым целенаправленно направляя DNMT1 на протеосомную деградацию 108 (Fig. 5d). Ацетилирование и деацетилирование DNMT1 регулируется с помощью TIP60 и HDAC1, соотв.
Proteasome-independent degradation
Ацетилирование регулирует также стабильность белка посредством ubiquitin-proteasome-независимых механизмов. Ацетилирование pyruvate kinase PKM направляет её на деградацию посредством chaperone-обеспечиваемой аутофагии 109. Сходным образом, ацетилирование lactate dehydrogenase A по Lys5 подавляет её активность, способствуя её распознаванию с помощью шаперона heat shock cognate 71 kDa protein (HSPA8) и направляет её в лизосомы для деградации 110.
Protein-protein interactions
Acetylation of non-histone proteins can promote or inhibit protein-protein interactions.
Promoting protein-protein interactions
Зависимые от ацетилирования белковые взаимодействия изучали наиболее активно в контексте bromodomain, который взаимодействует с ацетилированными белками. Протеом человека включает 61 уникальный bromodomains у 46 белков, почти все они ядерные111. Bromodomain-acetyl-lysine взаимодействия наиболее охарактеризованы для bromodomain and extraterminal (BET) семейства белков, которое включает bromodomain-containing protein 2 (BRD2), BRD3, BRD4 и bromodomain testis-specific protein (BRDT). BET белки взаимодействуют с ацетилированными гистоновыми хвостами и регулируют экспрессию генов. Ацетилирование HIV-1 белка Tat устраняет его взаимодействие с HIV-1 trans-activation response (TAR) РНК; вместо этого, Tat ацетилирование усиливает его взаимодействие с bromodomain из PCAF и транскрипционную активность Tat. Т.о., bromodomain из PCAF конкурирует с TAR РНК за связывание Tat112.
Взаимодействие bromodomain характеризуется низким сродством и разношерстностью лигандов 113, это может предоставить высокую чувствительность и соединение с широким кругом лигандов. Сродство белковых взаимодействий может быть также увеличено за счет тандемного связывания bromodomains и за счет кооперативного связывания со многими ацетилированными белками. Напр., ацетилирование транскрипционного фактора. C-ets-1 (ETS1) по двум остаткам в его amino конце способствует его взаимодействию с BRD4 и высвобождению RNA polymerase II (Pol II) , которая замерла (paused) на промоторах генов мишеней vascular endothelial growth factor 114. Сходным образом ,ацетилирование транскрипционного регулятора TWIST (известен также как TWIST1) способствует его взаимодействию со вторым bromodomain из BRD4, тогда как первый bromodomain из BRD4 взаимодействует с ацетилированным гистоном H4, способствуя тем самым формированию комплекса, состоящего из TWIST, BRD4, Pol II и positive transcription elongation factor b (P-TEFb), на промоторе и энхансере гена, кодирующего WNT5A 115 (Fig. 5e). Bromodomains могут также действовать в комбинации с др. PTM-связывающими доменами, чтобы увеличивать сродство и специфичность белковых взаимодействий. Фосфорилирование cAMP-responsive element-binding protein (CREB) способствует его взаимодействию с KIX доменом из CBP, тогда как ацетилирование CREB способствует его взаимодействию с bromodomain из CBP, вызывая реципрокное зависимое от модификации связывания, которое, как полагают, усиливает рекрутирование CBP на промоторы генов 116.
Inhibiting protein-protein interactions
Nuclear factor-κB (NF-κB) inhibitor-α (IκBα) взаимодействует с и сохраняет субъединицу NF-κB p65 в цитоплазме, ингибируя тем самым его транскрипционную активность. Ацетилирование p65 нарушает его взаимодействие с IκBα, тогда как деацетилирование p65 с помощью HDAC3 способствует его экспорту в ядро и деградации 117. Ацетилирование лизиновых остатков в carboxy-terminal домене (CTD) из p53 разрушает его взаимодействия с некоторыми белками, содержащими кислые домены, включая белки SET, VPRBP (известен также как DCAF1), DAXX и PELP1 (ref.118). Кислые домены служат как 'converse readers', которые взаимодействуют с позитивно заряженными, не-ацетилированными лизиновыми остатками в p53 CTD, а их ацетилирование разрешает эти взаимодействия.
Regulation of DNA binding
Транскрипционный фактор heat shock factor 1 (HSF1) является ключевым регулятором генов, участвующим в укладке белков. Ацетилирование HSF1 подавляет его связывание с промотором HSP70 , а деацетилирование с помощью SIRT1 восстанавливает ДНК-связывающую способность 119. Ацетилирование CTD в p53 усиливает его взаимодействие с известными последовательностями ДНК 120, а катализируемое TIP60 ацетилирование p53 внутри его DNA-связывающего домена усиливает кго рекрутирование на промоторы способствующих апоптозу генов 121,122. Сходным образом, ацетилирование транскрипционного фактора GATA1 увеличивает его взаимодействие с ДНК 123.
Regulation of subcellular localization
Ацетилирование контролирует десятки не-гистоновых белков (Supplementary Table 1).
Enhancement of cytoplasmic localization
Ацетилирование с помощью p300 S phase kinase-associated protein 2 (SKP2) в его сигнале ядерной локализации (NLS) способствует его удержанию в цитоплазме и подавляет его деградацию 124. Истощение деацитилазы SIRT3 увеличивает удержание SKP2 в цитоплазме, где она усиливает клеточную миграцию посредством убиквитилирования и деградации E-cadherin. Сходным образом, вирусная инфекция запускает p300-зависимое ацетилирование NLS из viral-DNA sensor γ-interferon-inducible protein 16 (IFI16), способствуя тем самым его цитоплазматической локализации 125 (Fig. 5f). С помощью альтернативного механизма ацетилирование транскрипционного фактора Sry box 2 (SOX2) способствует его ассоциации с аппаратом экспорта в ядро, вызывая перемещение в цитоплазму и последующую деградацию с помощью ubiquitin-proteasome пути 126.
Enhancement of nuclear localization
CBP-катализируемое ацетилирование NLS hepatocyte nuclear factor 4 (HNF4) способствует его удержанию в ядре 127. Не-ацетилированный HNF4 экспортируется с цитоплазму посредством пути exportin 1. Ацетилирование регулятора транскрипции CtBP2 также необходимо для удержания его в ядре 128.
Extracellular secretion
HMG protein B1 (HMGB1) является преимущественно хроматин-связывающим белком. Однако, после активации моноцитов и макрофагов эти клетки секретируют HMGB1, чтобы вызывать воспаление. Этот процесс регулируется с помощью ацетилирования HMGB1, которое запускает его перемещение в цитозоль, концентрацию в секреторных лизосомах и последующую внеклеточную секрецию129.
Nicotinamide phosphoribosyltransferase (NAMPT) является скорость-ограничивающим энзимом при превращении nicotinamide в NAD+. Клетки млекопитающих экспрессируют две разные изоформы NAMPT, внутриклеточную и внеклеточную (iNAMPT и eNAMPT, соотв.). SIRT1-катализируемое деацетилирование NAMPT усиливает его активность и запускает его секрецию из адипоцитов; секретируемый eNAMPT способствует биосинтезу NAD+, активации sirtuin и активности нейронов в гипоталямусе 130.
Membrane localization
Деацетилаза SIRT1 регулирует ацетилирование и мембранную локализацию кардио-специфической voltage-gated sodium channel субъединицы-α (Nav1.5; также известна как SCN5A) 131. Дефицит кардио-специфического SIRT1 приводит к гиперацетилированию Nav1.5 и снижению уровней Nav1.5 на клеточной мембране кардиомиоцитов, приводя к аномалиям проведения импульсов в сердце и преждевременной гибели. Напротив, ацетилирование регулятора передачи сигналов RAS-MAPK CNK1 (известен также как CNKSR1) внутри его PH домена управляет его локализацией на клеточной мембране 52.
Translocation to mitochondria
При условии высокого содержания глюкозы ацетилирование сигнального адаптора 66 kDa SRC homology 2 domain-containing protein (p66Shc) способствует его фосфорилированию по Ser36 и его транслокации в митохондрии, где он увеличивает продукцию реактивных видов кислорода посредством генерации hydrogen peroxide 132. SIRT1 деацетилаза p66Shc Lys81, и knock-in мышей, экспрессирующих не способные к ацетилированию формы белка, защищают от оксидативных стрессов.
Crosstalk with other PTMs
Большинство белков млекопитающих модифицируются с помощью множественных PTMs, которые могут реципрокно влиять др. на др.; это часто означается как PTM общение. PTM общение может интегрировать разнообразные сигналы и значительно повышает их регуляторный потенциал. Поскольку amino group лизина может быть модифицирована по-разному, включая ацетилирование, а также acylations, methylation, ubiquitylation и ubiquitin-like модификаторы, то это может приводить к конкуренции PTM общения посредством разных PTMs, конкурирующих модификацию одного и того же остатка лизина133. Протеомное исследование установило, что большая фракция ацетилированных остатков лизина также подвергается целенаправленному действию др. PTMs, таких как ubiquitylation и succinylation134,135. Однако, само по себе появление разных PTMs на одном и том же лизине не указывает на конкурентное общение. Хотя протеомный анализ общения между ацетилированием и др. PTMs пока не осуществлен, мы обсуждаем специфические примеры acetylation crosstalk. Поскольку транскрипционные факторы и др. регуляторы транскрипции находятся среди наиболее активно изучаемых групп ацетилируемых не-гистоновых белков, не удивительно , что эта группа белков часто описывается как обладающая acetylation crosstalk с др. PTMs.
p53 является архетипическим примером общения PTM у не-гистоновых белков 37. Ацетилирование p53 по его CTD лизиновым остаткам непосредственно конкурирует с MDM2-катализируемым ubiquitylation по тому же самому остатку, подавляя тем самым ubiquitin-proteasome-зависимую деградацию 136. Соотв., MDM2 подавляет CBP-катализируемое и p300-катализируемое ацетилирование p53 (ref.137). Ацетилирование p53 может быть увеличено с помощью метилирования, катализируемого с помощью SET domain-containing protein 7 (SETD7; известен также как SET7/9), который способствует рекрутированию TIP60 и тем самым увеличивает ацетилирование по p53 Lys120 (refs121,138) (Fig. 6a). Независимо от этого механизма, SETD7 негативно регулирует SIRT1 и тем самым увеличивает ацетилирование p53 по Lys382 (ref.139).
 Fig. 6: Crosstalk between acetylation and other post-translational modifications. Fig. 6: Crosstalk between acetylation and other post-translational modifications.
a | Histone-lysine N-methyltransferase SETD7-catalysed methylation of p53 at Lys372 enhances its interaction with the acetyltransferase TIP60, which acetylates p53 at Lys120. p53 is also acetylated at Lys382 by CBP and p300 and deacetylated by sirtuin 1 (SIRT1). SETD7 inhibits SIRT1 and thereby prevents p53 deacetylation. b | Interaction of farnesoid X-activated receptor (FXR) with its agonist results in FXR sumoylation at Lys277 by the E3 SUMO ligase PIASγ. Sumoylated FXR associates with transcriptional co-repressors and with the NF-κB p65 subunit and inhibits transcription of pro-inflammatory genes. In nutrient-rich conditions, FXR is acetylated at Lys217, which prevents FXR sumoylation and leads to activation of pro-inflammatory genes. c | Myocyte-specific enhancer factor 2A (MEF2A) is phosphorylated by cyclin-dependent kinase 5 (CDK5) at Ser408, which promotes sumoylation of MEF2A at Lys403 by PIASx. Sumoylated MEF2A represses transcription and promotes dendritic maturation at neurons and synapse formation. Activation of calcium signalling causes dephosphorylation of MEF2A by the phosphatase calcineurin. Non-phosphorylated MEF2A is acetylated by CBP and/or p300. Acetylation and sumoylation target the same lysine residue (403) in MEF2A and thereby oppose each other. d | NF-?B p65 is phosphorylated at Ser276 and Ser536 by MAPK and by I?B kinase 1 (IKK1) and IKK2, respectively. Phosphorylation promotes acetylation of p65 and transcription activation. e | p65 Lys310 deacetylation by SIRT1 is necessary for its binding to SETD7, which methylates p65 at Lys314 and Lys315. Methylation of p65 is proposed to promote its ubiquitylation by an unknown ligase and its subsequent degradation by the proteasome. Acetylation of Lys310 by p300 neutralizes its positive charge and thus inhibits its interaction with SETD7 and p65 methylation. f | Forkhead box O1 (FOXO1) is acetylated and deacetylated by CBP and SIRT2, respectively, at three different residues. Acetylation of FOXO1 attenuates its transcriptional activity and promotes its phosphorylation by AKT1 at Ser253. Phosphorylated FOXO1 interacts with 14-3-3 proteins, which retains FOXO1 in the cytoplasm.
Ядерный рецептор farnesoid X-activated receptor (FXR; известен также как NR1H4) sumoylated с помощью E3 SUMO лигазы PIASγ (также известна как PIAS4), которая приводит к взаимодействию FXR с NF-κB p65 субъединицей и к репрессии транскрипции способствующих воспалению генов (Fig. 6b). Ацетилирование FXR по Lys217 блокирует его взаимодействие с PIASγ и активирует гены., способствующие воспалению140.
Некоторые транскрипционные факторы, такие как HSF1, HIC1 и члены семейства myocyte-specific enhancer factor 2 (MEF2) sumoylated зависимым от фосфорилирования способом141-144. Во всех случаях фосфорилирование phosphorylation-зависимого SUMO мотива ψKX(D/E)XXSP145, способствует сумоилированию лизина внутри последовательности мотива. Напротив дефосфорилирование приводит к снижению сумоилирования и увеличению ацетилирования того же самого лизина. HIC1 и MEF2 ацетилируются с помощью CBP и p300, а деацетилируются с помощью SIRT1 (refs143,144). MEF2A и MEF2D фосфорилируются с помощью CDK5 и дефосфорилируются с помощью calcineurin142. Зависимое от фосфорилирования сумоилирование MEF2A подавляет его транскрипционную активность и способствует созреванию дендритов на нейронах и образованию синапсов146 (Fig. 6c). Передача сигналов кальция способствует дефосфорилированию и десумоилированию и помогает ацетилированию MEF2A, тем самым устанавливается реципрокная регуляция активности MEF2A с помощью сумоилирования или ацетилирования.
Фосфорилирование NF-κB p65 субъединицы по Ser276 и Ser536 с помощью MAPK и IκB kinase (IKK), соотв., способствует её последующему ацетилированию с помощью p300 по Lys310 и увеличивает её транскрипционную активность147 (Fig. 6d). Если Lys310 не ацетилирован и поэтому заряжен положительно, то p65 взаимодействует c methyltransferase SETD7 (ref.148) (Fig. 6e). ацетилирование p65 по Lys310 удерживает SETD7 от связывания и метилирования p65. SIRT1 деацетилирование Lys310, тем самым увеличивает рекрутирование SETD7 и метилирование p65, это приводит к зависимой от протеосом деградации p65.
Транскрипционный фактор forkhead box O (FOXO) участвует в разных биологических процессах, включая метаболизм, пролиферацию клеток и стрессовые реакции. Фосфорилирование FOXO белков способствует их взаимодействию с белками 14-3-3 и их удержанию в цитоплазме. В ответ на внеклеточные сигналы FOXO1 транслоцируется в ядро, ult он ацетилируется и деацетилируется с помощью CBP и SIRT2, соотв. Ацетилирование FOXO1 по Lys245, Lys248 и Lys265 ослабляет его связывание с ДНК и увеличивает его фосфорилирование по er256 с помощью AKT149(Fig. 6f). Фосфорилированный FOXO1 экспортируется из ядра и удерживается в цитоплазме благодаря взаимодействию с 14-3-3 белками.
Open questions and conclusion
Acetylation regulation and function
Although acetylation targets multiple proteins that function in diverse processes, little is known about whether acetylation coordinately regulates different proteins involved in specific biological processes, such as cell signalling and autophagy. This is because most studies investigate the function of acetylation in regulating only one protein. A more integrated analysis of acetylation in specific biological processes could greatly aid in the understanding of the order in which acetylation targets different proteins in given biological processes and pathways.
For the majority of acetylation sites on non-histone proteins, the responsible enzymes and bromodomain (reader) interactions are unknown. Elucidating enzyme-substrate relationships, distinguishing between enzymatic and non-enzymatic acetylation mechanisms and identifying ligands of bromodomain proteins will be important for expanding the functional and mechanistic understanding of acetylation. In this regard, several mass spectrometry-based studies have revealed a multitude of non-histone proteins targeted by various deacetylases, including SIRT1, SIRT2, SIRT3, SIRT6 and HDAC6 (refs11,12,13). Furthermore, a global analysis of commonly used KDAC inhibitors has defined their specificities in vivo at thousands of acetylation sites12. The use of genetic knockouts and selective CBP and p300 inhibitors26 has recently provided a comprehensive map of CBP-regulated and/or p300-regulated acetylation sites and their turnover rates14. CBP and p300 acetylate up to one-third of the nuclear acetylome, and many of the acetylated proteins show rapid deacetylation kinetics, indicating the existence of a tight equilibrium between the activities of CBP and p300 and the activities of deacetylases. We anticipate many more similar proteomic analyses in the future, which, combined with focused functional analyses, should help decode the acetylome.
The stoichiometry of acetylation
A few studies have analysed proteome-wide stoichiometry of acetylation in eukaryotes, and estimates of acetylation stoichiometry vary substantially when different methods are used for determining stoichiometry. Using an in vitro partial chemical acetylation approach, most of the acetylations in yeast17 and mouse tissues98 were shown to occur at a low stoichiometry (median 0.02-0.05%). Similarly, the stoichiometry of acetylation remains very low (<1%) in human HeLa cells, even when they are treated with aspirin, which causes widespread and greatly increased acetylation in cells150. Stoichiometry estimations using fully chemically acetylated peptides were substantially higher151,152, but these estimates have not been validated independently, and further work is required to resolve the question of acetylation stoichiometry.
It should be clarified that low stoichiometry does not indicate lack of functionality. For example, low stoichiometry may be observed if regulation by acetylation is restricted to subsets of proteins residing at a specific location and/or occurs for a brief period of time in response to a specific cue. For example, acetylation of transcription factors may be restricted to gene enhancers and promoters and may be rapidly followed by deacetylation. This could enable tight control of gene expression. Similarly, most studies are conducted using asynchronous cell populations; therefore, cell cycle-specific acetylation events may seem to occur at a low stoichiometry, even if the targeted protein is fully acetylated at a specific time in the cell cycle. Nevertheless, stoichiometry is useful in interpreting the implications of acetylation, and mechanistic models should account for the stoichiometry of modification. For example, if acetylation results in enzyme inactivation, the degree of inactivation should be reflected by the stoichiometry of the modification.
Distinguishing diverse acylations
An increasing number of acylations have been found to target lysine residues, including propionylation, butyrylation, succinylation, crotonylation and glutarylation7. Identification of their regulatory functions and distinguishing them from acetylation remains a challenge. This task is complicated because many components of the acetylation apparatus, including KATs, KDACs and bromodomain-containing proteins, are also implicated in other (non-acetyl) acylations. For example, p300 can catalyse acetylation, propionylation, butyrylation and crotonylation, but the rate of catalysis decreases with increasing length of the acyl-CoA chain153, and crotonylation is catalysed at a rate that is 50 times slower than that of acetylation. Furthermore, some of the canonical acetyl-lysine reader bromodomain-containing proteins can also recognize other lysine acylations, such as propionylation, butyrylation and crotonylation, albeit with varying levels of selectivity154. In addition to the bromodomain, the YEATS domain can interact with crotonylated histone peptides155 and double plant homeodomain finger domains interact with diverse acyl-lysine ligands, with their strongest affinity being for crotonylated lysine156. Thus, dedicated readers of other acylations may exist. Defining the relative abundance of various acylations and identifying their regulating enzymes will be crucial for understanding their overlapping and unique regulatory functions.
|
 Fig. 1: Regulation of reversible lysine acetylation.
Fig. 1: Regulation of reversible lysine acetylation.  Fig. 2: Biological processes that are regulated by non-histone protein acetylation (I).
Fig. 2: Biological processes that are regulated by non-histone protein acetylation (I).  Fig. 3: Biological processes that are regulated by non-histone protein acetylation (II).
Fig. 3: Biological processes that are regulated by non-histone protein acetylation (II).  Fig. 4: Regulation of autophagy by non-histone protein acetylation.
Fig. 4: Regulation of autophagy by non-histone protein acetylation.  Fig. 5: Functional mechanisms of acetylation.
Fig. 5: Functional mechanisms of acetylation.  Fig. 6: Crosstalk between acetylation and other post-translational modifications.
Fig. 6: Crosstalk between acetylation and other post-translational modifications.