Посещений: 
АМИЛОИДНЫЕ СТРУКТУРЫ
Структура, функция и нарушения при болезнях
A new era for understanding amyloid structures and disease • Matthew G. Iadanza,
• Matthew P. Jackson,
• Eric W. Hewitt, et al.
 Nature Reviews Molecular Cell Biology volume 19, pages755-773 (2018)
| |
|
В последние два года определена структура фибрилл почти с атомной точностью, благодаря разработке методов по созданию фибрилл in vitro или очистке их от материала ex vivo, а также благодаря прорыву в крио-электронной микроскопии (cryo-EM) и solid-state NMR spectroscopy (ssNMR). Эти методы выявили структуру амилоидных фибрилл при некоторых болезнях человека - amyloid-β (Aβ) 40/42 и tau ассоциированных с AD 2,3 и α-synuclein, ассоциированного с PD 4. Хотя, как ожидалось, фибриллы адаптируются к канонической cross-β структуре амилоида (see below), эти фибриллы более сложные и тщательно разработанные, чем полагалось ранее, подтверждая, что широкое разнообразие существующих амилоидных структур, напоминает вообще-то разные организации α-спиралей и β-нитей в глобулярных белках (идентифицировано 1375 разных складок в глобулярных белках 5). Такое разнообразие может объяснить, почему амилоидные болезни так трудно понять и лечить, с разными клиническими проявлениями, даже когда агрегирует один и тот же виновный белок.
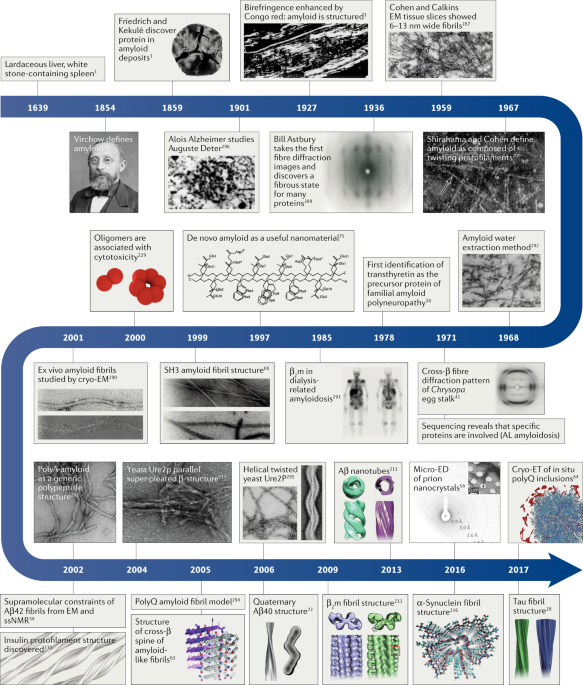 Fig. 1: Progression of amyloid structure research over close to 400 years that has culminated in the first atomic structures of amyloid fibrils.
Fig. 1: Progression of amyloid structure research over close to 400 years that has culminated in the first atomic structures of amyloid fibrils.
The timeline displays the history of key discoveries in the amyloid field from the initial identification of amyloid to discoveries that led to the first structures of amyloid fibrils associated with disease in all-atom detail288-296. Aβ amyloid-β; β2m, β2-microglobulin; cryo-EM, cryo-electron microscopy; cryo-ET, cryo-electron tomography; EM, electron microscopy; micro-ED, micro-electron diffraction; polyA, poly-alanine; polyQ, poly-glutamine; ssNMR, solid-state NMR spectroscopy. Images reproduced with permission from ref.288, Cold Spring Harbor Laboratory Press; ref.289,290, Elsevier; ref.291, American Society for Clinical Investigation; refs292,294, John Wiley and Sons; ref.293, American Chemical Society; refs295,296, Springer Nature Limited.
Приблизительно 50 разных белков или пептидов, как известно, собираются в амилоидные фибриллы, ассоциированные с болезнями людей6 (Table 1). Эти предшественники, каждый с разными первичными последовательностями, само-собирается в амилоидные фибриллы и накапливается в виде внеклеточных бляшек и внутриклеточных включений, ассоциированных с болезнями, которые особенно превалируют при старении7,8. Появляются доказательства, показывающие, что внутриклеточные включения амилоида могут вмешиваться в клеточную физиологию, напр., путем нарушения транспорта белков и РНК9 и путем секвестрации шаперонов и протеосом10. Бляшки разных фенотипических форм при одной болезни могут также накапливать разные белки11 и не-белковые компоненты12,13 в разной степени, потенциально предоставляя сигналы для разных фенотипов , наблюдаемых при амилоидной болезни.
Table 1 Protein precursors associated with amyloid disease
Амилоидные фибриллы обладают общей в своей основе архитектурой, в которой β-нити внутри каждой профиламенты располагаются перпендикулярно длинной оси фибриллы, наз. cross-β амилоидные складки (Fig. 2) отмечаемые характерными ~4.7-4.8Å повторами, идущими вниз вдоль оси фибриллы. Эта структура обладает силой стали 14,15 и на базе этой простоты и легкости формирования, было предположено, что это потенциально примордиальная структура жизни 16. Амилоид может быть или функциональным (у бактерий, грибов и высших эукариот) 17-26 или ассоциированным с болезнью (Table 1), оба типа фибрилл обладают общими каноническими cross-β архитектурами, уникальными для амилоидных складок.
 Fig. 2: Schematic of amyloid formation. Fig. 2: Schematic of amyloid formation.
Native proteins are in dynamic equilibrium with their less-structured, partially folded and/or unfolded states. One (or possibly several) of these states initiates amyloid fibril formation by assembling into oligomeric species. The precursor of aggregation (native, partially folded or unfolded) may differ for different protein sequences. Oligomeric species can then assemble further to form higher-order oligomers, one or more of which can form a fibril nucleus, which, by rapidly recruiting other monomers, can nucleate assembly into amyloid fibrils. This process occurs in the lag time (nucleation phase) of assembly. As fibrils grow, they can fragment, yielding more fibril ends that are capable of elongation by the addition of new aggregation-prone species140,144,145. This elongation results in an exponential growth of fibrillar material (blue line) until nearly all free monomer is converted into a fibrillar form. Fibrils are dynamic and can release oligomers that may or may not be toxic177. Fibrils can also associate further with each other, with other proteins and with non-proteinaceous factors188 (not shown here) to form the amyloid plaques and intracellular inclusions characteristic of amyloid disease. Note that any and/or all of these steps are potential points for drug intervention.
Fibril formation and disease
Наше понимание того, как амилоидные фибриллы связаны с соотв. болезнью существенно выросло в последнее время.
A timeline of amyloid discovery
Впервые описанные в 1639 как амилоидная дегенерация печени и 'white stone'-содержащая селезенка1, термин амилоид (происходит от amylum иamylon, лат. и греческие слова для крахмала, соотв. ), придуман ~200 лет спустя Вирховым на базе его открытия, что эти отложения окрашиваются позитивно iodine1,33. Спустя 5 лет после неправильной идентификации как полисахарида, Friedrich and Kekule показали, что амилоид преимущественно белковый1, с углеводами, в особенности с glycosaminoglycans, повсеместно ассоциирован с этими отложениями34. Было установлено, что отложения амилоидов обнаруживают уникальные свойства окрашивания в дву-преломляющий красно-зеленый в присутствии Congo red35, указывая на о, что амилоид образуется высоко организованными белковыми субъединицами. Идентификация амилоида A36 (в 1971), антител к легким цепям37 (в 1971) и transthyretin (TTR)38 (в 1978) в качестве основного белкового компонента фибрилл в бляшках показало, что индивидуальный белковый предшественник может быть ответственен за амилоидную болезнь. Между тем, Bill Astbury's пионер исследований X-ray дифракции волокон показал, что амилоид-подобные фибриллы могут быть созданы из обычных глобулярных, растворимых белков с помощью их денатурации in vitro39, открыл дверь к синтетическим материалам, надеясь заменить шерсть40. В 1968, Sandy Geddes, Bill Aiken с колл. из University of Leeds, UK, использовали X-ray дифракцию волокон, чтобы показать, что яйцевая ножка мух златоглазок обладает отличительными ~4.7Å повторяющимися структурами вдоль оси фибрилл, названные cross-β41. Эта основополагающая работа выявила структурный отпечаток амилоида и показала, что амилоид не просто ассоциирован с болезнью (Table 1), но может также выполнять физиологические функции в организме42-47.
Далее с мучениями получена информация о фибриллах, формируемых из коротких пептидов с использованием X-ray дифракции волокон 48, X-ray кристаллографии 49-51, микро-электронной дифракции (micro-ED) 52 микрокристаллов 53-56, ssNMR 57-66, cryo-EM 27,28,67-72 и др. методов (Box 1). Способность собираться в фибриллы in vitro из синетических пептидов 73-75 и естественно возникающих амилоидогенных белков и пептидов 76-78 или из белков, не связанных с функциональными амилоидами или болезнями 68,79, способствовали развитию структурной техники. Однако, главной ступенью стала разрешающая сила cryo-EM 80 (Box 2). Наконец, совершен прорыв в этой области, выявивший структуры, ставшие прекрасными и замысловатыми как и их глобулярные аналоги 27,28. Эти структуры намекнули нам впервые, как индивидуальные белковые субъединицы формируют cross-β структуры и в комбинации с данными по сверх-разрешающей микроскопии 81,82, cryo-electron томографии (cryo-ET) 13,83,84и ssNMR 85, мы вступили в новую эру интегративной структурной биологии, которая позволила нам 'увидеть' структуру амилоидных фибрилл во многих масштабах, из индивидуальных субъединиц, как они формируют фибриллы и до клеточных последствий отложения фибрилл в бляшках и клубочках.
Box 1 Techniques that inform on amyloid structure
Electron microscopy (EM) is by no means the only technique that has driven the understanding of amyloid fibril structure in recent years. A variety of biophysical techniques have been utilized to make advances in understanding fibril structure.
AFM has been used to examine fibrils adsorbed onto a surface and can report on length distribution, fibril height, width and crossover length. AFM has also been used to track the dynamics of fibrils275 and oligomers276 over time.
Solid-state NMR spectroscopy
ssNMR (also referred to as magic angle spinning (MAS) NMR) can be used to determine dihedral angles and inter-atom distances in the subunit of fibrils. These restraints have been used to build atomic models of fibrils 65,66,216,251,277,278 as well as models of the subunit structure, which were then fit into lower-resolution EM models 64,67.
Fluorescent dyes
Fluorescent dyes such as thioflavin T and Congo red have a long history of use identifying amyloid fibrils 35. More recently, polythiophene dyes have also been shown to have distinct emission wavelengths when bound to different fibril morphologies and can be used to differentiate fibril types 279.
Super-resolution microscopy
Super-resolution microscopy with labelled proteins has been used for high-resolution light microscopy imaging 280 and to observe the addition of monomers to fibril ends, yielding information about fibril polarity and growth 81.
Single-molecule Förster resonance energy transfer
FRET experiments have also been used to track fibril growth and characterize amyloid oligomers 172.
X-ray fibre diffraction
One of the earliest methods used to identify the cross-? motif 41, it is still used, especially as an orthogonal validation technique, as simulated fibre diffraction patterns from a model can be compared with experimental data 281.
X-ray crystallography and micro-electron diffraction
Two methods that have been especially useful to determine the structures of small amyloidogenic peptides; although these peptides usually do not crystallize as fibrils, they have been used to predict the interactions present in the fibrillar form 51,55, to link structure to toxicity54 and to design inhibitors of fibril formation 272.
Spectroscopy
Methods such as circular dichroism (CD) and Fourier transform infrared (FTIR) can be used to characterize the secondary structure of fibril-forming proteins over time, to track the formation of oligomers and/or fibrils and, in the case of FTIR, to differentiate amyloid from non-amyloid β-sheets 201.
Mass spectrometry
A variety of mass spectrometry (MS) methods have been used to characterize fibrils, including interrogating exposed surfaces via N-ethylmaleimide labelling coupled with electrospray ionization MS (ESI-MS)282 and hydrogen-deuterium exchange (HDX) 283.
Electron paramagnetic resonance
EPR spectroscopy has been used to identify residues involved in the cross-β core of amyloid 284 and to characterize amyloid precursors, oligomers and membrane interactions 285.
Box 2 Advances in electron microscopy of amyloid fibrils
Although the use of electron microscopy to examine amyloid fibril structure has a long history 209,286,287, determination of atomic resolution structures became a possibility only with the advent of cryo-electron microscopy (cryo-EM). Cryo-EM led to observation of several fibril structures at intermediate resolutions 68,71,72,210,211,229. Although this gave information about gross fibril morphology, it could not be used to build atomic models. Only in the past year have cryo-EM structures reached the resolution at which atomic detail can be resolved 27,28. This advance in resolution has been driven by technological advances in microscope and electron detection equipment and improvements in image processing software80. The increase in achievable resolution of cryo-EM reconstructions of fibrils is illustrated with structures of fibrils formed from SH3 domains 68, prion protein (PrP)210, amyloid-β (Aβ) 1-40 formed in vitro71 and ex vivo tau28 (see the figure, parts a-d).

Part a adapted with permission from ref.68, Elsevier. Part badapted with permission from ref.210, Elsevier. Part c adapted with permission from ref.71 copyright (2008) National Academy of Sciences USA. Part d adapted from ref.28, Springer Nature Limited.
|
Diseases associated with amyloid fibril deposition
Alois Alzheimer впервые описал AD у своего пациента, Auguste Deter,в 1901 (refs86,87) (Fig. 1). Эта работа, включавшая посмертные наблюдения бляшек, окрашенных Congo-red в головном мозге, внесла AD в растущий список амилоидозов. Сегодня идентифицировано более 50 болезней, вызываемых амилоидогенными белками, которые вызывают даже большее количество болезней в зависимости от предшественника и места отложения амилоида88,89,90 (Table 1). Эти болезни включают нейродегенеративные нарушения, такие как AD (связанную с агрегацией Aβ91 и/или tau2), Creutzfeldt-Jakob disease (CJD; prion protein (PrP))92, Huntington disease (huntingtin93), PD (α-synuclein94) и amyotrophic lateral sclerosis (ALS; superoxide dismutase (SOD), TAR DNA-binding protein 43 (TDP43) и др. 95). Амилоидные нарушения затрагивают разные ткани: type II diabetes вовлекает в агрегацию amylin (известен также как islet amyloid polypeptide (IAPP)96) в островках Langerhans; при AL amyloidosis, антитела к легкой цепи откладываются в почках и сердце97; и при dialysis-related amyloidosis, β2-microglobulin (β2m) формирует амилоидные бляшки в костно-суставных тканях98. Существуют взаимодействия между амилоидными болезнями. Напр., пациенты с type II диабетом имеют более высокий риск возникновения AD99, а не-амилоидный компонент (NAC) α-synuclein обнаружен в бляшках пациентов с AD100.
Что же инициирует начало амилоидной болезни, остается неясным. Многие болезни оказались ассоциированы со старением и используют агрегацию белков дикого типа, включая и большинство типов PD и AD8. Из-за старения популяции человека, подсчитаны экономические затраты в Европе только от AD и PD, которые вырастут до €357 billion к 2050 (ref.101), сравнимо с внутренним валовым продуктом (GDP) Австрии в 2016. Мутации в амилоидогенных предшественниках, такие как α-synuclein варианты A30P или A53T при PD102, варианты Aβ E22Δ или E22K при AD103 или D76N при β2m-associated амилоидозе104, могут вызывать болезни (Table 1). Др. нарушения вызываются за счет экспансии амилоидогенных последовательностей, такие как болезни тринуклеотидных повторов, которые приводят к ассоциированной с poly-glutamine (polyQ) атаксии, такой как болезнь Гентингтона93,105, poly-alanine (polyA) экспансиям при ассоциированной с polyadenylate-binding protein 2 (PABPN1) (ref.106) oculopharyngeal мышечной дистрофией107 и экспансиям дипептидов, таких как poly-GlyAla при C9orf72, наиболее распространенной генетической форме ALS и frontotemporal деменции108,109. Возраст начала болезни у людей варьирует, поскольку критический порог количества повторов предопределяет их патогенность, а скорость начала болезни коррелирует с количеством повторов105,110.
Модификации первичной последовательности предшественников (напр., укорочения за счет действия протеаз или hyperphosphorylation) могут усиливать или супрессировать амилоидогенность. Укорочение белка предшественника может снижать амилоидогенность, как показывает низкий риск AD у пациентов с повышенным соотношением Aβ40 к Aβ42 (ref.111). Напротив протеолиз apolipoprotein A1 (APOA1) повышает риск амилоидоза при системном амилоидозе 112 (Table 1), а укорочение 6 N-терминальных аминокислот β 2m обнаруживается при связанном с диализом амилоидозом 113,114 (Table 1). Постое увеличение концентрации мономерного предшественника за счет генной дупликации также может вызывать болезнь, при генной дупликации, трипликации и даже квадрупликации, ассоциированной с ранним началом PD 94,115, и у пациентов с трисомией 21, которая содержит ген, кодирующий предшественник амилоида (APP; из которого происходят Aβ40/42), обнаруживают высокий риск AD 116. Невозможность гемодиализа для устранения дикого типа β 2m из сыворотки пациентов с почечной недостаточностью вызывает ~50-кратное увеличение концентрации β 2m в сыворотке 117. Отделение жидкой фазы 118 также может приводить к локальному увеличению концентрации, вызывающему образование фибрилл 119. Прирожденно нарушенные белки обладают высокой склонностью в отношении слияния (coacervation), которая может объяснить, почему многие являются амилоидогенными, а cross-β полимеризация, как полагают, является движущей силой в образовании жидких капель in vivo120, которые могут приводить к связанному с диализом амилоидозу у пациентов, подвергавшихся длительной (более 10 лет) почечной заместительной терапии 117. Наконец, амилоидогенность может модулироваться с помощью малых молекул, таких как метаболиты или ионы металлов, с помощью мембран и glycosaminoglycans и с помощью статуса самой клетки (уровни шаперонов, скорость синтеза белка и т.д.), которые влияют на величину агрегации белков и способность клеток реагировать на образование потенциально токсических видов 9,121.
Prion aggregation and disease
Способность амилоида затевать свою собственную сборку, заставляя болезнь распространяться между клетками, в некоторых случаях, между организмами, является характерной особенностью прионовых болезней122,123. У млекопитающих PrP вызывают семейство болезней, известных как transmissible spongiform encephalopathies92. Растворимый α-спиральный белок, PrPC, может конформационно преобразовываться в инфекционную изоформу, PrPSc, которая имеет структуру β-пластинки (процесс, который пока не понятен в атомных деталях). Как инфекционный агент PrPSc, как полагают, лишен нуклеиновых кислот 124, хотя это оспаривается некоторыми исследованиями125. Существует множество прионовых болезней у людей, такие как CJD, familial fatal insomnia, Gerstmann-Sträussler-Scheinker болезнь и Kuru, это приводит к тому, что разные болезни характеризуются разными возрастами начала126. Bovine spongiform encephalopathy (BSE) у крупного рогатого скота, хроническая wasting disease у оленей и лосей и почесуха у мелкого рогатого скота sheep127 идентифицированы в качестве transmissible spongiform encephalopathies. BSE может пересекать видовые барьеры к человеку, приводя к варианту CJD (vCJD)123,124.
Хотя прионовые болезни преимущественно нейрологические, при vCJD, PrP Sc может обнаруживаться в разных типах тканей 128. Prion-подобное распространение болезни в головном мозге не является уникальным для PrP; оно наблюдается также при PD 129 и AD 130, подтверждая, что существуют общераспространенные механизмы, с помощью которых агрегация белка распространяется и вызывает гибель клеток. У дрожжей prion-подобное распространение агрегатов белков, таких, которые формируются белками Ure2p и Sup35, может быть благоприятным, наделяющим метаболическими преимуществами дочерние клетки при определенном селективном давлении 131. В самом деле, большое количество prion-подобных доменов идентифицированных у дрожжей 132 подтверждает, что такие селективные преимущества обычно используются, чтобы повысить приспособленность. Несмотря на способность prion-подобного рассеяния амилоидных фибрилл, в др. случаях не прионопатий, нет доказательств распространения амилоидных болезней между млекопитающими. Имеются, однако, некоторые доказательства передачи амилоидных болезней в экспериментальных условиях 133,134. Поэтому следует рассматривать амилоидогенные белки и пептиды как инфекционные агенты.
Mechanisms of fibril and plaque formation
Амилоид образуется за счет агрегации мономерных белков предшественников в фибриллы с помощью широко распространенных механизмов роста нуклеации135,136 (Fig. 2). Мономерные предшественники могут быть развернуты (от природы беспорядочны) или частично уложены (формируя временные разворачивания нативного белка или временные образования складок в развернутом белке) (Table 1). В редких случаях агрегация может быть инициирована самим нативным белком137. Первой ступенью сборки фибрилл является образование олигомеров, которые являются динамичными, временными, гетерогенными с неизвестной и возможно варьирующей структурой136,138,139. Олигомеры могут затем далее ассоциировать, чтобы создать высокого порядка структуры, которые или важными предшественниками амилоидных фибрилл (on-pathway) или тупиковыми (dead-end) ансамблями, которые не дают фибрилл (off-pathway)136. Хотя олигомеры off-pathway не формируют фибрилл, они могут всё ещё оставаться цитотоксическими и иметь отношение к болезни. На определенной стадии во время олигомеризации формируется критическое ядро, которое может быть определено как кинетически очень нестабильное (highest energy) образование, формируемое перед быстрой полимеризацией в амилоидные фибриллы. Вероятность образования такого ядра предопределяется (частично) длиной временной выдержки (lag time) сборки амилоида и возможно от возраста начала болезни (Fig. 2).
В определенный момент во время самосборки, каждый предшественник подвергается структурной трансформации, чтобы сформировать богатую β-нитями вторичную структуру, в независимости от инициальной укладки (Table 1). Как только сформируются фибриллы с cross-β структурами, они могут фрагментироваться, продуцировать новые концы фибрилл, которые смогут рекрутировать мономеры, уменьшая длину lag периода и давая в результате экспоненциальный рост фибрилл140 (фаза элонгации показана на Fig. 2). Др. процессы, такие как вторичная нуклеация, при которой формирование олигомеров катализируется на поверхности предсуществующих фибрилл, также увеличивает скорость формирования фибрилл136,141. Понимание каждого из этих процессов, того, как они комбинируются, чтобы предопределять скорость сборки фибрилл (а значит и груз фибрилл), является жизненно важным для выяснения механизма формирования фибрилл.
Разные модели были инспирированы работой по серповидно-клеточной болезни Eaton, Oosawa and colleagues 142,143, включая цифровой 140,144 и аналитический подходы 145, это выявило индивидуальные ступени формирования амилоида, их алгоритмы теперь доступны online 140. Кинетика сборки обычно измеряется in vitro, используя окрашивание thioflavin T (ThT), который соединяется с амилоидными фибриллами, генерируя усиленный сигнал флуоресценции 145,146. Используя этот подход, можно выяснить эффект синтетических мембран 147, состояний растворимости 148, молекулярных шаперонов 149, малых молекул 150 и первичной последовательности 141 на скорость агрегации. Наиболее важна способность определять роль разных дополнений на сборку, открывающих возможности контроля агрегации с помощью синергичного воздействия реагентов, которые целенаправленно воздействуют на разные ступени формирования амилоида.
Cytotoxicity and implications for disease
Идентификация токсических видов, образующихся во время формирования амилоида, и того как они вызывают дисфункцию и гибель клеток остается трудным и приоритетным (Fig. 3). Остается множество вопросов, включая, как инициируется агрегация, как агрегаты распознаются шаперонами и др. клеточными компонентами, как и почему агрегаты насыщены клеточными шаперонами и сетями деградации 151-153. Модели цитотоксичности, связанной с амилоидом, включают подавление протеосомной деградации 10,151, нарушения аутофагии 154, нарушения функции митохондрий 155, продукцию reactive oxygen species (ROS) 156, секвестрирование др. белков 121 и разрушение мембран, включая у митохондрий, эндоплазматического ретикулума (ER), лизосом и плазматической мембраны 84,121,157,158 (Fig. 3).
 Fig. 3: Amyloid aggregates can cause cell disruption by a variety of mechanisms. Fig. 3: Amyloid aggregates can cause cell disruption by a variety of mechanisms.
Amyloid aggregates can deposit extracellularly or intracellularly, and both can give rise to cellular dysfunction and disease. The aggregates that form from different protein precursors may have different cellular effects, but deconvoluting the toxic mechanism of an individual protein and its ensemble of misfolded or aggregated states (misfolded monomers, oligomers, fibrils or plaques and intracellular inclusions) remains a challenge. Plaques and inclusions sequester a range of other molecules that include glycosaminoglycans12,188, lipids158,297 and metal ions237, which stabilize their assembly. Plaques are physically large and can disrupt organ function by their sheer size. Small fibrils can also be taken up into a cell via endocytosis, but this can be perturbed by preventing binding to certain cell surface receptors such as lymphocyte activation gene 3 protein267. Within endosomes and lysosomes, fibrils can release toxic oligomers and can disrupt the endosomal and lysosomal function and dynamics because fibrils are highly resilient to degradation190,298. Fibrils can also access the intracellular space following release from cells, thus spreading disease by uptake into adjacent cells. Other effects of aggregates within cells include disruption of endoplasmic reticulum (ER) dynamics84, release of reactive oxygen species (ROS)156 from mitochondria and the induction of stress responses121 (not shown here).
Тяжесть когнитивных нарушений у пациентов с AD не коррелирует с формированием бляшек159, указывая, что пре-амилоидные агрегаты вызывают болезнь138,139,160-164. В соответствии с этим многочисленные эксперименты in vitro продемонстрировали цитотоксичность типов олигомеров, включая их способность разрушать мембраны165-167. Олигомеры образуются из белков, которые не обычно ассоциируют с болезнью, могут также разрушать мембраны и могут быть цитотоксичными, подтверждая, что олигомеры являются причинными агентами дисфункций клеток, ассоциированных с амилоидом162,166-168. Олигомеры образуются из предшественников, связанных с болезнью, которые, как было установлено, нарушают память и долговременную potentiation, снова подтверждая их роль в болезни169,170. Однако, не все олигомеры токсичны171,172. Известно, что токсичные олигомеры, выставляющие свои гидрофобные поверхности, не обнаруживаются в безвредных предшественниках или не-токсичных аналогах173, это согласуется с их способностью разрушать мембраны и изливать цитоплазму во внеклеточное пространство, вызывая истечение кальция и клеточную гибель164,174. Эти молекулярные основы цитотоксичности олигомеров остаются неясными до тех пор, пока не будет установлена высокого разрешения структура токсичных олигомеров. Однако, поскольку олигомеры нестабильны, динамичны и гетерогенны в отношении своей массы и структуры175,176, то определение из структурно-функциональных взаимоотношений затруднено.
Недавние эксперименты подстегнули дебаты, как и каким образом амилоидные фибриллы вносят вклад в болезни177. Используя cryo-ET, амилоидные фибриллы и, в частности, их концы, как было установлено, вызывают нарушения искусственных липидных мембран (включая разрывы, образование пузырьков и формирование защемленных острых участков с высоким изгибом мембран)178 и это вызывает ущемление клеточных мембран84, подтверждая роль фибрилл в болезни. Cryo-ET также подтвердила, что внутриклеточные включения, образуемые exon-1-encoded huntingtin, который содержит 97 glutamines, располагается на грубом ER, нарушая функцию и динамику ER84. Интересно, что внеклеточные ансамбли Aβ42 фибрилл в культуре клеток принимают разные формы, включая сеточки, наполовину параллельные пучки и 'звездочки' исходящие из центральной точки13,83. Эти внеклеточные фибриллы также взаимодействуют с мембранами, секвестрацией липидов и формированием трубчатых включений на клеточной поверхности83. Внутриклеточные включения формируются с помощью ATG-независимой трансляции не-кодирующего региона связанного с ALS гена C9orf72, секветрируют протеосомы и нарушают активность протеосом10, демонстрируя, что фибриллярные ансамбли из разных белков отличаются своими клеточными эффектами. В подтверждение этого мнения NMR metabolomics показала, что мономерные, олигомерные и фибриллярные α-synuclein и Aβ40/42 имеют разные метаболические эффекты на клетки нейробластомы, указывая, что клетки пытаются противостоять токсичности, вызываемой пре-фибриллярными видами, тогда как фибриллы приводят клетки к отключке (shutdown)179. Недавние эксперименты также показали, что разная морфология фибрилл, даже если она формируется тем же самым белком, может вызывать разные клеточные эффекты, преимущественно путем связывания разных молекул и/или отложением в разных местах60,180-186. Это иллюстрируется Aβ40 фибриллами, продуцируемыми in vitro при разных условиях. Т.наз. 2A фибриллы имеют симметрию второго порядка и они были произведены путем получения Aβ40 фибрилл, продуцируемых при смятениях, тогда как фибриллы. формируемые из того же белка с трехступенчатой симметрией (наз. 3Q) были получены из фибрилл, продуцируемых в состоянии покоя187. Эти Aβ40 фибриллы связывают glycosaminoglycan, heparin, с разным сродством12,188, тогда как др. фибриллы связывают специфические молекулы РНК или др. белки121. Наконец, была изучена роль структуры фибрилл при болезни. Напр., фибриллы из экстрактов головного мозга пациентов с AD были разного размера, с разными характеристиками концентрации и конформации, которые коррелировали с продолжительностью и тяжестью болезни189. Эти различия в характеристиках фибрилл могут частично объяснить , почему амилоидные фибриллы не всегда коррелируют с тяжестью болезни, поскольку биологические эффекты и клинические симптомы могут зависеть от полиморфизма фибрилл, присутствующих в амилоидных отложениях60.
Хотя выявлены впечатляющие эффекты различных олигомеров и фибрилл на дисфункцию клеток, скорее всего, комбинация их будет коррелировать с болезнью. Формирование амилоида является динамичным процессом, при этом мономеры и олигомеры быстро обмениваются др. с др.148. Олигомеры могут также быть сгенерированы непосредственно благодаря потере мономеров и/или олигомеров с концов фибрилл190,191 (Fig. 2). Этот феномен может быть усилен за счет клеточного окружения, такого как низкий pH эндосом и лизосом190. Концентрация белка в клетках также тонко настроена, при этом наблюдается тонкая взаимосвязь со скоростью синтеза и деградации белка, чтобы удерживать белки внутри границ их растворимости192,193. Учитывая этот баланс, неудивительно, что избыточная продукция белка может запускать массовую агрегацию чувствительных белков, которые находятся на вершине своей растворимости в клетке194-196. Мутации предшественников, изменения в пост-трансляционных модификациях, стрессы или старение также могут нарушать эти обычно хорошо защищенные сети, приводя к агрегации.
Что же выходит при рассмотрении этих сложных сетей взаимодействий, это необходимость выяснения структур белковых агрегатов с атомным разрешением. Такое знание сможет помочь понять, как эти агрегаты мешают клеткам в молекулярных деталях и определить методы и молекулы, которые смогли бы помочь контролировать агрегацию белков, с благоприятными эффектами на дисфункцию клеток и болезнь. Кроме того, необходимо понять, почему сборка функционального амилоида не приводит к клеточной гибели. Сравнение структур функциональных и ассоциированных с болезнью амилоидных фибрилл и механизмов их сборки необходимо, чтобы выявить, как токсичность амилоида может быть устранена, если сборка фибрилл благоприятна для организма.
Diversity of amyloid structures at high resolution
Амилоидные фибриллы собираются вместе при большом разнообразии взаимодействий между мономерами и между фибриллами. Основные способы взаимодействий варьируют в разных структурах фибрилл, формируемых из одного и того же белка, а тем более из разных белков. Эти взаимодействия затрагивают физические свойства ансамблей фибрилл, которые могут вносить вклад в фенотипические эффекты, наблюдаемые для разных полиморфных образцов фибрилл.
Amyloid fibril structure at the subunit level
Определяющим структурным свойством амилоидных фибрилл является cross-β укладка, которая общая для всех фибрилл. Такая 'amyloid fold' использует лестницу из сложенных др. на др. β-нитей, ориентированных перпендикулярно оси фибриллы, при этом каждая секция ('rung') ступенька из cross-β лестницы отделена пространством 4.7-4.8Å, которое возникает из регулярных водородных мостиков, занимающих пространство между парными carbonyl и amide группами соседних β-нитей (Fig. 4). Эти пространства впервые были продемонстрированы в 1968-1969 с использованием X-ray дифракции волокон 41,197 (Fig. 1) и они были найдены во всех амилоидных фибриллах независимо от последовательностей белковых предшественников. Присутствие cross-β конформации теперь доказано как повсеместное для амилоидных фибрилл, как для функциональных, так и связанных с болезнью 198, X-ray кристаллография 63, cryo-EM 199 и Fourier transform infrared spectroscopy (FTIR) 200. При FTIR, сильные водородные связи между соседними β-нитями в cross-β складке (fold, абсорбируют характерные частоты ~1,618 cm -1, тогда как более скрученные, менее стабильные β-листы в глобулярных белках абсорбируют более длинные длины волн 201,202.
 Fig. 4: Structural motifs that stabilize amyloid fibrils. Fig. 4: Structural motifs that stabilize amyloid fibrils.
a | A ten-residue peptide from transthyretin (TTR), showing β-sheet stacking in which each β-strand 'rung' is stabilized by hydrogen bonds (denoted by fine black dotted lines) between the polypeptide backbones of precursors, which are separated by the canonical 4.7-4.8Å repeat of the cross-? amyloid fold (PDB accession number 2nm5 (ref.67)). Further stabilization is provided by a steric zipper between the β-sheets, which stabilizes the fibril core. b | The β-helix of HET-S illustrating its steric zippers (PDB accession number 2rnm (ref.66)). c | A structure of amyloid-β (Aβ)42 fibrils (PDB accession number 5oqv (ref.27)) illustrating the variety of interactions that stabilize the fibril, including β-strand stacking (top left), formation of inter-protofilament salt bridges (top right), intra-protofilament steric zippers (bottom left) and inter-protofilament steric zippers (bottom right).
Важно отметить, что имеется несколько фибриллярных структур, которые не считаются амилоидными, несмотря на присутствие некоторых общих признаков. Напр., небольшие ароматические молекулы (такие как diphenylalanine203) собираются в фибрилло-подобные структуры, укладывающиеся с расстоянием 3.4Å и стабилизирующиеся с помощью pi-stacking взаимодействий204. Поскольку эти структуры не состоят из белков, они не считаются амилоидными, несмотря на их структурное сходство и тот факт, что они также вредны для клеток204, хотя не описано болезни, вызываемой такими 'chemi-fibrils'. Др. белковые ансамбли обладают свойствами, напоминающими амилоид, но нарушают некоторые определяющие характеристики амилоидных укладок (fold). Напр., короткие helix-turn-helix пептиды собираются в закрученные фибриллы, стабилизируемые уложенными α-спиралями205. Фибриллы, в которых α-спирали, скорее, чем β-нити, ориентированы перпендикулярно к оси фибриллы (т. наз. cross-α) также обнаруживаются и in vivo, где они важны для формирования биопленки у Gram-позитивных организмов206. Напр., токсический олигомер SOD1, ассоциированный с ALS (Table 1), обладает многими общими структурными и патологическими характеристиками с амилоидом, но не считается каноническим амилоидом, т.к. его β-пластинки расположены в виде спиралеобразных нагромождений (stack) под ~45° углом к оси фибрилл, похож на β-бочонок207. Сходная структура наблюдается у олигомоеров, наз. cylindrin, собранных из β-hairpin пептида, происходящего изαβ-crystallin208. Интересно, что эта структура cylindrin токсична для HeLa и HEK293 клеток208.
Хотя сложенные с интервалом 4.7-4.8Å мотивы β-нити обозначают амилоид, но некоторые амилоидные фибриллы обладают также свойствами на более крупной шкале длин. Некоторые ранние EM наблюдения фибрилл, изолированных из селезенки пациентов, описывались как 'бусинки' с периодичностью в ~100Å , отложенными вдоль оси фибриллы209. Более поздние cryo-EM исследования фибрилл, образующихся in vitro из PrP и β2m описали повторы ~60 Å (ref.210) или 52.5 Å (ref.211), соотв., в дополнение к каноническим ~4.7 Å cross-β повторам, подтверждая существование повторяющихся структур более высокого порядка. Эти более длинные повторы не наблюдались в структурах более высокого разрешения tau или Aβ42 фибрилл27,28, структурные основы этих более крупных повторов остаются спорными.
Др. широко распространенное свойство структур субъединиц амилоидных фибрилл, независимо от последовательности и структуры их предшественников (Table 1). Во всех случаях субъединичная структура, принимаемая внутри фибрилл, драматически отличается от таковой у нативных белков (Table 1). Т.о., главное структурное превращение д. проявляться как амилоидные формы: от развернутой к β-нити, от α-спирали к β-нити или к реорганизации пред-существующей β-слойной структуры (Table 1). Несмотря на общность их cross-β укладки, структуры фибрилл не идентичны, в недавних исследованиях установлено удивительное разнообразие архитектур, все они приспособлены к амилоидной укладке (fold) (Fig. 5). Пептид в 10 остатков из TTR67 образует антипараллельные пары β-нитей, при этом каждый пептид формирует одну ступеньку из cross-β лестницы, тогда как Aβ40 формирует отличающиеся структуры фибрилл, которые имеют совпадающие по регистру параллельные организации их β-нитей, но отличаются по точности локализации и/или организации их β-loop β-motif 212,213 (Fig. 5c). У крупных белков, множественные наборы антипараллельных β-листков, наз. super-pleated β-листки, были предсказаны для Ure2p прионовых филамент 214 и IAPP фибрилл 215, тогда как более сложное расположение, при котором β-нити формировали т. наз. Leu-Ser мотивы, которые затем складывались в параллельные in-resister порядки на длинной оси фибрилл, наблюдалось в структуре фибрилл, формируемых Aβ42 (Fig. 5b, left) 27,65. Др. фибриллярные структуры со сложной оганизацией β-нитей внутри каждой супеньки (rung) из cross-β лесенки также наблюдались, включая те, что из α-synuclein 55,216 (Fig. 5e) и tau 28 (Fig. 5d). Стало ясно, что существуют очень разные организации полипептидных цепочек, которые могут складываться в фибриллы, что подтверждает cross-β структуру амилоида.
 Fig. 5: Subunit packing in amyloid fibrils. Fig. 5: Subunit packing in amyloid fibrils.
Space-filling representations of near-atomic-resolution models of different amyloid fibrils, each filtered to 4Å. Individual subunits are coloured in red to highlight different inter-protofilament packing in different fibril types. a | The β-helix of HET-S that forms a single filament (PDB accession number 2lbu (ref.66)). b | Two polymorphs of amyloidβ (Aβ)42 fibrils formed under different growth conditions (PDB accession number 5oqv27 (left) and PDB accession number 5kk3 (ref.278) (right)). c | Two polymorphs of Aβ40. Fibrils formed under the same solution conditions but propagated from seeds with different morphologies (2A, PDB accession number 2lmn (ref.212) (left) and 3Q, PDB accession number 2lmp (ref.212) (right)). d | Two polymorphs of tau fibrils: paired helical (PHF) (left) (PDB accession number 5o3l (ref.28) and straight (SF) (right) (PDB accession number 5o3t (ref.28)). e | The single filament of α-synuclein fibrils (PDB accession number 2n0a216). The main chain of the top layer of polypeptide chain in each fibril is shown in red. '2A' indicates fibrils with two-fold symmetry; '3Q' indicates fibrils with three-fold symmetry.
Во всех структурах амилоидных фибрилл, установленных с атомной точностью β-нити стабилизируются с помощью сухих 'steric застежек'51 (крепкие интерфейсы из взаимно сплетенных пальцев гидрофобных боковых цепочек, которые исключают воду (Figs 4,5)) и с почти безупречной упаковкой их аминокислотных боковых цепочек. Такие застежки, по-видимому, уникальны для амилоидных фибрилл, т.к. они не встречаются в глобулярных белках или в др. природных фиброзных белков51. Eisenberg's оригинальное описание интерфейса стерических застежек из микрокристаллов коротких пептидов, происходящих из амилоид-формирующих белков, включая фрагменты Aβ tau, PrP, insulin, IAPP, lysozyme, β2m и α-synuclein51. Эта работа описала 8 классов застежек - 4, формируемых из параллельных β-нитей и 4-х из антипараллельных β-нитей51. 5 из 8 предполагаемых структур были обнаружены экспериментально51. Микрокристаллы имеют сходства с фибриллами тем, что они могут расти в сходных условиях, имеют ~4.7Å повторы в их элементарных ячейках217 а в некоторых случаях, небольшие изменения в условиях вызывают взаимные превращения фибрилл в кристаллы и наоборот218. Пептиды микрокристаллов могут также засевать фибриллы сходной морфологии из белков полной длины54, подтверждая, что стерические застежки являются 'стержнем' амилоидных фибрилл, формируемых их интактными белковыми аналогами54,55. Однако, стерические застежки, идентифицированные во фрагментах tau53 не образуют сходные застежки в cryo-EM структуре из фибрилл, формируемых из белка полной длины28, хотя это не мешает образованию застежек этими регионами в tau фибриллах с др. морфологией.
Белки с cross-β структурой также найдены в β-спиралях 219,220. Такие структуры стабилизируются с помощью специфического паттерна гидрофильных боковых цепочек на внешней стороне β-спирали и гидрофобные боковые цепочки на внутренней, вместе с терминальным glycine 220 (Fig. 4b). β-Спирали, сформированные из предназначенных для этого пептидов 221, были найдены в растворимых белках (включая разнообразные бактериальные lyases 222, antifreeze белках 223 и кончиках вирусных хвостов 224) и оказались задействованы в формировании и прионной природе фибрилл у грбов и др. организмов 28,198,225. Высокого разрешения структуры tau фибрилл определены с помощью cryo-EM 28, а HET-S из ssNMR 66,226 обнаружило β-спиральные мотивы с очень сходными основами (root-mean-square deviation (r.m.s.d.) 1.3 Å) несмотря на низкое сходство последовательностей в их β-спиральных регионах. Итак, результаты очерчивают набор возможных структур, которые приспосабливаются к общим амилоидным укладкам, которые отличаются в деталях того, как их β-нити организуются.
Filament architecture of the amyloid fibril
Морфология амилоидных фибрилл предопределяется количеством и расположением протофиламент, которые формируют полностью собранные фибриллы28,64,70-72,211,227, а также структуры из собственно субъединиц. Вариации в расположении и типе взаимодействий между протофиламентами усиливает разнообразие амилоидных укладок (fold). Некоторые амилоидные фибриллы представлены одиночной профиламентой (напр.,β-спираль HET-S66 (Figs 4b,5a)), но большинство содержат множественные протофиламенты27,28,64,199,227, которые скручиваются вместе68,228-230. Разные скручивания наблюдаются между фибриллами, формируемыми в одной и той же ростовой смеси70,211,229 и даже внутри одиночной фибриллы. Были найдены и др. организации протофиламент, включая цилиндры231, плоские ленты 64,227,230 и псевдо кристаллиновые листки218. Протофиламенты в скрученных фибриллах были найдены с разными симметриями, видимыми внизу оси фибриллы, а также со спариваниями асимметричным способом28. Такие симметрии включают две или три мономерные единицы в одной плоскости (in-register two-fold and three-fold)212,213 и 21 винтообразную симметрию27,28 (поворот на 180° сопровождаемый переходом (translation) половины β-листка в расположение ниже вдоль оси фибриллы). В недавних высокого разрешения cryo-EM структурах tau и Aβ42, обнаружена упаковка протофиламент параллельным образом, придавая фибриллам полярность27,28. Напротив, при реконструкции с низким разрешением cryo-EM β2m фибрилл было показано, что фибриллы возникают как из неполярных (антипараллельных), так и полярных (параллельных) организаций протофиламент, в одном и том же препарате211. Однако, необходимо отметить, что структура при высоким разрешении неполярных фибрилл с антипараллельным расположение своих протофиламент всё ещё просматривается. Измерения Mass per unit length (MPL) с использованием scanning transmission EM (STEM)65,211,227 были использовано для определения количества протофиламент у β2m211, IAPP228 и α-synuclein216 фибрилл и были дифференцированы полиморфы Aβ40 с two-fold и three-fold структурами симметрии58,212,213,232 (Fig. 5c). MPL может быть также определена с помощью получения tilt-beam transmission EM (TB-TEM) изображений233 или с помощью масс-спектрометрии целых фибрилл234.
Расположение протофиламент в недавно обнаруженных амилоидных фибриллярных структурах показано на Fig. 5. Сюда входят 2A и 3Q фибриллы из Aβ40, описанные выше (Fig. 5c), у которых разная морфология фибрилл соответствует разной организации сходных (но не идентичных) β-петель-β субъединичных мотивов212. В др. случаях, включая спаренные спиральные и прямые филаменты tau28, разные морфологии фибрилл, формируемые идентичными субъединицами соединяются за счет разных взаимодействий (Fig. 5d). Хотя cryo-EM структуры tau полиморфов предоставляют первые прямые доказательства разных морфологий фибрилл, возникающих в результате альтернативной упаковки идентичных субъединиц, этот феномен был прдтвержден и для α-synuclein64,230, Aβ40 (refs71,72), TTR67 и β2m211 фибрилл. Протофиламенты, спаренные в спиральные филаменты tau28 стабилизируются с помощью водородных связей внутри его стержня332PGGGQ336 последовательности, которая формирует антипараллельную poly-glycine (polyG) II β-спираль235, а также с помощью водородных связей между боковыми цепочками из Gln336 и backbone of Pro332 от противоположной протофиламенты. Недавно на cryo-EM структуре Aβ42 (ref.27), протофиламенты, как было установлено, удерживаются вместе с помощью гидрофобных стерических застежек, использующих Val39 и Ile41 боковых цепочек от каждой протофиламенты и стабилизируются ещё сильнее за счет солевых мостиков между N-терминальной Asp и Lys28 боковыми цепочками противоположных протофиламент (Fig. 4c). Напротив, в асимметричных прямых филаментах (SF) tau полиморфов28, взаимодействия ни между стрежнем, ни боковыми цепочками, по-видимому, не играют существенной роли в стабилизации их структуры. Вместо этого 6 боковых цепочек (Lys317, Lys321 и Thr319 от каждой протофиламенты) координируют неизвестным способом плотность, которую авт. приписывают N-концевому 7EFE9 каждой субъединице tau. Такая плотность д., однако, использовать и др. polyanionic молекулы, такие как glycosaminoglycan или нуклеиновые кислоты в таких неочищенных экстрактах из головного мозга28. Анализ амилоидных фибрилл α-synuclein с полосками высокой электронной плотности, идущими вниз вдоль оси фибрилл230,236 подтвердил роль ионов металла в стабилизации фибрилл, что согласуется со многими исследованиями, предположившими связи с ионами металлов при инициации образования амилоида237.
Данные X-ray дифракции и micro-ED52 малых, амилоидогенных пептидов были использованы для предсказания формирования стерических застежек53-55,76. Т.к. взаимодействия в этих стерических застежках при упаковке кристаллов обязательно образуются между идентичными пептидами, то они могут предсказать только регионы, которые само-ассоциируются в симметричные, спаренные протофиламенты. Структура NAC стержневого домена α-synuclein с помощью micro-ED55 была интерпретирована как указывающая на возможных кандидатов для стерических застежек между протофиламентами в фибриллах, формируемых из интактных белков в 140 остатков. Несмотря на идентификацию некоторых полиморфов α-synuclein фибрилл, состоящих из скрученных протофиламент227,230, пока не получена высокого разрешения структура α-synuclein фибрилл, содержащих множественные протофиламенты, чтобы оценить эту гипотезу.
Недавние структуры амилоидных фибрилл показали, что одна и та же первичная последовательность может собираться в разные структуры, даже в одних и тех же условиях роста 76,187,238,239. Эта находка находится в резком контрасте с упаковкой огромного большинства глобулярных белков, в которых данная последовательность формирует одну и ту же укладку каждый раз, когда они сходят с рибосом или укладываются in vitro240. Более того, формирование амилоида медленное, несмотря на термодинамические преимущества; поэтому необходимо чрезвычайно продожительное время, возможно годы in vitro241, чтобы рост фибрилл достиг равновесия. Т.о., морфология фибрилл может меняться со временем 241 и в ответ на изменения внешне-средовых условий 77. В энергетических терминах, энергетический ландшафт формирования фибрилл является значительно более неровным и сложным, чем для глобулярных белков, в принципе использующим множественные промежуточные образования, параллельные пути сборки и в результате отличающиеся конечные амилоидные продукты с отличающимися cross-β структурами 242.
Amyloid polymorphism in disease
Ясно, что вариации в последовательности гена для белка предшественника могут прямо связанными с изменчивостью как возраста начала, так и продолжительности многисоенных амилоидных болезней.
 Fig. 6: How changes in primary sequence affect amyloid disease. Fig. 6: How changes in primary sequence affect amyloid disease.
Top left panel: various diseases are caused by poly-glutamine (polyQ) expansion disorders. Depending on the specific disease (shown in the figure), polyQ repeat lengths exceeding a critical threshold can cause disease, whereas fewer repeats are innocuous. Data were taken from refs93,105. Lower left panel: the age of onset of patients with Parkinson disease (PD) is influenced by the copy number of the α-synuclein gene (duplication (2SNCA), triplication (3SNCA) or quadruplication (4SNCA)), with increased expression correlating with earlier onset. Age of onset and disease duration are also influenced by single point mutations, which may result in different aggregation pathways and/or kinetics or different fibril architectures resulting in different disease phenotypes. Data were taken from refs299,300. Top right panel: the pathology of Alzheimer disease (AD) can be influenced by fibril morphology. In particular, typical-AD (t-AD) and a rapidly progressive form of AD (r-AD) show similar fibril architecture monitored by solid-state NMR spectroscopy (ssNMR) but have varied ages of onset and disease duration. However, in posterior cortical atrophy AD (PCA-AD), fibrils with a different structure are formed. The age of onset and disease duration for PCA-AD are similar to t-AD and r-AD, but the disease primarily affects the cerebellum rather than the temporal lobe. Centre panel: a diagram of the brain highlighting the regions primarily affected by each of the diseases shown. CACNA1A, voltage-dependent P/Q-type calcium channel subunit α1A; HD, Huntington disease; TBP, TATA-box-binding protein; WT, wild type. The top right panel was adapted from ref.60.
Хотя развитие болезни протекает в разных временных шкалах у индивидов, затронутых болезнью polyQ экспансии, AD и PD (Fig. 6), при прионовых болезнях гибель наблюдается в чрезвычайно узкий промежуток времени в течение нескольких дней243. Люди также обнаруживают расширенный инкубационный период при CJD244, но имеют короткую продолжительность болезни (обычно 6 мес.), которая является уникальной для этих болезней. В противоположность прионовым болезням мышиные модели AD приводят к гибели в течение значительно более продолжительного периода времени245, как и у людей60, хотя способность мышиных моделей аккуратно воспроизводить болезненные процессы у людей, спорна245. При болезни Гентингтона, индивиды, содержащие huntingtin с менее, чем 35 Gln остатками, выглядят здоровыми в течение своей жизни. Однако, индивиды с длинными polyQ повторами обнаруживают зависимое от возраста начало и тяжесть болезни коррелирует с количеством Gln остатков выше критического порога105 (Fig. 6, top left). При Machado-Joseph болезни, др. polyQ нарушении, при котором ataxin 3 содержит glutamine расширения, длина не патологических polyQ повторов составляет 12-40 остатков, при этом патология не проявляется, пока не будет достигнут уровень в 62 повтора105. Широкие границы количеств повторов связаны фактически с тем, что увеличение повторов увеличивает тяжесть симптоматики болезни, подтверждая, что полиморфные эффекты, обусловленные первичной экспансией последовательностей, сцеплены с болезнью105.
PD может быть вызвана мутациями в гене SNCA, кодирующем α-synuclein, с вариантами, такими как A30P, E46K, H50Q, G51D и A53T, приводящими к болезни с ранним началом и более короткой продолжительности болезни102,246-249 (Fig. 6, lower left). Напр., G51D вариант является агрессивным как quadruplication гена SNCA в терминах возраста начала болезни, но он также вызывает и др. симптомы, включая эпилепсию250. Хотя мультипликация гена снижает возраст начала PD, как и ожидается из-за повышенной концентрации белка предшественника, дополнительные симптомы у пациентов с мультипликациями гена SNCA не могут быть объяснены просто грузом амилоида. Очевидно, что специфические амилоидные полиморфы могут объяснить наблюдаемые фенотипы PD250. Специфические точечные мутации дают разные эффекты на нарушения познавательной способности, психиатрические нарушения, галлюцинации, дисфункции автономной нервной системы, и ранее упомянутые симптомы250.
Вариации первичных последовательностей, включая экспансии последовательностей (таких как polyQ, polyA и poly-GlyAla93) или одиночные точечные мутации (такие как те, что описаны для α-synuclein) могут приводить к разным укладкам субъединиц и упаковкам субъединиц в фибриллы. В соответствии с этим мнением, ssNMR исследования фибрилл у 'Osaka' (ΔE22) и 'Iowa' (D23N) мутантов Aβ40 выявили структуры, которые отличаются от тех, что формируются дикого типа Aβ40/42 (refs61,251). Связь между полиморфизмом и патологией фибрилл с идентичными первичными последовательностями менее четкая, но всё ещё доказуемая. Возраст начала болезни у пациентов с болезнью Гентингтона скоррелирован с количеством CAG повторов252, и с разными полиморфами Aβ40 (ref.253) и α-synuclein227, имеющими разную цитотоксичность in vitro и разные скорости отложения бляшек in vivo254,255. Разная цитотоксичность наблюдается у фибрилл полной длины IAPP, возникших из токсических и не токсических коротких пептидных фибрилл54. Выделение и характеристика фибрилл от пациентов также подтверждает, что морфология фибрилл варьирует от пациента к пациенту. Как обсуждалось выше запуск образования фибрилл из Aβ40/42, используя бляшки, экстрагированные от пациентов, обладающих разными фенотипическими проявлениями и прогрессированием болезни, дают разные ssNMR спектры60,213, подтверждая, что разные полиморфы фибрилл преобладают у каждого пациента. Это не означает, что все фибриллы, формируемые in vivo будут мономорфны. В самом деле, множественные полиморфы tau присутствуют в выборке от одно и того же пациента28, и разные Aβ полиморфы были идентифицированы у одного и того же пациента при использовании X-ray дифракции256. Дальнейшие доказательства получены при анализе фибрилл, полученных (seeded) из ex vivo материала от пациентов, которые представляли или posterior cortical atrophy форму AD (PCA-AD), rapid-AD (r-AD) или типичную AD (t-AD)60. Одиночный Aβ40 полиморф был наиболее многочислен при PCA-AD и t-AD, тогда как r-AD выборки содержали высокие пропорции дополнительных структур. Снова ex vivo выборки оказались структурно отличающимися от синтетических линий, созданных in vitro, подчеркивая удивительный линейный полиморфизм даже у одного пациента60.
Разнообразие амилоидных полиморфов может объяснить разные фенотипы болезни, наблюдаемые у пациентов с одними и теми же агрегатами APP. Альтернативно, принимая во внимание, что формирование фибрилл может протекать годами, чтобы достичь равновесия 241, фибриллы могут медленно изменяться в структуре. В самом деле, фибриллярные бляшки из Aβ у модельных трансгенных мышей, как было установлено, подвергаются структурным перестройкам 257, а разные α-synuclein полиморфы фибрилл со временем возникают in vitro241. Структуры фибрилл у пациентов могут варьировать в ходе болезни. Такие находки могут объяснить, почему груз амилоидных бляшек не коррелирует с симптомами болезни 258,259; поэтому необходимо подтверждение связи структуры фибрилл post-mortem с типом болезни.
Potential for therapeutic interventions
Исследования, как амилоидные структуры ассоциируют с определенным проявлением болезни, находятся в зачаточном состоянии, но разработка лучшей диагностики может помочь идентифицировать пациентов, нуждающихся в срочном терапевтическом вмешательстве. Сегодня болезни диагностируются, используя спинно-мозговую жидкость из позвоночника и получения positron emission tomography (PET) изображений и обнаружения олигомеров с использованием immunoassays, включая зависимые от конформации подходы260. Однако, персонализованная amyloid-блокирующая медицина, нацеленная на специфические амилоидные полиморфы, присутствующие у индивидуальных пациентов, остается только в мечтах. Сегодня за одним исключением261, нет терапии, способной снижать образование амилоида у людей.
Др. важным размышлением относительно целенаправленного воздействия на эти опустошительные болезни является как вмешаться в каскад амилоидной агрегации ил болезненный процесс. Эти размышления осложняются динамической природой формирования предшественников амилоида, которые расправлены, не нативные или частично упакованные, что препятствует разработке лекарств. Снижение концентрации мономеров д. снижать общее количество белка, способного давать амилоид, но такие стратегии могут быть вредными, если мономеры выполняют жизненно важную функциональную роль. Интересно, что функция некоторых амилоидных белков остается неизвестной262,263. Нарушения образования олигомеров (Fig. 2) могут открыть путь к лечению, но динамическая природа этих видов делает это затруднительным264, и сегодня недоступны высокого разрешения структуры амилоидных олигомеров, чтобы осуществлять подобные попытки. Снижение популяции любого из олигомеров может влиять на равновесие в направлении более токсической сборки. Малые молекулы, как полагают, могут предупреждать формирование олигомеров или напротив способствовать образованию фибрилл, это, в свою очередь, д. снижать время жизни, а, следовательно, и потенциал токсичности видов олигомеров. Разрабока вмешательств, способствующих сборке менее токсичных полиморфов такж может снижать тяжесть болезни.
Др. подход может способствовать секвестрации амилоидогенных мономеров в не-амилоидные аморфные агрегаты265, хотя это само по себе может вызывать вредные эффекты. Наконец, предупреждение распространения токсических видовt может открыть новый путь интервенции. Олигомеры, как было установлено, взаимодействуют со многими рецепторами клеточной поверхности как в пре-синаптических, так и пост-синаптических мембранах, таких как ephrin-type B receptor 2 (EphB2), PrPC (ref.266), renal tumour antigen (RAGE; известен также как MOK) и scavenger receptor class A (SCARA) и class B (SCARB), обеспечивая как их токсические эффекты, так и интернализацию. Др. рецепторы клеточной поверхности, такие как lymphocyte activation gene 3 protein (LAG3) (ref.267), как было установлено, важны для эндоцитотического импорта фибриллярных видов. Содержание токсических видов индивидуально повреждает клетки и/или мешает вступлению антител, блокируемых рецепторами267, это могло бы предотвратить прион-подобное распространение, а , следовательно, остановить прогрессирование болезни. Знание, где вмешаться, базируется на идентификации токсических видов в амилоидной агрегации, что может зависеть от белковой последовательности и/или затронутых типов клеток. Преступником может оказаться любой или все из on-pathway и off-pathway олигомеры, а также сами фибриллы268.
Описаны зависимые от лекарств и резистентные к лекарствам прионовые болезни 269-271, указывающие на то, что существуют возможности терапевтического вмешательства. Более того, малые молекулы, пептиды и peptidomimetics способны целенаправленно воздействовать по-разному, но близко родственные, стерические затежки были успешно созданы 272-274, давая надежду, что мы вскоре окажемся способными идентифицировать, какие амилоидные фибриллы формируются у разных индивидов , а , следовательно, и соотв. амилоидные структуры и сборки, соотв. болезни и этиологии. Сегодня необходимы реагенты, способные стабилизировать олигомеры в специфических конформациях или препятствовать их образованию, а также реагенты, способные переводить формирование амилоида в специфическое, хорошо-известное структурное состояние, позволяющее выявить связь между формированием фибрилл и болезнью. Ответ может быть разным для разных белков и белковых последовательностях; но прежде необходимо понимание амилоидной структуры и структуры и конформаций олигомеров, вызывающих амилоидные болезни.
Conclusions and future perspectives
Amyloid fibrils have highly organized hierarchical structures that are built from protofilaments in which individual monomeric subunits form (most often) parallel in-register β-strands. These protofilaments then pack against each other, forming fibrils that are stabilized by dry steric interfaces. Further inter-fibril interaction leads to the formation of the plaques and inclusions characteristic of amyloid disease. Recent advances in cryo-EM and ssNMR have given insights into the structure of amyloid fibrils in unprecedented detail, revealing a variety of structures that conform to the cross-? amyloid fold. Coupling these techniques with orthogonal data (for example, with other biophysical measurements) and data on disease type, presentation and progression will help to elucidate which amyloid formation pathways, amyloid intermediates and/or fibril structures are responsible for disease. As the capabilities of cryo-ET improve, we will be able to study amyloid fibrils and plaques and intracellular inclusions in situ with increased resolution. This increased resolution will allow us to discern how polymorphism relates to disease phenotype and how fibril structure affects and is affected by the cellular environment. The time has never been better to finally understand amyloid structure, protein aggregation mechanisms and how they relate to disease. In turn, these breakthroughs bring new hope and renewed vigour in our quest to develop agents that can diagnose, delay or even halt the progression of disease.
|
 Fig. 1: Progression of amyloid structure research over close to 400 years that has culminated in the first atomic structures of amyloid fibrils.
Fig. 1: Progression of amyloid structure research over close to 400 years that has culminated in the first atomic structures of amyloid fibrils.  Fig. 2: Schematic of amyloid formation.
Fig. 2: Schematic of amyloid formation. Fig. 3: Amyloid aggregates can cause cell disruption by a variety of mechanisms.
Fig. 3: Amyloid aggregates can cause cell disruption by a variety of mechanisms.
 Fig. 4: Structural motifs that stabilize amyloid fibrils.
Fig. 4: Structural motifs that stabilize amyloid fibrils.  Fig. 5: Subunit packing in amyloid fibrils.
Fig. 5: Subunit packing in amyloid fibrils.  Fig. 6: How changes in primary sequence affect amyloid disease.
Fig. 6: How changes in primary sequence affect amyloid disease.