Molecular programs can rescue cells already engaged in the process of apoptosis or other forms of programmed cell death. | |
|---|---|
|
Ho Lam "Hogan" Tang в Ming-Chiu Fung's immunology lab исследовал, как нарушения цитоскелета клетки могут вносить вклад в фрагментацию митохондрий во время апоптоза. Но его брат Ho Man "Holly" Tang задался более фундаментальным вопросом: могут ли клетки восстанавливаться при начавшемся апоптозе?
Cуществует множество разных триггеров апоптоза, но все они в конечном итоге активируют убийц, наз. каспазами. Расщепляя сотни разного типа белков внутри клетки, эти энзимы разрушают геном, атакуя структурные белки, составляющие клеточные органеллы, и демонтируют цитоскелет, приводя клетку к сжатию, пузырькам и фрагментам и, наконец, к гибели. До сих пор считалось, что апоптоз необратим. 'Действительно ли это так?'
Tangs подвергал воздействию разнообразные раковые клетки человека токсинов, таких как этанол, и наблюдал за появлением признаков апоптоза, таких как активация каспаз и сжатие клеток. Затем вместо того, чтобы выбрасывать "погишие" клетки в конце эксперимента мы отмывали и инкубировали их в свежей среде в течение ночи, сказал Tang.
К удивлению, некоторые клетки приобретали нормальную морфологию на следующее утро.1 Братья назвали этот феномен anastasis. Апоптоз по-гречески означает "падение" и этот процесс способствует естественному обновлению клеток, близкое к падению лепестков увядающих цветов осенью. Anastasis, с др. стороны, означает "подъем," и в Христианстве означает воскрешение Христа.
Научное сообщество первоначально скептически отнеслось к тому, что клетки могут воскресать из мертвых. "Наши находки были совершенно необычными и первые работы были отклонены 11 рах в течение 3-х лет," говорит Tang, теперь работающий в Johns Hopkins University.
Он предоставил множество экспериментальных подтверждений после присоединения к лаб. Denise Montell, из Johns Hopkins. Батья из Китая и их сестра после получения степени магистра в Iowa State, Tang провели эксперименты не только на линиях раковых клеток человека, таких как HeLa, но и также на нормальных культивируемых клетках мышиной печени, сердца крыс, клеток головного мозга хорька, а также множества культивируемых клеток человека, включая фибробласты.2 Снова и снова клетки восстанавливались из поздней стадии апоптоза, даже после мучительных повреждений ДНК и фрагментации клеток. "Сегодня я действительно знаю, что существует важный феномен, когда мы можем всю область клеток рака легких человека заставить сморщиваться и формировать пузырьки, а затем восстанавливаться," говорит Montell, сегодня он в University of California, Santa Barbara. "Это поразительно."
С 2012, когда anastasis был впервые обозначен, исследователи глубоко внедрились в понимание, как клетки безусловно могут сшивать сами себя после того как они были сильно повреждены апоптозом. Учёные засвидетельствовали, что фрагментированные митохондрии в культуре клеток человека снова становятся целыми, и создают запасы мРНК и сохраняется резерв во время апоптоза, чтобы помочь прыжком стартовать обратно к жизни. Они также нашли доказательства, что anastasis может возникать и in vivo у Drosophila.
Открытие может изменить определение учёных жизни и смерти на уровне клетки говорит Yinan Gong, из University of Pittsburgh Medical Center. "Что означает смерть для клетки?"
Как клетки выживают
 A SECOND LIFE: Live cell confocal microscopy of human cervical cancer HeLa cells before cell death induction (top), treated with ethanol to induce cell death (middle), and after washing and incubating with fresh medium to allow recovery for 30 hours (bottom). Mitochondria are stained in red, nuclei in blue. HO MAN (HOLLY) TANG AND HO LAM (HOGAN) TANG Клетки могут жить дни, месяца, даже годы, но однажды начинается апоптоз, он сосвем не требует времени для запуска гибели. В течение 10 мин. активации каспаз клетки заметно трансформируются: их мембраны искривляются, т.к. клетки сжимаются и их ДНК конденсируется в пучки, которые затем разъединяются. Каспазы также вызывают молекулы, известные как phosphatidylserine, чтобы слететь с внутренней поверхности мембраны на наружную поверхность клеточной мембраны, подающие сигналы "съешь меня" для фагоцитов. (See illustration.) "Вы активируете эти каспазы подобно наёмных убийц, которые могут расщеплять несколько сотен субстратов в клетках и убивать клетку в течение 5-10 мин. ," говорит Gabriel Ichim из University of Lyon in France.
Апаптоз запускает множество разных путей, но все они в конечном итоге активируют энзимы, известные как каспазы, которые разрушают ДНК клеток, органеллы и цитоскелет. Каспазы также рекрутируют др. клетки для поглощения умирающих клеток. Даже после осуществления этого процесса убийства клетки может восстановиться посредством процесса anastasis. Но если anastasis происходит поздно, то выжившие клетки могут нести крупные хромосомные шрамы и др. генетические дефекты, которые могут привести к озлокачествлению.
В 2015, работая с культивируемыми клетками человека, Ichim, Tait и их колл. описали феномен, сходный, но отличающийся от anastasis, известный как "неудавшийся апоптоз," при котором клетки восстанавливаются только после частичных из радикальных изменений, обычно происходящих во время апоптоза.3 Ранее полагали, что когда митохондрии клеток начинают терять cytochrome c, мощный активатор каспаз, то все органеллы делают это синхронно по всей клетке. Однако, когда исследователи проверили, то они установили, что иногда только немногие митохондрии клеток протекают, т.е. только небольшая фракция каспаз активируется и клетка выживает.3
Подобно anastasis, неудавшийся апоптоз показывает, что инициация апоптоза часто не является смертельным приговором. Но неудавшийся апоптоз затрагивает клетки, которые лишь частично прошли через апоптоз - уровни активных каспаз значительно ниже, чем когда апоптоз оказывается успешным и лишь ограниченное количество ключевых энзимов расщепляют мишени. Напротив находка Tangs' указывает, что клетки могут восстанавливаться даже если апоптоз полный, говорит Tait.
Tangs с колл. установили, напр., что anastasis может позволить восстановление после апоптоза даже после разъединения на составляющие. Ещё ранее они опубликовали time-lapse микроскопию живых клеток HeLa повторно собравшихся из фрагментов с нормальной морфологией.4 При этом не было наблюдения того, как начинался апоптоз; если восстанавливались благоприятные условия, то anastasis мог восстанавливать клетки после различных инсультов, включая холодовой шок, белковое голодание и воздействие токсических веществ. В клетках, достигших поздних стадий апоптоза, фрагментированные митохондрии могут даже сливаться и восстанавливать свою нормальную структуру.4,5 Восстановленные клетки теряют также сигнал "eat me" с поверхности спустя всего несколько часов, избегая тем самым фагоцитоз.2
В 2017, Montell и Tangs независимо опубликовали более глубокие данные о молекулярных сигнатурах anastasis. Группа Montell's установила, что более 1000 генов оказывались активными в апоптических клетка HeLa в свежей среде и что молекулярные реакции anastasis были сходны до некоторой степени с таковыми в клетках, поправившихся после аутофагии, клеточного процесса, с помощью которого белки и органеллы подвергаются рециклингу.6 Кроме того, мРНК, связанные с клеточным восстановлением, по-видимому, накапливаются до того, как апоптоз будет остановлен, указывая тем самым, что клетки готовятся к anastasis в начале апоптоза для обеспечения потенциального восстановления. Во время anastasis в первичных печеночных клетках мышей Tangs с колл. отметили резкие изменения в экспрессии генов, участвующих в удалении поврежденных митохондрий, губительных свободных радикалов и др. клеточных компонентов, а также участвующих в аресте клеточного цикла, вообще-то давая клетке время для репарации.7
See "Eat Yourself to Live: Autophagy's Role in Health and Disease" Validating anastasis
Исследователи в последнюю декаду подтвердили, что апоптоз не всегда является финалом, существует широко распространенный скептицизм относительно этого. Одно основание anastasis остается спорным, это вопрос, действительно или нет клетки остаются живыми после воздействия стрессами, вызывающими апоптоз, и после активации каспаз, или они избегают стрессовых воздействий, активирующих палачей. "Необходимо понаблюдать такие выжившие клетки в течение длительного времени, особенно in vivo," заявил Ichim.
Чтобы отслеживать выжившие клетки in vivo после апоптоза Tangs и Montell независимо разработали gene constructs-CaspaseTracker7 в 2015 и CasExpress8 в 2016, соотв. - которые генерировали флуоресцентные белки во время активации каспаз и затем др. неясно отличающиеся по цвету после. Затем с помощью time-lapse live-cell микроскопии наблюдали за отдельными клетками, отслеживая их судьбу.
Этот подход помог группам наблюдать anastasis in vivo впервые. Используя эти конструкции Tangs и Montell наблюдали за клетками многих типов тканей у эмбрионов Drosophila, переживших активацию каспаз перед полным восстановлением после появления характерных меток апоптоза, таких как сжимание клеток и образование пузырей на мембране. Теперь они работают с клетками грызунов.
Результаты всё ещё не воспринимаются всеми, частично из-за того, что ранние исследования показали, что каспазы вносят вклад в процессы иыне, кроме клеточной гибели. Напр., в нервной системе каспазы активируются во время нейронального укорочения (pruning), связанного с обучением и запоминанием, отмечает Scott Dixon, из Stanford University, так что активация каспаз не может быть четким маркером апопоза.
Montell и её колл. отметили, что одним из способов отличить активность anastasis от др. событий с участием каспаз является то, что активация не-апоптических каспаз обычно происходит на специфических стадиях развития и в каждой клетке одного и того же типа ткани. Напротив, во время развития anastasis может возникать в случайных фракциях клеток спорадически в течение времени.10 Montell соглашается, что необходимо провести больше исследований, чтобы понять в точности, что происходит. Предполагая, что клетки могут при некоторых обстоятельствах приходить в норму после апоптоза и др., кажущихся фатальными, процессов, всё ещё остается неясным, насколько распространено и важно такое восстановление. Необходимо продемонстрировать значение восстановления после клеточной гибели. 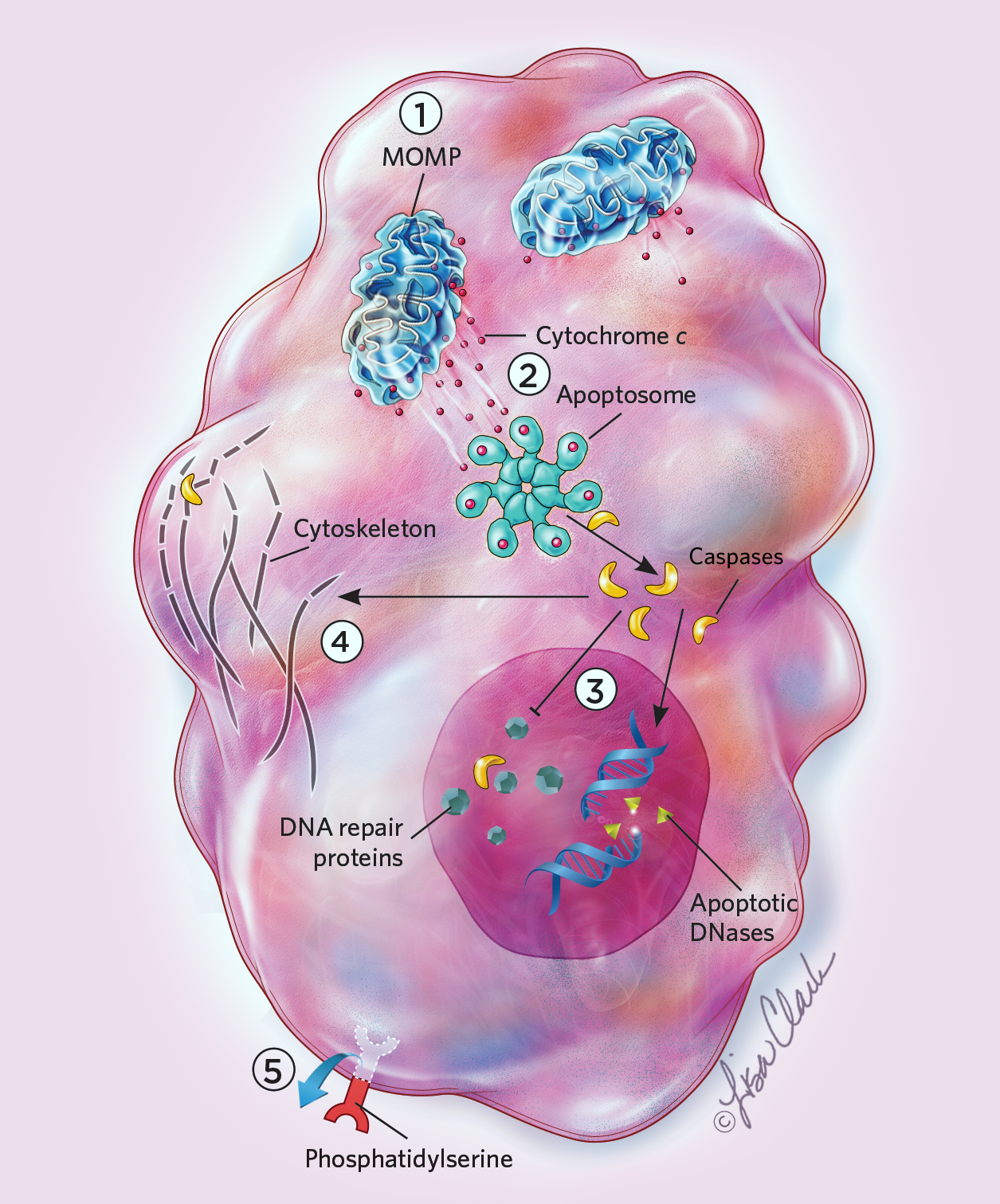 Anastasis: How Cells Cheat Death
Anastasis: How Cells Cheat Death Apoptosis is triggered many different ways, but they all ultimately activate enzymes known as caspases that disrupt a cell's DNA, organelles, and cytoskeleton. Caspases also recruit other cells to eat the dying cell's remains. Even after commencing this suicidal process, cells can recover through a recently discovered process dubbed anastasis. But if anastasis happens late in apoptosis, the surviving cells may carry major chromosomal scars and other genetic defects that can lead to malignancy. Apoptosis See full infographic: WEB | PDF © LISA CLARK 1 Dozens of known triggers can initiate apoptosis. Once started, apoptosis regulators can spark mitochondrial outer membrane permeabilization (MOMP), a critical step in fragmenting mitochondria. 2 MOMP releases cytochrome c and other factors that trigger the formation of a protein structure called the apoptosome that can activate caspases. 3 Caspases cleave proteins involved in DNA repair while activating an enzyme that attacks DNA. 4 Caspases also attack the cytoskeletal scaffolds of cells, causing them to shrink and deform. 5 The membrane molecule phosphatidylserine flips from the inner to the outer surface of the cell to signal phagocytes to engulf the dying cell. Anatasis See full infographic: WEB | PDF © LISA CLARK 1 A number of heat-shock proteins can suppress MOMP and caspase activation. 2 Fragmented mitochondria glue themselves back together, while a subset of mitochondria remain intact or partially functional to supply energy to help cells recover. 3 Messenger RNAs that accumulate before the cells die from apoptosis could support a quick recovery. 4 Damaged proteins, mitochondria, and other cellular components are removed, possibly via autophagy and other mechanisms. 5 Cells lose the phosphatidylserine "eat me" signal from their surfaces. 6 Anastasis can induce angiogenesis and cell migration, which could enhance nutrient absorption and remove waste resulting from apoptosis. It can also arrest the cell cycle to give the cell time to repair. Effects of apoptosis recovery
Одной из возможных функций anastasis как механизма выживания клеток, полагает Tang, является ограничение постоянных повреждений, которые могут возникать в ответ на временные ситуации. Напр., ткани в развивающемся организме могут случайно пережить нехватку ростовых факторов, событие, которое может запускать апоптоз во время, когда клетки пролиферируют с высокой скоростью. Montell и её колл. установили, что anastasis может происходить во время развития у Drosophila, при этом клетки, переживающие активность каспаз в головном мозге личинок и в имагинальных дисках, которые после метаморфоза развиваются в конечности и органы взрослых.10
Anastasis может также способствовать эволюционным изменениям, заявляет Tang. "Наше недавнее исследование продемонстрировало возникновение anastasis в зародышевых клетках Drosophila после временного воздействия физиологических и средовых стрессов, таких как голодание и холодовой шок".9 Возникает вероятность, что эти клетки могут приобретать новые мутации, генерируемые во время апоптоза, которые могут передаваться потомству.
Anastasis может служить многим целям, чем просто защита. В 2012 Tangs и Montell уcтановили, что клетки, восстановленные от апоптоза, могут репарировать генетические повреждения, иногда возникают ошибки способом, с помощью которого они увязывают свои геномы снова вместе. Как результат ряд выживших клеток, имеющих хромосомные аномалии и др. генетические дефекты, переходит к злокачественному росту. Это подтверждает, что повторяющийся подвоз клеток с берега гибели может объяснить высокий риск рака в тканях, подвергнутых многократным нападениям, так как рак печени, обусловленный алкоголизмом, и рак рта, пищевода или желудка может быть результатом регулярного потребления очень горячих напитков.7 Даже при неудавшемся апоптозе, где повреждения менее тяжелые до восстановления, геномы клеток иногда оказываются нестабильными, и некоторые клетки даже становятся злокачественными, согласно исследованию, проведенному Tait, Ichim и их колл.3 "Мы отслеживали клетки, чтобы посмотреть долговременные последствия в направлении раковой прогрессии и мы установили, что они могут переживать геномную нестабильность," говорит Ichim. "Они могут стать более агрессивными и формировать более крупные опухоли у мышей."
Способность клеток восстанавливаться после запрограммированной клеточной гибели также может играть роль также в способности некоторых раковых опухолей уклоняться от терапевтических вмешательств. Облучение и химиотерапия индуцируют апоптоз и поскольку это может убивать опухолевые клетки, то любое выживание может приводить к рецидивам и метастазам.9 Более того, раковые клетки, которые выживают после такой терапии могут безусловно обнаруживать новые venации, которые помогают им противостоять лекарствам.
Tang с колл. также установили, что anastasis может активировать гены у Drosophila, сцепленные с ангиогенезом и миграцией клеток,7 т.е. процессами, которые могут усиливать абсорбцию питательных веществ и удалять отходы, чтобы помочь клеткам в восстановлении от апоптоза. В то же самое время эти изменения могут усиливать распространение раковых клеток.
Принимая во внимание потенциальную связь между раком и anastasis, вмешательства, нацеленне на этот процесс, д. помочь в предупреждении возникновения рака или его лечении, говорит Tang says. "Супрессия anastasis в умирающих раковых клетках во время и после лечения рака д. стать новой терапевтичекой стратегией для лечения рака путем ингибирования рецидивов рака."
Напротив целенаправленное воздействие на anastasis позволит однажды лечить болезни, возникающие из-за потери невозобновляемости клеток, таких как кардиомиоциты или нейроны. "Сегодня одно из основных усилий сосредоточено на идентификации ключевых регуляторов anastasis и малых молекул, которые способствуют или супрессируют anastasis," говорит Tang. "Наши находки д. снабдить нас списком важных инструментов, для контроля anastasis, тем самым запустить новые области исследований для выяснения потенциальных функций и терапевтического использования anastasis."
В конце концов лучшее понимание anastasis может не только помочь спасти клетки от болезней и повреждений, но и также больше понять о гибели клеток в целом. "Святым Граалем вопросов является, сможем ли мы предсказывать судьбы клеток на уровне одной клетки," говорит Gong. "Напр., если мы облучаем опухоль, то мы д. знать, что может 90% опухоли сокращаться, но мы не может сказать, какие 90%. Предсказание, какие клетки погибнут и каким способом можно будет в конечном итоге им помочь, поможет нам минимизировать побочные эффекты и максимизировать благоприятные эффекты. Это клеточная гибель
2.0."  References
1. H.L. Tang et al., "Reversibility of apoptosis in cancer cells," Br J Cancer, 100:118-22, 2009. 2. H.L. Tang et al., "Cell survival, DNA damage, and oncogenic transformation after a transient and reversible apoptotic response," Mol Biol Cell, 23:2240-52, 2012. 3. G. Ichim et al., "Limited mitochondrial permeabilization causes DNA damage and genomic instability in the absence of cell death," Mol Cell, 57:860-72, 2015. 4. H.M. Tang et al., "Detecting anastasis in vivo by CaspaseTracker biosensor," J Vis Exp, 132:e54107, 2018. 5. H.M. Tang et al., "Molecular signature of anastasis for reversal of apoptosis," F1000 Res, 6:43, 2017. 6. G. Sun et al., "A molecular signature for anastasis, recovery from the brink of apoptotic cell death," J Cell Biol, 216:3355-68, 2017. 7. H.L. Tang et al., "In vivo CaspaseTracker biosensor system for detecting anastasis and non-apoptotic caspase activity," Sci Rep, 5:9015, 2015. 8. A.X. Ding et al., "CasExpress reveals widespread and diverse patterns of cell survival of caspase-3 activation during development in vivo," eLife, 5:e10936, 2016. 9. G. Sun, D.J. Montell, "Q&A: Cellular near death experiences-what is anastasis?" BMC Biol, 15:92, 2017. 10. Y.N. Gong et al., "ESCRT-III acts downstream of MLKL to regulate necroptotic cell death and its consequences," Cell, 169:P286-300.e16, 2017. 11. J.C. Hamann et al., "Entosis is induced by glucose starvation," Cell Rep, 20:201-10, 2017. |