Eat Yourself to Live: Autophagy’s Role in Health and Disease | |
|---|---|
|
|
 New details of the molecular process by which our cells consume themselves point to therapeutic potential. New details of the molecular process by which our cells consume themselves point to therapeutic potential. В середине 1950s, Sam Clark Jr. из School of Medicine at Washington University in St. Louis обнаружил посредством ЭМ в почках новорожденных мышей некие пятна, о которых не было ничего известно. Позднее он описал их как связанные в цитоплазме клеток почек. Оказалось, что эти структуры содержат измененные митохондрии.1
Вскоре после Clark опубликовали свои наблюдения др. исследователи, которые использовали термин для этих структур цитолизосомы. 2 "Цитоплазма какм-то образом обнаруживается внутри капель и, по-видимому, находится в процессе переваривания."
Это были первые описания того, что сегодня известно как макро-аутофагия (после этого обозначаемая как аутофагия, самопоедание). Во время аутофагии клетка потребляет части себя регулируемым способом.
Характерным признаком аутофагии является образование временных состоящих из двойных мембран структур, обозначаемых фагофорами. В противоположность секреторным транспортным пузырькам, которые отпочковываются от органелл, с грузом, уже заключенным внутри, фагофоры приобретают приобретают груз во время своей сборки. Они могут формироваться de novo в цитоплазме в качестве свободно расположенных структур или могут контактировать с органеллами, такими как эндоплазматический ретикулум. Фагофоры постепенно расширяются, обнаруживая потрясающую гибкость относительно грузоподъемности. Как только они расширятся, они секвестрируют цитоплазматические компоненты, включая белки, липиды и даже целые органеллы. Как только они оказываются загружены необходимым грузом, фагофоры закрываются и созревают в аутофагосомы, с секвестрированным грузом, теперь заключенным в просвете этого компартмента. Аутофагосомы затем высвобождают груз посредством слияния мембран с литическими компартментами - вакуолями у грибов и растений с лизосомами у метазоа для деградации и переработки.
TYPES OF AUTOPHAGY Аутофагия может быть подразделена на две крупные категории, избирательная и не избирательная, базируясь на природе того, что они поглощают. Наиболее активно исследовали и охарактеризовали форму аутофагии, макроаутофагию, которая участвует в доставке клеточных компонентов к лизосомам (или вакуолям у грибов и растений) посредством структур из двойной мембраны. Две др. формы, находящиеся вне рассмотрения в данной статье, - это микроаутофагия и обеспечивая шаперонами аутофагия. Во время микроаутофагии мембраны лизосом инвагинируют и секвестрируют соседний клеточный материал для деградации и преобразования. Обеспечиваемая шаперонами аутофагия, напротив, специализируется на процесс деградации белков с использованием соотв. лизосомных транспортеров.
Сегодня аутофагия рассматривается как критический процесс для поддержания клеточного гомеостаза, а также для реакции на стрессы, такие как дефицит питательных веществ. Когда клетка подвергается воздействию таких стрессовых факторов, то аутофагия, которая происходит постоянно на низких уровнях для обеспечения баланса постоянному синтезу биомолекул, она сильно возрастает. Это усиление вызывает секвестрацию и деградацию частей клетки, высвобождение макромолекул обратно в цитозоль, чтобы поддержать важные метаболические реакции и генерировать энергию.
Вклад аутофагии в здоровье клеток в нормальных и стрессовых состояниях указывает на важную физиологическую и патологическую роль для этого тонко регулируемого процесса. В самом деле, аутофагия, как было установлено, служит определенным способом во время развития млекопитающих. Кроме того, недавние исследования установили, что аутофагия является критическим модулятором широкого круга болезней и нарушений. Исследования участия аутофагии в развитии и при болезнях являются важными для полного понимания её ролей и имеет значение для поддержания здоровья или лечения болезней. Пока нам лишь частично понятны общая морфология и функция.
Mechanisms of autophagy
Некоторые катаболические пути в клетке разрушают крупные молекулы. Так, конъюгация малого белка, наз. ubiquitin с др. клеточным белком - часто сопровождаемая последовательным добавлением молекул ubiquitin, чтобы генерировать цепочку polyubiquitin - может метить белок, предназначенный для деградации с помощью протеосом, приводя к высвобождению аминокислот. (See "The Proteasome: A Powerful Target for Manipulating Protein Levels," The Scientist, May 2017.) Подобные механизмы деградации существуют и для др. биологических полимеров, таких как углеводы и липиды.
Что делает аутофагию уникальной? Ответ заключается в её гибкости размера и выбора груза. Аутофагия может способствовать массовой деградации для большого количества и разнообразных субстратов, позволяя клеткам быстро и эффективно генерировать преобразованные основные строительным материалы перед лицом широкого круга дефицитов питательных веществ. Кроме того, аутофагия является единственным способом, который способен деградировать целые органеллы, случайно или целенаправленно - критический процесс для поддержания гомеостаза в сложном ландшафте клеток эукариот.
Аутофагия тонко регулируется, чтоб гарантировать, что она будет задействована только когда это необходимо и своевременно. Центральный метаболический сенсор клетки, TOR complex 1 (TORC1 или MTORC1 у млекопитающих), чувствителен к доступности аминокислот и ростовых факторов и ингибирует индукцию аутофагии, если эти компоненты присутствуют в достаточном количестве. Когда клетки голодают относительно этих молекул, то TORC1/MTORC1 инактивируется, способствуя усилению аутофагии. Между тем др. молекулярные регуляторы мониторят клетки в отношении состояния различных питательных веществ, таких как глюкоза или энергия в форме АТФ и запускают аутофагию, когда запас ткаих питательных веществ или метаболитов достигает критически низких уровней.
Как только инициируется аутофагия, то некоторые связанные с аутофагией (Atg) белки действуют совместно, чтобы скоординировать образование фагофор и последующие ступени аутофагии. Дрожжевые ATG гены были открыты в 1990s, они, по-видимому, действуют очень механистически на молекулярном уровне. Эксперименты с использованием хорошо изученных генетически почкующихся дрожжей Saccharomyces cerevisiae сыграли важную роль в дешифровке основного механизма аутофагии. Исследования на др. организмах, проводимые после этого, выявили удивительную эволюционную консервацию природы и функции аппарата аутофагии от дрожжей до человека. (See illustration here.)
Хотя в целом процесс аутофагии теперь стал намного яснее, но эта область всё ещё ьоудна для поиска многих отсутствующих кусочков мозаики. Напр., донор мембран для аутофагосом в точности не установлен. (See "The Enigmatic Membrane," The Scientist, February 2012.) Кроме того, мы до конца не понимаем, как регулируется экспансия фагофор или чем диктуется частота генерации аутофагосом. Ещё больше вопросов возникает, когда мы принимаем во внимание, что многие типы аутофагии чрезвычайно избирательны и инициация и регуляция этих процессов остается загадкой. Изучение этих избирательных путей является важным, поскольку они интимно связаны с эмбриональным развитием, здоровым ростом и болезнями человека.
Autophagy in development
В конце 1970s, Richard Lockshin из St. John's University in New York с колл. продемонстрировали, что аутофагия возникает во время метаморфоза у насекомых.3 Спустя 15 лет исследователи показали, мутантные дрожжевые клетки, дефектные по аутофагии, не образуют спор.4 Это были первые намеки, что аутофагия может играть роль в развитии организмов, но лишь сравнительно недавно исследователи начали выявлять процессы, вносящие вклад в клеточную дифференцировку и развитие метазоа.
 Более 15 лет назад исследователи продемонстрировали, что неизбирательная аутофагия, которая преимущественно является ответом на голодание, необходима также во врея раннего эмбриогенеза млекопитающих. Аутофагия, скорее всего, является критической для репрограммирования ооцитов после оплодотворения. Ооциты оказываются нагруженными происходящими от матери мРНК и белками, которые деградируют после слияния со спермием и делением зиготы на две клетки, когда геном собственно эмбриона начинает действовать. (See "New Techniques Detail Embryos' First Hours and Days," The Scientist, December 2017.) Такой переход от материнского к эмбриональному контролю, скорее всего, зависит, по крайней мере, частично от аутофагии. Одним из доказательств такой гипотезы является то, что мышиные эмбрионы, гомозиготные по нокауту Atg5, происходящие от ооцитов, которые были истощены по транскриптам Atg5, погибают где-то на ст. 4-8 клеток.5
Аутофагия, скорее всего, необходима также для перехода от плодного к новорожденному состоянию после рождения. Гомозиготные по Atg5-null мышиные эмбрионы, получаемые из ооцитов, не подвергшихся манипуляциям от гетерозиготных Atg5 матерей жизнеспособны во время беременности, по-видимому, благодаря присутствию происходящих от матери ATG5 в ооцитах, но погибают в течение одного дня после рождения.6 В самом деле, значительное увеличение аутофагии наблюдается в определенных тканях мышей, включая сердце, вскоре после рождения. Причина такого увеличения может быть временной, но при сильном голодании, вызываемом при завершении плацентарного питания; аутофагия помогает выделению источников аминокислот и энергии, необходимых для выживания во время этого периода.
Избирательная аутофагия также играет важную роль во время постэмбрионального развития. Функция транспорта кислорода эритроцитами зависит от присутствия крупных количеств белка, связывающего кислород, гемоглобина. Чтобы обеспечить эту потребность, предшественники ретикулоциты д. потерять большинство органелл, когда они превращаются в зрелые эритроциты. Ретикулоциты теряют митохондрии посредством mitophagy, избирательной аутофагической деградации. Целенаправленная деградация митохондрий также происходит во время развития зигот у некоторых видов метазоа, делая возможной элиминацию отцовских митохондрий Так. что наследуются только материнские митохондрии.7 В 2017, Beth Levine из University of Texas Southwestern Medical Center с колл. идентифицировали белок внутренней митохондриальной мембраны, который функционирует как новый рецептор для mitophagy, и показали, что этот белок играет существенную роль в очистке от отцовских митохондрий у C. elegans.8
Существуют некоторые подозрения на роль аутофагии в нормальном развитии. Кгода организм созревает, то этот путь преобразования продолжает поддерживать здоровый баланс между функциональными органеллами и базовыми биомакромолекулами в клеточном окружении. Дальнейшее выяснение роли аутофагии не только на механистическом уровне, но и также в терминах физиологических исходов, будет важным для понимания, как этот динамический процесс регулирует метаболический гомеостаз в организмах всех возрастов.
Autophagy gone awry 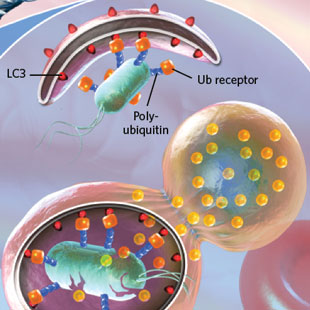 SELECTIVE AUTOPHAGY
See full infographic: WEB | PDF© N.R.FULLER, SAYO-ART LLCGiven the role of autophagy in physiology, it's not surprising that dysregulation of the process is tied to a number of pathologies, ranging from infectious diseases to neurodegenerative disorders to cancer. Understanding the relationship between autophagy and disease could be critical to designing effective therapeutic interventions.
Первое сообщение об индукции аутофагии в ответ на инфекцию было опубликовано в 1984, когда Yasuko Rikihisa из Virginia Tech's College of Veterinary Medicine, сообщил, что инкубация клеток млекопитающих с риккетсиями, бактериями, вызывающими разные передаваемые клещами болезни, запускает образование аутофагосом.9 Однако, исследователи лишь недавно поняли, как эукариотические клетки используют тип селективной аутофагии, наз. xenophagy, чтобы разрушать проникающие патогены. Xenophagy инициируется с помощью убиквитинирования белков на поверхности бактерий, которые затем распознаются с помощью ubiquitin-связывающих аутофагичных рецепторов, что способствует секвестрации патогенов с помощью фагофор (phagophores). (See illustration here.)
В этом контексте, аутофагия работает совместно с компонентами врожденной иммунной системы, такой как toll-like receptors (TLRs). TLRs обеспечивают первоначальное распознавание патогенов и последующая передача сигналов TLR способствует воспалению и может стимулировать аутофагию, по крайней мере, частично путем модификации рецепторов аутофагии.10 Поскольку воспаление является необходимой ступенью в рекрутировании иммунных клеток к месту инфекции, то распространенная воспалительная реакция может быть вредной для ткани. Исследование в лаб. Shizuo Akira at Osaka University in Japan показало, что потеря важного для аутофагии белка ATG16L1 ведет к усилению продукции способствующих воспалению цитокинов у мышей.11 Эта находка подтверждает, что во время воспалительной реакции, аутофагия не только обеспечивает элиминацию патогена, нои может также ограничивать воспаление, чтобы предупредить нежелательные повреждения ткани.
Недавно в работе J. Magarian Blander's laboratory at Weill Cornell Medical College было установлено, что аутофагия эндоплазматического ретикулума является важным компонентом пути клеточной стрессовой реакции, инициируемого после инфекции живыми Gram-позитивными бактериями. В этом каскаде аутофагия играет инструментальную роль по мобилизации эффективной реакции врожденного иммунитета в ответ на стрессовую реакцию от инфицированных клеток, частично за счет перемещения сенсорного белка TMEM173/STING.12
Однако, модулирование иммунной системы с помощью аутофагии не всегда благоприятно. Недавнее исследование в Jan L?nemann's laboratory at the University of Zurich показало, что компоненты аппарата аутофагии могут играть роль в усилении множественного склероза, аутоиммунного заболевания, затрагивающего ЦНС. Класс иммунных клеток, наз. дендритными клетками, использует ATG-зависимый фагоцитоз, чтобы презентировать пептиды, происходящие в результате деградации миелинизированных клеток, находящихся в ЦНС, в качестве антигенов. Эти само-антигены способствуют активации аутореактивных эффекторных Т клеток, что ведет к аутоиммунной атаке и прогрессирующей дегенерации нервов.13
Главная роль аутофагии, однако, безусловно защита клеток, это подчеркивается её защитной функцией при некоторых нейродегенеративных нарушениях, таких как болезнь Гентингтона (HD) и болезнь Паркинсона (PD). David Rubinsztein из Cambridge Institute for Medical Research с колл. впервые показали, что аутофагия способствует деградации склонных к агрегации белков, таких как мутантный HTT (huntingtin), один из главных виновников HD.14 Позднее они сообщили, что активация аутофагии устраняет нейродегенеративный фенотип у модельных мышей и мух HD.15
При PD, потеря mitophagy была установлена как главный ключевой фактор в патогенезе. Хотя большинство случаев PD спорадические, мутации в генах, связанных с mitophagy PINK1 и PRKN обычно ассоциируют с семейными случаями PD. В 2016, исследователь из Stanford University School of Medicine laboratory of Xinnan Wang установил, что спорадические случаи PD также могут быть интимно связаны с дефицитом mitophagy.16 Это не стало поскольку нейроны сильно зависят от синтеза митохондриальных АТФ для обеспечения процессов с интенсивными затратами энергии, такими как генерация и передача потенциалов действия, передачи нейротрансмиттеров и передачи синаптических сигналов. Следовательно, митохондриальный гомеостаз является критическим для исполнения функций нейронами продукции АТФ, но и также генерируют высокие уровни реактивных видов кислорода (ROS), это способствует окислению белков и липидов и повреждениям ДНК, вызывающими дисфункцию клеток. ROS-индуцируемая гибель мутантных дефицитных по mitophagy нейронов, скорее всего, является главным фактором патогенеза PD. Mutations in the mitophagy-related genes PINK1 and PRKN are commonly associated with familial PD. Аутофагия также оказалась связанной с раком. В 1999, группа Levine сделала важное открытие, что мыши только с одной функциональной копией связанного с аутофагией гена Becn1 обнаруживают повышенный туморогенез.17 В противовес кажущейся роли аутофагии в блокировке инициации опухолей, однако, появились доказательства, что аутофагия может также способствовать озлокачествлению в в возникших опухолях. Двойственность аутофагии в канцерогенезе частично объясняется факторами, участвующими в генерации или прогрессирования опухолей. Онкогенной трансформации способствуют стрессовые факторы, такие как геномная нестабильность, метаболические нарушения и дисфункции митохондрий; аутофагия активно супрессирует эти стрессы и тем самым подавляет инициацию опухолей. Однако, как только опухоль сформируется, область действия резко меняется. Клетки внутри опухоли повышают метаболические потребности благодаря более быстрому росту и скорости пролиферации, но такие канцерогенные клетки снабжаются недостаточно питательными веществами посредством кровоснабжения. У таких клеток повышаются метаболические потребности обеспечиваются посредством усиления аутофагии.
Недавнее исследование установило, что роль аутофагии в обеспечении опухолевой прогрессии не ограничивается эффектами на клетки в самой раковой опухоли, но и вызвает модуляции опухолевого микроокружения. В 2017 группа Tor Erik Rusten's из University of Oslo продемонстрировала, чт у Drosophila melanogaster, повышенная аутофагия внутри опухолевого микроокружения способствует опухолевому росту и инвазии.18 Сходным образом в работе Alec Kimmelman с колл. из NYU Langone Health's Perlmutter Cancer Center выявила взаимодействие между опухолевыми клетками аденокарциномы протоков поджелудочной железы и ассоциированными со стромой pancreatic stellate cells (PSCs). Это исследование подтвердило, что опухолевые клетки способствуют аутофагии в PSCs, стимулируя продукцию метаболитов и базовых биомолекул этими клетками. Опухолевые клетки затем отлавливают и используют эти метаболиты для своего выживания и роста в условиях бедных питательными веществами.19
Поскольку жизнеспособность раковых клеток зависят от аутофагии, то подавление этого процесса является заманчивой стратегией для терапии опухолей; однако, ограничение аутофагии может повышать чувствительность к инфекции и нейродегенерации.
20
References
1. S.L. Clark Jr., "Cellular differentiation in the kidneys of newborn mice studied with the electron microscope," J Cell Biol, 3:349-62, 1957.
2. A.B. Novikoff, E. Essner, "Cytolysomes and mitochondrial degeneration," J Cell Biol, 15:140-46, 1962.
3. J. Beaulaton, R.A. Lockshin, "Ultrastructural study of the normal degeneration of the intersegmental muscles of Anthereae polyphemus and Manduca sexta (Insecta, lepidoptera) with particular reference to cellular autophagy," J Morphol, 154:39-57, 1977.
4. M. Tsukada, Y. Ohsumi, "Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae," FEBS Lett, 333:169-74, 1993.
5. S. Tsukamoto et al., "Autophagy is essential for preimplantation development of mouse embryos," Science, 321:117-20, 2008.
6. A. Kuma et al., "The role of autophagy during the early neonatal starvation period," Nature, 432:1032-36, 2004.
7. M. Sato, K. Sato, "Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos," Science, 334:1141-44, 2011.
8. Y. Wei et al., "Prohibitin 2 is an inner mitochondrial membrane mitophagy receptor," Cell, 168:224-38.e10, 2017.
9. Y. Rikihisa, "Glycogen autophagosomes in polymorphonuclear leukocytes induced by rickettsiae," Anat Rec, 208:319-27, 1984.
10. P. Wild et al., "Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth," Science, 333:228-33, 2011
11. T. Saitoh et al., "Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production," Nature, 456:264-68, 2008.
12. J. Moretti et al., "STING senses microbial viability to orchestrate stress-mediated autophagy of the endoplasmic reticulum," Cell, 171:809-23.e13, 2017.
13. C.W. Keller et al., "ATG-dependent phagocytosis in dendritic cells drives myelin-specific CD4+ T cell pathogenicity during CNS inflammation," PNAS, 114:E11228-E11237, 2017.
14. B. Ravikumar et al., "Aggregate-prone proteins with polyglutamine and polyalanine expansions are degraded by autophagy," Hum Mol Genet, 11:1107-17, 2002.
15. B. Ravikumar et al., "Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease," Nat Genet, 36:585-95, 2004.
16. C.-H. Hsieh et al., "Functional impairment in miro degradation and mitophagy is a shared fea ture in familial and sporadic Parkinson's disease," Cell Stem Cell, 19:709-24, 2016.
17. X.H. Liang et al., "Induction of autophagy and inhibition of tumorigenesis by beclin 1," Nature, 402:672-76, 1999.
18. N.S. Katheder et al., "Microenvironmental autophagy promotes tumour growth," Nature, 541:417-20, 2017.
19. C.M. Sousa et al., "Pancreatic stellate cells support tumour metabolism through autophagic alanine secretion," Nature, 536:479-83, 2016.
20. G. Karsli-Uzunbas et al., "Autophagy is required for glucose homeostasis and lung tumor maintenance," Cancer Discov, 4:914-27, 2014.
|