Посещений: 
ХОЛЕСТЕРИН И СФИНГОЛИПИДЫ
при развитии и болезнях головного мозга
Role of cholesterol and sphingolipids in brain development and neurological diseases Ghulam HussainEmail,Jing Wang, Azhar Rasul,et al.
 Lipids in Health and Disease201918:26
https://doi.org/10.1186/s12944-019-0965-z
| |
|
Головной мозг представлен более чем 100 миллиардами нервных клеток, которые общаются с помощью хорошо известных структур, синапсов. Он служит в качестве первичного центра для инициации, координации, интерпретации и интеграции большинства нервных сообщений [1]. Он контролирует многие бессознательные функции тела, такие как процессы дыхания и сердцебиения. Он также синхронизирует большую часть произвольной активности [2]. Интересно, что эта сложная и важная система тела человека сильно обогащена липидным содержимым и является в этом отношении следующим после жировой ткани [3, 4, 5]. Липиды составляют 50-60% от его сухого веса [6] и существенное количество липидов нервной системы присутствует с миелиновых слоях, в частности формируя мембраны с максимальным содержанием липидов по сравнению с остальными биологическими мембранами [7]. Липиды, обнаруживаемые в головном мозге группируются как sphingolipids, glycerophospholipids и cholesterol и присутствуют почти в равных пропорциях [8, 9]. Эти липиды участвуют в развитии, поддержании и во многих др. клеточных процессов головного мозга. Липиды действуют как сигнальные молекулы, источники энергии, для внесения вклада в синаптогенез, нейрогенез, проведение импульсов и многие др. [1, 7]. Более того, lysophospholipids, endocannabinoids и sphingolipids (SP) участвуют также в передаче клеточных сигналов, включая регуляцию многочисленных ионных насосов, каналов и транспортеров [10, 11]. Все жизненно важные события, ответственные за развитие и поддержание функциональных активностей нервной системы зависит от содержания уникальных липидов, обнаруживаемых в разных регионах мембран (липидные платформы) нервных клеток. Любые изменения в метаболизме липидов приводят к изменениям композиции липидов компартментов внутриклеточных мембран, которые являются общими биомаркерами при многих нервных болезнях [3, 4]. Липидные платформы обнаруживаются в мембранах нервных клеток, содержащих холестерол и сфинголипиды (особенно glycosphingolipids) [9, 12, 13]. Более того, давно известно, что миелиновые структуры и гомеостаз головного мозга базируются на специфических липид-белковых взаимодействиях и на специфической передаче межклеточных сигналов [13]. Большая часть нарушений и повреждений ЦНС связана с нарушениями липидного метаболизма, как при болезни Альцгеймера (AD), Паркинсона (PD), Гентингтона (HD), шизофрении, эпилепсии и биполярных расстройствах, при которых происходит прогрессирующая дегенерация нейронов [3, 14].
Cholesterol
Холестерин, жизненно важная составляющая часть нормально функционирующей нервной системы, он играет важную роль как во время развития, так и во взрослой жизни [9]. Головной мозг содержит приблизительно 25% от всего холестерола в теле и считается как богатый холестеролом орган [15]. Холестерол является наиболее важным компонентом и фундаментальной функциональной единицей клеточной мембраны млекопитающих [16]. Большая часть холестерола располагается в головном мозге в форме миелина [17], который содержит почти 80% холестерола, обнаруживаемого в головном мозге взрослых [13]. Поэтому он является ключевым составляющим миелина в ЦНС и ПНС, который синтезируется олигодендроцитами и Шванновскими клетками, соотв. [13]. У человека и др. грызунов холестерол активно синтезируется в ЦНС во время первых нескольких недель после рождения и на этой неонатальной стадии любое нарушение синтеза и снабжения может приводить к возникновению нейродегенеративных нарушений (NDDs) [18]. Итак, холестерол необходим для клеточных процессов, напр., пролиферация глиальных клеток, рост нейритов, стабильность микротрубочек, синаптогенез и миелинизация [19]. Большое количество исследований подтверждает, что доступность холестерола для функционирования олигодендроцитов выступает в качестве лимитирующего фактора созревания головного мозга, миелинизации и нейротрансмиссии [20]. Холестерол может быть синтезирован эндогенно или может быть добавлен экзогенно с помощью эндоцитоза липопротеинов плазмы; напр., low density lipoproteins (LDLs) опосредуются с помощью определенных рецепторов [21]. Скорость синтеза холестерола зависит от хода процесса миелинизации, а избыток холестерола экспортируется в форме 24-hydroxycholesterol для поддержания гомеостаза холестерола [22, 23]. Нейроны могут синтезировать только минимальные количества самого холестерола и в основном базируются на cholesterol-содержащих липопротеинах, секретируемых астроцитами [24].
Метаболизм холестерина в ЦНС отличается от такового в ПНС. Гемато-энцефалический барьер (BBB) препятствует прохождению плазматических липопротеинов в ЦНС, поэтому потребности в холестероле в ЦНС восполняются за счет локально синтезированного холестерина [25]. В ЦНС транспорт холестерола осуществляется с помощью специальных липопротеинов, таких как Apolipoprotein-E (Apo-E), секретируемый астроцитами [26-28]. Комплекс cholesterol-Apo-E ускоряет рост аксона, если воздействие приходится на на дистальный конец, но не на тело нейрона [29, 30].
Регенерация исцеляет или полностью замещает поврежденные нервные клетки. Это происходит в результате настоятельной потребности в поддержании нормальной физиологии после повреждения., но, к сожалению, эта способность ограничена у высших организмов, включая человека [31]. Нейроны ЦНС ntz.n свою способность к регенерации в раннем развитии, а отвечающие за это механизмы плохо изучены [32]. В этой связи исследования продемонстрировали, что это ограничение регенерации нейронов связано с экспрессией Nogo-A и NgR1 рецепторов после повреждений в ЦНС [33]. Задержка регенерации аксонов является главным препятствием для функционального восстановления после таких повреждений [34], которые могут приводить к длительной недееспособности [14]. Холестерол регулирует большое количество путей, которые играют критическую роль в здоровье головного мозга. Сходным образом, он также играет важную роль в регенерации нервов. Хотя холестерол и его метаболиты влияют на регенерацию нервов положительно, но в состоянии нарушенной метаболической регуляции холестерол рассматривается как причинный фактор при некоторых нарушениях головного мозга.
 Fig. 1
Role of cholesterol in brain health and disorders
Fig. 1
Role of cholesterol in brain health and disorders
Cholesterol in synaptogenesis
Синаптогенез, процесс формирования синапсов, зависит от холестерола, а доступность холестерола является ограничивающим фактором для формирования синапсов в головном мозге. Глиальные клетки предоставляют большие количества холестерола в форме комплекса cholesterol-Apo-E для массивного синаптогенеза [28, 35]. Происходящий из глии холестерол способствует развитию синапсов высоко очищенных ретинальных ганглиолярных клеток (RGCs). Это исследование также показало, что холестерол усиливает пресинаптическую дифференцировку. Это жизненно важно постоянного синаптогенеза и важно для стабильности нейротрансмиттеров. Эти находки четко продемонстрировали, что холестерол играет ключевую роль в дифференцировке и пластичности нейронов [19]. Соотв. доступность холестерола необходима для нормальной функции и морфологии нейронов. Функции нейронов нарушаются не только из-за его дефицита, но и также из-за избыточного уровня [36, 37]. Уровень холестерола в головном мозге четко отслеживается с помощью многих факторов. Brain-Derived Neurotrophic Factor (BDNF) обеспечивает биосинтез холестерола в ЦНС, он служит в качестве хранилища для формирования синаптических пузырьков [38]. Обрывочные доказательства показывают, что пре- и постсинаптические области богаты холестеролом, который поддерживает и организует синаптические белки. Тем самым влияет на нейротрансмиссию и синаптическую пластичность, которые в дальнейшем облегчают нормальное развитие когнитивных способностей [39].
Cholesterol in peripheral nerve injury
Повреждения периферической нервной системы (PNI) могут оказывать потенциально разрушительное влияние на качество жизни пациента, приводя к существенным социальным и персональным затратам [40]. Потребность в холестероле повышается в случае регенерации нервов, т.к. он важный модулятор регенерации аксонов после повреждений нервов [41]. Холестерол играет критическую роль в регенерации нервов после повреждений в ЦНС и ПНС. Локальная доступность холестерола при повреждениях необходима для регенерации нервов [42]. Это происходит при повышении потребления холестерола в форме липопротеинов из макрофагов, которые преобразуют холестерол из дегенерирующих нейронов. Установлено, что поврежденные нервы реагируют на повышенную доставку экзогенно продуцируемого холестерола. Содержание холестерола в плазматической мембране играет ключевую роль в формировании комплекса synaptophysin-synaptobrevin, который регулирует рециклинг синаптических пузырьков для высвобождения нейротрансмиттеров [43]. В этом контексте регуляция липидов, особенно холестерола, может обеспечивать помощь против нейродегенеративных болезней или др. нарушений из-за проблем с нервами. Интересно, что некоторые исследования также продемонстрировали, что частичное восстановление возможно после повреждений нервов.
Богатый холестеролом транспортер липопротеин Apo-E , как полагают, накапливается в месте повреждения нерва [44]. Простое повышение доступности холестерола вносит вклад в регенерацию и ремиелинизацию и это подтверждает идею, что регуляция доступности холестерола после повреждения может помочь в восстановлении ПНС [45]. Роль Apo-E в созревании и регенерации седалищного нерва подтверждена многими исследованиями. После повреждения нерва холестерол умирающего аксона потребляется Шванновскими клетками и резидентными макрофагами. Это позволяет повторно использовать его для регенерации аксонов и транспортируется он в основном с помощью Apo-E. Apo-E синтезируется макрофагами и накапливается в месте регенерации аксона и его количество увеличивается после повреждения. По-видимому, эффективный транспорт липидов играет ключевую роль в регенерации нерва, поскольку LDL рецепторы обнаруживаются в виде кластеров на кончике растущего аксона. Экспрессия Apo-E увеличивается с повреждением и снижается, когда регенерация заканчивается [46]. Однако, в др. исследовании показано, что участие неизвестных рецепторов помимо low-density lipoproteins receptors (LDLR), которые, как полагают, в первую очередь участвуют в потреблении холестерола Шванновскими клетками для обеспечения регенерации нерва [47].
В случает повреждения с раздавливанием и аномального транспорта холестерола наблюдается задержка регенерации аксонов периферических нервов, но не влияет на ремиелинизацию нейронов с недостатком холестерола [48]. Это показывает, что синтез de novo холестерола Шванновскими клетками является достаточным для ремиелинизации, но рост аксона при этом затронут из-за недоступности холестерола. Это легло в основу идеи, контроль транспорта холестерола или улучшение его доступности при neurodegenerative diseases (NDDS) может в принципе защищать оит болезни или даже приводить к задержке начала болезни.
Cholesterol in neurodegenerative diseases
Хотя холестерол оказывает позитивный эффект на физиологические функции головного мозга, , однако, любое отклонение в его метаболизме ведет к возникновению различных болезней головного мозга.
Alzheimer's disease
из главных NDDs является болезнь Альцгеймера (AD), которая характеризуется агрегацией β-amyloid (Aβ) пептидов и старческими бляшками [1, 49]. Образование бляшек при AD приводит к повреждениям нейритов и синапсов. Важно, что Aβ формируются в результате последовательного расщепления Amyloid precursor proteins (APP) и β-secretase (beta-site amyloid precursor protein cleaving enzyme, BACE), это обеспечивается с помощью фермента gamma secretase [50]. Хорошо известно, что аномальный метаболизм холестерола играет критическую роль в возникновении AD. Нарушение регуляции уровня цитозольного кальция происходит в астроцитах в случае AD , это приводит к гибели нейронов. Высокий уровень холестерола в мембранах приводит к инкорпорации Aβ в мембраны и также повышает уровень кальция в цитозоле, вызывая гибель нейрональных клеток [51, 52]. Apo-E является главным переносчиком, участвующим в транспорте холестерола и имеет три изоформы, известные как ε2, ε3 и ε4. Личность, несущая аллель ε4 в своем геноме обладает высоким риском развития AD. Этот липопротеин связывает многочисленные рецепторы на поверхности клетки для доставки холестерола, а также Aβ пептид, который инициирует события токсичности и приводит к нейродегенерации и дисфункции синапсов при AD [53]. Он также влияет на метаболизм холестерола и приводит к образованию продуктов окисления холестерола (oxysterols) [54]. Исследования показали, что диета, содержащая высокие количества холестерина повышает уровень Aβ пептидов. Концентрация в сыворотке холестерола возрастает приблизительно на 10% у AD пациентов по сравнению со здоровыми индивидами [55]. Более того, агрегация холестерола в системе эндосом-лизосом приводит к изменению процессинга APP и к генерации Aβ пептидов и запускает также дегенерацию [56]. Кроме того, независимо от Apo-Eε4, увеличивается концентрация LDL и снижается концентрация HDL в соотв. с показателями Aβ [57, 58]. Следовательно, можно утверждать, что диета с низким содержанием LDL-C будет значительно модулировать симптоматику AD.
Parkinson's disease
Болезнь Паркинсона (PD) является второй по значимости среди NDDs после AD. Эта патология связана с потерей допаминергических нейронов в SN (substantia nigra) и накоплением α-synuclein и образованием телец Lewy [59]. Известно, что высокий уровень липида способствует накоплению α-synuclein, главного составляющего телец Lewy, путем стимуляции их зарождения (nucleation) [60]. Недавно было продемонстрировано, что высокий уровень холестерола и его окисленного продукта (oxysterol) играет критическую роль в развитии PD за счет агрегации α-synuclein. Это также вызывает воспаление, повышает оксидативный стресс и приводит к гибели допаминергических нейронов [61, 62]. Подтверждено, что высокий уровень холестерола и oxysterols инициирует патологические пути агрегации α-synuclein, увеличивая тяжесть PD. Oxysterols инициируют несколько патологических путей, подобных клеточной гибели вследствие воспаления и окисления, приводя в конечном итоге к агрегации α-synuclein. Очевидно, что высокие уровни холестерола и oxysterols вносят существенный вклад в патогенез PD и также служат потенциальными биомаркерами [61, 63, 64] Fig. 2.
 Fig. 2
Role of cholesterol in Alzheimer's and Parkinson's disease Fig. 2
Role of cholesterol in Alzheimer's and Parkinson's disease
Huntington's disease
Болезнь Гентингтона (HD) относится к семейству NDDs, она вызывается мутацией в аутосомно доминантном аллеле и аномальным увеличением повторов CAG в гене Htt (huntingtin). Она характеризуется дегенерацией нейронов коры и полосатого тела [65]. Метаболизм холестерола нарушен при HD и пропорционален длине CAG повторов. Его уровень понижен на продвинутой стадии HD [66, 67]. Недавно было проведено измерение синтетических предшественников, их метаболитов и продуктов окисления холестерола в 5 областях головного мозга умерших пациентов с HD. И было сделано заключение, что головной мозг человека с HD обнаруживает существенно сниженный метаболизм холестерола.
Neurological and psychiatric disorders
Подтип глютаматовых рецепторов, наз. N-methyl-D-aspartate receptors (NMDARs), которые обеспечивают нейрональную передачу возбуждений, играют критическую роль в функции головного мозга [68]. Нейрологические и психиатрические нарушения, такие как инсульт, шизофрения и некоторые формы аутизма могут быть приписаны дисфункции NMDARs [69, 70]. 24S-hydroxycholesterol, метаболит холестерола в головном мозге, позитивный модулятор NMDARs, если применяется экзогенно [71, 72]. Исследования продемонстрировали модуляторный эффект эндогенного 24S-hydroxycholesterol на активность NMDARs и что он модулирует NMDAR-опосредованные функции. Он может быть потенциальной терапевтической мишенью для лечения нейро-психиатрических нарушений [73]. Сообщалось, что дефицит LDL-C, вызываемый мутациями в 3-hydroxy-3-methylglutaryl-CoA reductase (вовлеченной в LDL-C), и гены proprotein convertase subtilisin kexin 9 (участвующие в LDL-C) связаны с повышенным риском нейрологических болезней и NDDs. Исследование показало, что пониженный уровень LDL-C связан с повышенным риском эпилепсии [74].
Sphingolipids
Sphingolipids (SP) представлены молекулами, обнаруживаемыми у всех эукариот немногих вирусов и прокариот. Этот класс липидов происходит из клеточных мембранных липидов, наз. sphingomyelin (SM) [75]. Гидрофобная цепочка ceramide является обычной молекулой в их структурной основе. Синтез SP нуждается в Palmitoyl-CoA и l-serine. Хотя, l-serine не считается важной аминокислотой, но её добавка извне является жизненно важной для синтеза phosphatidylserine (PS) и sphingolipids в специфических типах нейронов [76]. Имеется несколько сотен разного типа SP, некоторые из них играют важную роль в разных физиологических процессах. Напр., ceramide, sphingosine (Sph), Sph-1-phosphate (S1P) и Cer-1-phosphate (C1P) действуют как биоактивные молекулы в разных клеточных процессах, напр., в регуляции сигнальной трансдукции, сортировке белков, для обеспечения межклеточных взаимодействий и распознавания [77, 78]. Они вносят вклад в структуру мембранного липидного бислоя и липидных плотиков, которые выполняют регуляторную роль в клеточных функциях [79]. SP являются повсеместными и играют существенную роль собственно в функционировании и развитии головного мозга. Это не только жизненно важные структурные компоненты плазматических мембран, но и также известны как важные регуляторы различных клеточных процессов, благодаря их способности создавать микродомены в плазматических мембранах. Они участвуют в дифференцировке нейронов и синаптической трансмиссии в соединениях между нейронами и глией и связаны также со стабильностью миелина. Т.о., любые пертурбации метаболизма SP могут привести к перестройкам плазматической мембраны и развитию разных нейрологических болезней [79]. Патологические изменения в нормальном метаболизме SP и их гомеостазе являются широко распространенными факторами, приводящими к прогрессированию шизофрении и метаболическому синдрому. Они выполняют важную структурную и функциональную роль в клеточном цикле и воспалительных процессах, которые являются частью патофизиологических процессов , участвующих в развитии таких болезней [80].
Sphingolipids in synaptogenesis
Процесс синаптогенеза обычно осуществляется в ходе всей жизни у здоровых индивидов, но он является критическим во время раннего развития головного мозга. В этой связи хорошо известен класс липидов, наз. SP. которые играют важную роль. Синаптогенез и синаптическая пластичность участвуют в разных феноменах, таких как периодическая пресинаптическая стимуляция и долговременная потенциация [81]. Важно, что нейрональная пластичность служит для модуляции эффективности синапсов и управляется с состава синаптических структур. SP интимно участвуют в организации нейрональных мембран. Поэтому неудивительно, что альтерации этого пути оказываются связанными с нарушениями нейрональной пластичности. Нейтральная sphingomyelinase-2 (nSMase) присутствует в гиппокампе и гидролизует sphingomyelin (SM) в ceramide и модулирует пост-синаптическую функцию [82]. Она регулирует пост-синаптические возбуждающие токи путем контроля кластеров рецепторов NMDA и инсерций в мембраны [83]. Некоторые доказательства подтверждают, что мыши, дефицитные по nSMase имеют нарушенную, эпизодичную и пространственно нарушенную пластичность [84]. Жизненно важно удерживать баланс между ceramide и SM для поддержания нормального статуса [81]. Недавняя работа подтвердила, что SP также стимулируют высвобождение трансмиттеров в окончаниях возбуждающих синапсов. Они усиливают скорость трансмиссии глютамата в гиппокампе и также стимулируют высвобождение глютамата из синаптосом [85]. Интересно, что sphingosine-1-Phosphate (S1P) регулирует локализацию synapsin-I в пре-синаптических компартментах и, следовательно, имеют значительное влияние на модуляцию пресинаптических функций. S1P и SP стимулируют высвобождение глютамата из синаптосом вместе с неслыханным увеличением трансмиссии глютамата в гиппокампе [85-87]. Все эти находки помогают определить роль SP в регуляции синаптической активности. Теперь считается, что их присутствие в пресинаптических сайтах влияет на активность синаптических пузырьков и стимулирует синаптическую передачу.
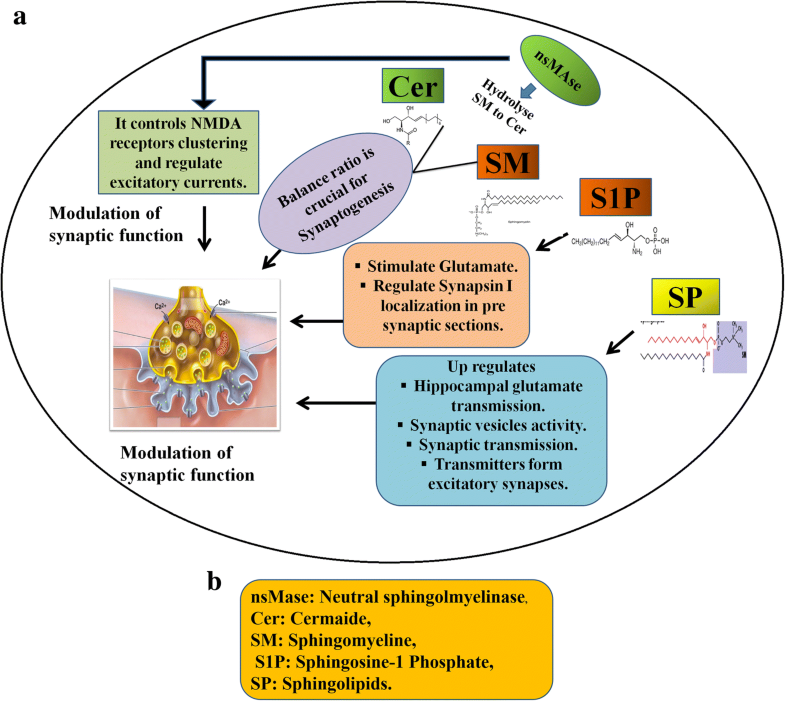 Fig. 3
Role of Sphingolipids on Synaptic function and formation Fig. 3
Role of Sphingolipids on Synaptic function and formation
Sphingolipids in neurogenesis
Головной мозг млекопитающих включает резидентные нейральные стволовые клетки (NSCs), которые облегчают развитие и функциональную зрелость нейронов при эмбриональной экспансии и этот процесс происходит в течение всей жизни [88]. Проекции аксонов и выросты из тела нейрона являются важными свойствами формирования нервной сети и пластичности. В этом контексте, роль SP очень уместна, поскольку они являются важным составляющим головного мозга. А именно, SM и ceramide участвуют в т. наз. процессе нейрогенеза. Важно, что в культуре нейронов гиппокампа истощение SM и ceramide сокращает рост аксона [79]. Однако, лежащий в основе механизм может использовать комбинированное подавление синтеза GluCer. Это свойство способствует снижению роста аксонов вместе с ветвлением нейронов [89]. Более того, в этой связи, одна из гипотез предполагает, что подавление синтеза ceramide приводит к накоплению предшественников ceramide, это возможно и ограничивает рост аксонов [79].
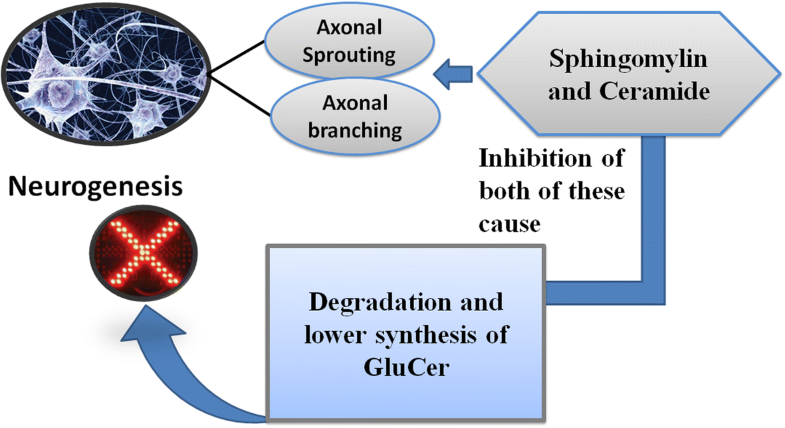 Fig. 4
Role of sphingolipids in neurogenesis Fig. 4
Role of sphingolipids in neurogenesis
Sphingolipids and neurodegenerative diseases
Важно защищать собственно метаболизм, состав и целостность sphingolipids для поддержания физиологических функций головного мозга. Не удивительно, что дефекты в метаболизме SP ассоциируют с многочисленными нейрологическими болезнями, подобными PD, AD и HD.
Parkinson's disease
В целом, считается, что точная причина PD до сих пор неизвестна, но нейродегенерация, сопровождаемая фибрилляцией и накоплением α-synuclein в нейронах указывает, что имеется главный фактор [49, 90]. Предполагается, что нарушения доставки пузырьков, лизосом и аутофагия, а также дисфункция митохондрий являются ключевыми факторами, которые вносят вклад в накопление α-synuclein [91]. Фермент, деградирующий гликолипид glucosylceramide (GlcCer), кодируется геном, известным как glucocerebrosidase-1 (GBA1), который является единственной характерной особенностью в патологии PD. Поэтому GlcCer облегчает токсические повреждения α-synuclein. Более того, мутации в GBA1 могут действовать как генетический фактор и может повышать риск PD в 5-6 раз [92]. Лизосомный энзим, кодируемый с помощью GBA1 является glucocerebrosidase (GCase), преимущественно экспрессируется в нескольких типах клеток. Внутри лизосом он превращает GluCer в глюкозу и ceramide. Более того, мутации в GBA1 являются гетерозиготными у пациентов с GBA1-ассоциированной PD [93]. Недавно было показано, что снижение активности GCase связано с агрегацией α-synuclein. Недостаточные уровни GCase приводят к снижению уровня ceramid, а мутации внутри клеток ограничивают Rab8a (минорную GTPase), которая связана с секреторной аутофагией. Все эти факторы нарушают секрецию α-synuclein и в конечном итоге приводят к его агрегации внутри клеток [94]. Более того, снижение активности GCase также воздействует на активность protein phosphate 2A (PP2A) путем повсеместной дисфункции лизосом, тем самым увеличивается накопление α-synuclein [95]. Итак, снижение генерации ceramide, обусловленное мутациями в GCase и PP2A, вносит вклад в накопление α-synuclein, особенно в результате нарушений секреторной аутофагии.
Alzheimer's disease
Alzheimer's disease (AD) основном характеризуется образованием бляшек вследствие накопления Aβ пептидов. Многочисленные ключевые энзимы также участвуют в прогрессировании AD, включая neprilysin, BACE-1 и комплекс из γ-secretase играют критическую роль в развитии и лечении AD. Ceramide и SM являются двумя главными классами сфинголипидов, которые могут быть трансформированы с помощью sphingomyelinase (SMase) и SM synthase (SMSs), соотв. Имеются важные факторы, участвующие в патологии AD. Ceramides способствуют генерации и накоплению Aβ путем стабилизации BACE-1 [96]. Мотив, связывающий SM, обнаружен в Aβ, это указывает на то. что он участвует в агрегации Aβ [97]. Лежащий в основе механизм может быть связан с активацией SM synthase-1 (SMS-1), которая способствует продукции ceramide на активированных сайтах BACE-1. Недавно было продемонстрировано, что нокаут SMS-1 в гиппокампе AD мышей приводит к ослаблению образования бляшек из Aβ и воспаления нейронов, которые обычно снижают когнитивную способность. Более того, SMS-1 нокаут или подавление также снижают стабильность BACE-1 за счет лизосомного нарушения BACE-1 за счет нарушений внутриклеточного трафика BACE-1 [98]. Более того, др. энзим, известный как glucosylceramide synthase (GCS) также ухудшает симптомы AD путем катализа биосинтеза ганглиозидов, особенно ceramides. Недавно было показано, что генетические делеции GCS в нейронах переднего мозга взрослых улучшают пространственную память и снижают повреждения дендритных шипов в зубчатой извилине гиппокампа [99]. Интересно, что Sphingosine-1-phosphate (S1P) влияет на пролиферацию, жизнеспособность клеток, синаптическую пластичность и секрецию нейротрансмиттеров. Уменьшение S1P receptor 1 (S1PR-1) также участвует в патологии AD. Более того, сопутствующие S1P гены, включая ceramide synthases (CERS-1, CERS-2) и Sphingosine-1-phosphate lyase (SGPL-1) были обнаружены в активном состоянии у пациентов с AD, тогда как уровни sphingosine kinases (SphK-1, SphK-2), ceramide kinase (CERK) и анти-апоптического Bcl-2 были снижены [100]. Следовательно, распространенность образования бляшек, как полагают, соответствует фосфорилированному Tau и ceramide-обогащенных Aβ экзосом [101, 102]. Важно отметить, что при снижении экзосом ceramide, бляшек и фосфорилированных Tau, прогрессирование AD может быть задержано. Все эти факторы подчеркивают, что баланс ceramide/SM и вклад ceramide в возникновение AD.
 Fig. 5
Sphingolipids and AD pathogenesis Fig. 5
Sphingolipids and AD pathogenesis
Sphingolipids in neurological and psychiatric disorders
Участие измененных сфинголипидов в метаболизме нейрологических и психиатрических нарушений активно исследовалось. Нарушения метаболизма или участвуют в путях деградации или биосинтеза сфинголипидов и их метаболитов.
Epilepsy
Эпилепсия является нарушением с аномальной активностью головного мозга, вызывающей необычное поведение и непрерывные эпизоды судорог. Нарушения регуляции метаболизма липидов является важным фактором измененной активности головного мозга. Сходным образом, измененный метаболизм сфинголипидов также указывает на его критическую роль в патогенезе эпилепсии. В этом контексте возможный механистический подход базируется на гетерозиготной делеции гена CERS2 (Ceramide synthase 2) и гомозиготной мутации в CERS1, а ген CERS1 прежде всего участвует в синтезе C18-ceramide. При нейробластоме, подавление CERS1 инициирует способствующие апоптозу пути и индуцирует ER стрессы. CERS-2, как известно, поддерживает целостность мембран, а мутации этого гена приводят к отсоединению и дегенерации слоёв миелина и в конечном итоге к неадекватной миелинзации нейронов, приводящей к их порче [79]. К сожалению, мало данных относительно роли сфинголипидов при эпилепсии. Более того, дефицит CERS1 также понижает уровень Myelin-associated glycoproteins (MAG)в олигодендроцитах, это указывает на влияние состава липидов в мембранах нейронов на экспрессию белков [103, 104]. Более того, мутации в CERS-1 с повышенной продукцией C-18 ceramide, наблюдались специфически при progressive myoclonic epilepsy (PME) type-8 [105].
Effect of dietary habits and nutraceuticals on Cholesterol and Sphingolipids metabolism
Диетические источники считаются главными вкладчиками, отвечающими за уровни холестерола и сфинголипидов в живых системах. Сходным образом, nutraceuticals, пищевые добавки также участвуют в поддержании эффектов, важных для здоровья. Nutraceuticals влияют на метаболизм липидов в значительной степени, используя разные биохимические пути [106]. Адекватные количества nutraceuticals и холестерола является важным фактором для физиологического функционирования головного мозга. Так, необходимые кол ичества холестерола и сфинголипидов может быть получены из пищевых источников и nutraceuticals. Потребление с высоким содержанием холестерола пищевых продуктов, включая яйца, мясо, масло, молоко и многие др. приводит к высоким уровням холестерина в теле. Таким образом, повышенное потребление холестерина компенсируется кго выведением с желчью. В то же самое время снижение эндогенной продукции холестерина может уменьшить уровни холестерина [107]. Т.о., чтобы предупредить высокие уровни холестерина в плазме, компенсаторный механизм помогает регулировать его физиологические уровни в теле. Подчеркивая роль nutraceuticals в регуляции метаболизма холестерина, важно описать его позитивные ассоциации. Наибольший эффект касается их способности понижать холестерин и действовать против гиперхолестеролемии [108, 109].
Сфинголипиды и их метаболиты регулируются путем повышения или уменьшения потребления с пищей. Хотя вся пища содержит существенные количества сфинголипидов, но молоко, яйца, рыба, печень кур и домашний сыр особенно богаты SP. В связи с пищевым поведением, западные диеты содержат концентрации SM приблизительно 200-400 mg/day [110]. Молоко и масло считаются главным источником сфинголипидов, поэтому их высокое потребление приводит к повышению уровней сфинголипидов. Это может влиять как общее здоровье, так и здоровье головного мозга [111]. Хотя нормальный уровень важен для функционирования синапсов в головном мозге, но измененные уровни оказывают аномальные эффекты. Имеющиеся данные недостаточны для демонстрации роли nutraceuticals в отношении регуляции метаболизма сфинголипидов.
Conclusion
Cholesterols plays a key role in the maintenance of brain health. It serves as a fundamental constituent of myelination and is also essential for development and functional outcomes. Sufficient availability of cholesterol for synapse formation is a critical step in the structural and functional development of our nervous system. Following a nerve injury, cholesterol is required for axonal regeneration. Previous studies have proved that the injured nerves positively respond to the exogenously supplied cholesterol. Thus, targeting cholesterol metabolism may provide a way to combat problems with regeneration of injured nerves. Literature suggests that controlling the cholesterol transportation or improving the cholesterol availability in NDDs may provide protection or may delay the onset of disease. Being an important part of membrane lipid rafts, sphingolipids play a vital role in the life cycle of cells. There are different types of sphingolipids that exist in the brain and contribute structurally in membrane microdomains formation. Although, this review has illustrated various underlying mechanisms of cholesterol and sphingolipids metabolism in relation to the brain health and physiology, but further rigorous research is required for the evaluation of other antecedent facts. Moreover, in this review, the association between impaired cholesterol and sphingolipids metabolism and NDDs, neurological and neuropsychiatry diseases has also been discussed in detail. Further research is critical for the advancement of the therapeutical applications of cholesterol and sphingolipids metabolism targeting agents depending on their effects on impaired metabolism in different diseases.
|
 Fig. 1
Role of cholesterol in brain health and disorders
Fig. 1
Role of cholesterol in brain health and disorders  Fig. 2
Role of cholesterol in Alzheimer's and Parkinson's disease
Fig. 2
Role of cholesterol in Alzheimer's and Parkinson's disease  Fig. 3
Role of Sphingolipids on Synaptic function and formation
Fig. 3
Role of Sphingolipids on Synaptic function and formation  Fig. 4
Role of sphingolipids in neurogenesis
Fig. 4
Role of sphingolipids in neurogenesis  Fig. 5
Sphingolipids and AD pathogenesis
Fig. 5
Sphingolipids and AD pathogenesis