Reprogramming human T cell function and specificity with non-viral genome targeting | |
|---|---|
|
Десятилетия работы с целью генетически репролграммировать Т клетки для терапевтических целей1,2 с использованием рекомбинантных вирусных векторов, которые не могли обеспечить целенаправленное воздействие трансгена на специфический геномный сайт3,4. Необходимость в вирусных векторах замедлила исследования и клиническое использование, поскольку их продукция и тестирование длительное и затратное. Геномное редактирование дает надежду на специфическое и эффективное внедрение крупных трансгенов в клетки мишени с использованием гомологом управляемой репарации5,6.
Мы установили, что ко-электропортация первичных Т клеток человека с помощью CRISPR-Cas9 ribonucleoprotein (RNP)10,11 комплексов и длинной (более 1 kb) линейной dsDNA матрицей снижает токсичность, связанную с dsDNA матрицей. Мы разработали CRISPR-Cas9 систему целенаправленного воздействия на геном, не нуждающийся в вирусных векторах, это сделало возможными быстрые и эффективные инсерции крупных последовательностей ДНК (крупнее одного kilobase) в специфические сайты генома первичных Т клеток человека, при этом сохраняются жизнескособность и функциональность клеток. Это сделало возможными индивидуальные или multiplexed модификации эндогенных генов. Во-первых, мы использовали эту стратегию, чтобы корректировать патогенную мутацию IL2RA в клетках от пациентов с моногенной аутоиммунной болезнью и продемонстрировали улучшение сигнальной функции. Во-вторых, мы замещали локус эндогенного T клеточного рецептора (TCR) новым TCR, который перенаправлял активность Т клеток на раковые антигены. Возникающие в результате TCR-преобразованные T клетки специфически распознавали опухолевые антигены и усиливали реакции продукции противоопухолевых клеток in vitro и in vivo. Эти исследования предоставили преклинические доказательства, что невирусное целенаправленное воздействие может позволить осуществление быстрых и гибких экспериментальных манипуляций и терапевтическое преобразование первичных иммунных клеток человека 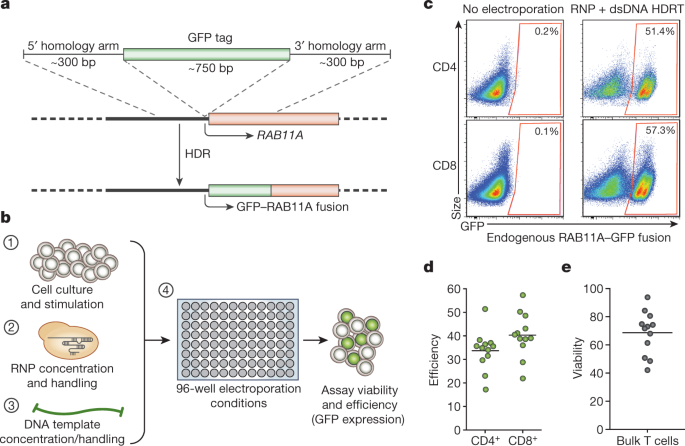 Fig. 1: Efficient non-viral genome targeting in primary human T cells. Fig. 1: Efficient non-viral genome targeting in primary human T cells.a, HDR-mediated integration of a GFP fusion tag to the housekeeping gene RAB11A. b, Development and optimization of non-viral genome targeting for both cell viability and HDR efficiency. c, Insertion of a GFP fusion into the endogenous RAB11A gene using non-viral targeting in primary human gated CD4+ and CD8+ T cells. HDRT, HDR template. d, Average efficiency with the RAB11A-GFP HDR template was 33.7% and 40.3% in CD4+ and CD8+ cells, respectively. e, Viability (number of live cells relative to non-electroporated control) after non-viral genome targeting averaged 68.6%. Efficiency and viability were measured 4 days after electroporation. Mean values of n?=?12 independent healthy donors are shown (horizontal bars, d, e). |