
Временные эмбриональные популяции эритроцитов и иммунных клеток возникают рано в развитии, до появления HSCs, из клеток предшественников , наз. erythro-myeloid progenitors (EMPs). В соответствии с моделью, согласно которой мезодерма дает эндотелий, который в свою очередь дает кровь, EMPs возникают из эндотелиальных клеток, расположенных в структуре, наз. желточный мешок, которая окружает эмбрион. Используя подход генного инженеринга для получение мышиных эмбрионов, у которых происходящие из желточного мешка EMPs и все их производные, были мечены флуоресцентным белком, Plein с коллегами неожиданно обнаружили, что эти клетки также вносят вклад в стенки кровеносных сосудов.
Анализ меченных клеток выявил, что EMPs активно мигрируют из желточного мешка в эмбрион и дифференцируется в эндотелиальные клетки - возвращаясь к своей первоначальной эндотелиальной судьбе, то теперь внутри эмбриона. В отличие от происходящих из мезодермы эндотелиальных клеток, которые формируют кровеносные сосуды посредством локальной пролиферации, авт. установили, что происходящие из EMP эндотелиальные клетки вносят вклад в сосудистую сеть нескольких органов, внедряясь в уже существующие сосуды и оказываются вкрапленными в происходящий из мезодермы эндотелий, где и остаются у взрослых (Fig. 1).
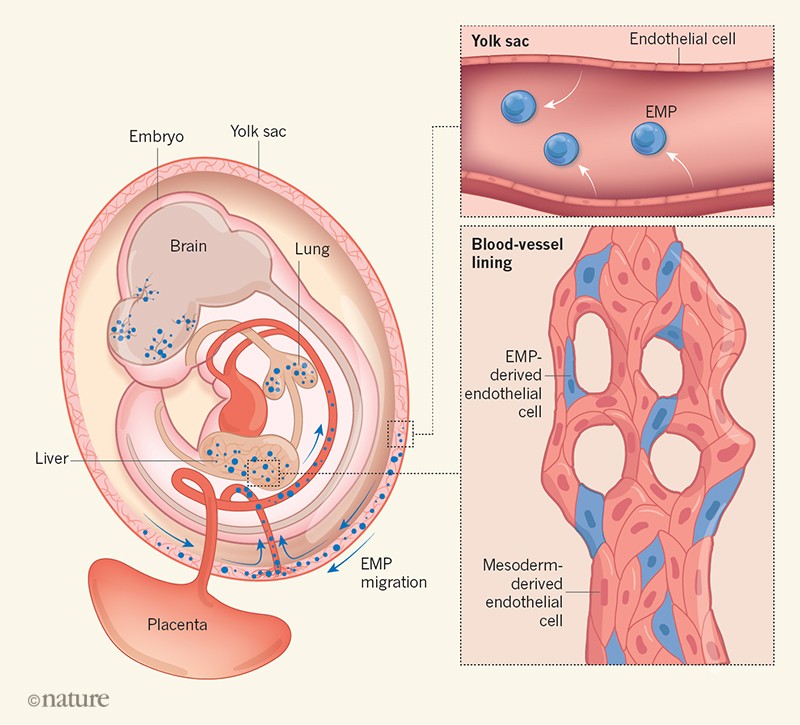 Figure 1 | Two contributors to the blood-vessel lining. An embryonic tissue called mesoderm (not shown) gives rise to endothelial cells, which proliferate to form both the inner lining of blood vessels and the lining of a structure called the yolk sac that surrounds developing embryos. Endothelial cells of the yolk sac in turn give rise (white arrows) to cells called erythro-myeloid progenitors (EMPs), which migrate into the embryo and are known to differentiate into embryonic blood-cell lineages. Plein et al.3 demonstrate in mice that migrating EMPs can also revert to an endothelial-cell type. EMP-derived endothelial cells are incorporated into mesoderm-derived blood vessels in developing organs such as the brain, liver and lung, forming a mosaic pattern across the vessel lining.
Figure 1 | Two contributors to the blood-vessel lining. An embryonic tissue called mesoderm (not shown) gives rise to endothelial cells, which proliferate to form both the inner lining of blood vessels and the lining of a structure called the yolk sac that surrounds developing embryos. Endothelial cells of the yolk sac in turn give rise (white arrows) to cells called erythro-myeloid progenitors (EMPs), which migrate into the embryo and are known to differentiate into embryonic blood-cell lineages. Plein et al.3 demonstrate in mice that migrating EMPs can also revert to an endothelial-cell type. EMP-derived endothelial cells are incorporated into mesoderm-derived blood vessels in developing organs such as the brain, liver and lung, forming a mosaic pattern across the vessel lining. В 2015 та же самая генетическая стратегия были использована4 , чтобы показать, что иммунные клетки взрослых, наз. расположенные в ткани макрофаги происходят из EMPs желточного мешка. Эот результат удивил исследователей, но затем было установлено, что макрофаги дифференцируются только из циркулирующих в крови белых кровяных клеток, наз. моноцитами. Т.о., эта популяция EMP состоит из разнородной группы клеток. Они обладают потенциалом генерировать примитивные эритроциты и иммунные клетки, необходимые временно во время эмбриональной жизни, но они могут также генерировать располагающиеся в тканях макрофаги и эндотелиальные клетки, чте потомство сохраняется и у взрослых.
Plein et al. установили, что процент эндотелиальных клеток в кровеносных сосудах взрослых, которые происходят из EMPs гаходятся в пределах от 30% в головном мозге до 60% в печени. Они установили, что происходящие из EMP эндотелиальные клетки экспрессируя высокие уровни гена Hoxa и что потеря экспрессии Hoxa нарушает развитие сосудов в головном мозге. Потеря Hoxa также затрагивает специфичные для головного мозга иммунные клетки, наз. микроглия, делая их жесткими, это указывает с определенностью, что дефекты вызываются исключительно за счет изменений в эндотелиальных клетках, происходящих из EMP. Тем не менее эти находки подтверждают существенную потребность для развития в эндотелии, происходящем из EMP в головном мозге.
Авт. также исследовали профили генной экспрессии эндотелиальных клеток из кровеносных сосудов. Они установили, что происходящие из EMP клетки, обладают транскрипционной сигнатурой, согласующейся полностью с приобретением эндотелиальной судьбы. Однако, имеются некоторые незначительные отличия между этими клетками и соседними, происходящими непосредственно из мезодермы. Напр., авт. установили избыточную репрезентацию генов, характерных для типа печеночных сосудов в происходящих из EMP клетках и низкую представленность специфичных для головного мозга маркеров эндотелиальных клеток.
Итак, эксперименты Plein с колл. показали, что сосудистая сеть эмбриона образуется из двух самостоятельных клонов. Почему так происходит? Источники этих клеток интересны и потому, что участвуют в физиологии с болезнях. Хотя существуют только спекуляции на этот счет, очевидно, что эндотелиальные клетки из разных онтогенетических источников отвечают по-разному на одни и те же стрессовые факторы, т.к. находятся в разных клонах.
Напр., сосудистые гладкомышечные клетки, которые образуют сократительные мышечные слои под эндотелием, происходят из трех самостоятельных эмбриональных источников5. Источники влияют на профили генной экспрессии в клетках и по-разному реагируют на патологические стресы6. Они также полагают, что было бы резонным предположить, что разные регионы сосудистой сети реагируют по-разному на воздействие одних и тех же стимулов. При почечной недостаточности у мышей паттерны кальцификации сосудов различаются в разных регионах аорты, которые имеют разное эмбриональное происхождение7. Мутации в гене, наз. NT5E у людей вызывают кальцификацию сосудов исключительно в конечностях8. Наконец, аневризмы, при которых стенка кровеносных сосудов истончается и выдавливается, запускаются, по-видимому, разными стрессовыми факторами в регионах кровеносных сосудов, которые имеют разное происхождение9.
Существуют ли разные реакции разных эндотелиальных клеток на стимулы? Это остается открытым вопросом, но существует вероятность, что эндотелий отвечает как функциональный мозаик. В то время как крупные участки сосудистых гладких мышц, происходят из одного и того же онтогенетического источника, очевидно, что происходящие из EMP эндотелиальные клетки перемешаны с клетками мезодермального происхождения. Как при этом могут возникать альтернативные реакции на стимулы в одном и том же сегменте эндотелия.
Интересно, что эндотелиальная выстилка аорты содержит клетки, которые отличаются своей пролиферативной способностью - клетки, способные к регенерации сосудов взрослых находятся бок о бок с клетками, обладающими низким пролиферативным потенциалом10. Вообще-то эта изменчивость связанна с происхождением этих клеток. Возможно, что присутствие высокого процента эндотелиальных клеток, происходящих из EMP в печени, является фактором, благодаря которому орган обладает удивительной способностью к регенерации.
Эти находки необходимо обязательно протестировать на людях. Конечно, отслеживание клонов нелегко осуществить на людях. Альтернативная стратегия д. идентифицировать эволюционно консервативные паттерны генной экспрессии, характеризующие эти два типа клонов эндотелиальных клеток у мышей и найти клетки, которые будут иметь каждый из этих профиле у человека. Это также позволит прояснить вопрос, действительно ли эти два клона вносят разные вклады в репарацию сосудов после повреждений.
 Figure 1 | Two contributors to the blood-vessel lining. An embryonic tissue called mesoderm (not shown) gives rise to endothelial cells, which proliferate to form both the inner lining of blood vessels and the lining of a structure called the yolk sac that surrounds developing embryos. Endothelial cells of the yolk sac in turn give rise (white arrows) to cells called erythro-myeloid progenitors (EMPs), which migrate into the embryo and are known to differentiate into embryonic blood-cell lineages. Plein et al.3 demonstrate in mice that migrating EMPs can also revert to an endothelial-cell type. EMP-derived endothelial cells are incorporated into mesoderm-derived blood vessels in developing organs such as the brain, liver and lung, forming a mosaic pattern across the vessel lining.
Figure 1 | Two contributors to the blood-vessel lining. An embryonic tissue called mesoderm (not shown) gives rise to endothelial cells, which proliferate to form both the inner lining of blood vessels and the lining of a structure called the yolk sac that surrounds developing embryos. Endothelial cells of the yolk sac in turn give rise (white arrows) to cells called erythro-myeloid progenitors (EMPs), which migrate into the embryo and are known to differentiate into embryonic blood-cell lineages. Plein et al.3 demonstrate in mice that migrating EMPs can also revert to an endothelial-cell type. EMP-derived endothelial cells are incorporated into mesoderm-derived blood vessels in developing organs such as the brain, liver and lung, forming a mosaic pattern across the vessel lining.