Посещений: 
ЭПИГЕНЕТИЧЕСКОЕ НАСЛЕДОВАНИЕ
Функции и механизмы
Functions and mechanisms of epigenetic inheritance in animals Ksenia Skvortsova,
Nicola Iovino & Ozren Bogdanovic
 Nature Reviews Molecular Cell Biologyvolume 19, pages774–790 (2018)
| |
|
Генетическая информация передается от родителей потомкам, тем не менее в ряде примеров наследуемая фенотипическая изменчивость у разных организмов, а также в клинических случаях у людей не может быть объяснена полностью Менделевской генетикой, согласно которой наследование базируется на последовательностях ДНК1-3. Помимо ДНК детерминанты регуляции генов, которые могут передаваться через митозы и мейоз, такие как ковалентные химические модификации ДНК, гистоновые post-translational modifications (PTMs) и разные виды РНК, могут передаваться также от родительских гамет зиготе (Fig. 1). Такие факторы, которые представляют слой регуляторной информации, которая накладывается на последовательности ДНК и влияет на специфичные для типа клеток функции, часто обозначают как 'эпигенетические' факторы4. Эти эпигенетические факторы часто привлекаются, когда обсуждается потенциально наследуемые клеточные реакции на средовые сигналы в отсутствие обнаружимых альтераций последовательности ДНК.
Идея, что определенные характеристики приобретаются в ответ на воздействия внешней среды и могут передаваться от родителей потомкам исходит от доктрины Гиппократа 5, которая в дальнейшем была распространена Ламарком 6 и др. Работа Conrad Waddington 7,8 продемонстрировала, что воздействие на куколок D rosophila melanogaster парами эфира или тепловым шоком дает фенотипы, которые благодаря отбору оказываются генетически ассимилированными; индуцированные генетические признаки в конечном итоге проявляются с высокой частотой в отобранной популяции, даже в отсутствие инициального средового агента. Такая генетическая ассимиляция внешней средой индуцированных фенотипов может поэтому действовать, как двигатель эволюционных изменений 9 и возможно вносить вклад в происхождение новых видов. Хотя сегодня мы знаем, что феномены, наблюдавшиеся Waddington, базируются на генетической основе скорее, чем на распространении через поколения приобретенных признаков, точные механизмы такой генетической ассимиляции остаются неизвестными. Такие эксперименты, однако, вызывают вопросы, какие молекулярные компоненты участвуют в сложных взаимодействиях между геномом и внешней средой и потенциал из наследуемости. Опубликован ряд исследований, которые постулируют, что травматические переживания, воздействия химических веществ и дефицит питательных веществ могут влиять на эпигенетическое состояние клеток 10-15 и что в некоторых случаях, такие измененные состояния могут передаваться потомству 2,16-21. В обзоре мы рассматриваем принципы meiotic epigenetic inheritance (MEI) у животных, которое мы определяем как эпигенетическое наследование посредством мейотических продуктов, которые распространяются , по крайней мере, на два поколения (т.е., с F0 на F1 и далее). MEI включает как эпигенетическое наследование между поколениями и transgenerational epigenetic inheritance (TEI). Всеобъемлющие обзоры TEI у микроорганизмов, дрожжей, растений и нематод Caenorhabditis elegans уже опубликованы 22-29.
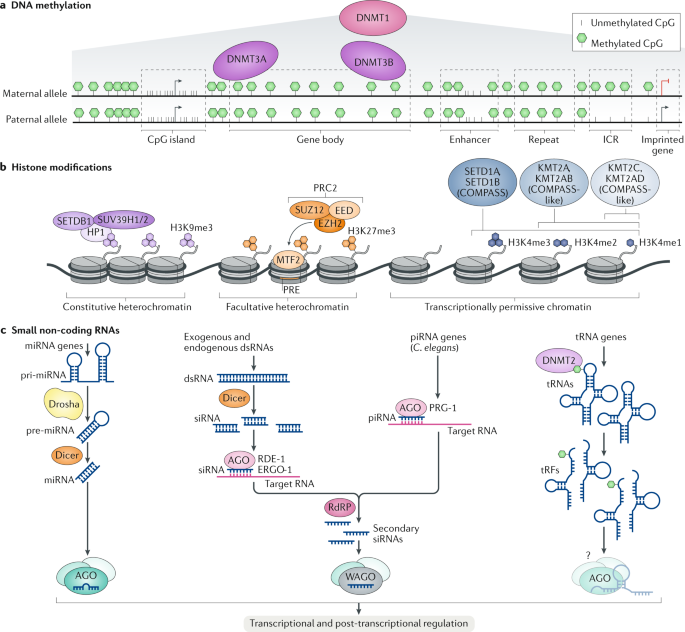 Fig. 1: DNA methylation, histone post-translational modifications and small non-coding RNAs.
Fig. 1: DNA methylation, histone post-translational modifications and small non-coding RNAs.
a | DNA methylation in vertebrates occurs primarily at CpG dinucleotides and is catalysed by DNA methyltransferases (DNMTs)89,90. DNMT1 is involved in the maintenance of DNA methylation whereas DNMT3A and DNMT3B catalyse de novo DNA methylation186. Although the majority of CpG sites in vertebrates are methylated, promoter-associated CpG-rich regions (CpG islands) are generally unmethylated187. Active enhancers display reduced DNA methylation132. Imprinted genes - genes expressed from only one of the parental alleles - display allele-specific methylation at imprinting control regions (ICRs)58. b | Trimethylation of histone H3 lysine 9 (H3K9me3) characterizes constitutive heterochromatin188. H3K9me is catalysed by histone methyltransferases SETDB1, SU(VAR)3-9 homologue 1 (SUV39H1) and SUV39H2 (refs189,190) and is bound by heterochromatin protein 1 (HP1) proteins191,192. H3K27me3 characterizes facultative heterochromatin193 and is catalysed by EZH2 (enhancer of zeste homologue 2)194,195, part of the Polycomb repressive complex 2 (PRC2), which also includes SUZ12 (refs196,197) and EED198. PRC2 is recruited by Polycomb response elements (PREs) in flies199,200 or by MTF2 (metal-response element-binding transcription factor 2) in vertebrates201. H3K4 mono-methylation (H3K4me1), H3K4me2 and H3K4me3 characterize transcriptionally permissive chromatin202,203,204 and are catalysed by SET domain-containing protein 1A (SET1A)-COMPASS (complex proteins associated with Set1) or SET1B-COMPASS, by histone-lysine N-methyltransferase 2A (KMT2A)-COMPASS-like or KMT2B-COMPASS-like and by KMT2C-COMPASS-like or KMT2D-COMPASS-like complexes205. c | Primary microRNAs (pri-miRNAs) are cleaved by the endoribonuclease Drosha to yield precursor miRNAs (pre-miRNAs)206. Pre-miRNAs and double-stranded RNAs (dsRNAs) are cleaved by the endoribonuclease Dicer to produce mature miRNAs and small interfering RNAs (siRNAs)206. In Caenorhabditis elegans, Argonaute (AGO) proteins such as RNAi-defective 1 (RDE-1) and ERGO-1 (ref.33) bind to siRNAs, which leads to the recruitment of RNA-dependent RNA polymerases (RdRPs) and their subsequent amplification to secondary siRNA34,35. Similarly, in the germ line, PIWI-interacting RNAs (piRNAs) are bound by Piwi proteins such as PRG-1 to recruit RdRPs, which results in the production of secondary siRNAs42,43. DNMT2 methylates tRNAs and alters their stability and the formation of tRNA fragments (tRFs)161,207. Processed small RNAs are loaded onto AGO and worm-specific AGO (WAGO) proteins to exert gene silencing208. It is not yet clear how tRFs exercise their function.
MEI in Caenorhabditis elegans
Одним из наиболее хорошо изученных механизмов эпигенетического наследования у животных является RNAi, которая тщательно изучена у нематод C. elegans. Помимо реакции RNAi, которая наследуется через многие поколения, C. elegans обладает также мощным наследованием в поколениях (transgenerational) как активных, так и репрессивных гистоновых PTMs.
RNAi pathways
У C. elegans, двунитевая РНК (dsRNA) запускает RNAi, которая способствует системной деградации мРНК и наследуется с помощью зародышевой линии 30. RNAi реакция у C. elegans зависит от расщепления dsRNA с помощью RNase III семейства нуклеаз Dicer 31,32, это приводит к продукции малых интерферирующих РНК (siRNAs) (Fig. 1c). siRNAs затем соединяются с Argonaute (AGO) белками, такими как RNAi-defective 1 (RDE-1) 33. Это приводит к рекрутированию RNA-dependent RNA polymerase (RdRP) и продукции вторичных siRNAs 34,35. Вторичные siRNAs загружаются на специфичные для червей AGO (WAGO) белки 36, которые располагаются в ядре и инициируют молчание 33,37. Transgenerational эффект RNAi у C. elegans зависит от наследования малых молекул РНК 38. Наследуемое поддержание молчания зависит от ядерных RNAi путей 39. Кроме того, недавно была идентифицирована очень консервативная RNA helicase, ZNFX-1, которая совместно с белками WAGO формирует разделенные по фазе (phase-separated) nuage гранулы в цитоплазме зародышевых клеток, чья роль заключается в распространении наследуемых RNAi 40,41. Эндогенно возникающие, происходящие из PIWI-interacting RNAs (piRNAs), которые супрессируют экспрессию и активность транспозонов в зародышевой линии, также могут запускать наследуемые RNAi 42,43. Вместе с PIWI-like белком PRG-1, piRNAs осуществляют свою функцию путем генерации вторичных siRNAs 42,43 (Fig. 1c). Такое инициированное piRNA молчание наследуется в поколениях и зависит от путей RNAi в ядре 44-46. Активность, ремоделирующая хроматин, и пути репрессии хроматина, включая гистон H3 lysine 9 (H3K9) methyltransferase SET-25, также участвуют в поддержании долговременного молчания 44,46-48. Интересно, что transgenerational наследование RNAi может продолжаться в отсутствие триметилирования H3K9 49,50, а H3K9 methyltransferase MET-2, как было установлено, подавляет биогенез наследуемых siRNAs, тем самым принуждая к transgenerational трансмиссии RNAi 50.
Histone PTM inheritance in Caenorhabditis elegans
TEI активирующих и репрессивных гистоновых PTMs появляются в зародышевой линии нематод C. elegans. Мутации в белках комплекса Trithorax methyltransferase (myeloid/lymphoid or mixed-lineage leukaemia, у млекопитающих) WD repeat-containing protein 5 (WDR-5), ASH-2 и SET-2 снижают уровни триметилирования H3K4 (H3K4me3; позитивный регулятор экспрессии генов) и приводят приблизительно к 20% увеличению продолжительности жизни C. elegans, это наследуется в нескольких поколениях 51. Истощение H3K4me3 demethylase RBR-2 устраняет передачу увеличения продолжительности жизни у WDR-5-лефицитных червей, подтверждая, что TEI удлиненной продолжительности жизни, обусловленный дефицитом триметилирования H3K4, зависит от деметилирования гистона. Сходным образом, нокауты spr-5, кодирующего ортолог H3K4 диметилирования (H3K4me2) lysine-specific histone demethylase 1A LSD1 (известна также как KDM1A), приводят к фенотипам, характеризующимися повышенными показателями стерильности в поколениях (гибели зародышевой линии) 52. Этот фенотип управляется путем накопления H3K4me2, вызывающего нарушения регуляции экспрессии генов во время сперматогенеза и это является показателем паттернов TEI для H3K4me2. Репрессирующие гистоновые PTMs, такие как H3K27me3 и H3K9me3 могут также наследоваться у C. elegans. Инактивация Х хромосомы посредством Polycomb repressive complex 2 (PRC2)-обусловленного триметилирования H3K27 может быть в поколениях передана от ооцитов и спермиев эмбрионам 53. Также недавнее исследование продемонстрировало TEI после воздействия высокой температурой, которое прямо подавляло H3K9 methyltransferase SET-25; это приводило к дерепрессии локусов мишеней для SET-25 в зародышевой линии и наследовалось многими поколениями червей, выращиваемых при нормальной температуре 54(Table 1). Этот эффект сохранялся в течение 14 поколений на интегрированный набор трансгенов, тогда как эндогенные повторяющиеся элементы, существенные изменения в уровнях экспрессии наблюдались до 6 поколений. Как малые РНК кооперируются с репрессивными гистоновыми PTMs при эпигенетическом наследовании пока неизвестно 44,46,48,50. Хотя инактивация компонентов RNAi, таких как HRDE-1 или NRDE-2, не влияет на передачу этой H3K9me3-обеспечиваемой эпигенетической памяти 54, однако, недавние исследования показали, что H3K9me3 может быть необходимо для siRNA-зависимого TEI, которое специфически нацелено на вновь возникшие гены и особенно избирательно к трансгенам 55.
Table 1 Inheritance of histone post-translational modifications and small RNAs
MEI in mammals
Хотя MEI хорошо изучено у растений (Supplementary Box 1) и у C. elegans, у млекопитающих этот феномен остается скорее как исключение, чем правило. Это частично связано с тем, что у млекопитающих эпигеном наследуется от гамет, уже репрограммированных после оплодотворения и во время образования primordial germ cells(PGCs) 56,57. Хотя эти процессы эпигеномного ремоделирования уменьшают метилирование ДНК до самых низких уровней во время жизненного цикла млекопитающих, метилирование не стирается и восстанавливается с той же самой эффективностью на всех последовательностях, создавая тем самым потенциальный путь для MEI. Так, мы используем термин 'intergenerational' эпигенетическое наследование, если наблюдается потенциально наследуемый эффект от беременной самки (F0) в F1 и F2, и мы используем термин 'transgenerational' эпигенетическое наследование, если эффект сохраняется в F3 или далее. Поэтому мы используем 'intergenerational', если эффект, переживаемый самцами (F0) или не беременными самками (F0) обнаруживается в F1 и 'transgenerational', если эффект персистирует в F2 и далее (Box 1).
Box 1 Interpreting meiotic epigenetic inheritance studies in animals
Although many studies of meiotic epigenetic inheritance (MEI) in animals have been published to date, the field is still facing substantial challenges. Whereas MEI in plants and nematodes encompasses a series of well-studied phenomena24,25,26,27,28, MEI studies in mammals have proved especially challenging to set up and to interpret owing to many external confounding factors, which can easily result in the misinterpretation of acquired data88. First, studies dealing with MEI should, where possible, incorporate robust DNA sequencing controls to exclude potential genetic contributions to the studied phenomena84. Another important consideration in interpreting MEI studies is the nature and persistence of the phenotypic effect under investigation. For example, if stress is applied to the paternal lineage (F0), the germ cells (sperm) that would participate in the formation of the F1 generation likely would have also been affected by the stress. This likelihood would make the F0-F1 transmission of phenotypic effects intergenerational, whereas for transgenerational epigenetic inheritance the phenotypic effect would have to be preserved to F2 and beyond (see the figure). In mammals, if the stress is applied to a pregnant female (F0), then the fetus (F1) as well as its primordial germ cells, which have the potential to form the F2 generation, would be affected. In such cases, only effects that would be visible in and beyond F3 would be perceived as truly transgenerational (see the figure). Parental care and shared environment can also considerably affect offspring epigenomes185, making it difficult to distinguish between MEI and de novo acquisition of epigenetic modifications in response to particular environmental cues. Additionally, the tissue of origin can be a major confounding factor in epigenetic inheritance studies. Most assays used for quantification of epigenetic modifications do not discriminate between different cell types in the interrogated sample; therefore, more subtle epigenetic changes or changes present in just a small subpopulation of cells could easily be missed. Altogether, MEI studies in animals, and particularly in mammals, frequently suffer from these methodological shortcomings, and it is important to be aware of these confounding factors when designing studies aimed at demonstrating intergenerational or transgenerational inheritance of epigenetic traits.
![]()
|
Genomic imprinting
У млекопитающих небольшое количество генов (~125 у мышей и ~100 у людей; подвергаются генном у импринтингу) экспрессируется способом, зависимым от родительского происхождения, феномен, наз. геномным импринтингом 58. Эта дифференциальная экспрессия аллелей является результатом эпигенетического молчания неактивного аллеля, процесс, который использует метилирование ДНК5 9-62. Такие импринтированные гены регулируются посредством регионов, контролирующих импринтинг, (Fig. 1a), которые устойчивы к репрограммированию метилирования ДНК после оплодотворения, тем самым формируется платформа для intergenerational эпигенетического наследования. Многие импринтированные гены экспрессируются во время пренатального развития и необходимы собственно для функционирования плаценты 63,64. Ошибки, возникающие во время становления импринтинга, в родительской зародышевой линии, как было установлено, объясняют ряд поведенческих и онтогенетических нарушений, таких как Prader-Willi синдром и синдром Angelman 65. Недавнее исследование на эмбрионах мышей предоставило доказательства импринтинга, который происходит независимо от метилирования ДНК и ассоциирует с материнским наследованием репрессивной модификации H3K27me3 (see below) 66. Ряд генов (n = 76) регулируется с помощью такого не канонического механизма импринтинга, не зависимого от метилирования ДНК.
Epigenetic reprogramming of intracisternal A particles
Intracisternal A particles (IAPs) являются ретротранспозонами, присутствующими во многих копиях (~1000) в геноме мышей 67. Чтобы супрессировать их способность retrotransposition в зародышевую линию, IAPs преимущественно метилируются и замалчиваются в зародышевых клетках. Сходным с геномным импринтингом образом, IAPs могут в основном сопротивляются репрограммированию метилирования ДНК у эмбрионов, это делает их потенциально привлекательными мишенями для изучения MEI 67. Одним из лучших примеров MEI у млекопитающих является локус agouti viable yellow (Avy) у мышей, который несет инсерцию IAP ретротранспозона выше гена agouti, который предопределяет окраску шерсти 68.Экспрессия Avy чрезвычайно изменчива среди потомков и зависит от состояния метилирования ДНК в IAP, вставленных в локус agouti 68,69. Когда фенотип молчащий, то метилированный аллель (pseudoagouti) вызывает дикого типа темно-бурую окраску шерсти, при гипометилировании активируемый аллель дает желтую окраску. Спектр фенотипов agouti у потомков зависит от фенотипа матери, при этом желтая окраска, скорее всего, дает желтую окраску шерсти у потомков 68. Интересно, что пищевые добавки доноров метила во время средины беременности приводит к сдвигу фенотипов агути в направлении pseudoagouti в F1 и F2, намекая на усиление метилирования IAP в зародышевой линии и intergenerational сохранение этого измененного эпигенетического состояния 16. Тем не менее, данные секвенирования bisulfite показали, что вносимый матерью и отцом вклад в Avy-ассоциированные IAPs, репрограммируется во время раннего эмбриогенеза, хотя и с разной динамикой 70. Это предположение подразумевает, что метилирование ДНК может не быть преимущественной наследуемой меткой, вносящей вклад в спектр фенотипов agouti в F1. Сегодня неясно, действительно ли модификации гистонов или базирующиеся на РНК механизмы играют роль в наследовании Avy эпиаллелей; однако, недавнее исследование продемонстрировало мощное intergenerational наследование гистоновых модификаций H3K4me3 и H3K27me3 через материнскую зародышевую линию 71. Добавление доноров метила в середине беременности влияет на процентное содержание agouti фенотипов только, когда Avy аллель вносит вклад посредством отцовской зародышевой линии. Эта находка подтверждает, что отцовский аллель подвергаться более значительному эпигенетическому репрограммированию и поэтому чувствителен к внешнесредовым сигналам в период репрограммирования метилома в PGC (день эмбриогенеза 8.5 (E8.5)-E.15.5) 16. Следовательно, возможно, что наследование материнского Avy локуса регулируется более тонко, вообще-то посредством скоординированного действия разных ген-регуляторных механизмов, включая гистоновые модификации и не ограничено лишь метилированием ДНК.
Contribution of MEI to human diseases
Значительные попытки были сделаны по идентификации вклада эпигенетических модификаций в наследование сложных болезней. В частности, возможности, что эпимутации обеспечивают предрасположенность к раку, привлекли большое внимание 72. Одним из лучших примеров таких эпимутаций является замалчивание гена mutL homologue 1 (MLH1), который кодирует DNA mismatch repair factor, путем гиперметилирования его промотора. Эпимутация MLH1 широко распространена в соматических тканях, происходящих из всех трех эмбриональные клонов (эктодермы, мезодермы и энтодермы), подтвеждая, что оно имеет эмбриональное происхождение или возникает из зародышевой линии 73,74. Такие MLH1 эпимутации вносят вклад в синдром Lynch, который характеризуется ранним началом множественных раковых опухолей, включая колоректальный рак т.е. рак эндометрия, в случае раков обнаруживается нестабильность микросателлитов 75. В большинстве случаев MLH1 эпимутации возникают de novo у затронутых индивидов и репрограммируют к не метилированному состоянию у их потомков 72. Тем не менее, по крайней мере, в одном случае сообщалось, что состояние метилирования наследуется от затронутой матери к одному из трех сыновей; однако, оно затем было стерто в его зародышевой линии 74. Это наблюдение демонстрирует возможность, что эпимутации могут передаваться от родителей потомкам, хотя и редко, скорее всего, благодаря тому, что репрограммирование метилирования ДНК происходит после оплодотворения и в PGCs. Хотя дополнительные данные подтверждают (редкое) появление intergenerational эпигенетического наследования MLH1 локуса 76,77, доказательства этого типа наследования у людей остаются очень ограниченными. Наконец, необходимо также подчеркнуть, что на доступных на сегодня случаев очень трудно исключить точно участия др. цис-действующих или даже транс-действующих факторов в intergenerational наследовании болезней, вызываемых эпимутациями у людей.
MEI of environmental cues in humans
Понимание того, как внешняя среда затрагивает эпигеном человека и как потенциально приобретаются свойства, которые могут передаваться в поколениях, остается областью интенсивных исследований78-81. Одним из наиболее заметных исследований стало Dutch Hunger Winter исследование79,82,83. Получение профилей метилирования ДНК выборок крови от индивидов, которые испытали Dutch Hunger Winter (1944-1945) выявило небольшие отличия в метилировании ДНК в differentially methylated region (DMR), ассоциированных с геном insulin-like growth factor 2 (IGF2)82. Пять CpG динуклеотида, расположенные в IGF2 DMR были оценены количественно с помощью масс-спектрометрии и было выявлено в среднем на 5.2% меньше метилирования ДНК у затронутых сиблингов. Эти результаты были успешно оценены (5.6% низе у затронутых индивидов) с помощью локус специфического секвенирования bisulfite. Исключительно, только когорта, подвергшаяся воздействию недостаточного питания матерями во время ранней беременности, но не во время поздних стадий беременности, обнаруживала эти изменения в метилировании ДНК в IGF2 локусе82. Хотя это и позволяет предполагать об эпигенетических механизмах адаптации к внешним условиям, необходимо учитывать, что исследования MEI у людей асто страдают от серьезных методологических огрехов. Главным ограничением, даже при наличии проверяемой гипотезы, является тот факт, что такие анализы часто затрагивают сложные ткани, такие как кровь, состоящие из разных типов клеток. Следовательно, трудно исключить вероятность, что наблюдаемые различия в метилировании ДНК в основном отражают различия в составе типов клеток у разных людей. Более того, даже если большинство отличий в сомом деле были вызваны предполагаемыми внешнесредовыми стрессами, остается проблема с проверкой, что такие слабые изменения могут приводить к адаптивному фенотипу. Наконец, одновременно обнаружен фактор, который часто оказывается нарушенным в исследованиях MEI, это различия в составе последовательностей ДНК между индивидами, которые, как известно, являются основными вкладчиками в наследование эпигенетических состояний84-87.
В то время как исследование Dutch Hunger Winter имело целью оценить потенциальное влияние на раннюю внутриутробную жизнь воздействия голода на метилирование ДНК во время взрослой жизни, недавнее исследование попыталось изучить, действительно ли intergenerational наследование эффектов от стрессов, таких как те, что возникают у перенесших Holocaust, может быть продемонстрировано у людей 81. Потомки у перенесших Holocaust обнаруживали снижение метилирования ДНК в гене FKBP5, который ранее обнаружил связь с пост-травматическими стрессовыми нарушениями, поскольку этот ген был немножко более метилирован у переживших Holocaust по сравнению с контролем. Концепция наследования последствий не генетической травмы прежде была постулирована у мышей 20; однако, выведение какого-либо определенного заключения относительно потенциала intergenerational эпигенетического наследования травм у людей оказалось очень затруднительным (Box 1). Очень трудно отличить эффекты родительского воспитания подрастающих детей от эпигенетического наследования per se. Из-за генетической гетерогенной природы популяции людей и продолжительной жизни, продольные исследования народонаселения, которые распространяются на многие поколения и которые смогли бы отличать генотип от фенотипа, очень затруднительны 88. В отсутствие таковых опубликованные исследования относительно MEI у людей требуют чрезвычайно продуманных трактовок.
MEI through DNA methylation
Метилирование ДНК часто предполагается в качестве носителя MEI у животных благодаря его относительной стабильности и хорошо известным механизмам отложения de novo и поддержания 89,90 (Fig. 1a). Хотя метилирование ДНК присутствует у грибов, растений и животных, его обилие в геноме и распределение существенно варьируют между видами 91,92. Напр., виды с легко обнаружимым MEI, такие как D. melanogaster и C. elegans, в действительности лишены метилирования ДНК 93,94. Поэтому неясно до какой степени серьезен вклад метилирования ДНК в MEI у животных и каков его биологический контекст. Однако, недавняя информация об изучении метилома в геноме подтвердила, что значительная фракция геномов млекопитающих может в принципе выживать после удаления метилирования ДНК, которое происходит во время перепрогаммирования преимплантационных эмбрионов и PGC (Table 2).
Table 2 Reprogramming of embryonic DNA methylation in vertebrates
Reprogramming of the preimplantation methylome
Метилированиt ДНК довольно статично во взрослых соматических тканях; однако, паттерны глобального метилирования ДНК репрограммируются дважды во время жизненного цикла 56. Первое событие репрограммирования имеет место после оплодотворения и связано с широко распространенным деметилированием ДНК отцовского пронуклеуса, сопровождаемое прогрессирующим снижением глобального метилирования ДНК у зигот, которое достигает наинизшей точки на ст. бластоциста 95-98. Точные механизмы ремоделирования эмбрионального ДНК метилома остаются предметом спосров 99-101; однако, скорее всего, активны оба механизма деметилирования (энзимный) и пассивный (связанное с репликацией разжижение). Активное деметилирование ДНК обеспечивается с помощью ten-eleven translocation (TET) энзимами, которые окисляют 5-methylcytosine, тогда как пассивное снижение уровней метилирования ДНК зависит от подавления активности DNA (cytosine-5)-methyltransferase 1 (DNMT1) в ядре 56. В то время как быстрое деметилирование после оплодотворения отцовского пронуклеуса наблюдается у эмбрионов мышей, крыс, свиней, телят и людей, у овец и кроликов преимплантационное развитие использует меньшее деметилирование отцовского генома, указывая на видо-специфические отличия в ремоделировании эмбрионального эпигенома у млекопитающих 102. Эмбриональный геном реметилируется после имплантации, это совпадает с потерей клеточной плюрипотентности 97,98,103. Тем не менее, не все геномные локусы репрограммируются с одинаковой эффективностью. Помимо импринтируемых локусов и IAPs, исследования с разрешением в одно основание у эмбрионов мышей выявили сохранение метилирования ДНК в oocyte-hypermethylated DMRs и в ряде long interspersed nuclear element транспозонов во время инициальной волны глобального гипометилирования 98. Сходным образом, ряд DMRs, идентифицированных как гиперметилированные в ооцитах, были найдены как метилированные на промежуточном уровне во время преимплантационного развития человека, подтверждая наследования материнского ДНК метилома 104. Др.ж важным свойством преимплантационного развития человека является сохранение метилирования ДНК в телах генов 104,105. Т.к. тела генов часто обогащены энхансерными элементами 106,107, то такое сохранение метилирования ДНК делает возможным intergenerational наследование цис-регуляторных состояний. Итак, эти наблюдения предоставляют доказательства локус-специфического удержания метилирования ДНК (Table 2) во время регуляторной фазы, при которой поддержание метилирования ДНК в основном неактивно. Это доказательство подтверждает, что ранее недооцененная фракция генома млекопитающих, включая промоторы, тела генов и повторы, обнаруживает устойчивость к раннему репрограммированию метилирования ДНК и тем самым может стать потенциальной платформой для MEI.
DNA methylation reprogramming in PGCs
Вторая волна репрограммирования метилирования ДНК происходит в PGCs и также использует комбинацию активных и пассивных механизмов108-111. Характерным для этого процесса является стирание импринтинга после специфического для пола восстановления импринтинга в гонадах. Т.к. в процессе деметилирования после оплодотворения репрограммируются не все последовательности с одинакой эффективностью109,112. Исследования на мышах показали, что особенностями, особенно устойчивые к репрограммированию, являются IAPs, которые остаются преимущественно гиперметилированными в ходе деметилирования PGC 109,112 (Table 2). PGCs человека обладают сходным геномным паттерном стирания метилирования ДНК с наблюдаемым у мышей113-115. Однако, более, чем 116000 геномных регионов были идентифицированы, которые остаются достоверно гиперметилироваными после репрограммирования метилома в PGCs человека115. Из них более 7000 регионов были бедны повторами и в основном совпадали с CpG-богатыми регионами, известными как CpG островки, промоторы, энхансеры и тела генов. Многие из этих регионов были ассоциированы с ожирением, множественным склерозом и шизофренией. Сравнение с данными секвенирования bisulfite у мышей выявило 794 таких белгецов, которые были общими у мышей и людей (Table 2). Конечно, многие из этих локусов оказались сцеплены с нервными и метаболическими функциями и поэтому вызвали интерес к их исследованию с контексте наследования, связанного с риском болезни.
У мышей, метаболические дефициты совпадали с нарушениями метилирования ДНК в зародышевой линии у взрослых, указывая на возможность intergenerationally наследования 116. Недоедание у беременных F0 матерей во время критической фазы эмбрионального репрограммирования PGC приводило к метаболическим фенотипам и умеренному гипометилированию ДНК дискретных локусов в спермиях взрослых F1 (F1 DMRs). В то же время эти измененные паттерны метилирования не были обнаружены в головном мозге и ткани печени, полученных от эмбрионов E16.5 F2, гены, обнаруживаемые вблизи небольшого количества F1 DMRs обнаруживали достоверно измененные профили транскрипции в этих тканях в F2. В самом деле, некоторые из этих генов были связаны с метаболическими функциями, а панкреатические островки, изолированные от 4-мес. F2 мышей обнаруживали нарушения секреции инсулина. Измененное состояние транскрипции этих генов у E16.5 эмбрионов в отсутствие соотв. изменений метилирования ДНК подтверждают, что F1 DMRs спермиев могут оказывать эффекты во время раннего F2 эмбриогенеза. Этот эффект не может быть обнаружен в терминах измененного метилирования ДНК; однако, он может быть преобразован в в обнаружимый измененный исход транскрипции на E16.5. Альтернативно, метилирование ДНК может не быть первичным регуляторным механизмом, отвечающим за формирование F1 DMRs спермиев, также как и для наблюдаемых изменений транскрипции в F2. В спермиях млекопитающих большинство нуклеосом замещены протаминами. Однако, определенные локусы, важные для развития, такие как Hox гены, промоторы онтогенетических генов, импринтируемые гены и кластеры microRNA (miRNA), могут сохранять нуклеосомы и ассоциировать с гистоновыми PTMs, такими как H3K27me3, H3K4me2 и H3K4me3 (refs117,118). Интересно, что 21% из идентифицированных F1 DMRs (n = 23) обнаружен среди таких нуклеосомных регионов 116. Эти находки открывают возможность, что наблюдаемые отличия в метилировании ДНК F1 спермиев могут быть, скорее всего, вторичными эффектами изменений в структуре хроматина, потенциально вызываемые дефектами регуляторных механизмов иных, чем метилирование ДНК, таких как позиционирование нуклеосом или гистоновые PTMs, оба из которых обладают потенциалом intergenerational наследования 119-122. В свете этих находок стоит упомянуть, что во многих случаях эпигенетическое наследование может быть ограничено только определенным геномным контекстом. Напр., целенаправленное триметилирование H3K27 и H3K9 нуждается в сигналах от специфических последовательностей ДНК 85-87. Т.о., возможно, что последовательности, избегающие различных раундов эпигенетического репрограммирования, могут быть генетически определенными.
Methylome reprogramming in anamniotes
В отличие от млекопитающих амниоты позвоночные, такие как рыбы и лягушки, не подвергаются глобальному ремоделированию метилирования ДНК во время эмбриогенеза 123-127. Вместо этого рыбки данио ремоделируют свой метилом перед активацией зиготического генома (ZGA) удивительным способом: материнский метилом реконфигурируется, чтобы совпасть с паттерном отцовского метилома, тем самым происходит ранняя адаптация эмбрионального метилома, адоптируя конфигурацию подобную отцовской при ZGA 126,127. Такая гармонизация отцовского и материнского наследуемого эпигенетичекого состояния перед ZGA достигается посредством использования 'placeholder' нуклеосом, которые уклоняются от метилирования ДНК, но , с другой стороны, несовместимы с активацией транскрипции 128 (see below). Др. заметные отличия раннего эмбрионального репрограммирования у рыбок данио и млекопитающих включают отсутствие ранней экспрессии TET и активное деметилирование у рыбок данио 127,129,130. Отсутсвие раннего глобального эмбрионального деметилирования и реметилирования делает рыбок данио потенциально пригодной моделью для изучения MEI у позвоночных 131.
MEI through histone PTMs
Не смотря на всё больше уточняющуюся классификацию регионов, которые могут избегать репрограммирования метилом ДНК у млекопитающих (Table 2), прямые доказательства роли метилирования ДНК при мейотическом наследовании у животных в основном отсутствуют 70,116. Это вообще-то не удивительно, принимая во внимание, что в большинстве случаев метилирование ДНК в основном обратным образом коррелирует с активностью ген-регуляторных регионов, подтверждая их роль в качестве вторичных, поддерживающих регуляторных меток 132,133. Вместо этого растет число исследований, демонстрирующих intergenerational эпигенетическое наследование и TEI гистоновых PTMs (Fig. 1b) у разных видов животных.
Histone PTM inheritance in Drosophila melanogaster
D. melanogaster давно используется в исследованиях MEI феномена 134,135. Роль гистоновых PTMs в TEI у этого организма недавно продемонстрирована путем формирования хроматиновых взаимодействий на длинные расстояния, сопровождаемые PRC2-обеспечиваемыми отложениями H3K27me3, которые очерчивают наследование репрессированных и дерепрессированных эпиаллелей во многих поколениях 136. Интересно, что становление этих эпигенетических состояний, как было установлено, чувствительно к внешне-средовым стимулам, таким как температура, демонстрируя тем самым взаимодействие между внешней средой и эпигеномом. В соответствии с этими наблюдениями стабильного Polycomb TEI, было показано материнское наследование H3K27me3 и enhancer of zeste (E(z)) белка у D. melanogaster играет инструктивную роль в экспрессии генов во время ZGA 137(see below). Итак, эти примеры демонстрируют необходимость мейотического наследования гистоновых PTM для реакций на средовые стимулы и надзора за ранним эмбриогенезом у насекомых.
Histone PTM inheritance in anamniotes
Степень сохранения нуклеосом в спермиях позвоночных значительно варьирует. В то время как рыбки данио сохраняют полностью свой состав нуклеосом138, у Xenopus laevis, только ~10% нуклеосом сохраняется в зрелых спермиях139. Этот уровень сходен с таковым у людей, тогда как у мышей сохранение нуклеосом приближается к 1%118. Хроматин спермиев у рыбок данио и млекопитающих характеризуется присутствием активных (H3K4me2 и H3K4me3) и репрессивных (H3K27me3) гистоновых PTMs, тем самым открывается возможность intergenerational передачи этих меток117,118,138. У X. laevis, созревание спермиев влечет за собой глобальну потерю H3K4me2 и H3K4me3 и сохранение H3K27me3, и этот процесс, по-видимому, важен для осуществления корректных паттернов экспрессии генов во время эмбриогенеза139. У рыбок данио, присутствие H3K27me3 и H3K4me3 в ряде онтогенетических генов предварительно маркируется в спермиях с помощью тех же самых гистоновых PTMs обнаруживается перед ZGA140. Эти наблюдения не смотря на это обнаруживают крупные сигнатуры хроматина в ходе эмбрионального развития, устанавливаемые во время или после ZGA141,142. Более того, закладки гистоновых меток во время ZGA, по-видимому, в основном предопределяются матерински143.
Сегодня очень мало известно о судьбе наследуемых через зародышевую линию модификаций хроматина во время эмбриогенеза. Возможным объяснением того, как паттерны родительского хроматина могут поддерживаться у ранних эмбрионов рыбок данио, недавно предложено с участием placeholder нуклеосом 128. Эти нуклеосомы, являющиеся специфическими для родительских зародышевых линий, обогащены моно-метилированными H3K4 (H3K4me1) и вариантом гистона H2A.Z(FV) и оккупируют гипометилированные регионы (Fig. 2). Интересно, что расположение в геноме placeholder нуклеосом в спермиях и ранних эмбрионах хорошо коррелирует, подтверждая роль placeholder нуклеосом в становлении pre-ZGA структуры хроматина. Вклад материнского генома, в котором первоначально отсутствуют placeholder конформации, накапливают placeholder нуклеосомы во время pre-ZGA развития и прогрессивно ремоделируются, чтобы совпасть с отцовским его гомологом, в соответствии с предыдущим упоминанием о репрограммировании материнско-отцовского ДНК метилома 126,127. Сосуществование H3K4me1 и H2A.Z на placeholder нуклеосомах удерживает от активности DNMT, в то же время удерживая хроматин в транскрипционно неактивном состоянии. Это предлагает возможный механизм ремоделирования метилирования ДНК в отсутствие активности TET белка у ранних эмбрионов рыбок данио 130. С началом ZGA, placeholder-маркированные локусы становятся или активными (H3K4me3-маркированные) или сбалансированными и молчащими (H3K4me3-H3K27me3-маркированные) (Fig. 2). Однако, важно отметить, что placeholder нуклеосомы устанавливаются даже у партеногенетических эмбрионов (материнские гаплоиды, лишенные ДНК спермия) 128, подтверждая существенный материнский вклад в становление placeholder хроматина. Остается определить, до какой степени placeholder нуклеосомы законсервированы помимо рыбок данио.
 Fig. 2: The role of placeholder nucleosomes in germline-to-embryo epigenetic reprogramming in zebrafish. Fig. 2: The role of placeholder nucleosomes in germline-to-embryo epigenetic reprogramming in zebrafish.
In zebrafish sperm and embryos before zygotic genome activation (ZGA), DNA hypomethylated regions are occupied by 'placeholder' nucleosomes bearing the histone variant H2A.Z(FV)128 and mono-methylated histone H3 lysine 4 (H3K4me1). The presence of placeholder nucleosomes mediates the maintenance of paternal hypomethylated DNA patterns through the transcriptionally quiescent cleavage stages by deterring de novo DNA methylation without activating transcription. The maternal contribution to the embryonic epigenome, which initially lacks the placeholder conformation, is remodelled through the accumulation of placeholder nucleosomes to match the sperm epigenome in pre-ZGA embryos. Upon ZGA, placeholder nucleosomes at DNA hypomethylated regions resolve into either active (H3K4 trimethylated (H3K4me3)-marked) or poised and inactive (H3K27me3-marked and H3K4me3-marked) nucleosomes128. DNMTs, DNA (cytosine-5)-methyltransferases; mC, methylcytosine.
Histone PTM inheritance in mammals
В спермиях млекопитающих большинство нуклеосом замещается protamines, чтобы облегчить упаковку отцовского генома 144. Тем не менее, небольшой процент нуклеосом и ассоциированных с ними гистоновых PTMs сохраняется, тем самым формируется потенциальная платформа для intergenerational передачи регуляторных состояний 117,118. Активные (H3K4me2 и H3K4me3) и репрессивные (H3K27me3, H3K9me3 и H4K20me3) гистоновые PTMs были обнаружены в спермиях млекопитающих; , однако, их распределение и динамика существенно варьируют у разных видов. Напр., у людей H3K9me3-меченные и H4K20me3-меченные нуклеосомы передаются через спермии в зиготы, где они участвуют в построении отцовского гетерохроматина в зиготе, инициируемое посредством материнского вклада PRC1 (ref.146). Вплоть до недавнего времени геномные исследования MEI у млекопитающих были затруднены из-за ограниченных количеств эмбрионального материала для исследований. Это ограничение теперь преодолено посредством новейших геномных технологий, которые позволяют профилирование небольших количеств транскриптома и эпигенома, часто с разрешением в одну клетку 147-149. Недавние геномные исследования показали существование мощного наследования паттернов H3K4me3 и H3K27me3 посредством ооцитов у мышей и их роль в регуляции эмбрионального развития 66,71,120-122. В согласии с этими находками избыточная экспрессия человеческого LSD1 в развивающихся мышиных спермиях приводит к снижению H3K4me2 на промоторах генов, регулирующих развитие и метаболические процессы, и это сопровождается нарушением регуляции экспрессии генов у ранних F1 эмбрионов 150. Очевидно, эти изменения способствуют дефектам развития у потомков и передаются в трех поколениях, указывая на TEI. Т.о., активные и репрессивные гистоновые модификации PTMs могут передаваться гаметами в эмбрионы млекопитающих (Table 1), с возможным влиянием на регуляцию эмбрионального развития.
MEI through small RNAs
Мейотическое наследование молчания посредством малых не-кодирующих РНК широко исследовалось на нематодах 30,38,39,44-48 и мухах 151,152, но значительно меньше на позвоночных153-156 (Table 1). Изобилие данных указывает, что определенные виды РНК присутствуют в спермиях и ооцитах, которые могут передаваться в зиготы после оплодотворения20,153-158. Несмотря на это молекулярные механизмы, с помощью которых эти РНК могут действовать у эмбрионов, чтобы в принципе регулировать раннее развитие, в основном остаются неизвестными. Разные внешние сигналы, такие как воздействие вирусов38, питание154-56,159, психологические стрессы20,21 и высокая температурe160, могут менять концентрацию и состав РНК в зародышевой линии, воздействуя на эмбриогенез и индуцируя фенотипические изменения у разных видов. Недавняя работа также показала, что модификации РНК могут играть важные роли в наследовании метаболических фенотипов. DNMT2, являющаяся RNA methyltransferase, может выполнять главную роль в передаче приобретаемых отцами метаболических нарушений у мышей161. В частности, инъекции общей РНК из спермиев жирных (high-fat diet (HFD)-fed) самцов в зиготы приводили к метаболическому фенотипу, который не обнаруживался после инъекций РНК, извлеченной из Dnmt2-/- HFD-fed самцов. Пока неизвестно, действительно ли потеря метилирования tRNA может оказывать столь широкий косвенный эффект на др. виды РНК, присутствующие в спермиях161.
piRNAs (Fig. 1c) обнаруживаются у широкого круга организмов, таких как C. elegans44-46, D. melanogaster151,152, рыбок данио 162 и млекопитающих, у которых они выполняют главную роль в поддержании стабильности генома зародышевой линии. Однако, в отличие от C. elegans и D. melanogaster45-47,151, где piRNAs также играют роль в эпигенетическом молчании, наследуемом с зародышевой линией (Fig. 1c), у млекопитающих, такая функция piRNAs пока остается недоказанной. Примеры intergenerational трансмиссии малых РНК у млекопитающих с четким воздействием на фенотипы потомков касаются miRNAs 153,157,163 и tRFs 154-156,161. Intergenerationally наследуемые miRNAs выполняют роль в эмбриональном развитии 157,163, передаче эффектов от стрессов 20,21 и парамутаций KIT гена 153, тогда как tRFs в основном связаны с передачей метаболических фенотипов 154-156. Итак, эти находки подчеркивают роль малых РНК в наследуемом молчании геномных элементов у разных видов, в регуляции эмбрионального развития и передаче приобретенных фенотипических отклонений. Хотя многие из этих примеров ожидают независимого подтверждения в будущем, представляет огромный интерес выявление вклада РНК в химические модификации 164 , их потенциала в MEI 161 и определения эволюционной консервации таких механизмов и их потенциального значения для человека.
MEI and embryogenesis
Ряд исследований, опубликованных в последнее время, подтвердил, что intergenerational трансмиссия гистоновых PTMs и малых РНК может иметь важное значение для регуляции раннего эмбриогенеза F1 потомства. Эти наблюдения были сделаны у позвоночных и беспозвоночных и выяви ли новые способы регуляции эмбриональных генов.
Regulation of embryogenesis by inherited histone PTMs
У D. melanogaster, H3K27me3 может быть передан от ооцита эмбриону вместе с матерински поддерживаемым E(z), который является компонентом methyltransferase комплекса PRC2137. Устранение материнки наследуемого E(z) у D. melanogaster , а также его гомологичного enhancer of zeste homologue 2 у мышей нарушает эмбриональное развитие, вызываемое гомеотическими трансформациями137,165. Следовательно, путем становления соотв. состояний хроматина в материнской зародышевой линии, Polycomb белки и H3K27me3 обеспечивают intergenerational контроль раннего эмбрионального развития перед ZGA137,165,166. В частности, специфическое для ооцита истощение E(z) приводит к аберрантному накоплению в активных генах гистоновых PTM H3K27 ацетилирования (H3K27ac) на энхансерах во время ZGA, тем самым обнаруживается связь между матерински наследуемым, Polycomb-обеспечиваемым молчание генов с использованием соотв. энхансеров у ранних эмбрионов137(Fig. 3a).
У эмбрионов млекопитающих H3K27me3, по-видимому, играют важную роль в независимом от метилирования ДНК материнском импринтинге66. Картирование открытых регионов хроматина с использованием DNase I-hypersensitivity метода у зигот мышей выявило несколько сотен специфических для родительских аллелей (импринтируемых) DNase I-hypersensitive sites (DHSs), которые указывают на экспрессию генов, включая новые импринтируемые регионы. Конечно, только ~20% специфических для отцов аллелей DHSs обнаруживали метилирование ДНК по материнскому аллелю, указывая на существование альтернативного механизма для снижения доступности хроматина материнского аллеля (Fig. 3b). Один из пяти таких импринтов материнского аллеля терялся после избыточной экспрессии lysine-specific demethylase 6B (KDM6B), которая у зигот является H3K27me3-специфической и формирует открытый хроматин на материнском аллеле. H3K27me3-регулируемые материнские аллели были гипометилированы в ооцитах, указывая, что репрессивные гистоновые PTM H3K27me3 скорее, чем метилирование ДНК, которое ограничивает доступность материнского аллеля этих импринтируемых локусов66. Более того, профилирование с помощью высоко чувствительной иммуно-преципитации хроматина, сопровождаемой секвенированием (ChIP-seq) ст. 14 эмбриогенеза мыши и гаметогенеза выявило существование матерью предоставляемого H3K27me3, который персистирует тысячах дистальных регуляторных регионов вплоть до ст. бластоциста122. Эта находка согласуется с предполагаемой ролью матерью вносимого H3K27me3 в регуляцию энхансера во время ZGA у D. melanogaster137. Однако, в отличие от D. melanogaster, у мышей H3K27me3 стирается с Hox генов после оплодотворения, а репрессивное состояние Hox кластера поддерживается с помощью альтернативных механизмов; H3K27me3 устанавливается повторно у пост-имплантационных эмбрионов122 (Fig. 3b). Др. Polycomb мишени у эмбрионов мыши обнаруживают сходную с H3K27me3 динамику.
В ооцитах мышей неканонически широкие H3K4me3 домены оккупируют почти четверть генома и совпадают с гипометилированием ДНК 120,121. Огромное большинство генов, активируемых во время основной ZGA - большого взрыва зиготической транскрипции с помощью RNA polymerase II - также как и дистальные регуляторные элементы, участвующие в ZGA и в становлении тотипотентности, располагаются внутри этих широких доменов H3K4me3 120,121. Однако, ZGA ассоциирует с распадом этих широких H3K4me3 доменов на острые, ассоциированные с точкой старта транскрипции H3K4me3 'пики' у поздних двух-клеточных эмбрионов, это сопровождается отложением H3K27ac 120(Fig. 3c). Становление широких H3K4me3 доменов в ооцитах, которое обеспечивается histone-lysine N-methyltransferase 2B (KMT2B), и их устранение после ZGA, которое обеспечивается с помощью гистоновых demethylases KDM5A и KDM5B, являются критическими для H3K4me3-ассоциированного геномного молчания во время оогенеза и реактивации у поздних двух-клеточных эмбрионов, соотв. 120,121. Истощение KMT2B, KDM5A или KDM5B нарушает раннее эмбриональное развитие 120,121,167,168. Вместе с недавними наблюдениями intergenerational наследования H3K27me3 66,137, эти находки предлагают интригующие намеки на то, как родителями вносимые гистоновые PTMs (Table 1) предоставляют критические сигналы, необходимые для собственно становления программ транскрипции в ZGA.
 Fig. 3: Intergenerational inheritance of histone post-translational modifications contributes to gene regulation during embryogenesis. Fig. 3: Intergenerational inheritance of histone post-translational modifications contributes to gene regulation during embryogenesis.
a | In Drosophila melanogaster, histone H3 lysine 27 trimethylation (H3K27me3), which is a repressive post-translational modification, is maternally transmitted to the embryo and maintained until zygotic gene activation (ZGA), including at Hox loci137. Depletion of the maternally inherited Polycomb protein enhancer of zeste (E(z)) results in loss of H3K27me3 and aberrant H3K27 acetylation (H3K27ac) at enhancers, leading to erroneous gene activation during ZGA. b | In mouse gametes, Hox loci and the majority of promoters targeted by Polycomb proteins are marked by H3K27me3; however, in the zygote and two-cell embryos, H3K27me3 is reduced at the maternal allele and is completely lost at the paternal allele. H3K27me3 at these regions emerges in the inner cell mass (ICM) of the blastocyst and is re-established in the epiblast at embryonic day 6.5 (E6.5). H3K27me3 at gene-distal regions is inherited from oocytes and propagated on the maternal allele in the zygote, two-cell embryos and ICM122. DNA methylation-independent imprinted loci, characterized by the presence of DNase I-hypersensitive sites (DHSs) at the paternal allele and H3K27me3 at the maternal allele, are inherited by the zygote and propagated to the blastocyst stage66. Their nearest genes (n = 76) display paternal-allele-specific gene expression that is largely maintained in the blastocyst (more so in the trophectoderm than in the ICM). In post-implantation embryos, H3K27me3-dependent imprinting is erased in the epiblast but is partially maintained in extra-embryonic ectoderm and visceral endoderm at E6.5 and in the placenta until E9.5. c | Non-canonically broad H3K4me3 domains in mouse oocytes are transmitted to the zygote upon fertilization and are transformed into canonical H3K4me3 peaks in late two-cell embryos, where they characterize genes and regulatory elements activated during ZGA. Decomposition of non-canonical H3K4me3 domains coincides with the appearance of H3K27ac at ZGA genes in late two-cell and eight-cell stages. Compared with the sperm, the paternal pronucleus has considerably less H3K4me3, which is re-established by lysine-specific histone demethylase 5A (KDM5A) and KDM5B in late two-cell embryos and onwards120,121. KD, knockdown; M, maternal; P, paternal; WT, wild type.
Regulation of embryogenesis by inherited small RNAs
Малые некодирующие РНК наследуются из гамет, они также участвуют в эмбриональном развитии. У мышей подавление происходящих из спермиев miRNA, miR-34c, уменьшает синтез ДНК и супрессирует первое зиготическое деление 157. Сходным образом, потеря матерями endonuclease Dicer, которая важна для формирования miRNA, не совместима с первым клеточным делением у эмбрионов мыши 163, тогда как отцовская потеря Dicer приводит к тяжелому нарушению преимплантационного развития 169. Однако, у рыбок данио этого нет, и эмбрионы, происходящие от материнского мутантного Dicer, начинают обнаруживать дефекты развития во время гаструляции, сомитогенеза, во время развития головного мозга и сердца 170. Эти исследования далее были подтверждены недавними наблюдениями, что малые РНК, обнаруживаемые в зрелых спермиях, существенны для эмбриогенеза. В частности, зиготы, генерируемые посредством intracytoplasmic sperm injection (ICSI) зрелых спермиев (происходящих из головки эпидидимиса) в основном неспособны поддерживать эмбриогенез и обнаруживают множественные дефекты во время и после имплантации 171. Однако, эти дефекты устранялись инъекциями малых РНК (18-40 нуклеотидов), происходящих из внеклеточных пузырьков (epididymosomes), которые высвобождают свой репертуар малых РНК, необходимый для созревания спермиев. Эти находки подтверждают, что малые РНК в зрелых спермия 171,172, которые соответствуют в основном miRNAs, а также tRFs, скорее всего, выполняют большую роль во время раннего эмбриогенеза.
Inheritance of metabolic phenotypes
Огромная область исследований MEI связана с исследованиями потенциальных адаптивных преимуществ intergenerational наследования гистоновых PTMs, мылых РНК и метилирования ДНК. Особый интерес представляет возможность влияния внешне-средовых факторов на эпигеном родительских гамет, которое может затем переноситься на зиготы, чтобы менять регуляцию генов. Важность мейотического наследования гистоновых PTMs H3K9me3 и H3K27me3 в ответ на внешне-средовые стимулы недавно продемонстрирована на D. melanogaster. Отцовское высокое потребление сахара, как было установлено, изменяет состояние хроматина эмбрионов, личинок и метаболических генов у F1 потомства, это сопровождается повышенными уровнями триглицеридов и веса тела173. Эти альтерации были обусловлены активацией транскрипции генов, располагающихся в 'black' (lamin/histone-H1-associated) и 'blue' (Polycomb-associated) гетерохроматине174, в соответствии с предыдущими находками гетерохроматинового MEI у мух175. Очевидно, что H3K9me3 метка была редуцирована в клетках жировых тел F1 мужского потомства, чьи отцы питались диетой с высоким содержанием сахара173.
Малые РНК, как было установлено, являются ключевыми детерминантами intergenerational передачи метаболических фенотипов у млекопитающих. Недавняя работа пролила свет на то, как малые (28-34 нулеотидов) tRFs, происходящие из tRNA 5' концов и передаваемые посредством спермиев могут в принципе регулировать эмбриогенез у мышей 154-156,171 (Table 1). tRFs, происходящие от tRNA-Gly-GCC отцов, питавшихся диетой с низким содержанием белка, обнаруживали умеренную репрессию генов, регулируемых с помощью длинных терминальных повторов MERVL (mouse endogenous retrovirus with leucine tRNA primer) у эмбрионов мышей и в эмбриональных стволовых клетках (Fig. 4a). Эти tRFs доставлялись их эпидидимиса, тем самым представляли собой убедительное доказательство передачи soma-to-germline отцовских пищевых эффектов 156,172. Сходным образом, инъекция в зиготы tRFs от отцов, которых держали на HFD, вызывали подавление метаболических путей у 8-клеточных эмбрионов и бластоцистов 154. В др. исследовании передача латентного метаболического фенотипа от жирных, пре-диабетических F0 самцов в F1 и F2 оказалось связанным с наследованием нескольких видов РНК. Сюда вошли tRFs и miRNAs, такие как miR-10, которые составляют ~25% от всех miRNAs от жирных отцов уF1 мышей 155 и являются мишенями, которые наделены функциями, связанными с регуляцией транскрипции (Fig. 4b). Очевидно, что передача метаболических фенотипов, оказывается тесно сцепленной со статусом метилирования малых РНК с помощью DNMT2 161. Метилирование ДНК было также недавно отмечено при передаче метаболических фенотипов, ассоциированных с in utero недоеданием у млекопитающих 116,176. Однако, точная функция метилирования ДНК в этих процессах и их значимость пока неясны. Итак, эти результаты служат доказательством широко распространенных MEI посредством разных молекулярных механизмов у насекомых и млекопитающих и продемонстрировали, как внешне-средовые сигналы могут быть восприняты и переданы потомству.
 Fig. 4: Inheritance of metabolic phenotypes through small RNAs in mammals. Fig. 4: Inheritance of metabolic phenotypes through small RNAs in mammals.
a | The abundance of tRNA fragments (tRFs) and let-7 family microRNAs (miRNAs) is altered in the sperm of mice exposed to a high-fat diet (HFD) or low-protein diet (LPD). Specifically, increased abundance of tRFs (such as tRF-Gly-GCC) and decreased abundance of the let-7miRNA was observed in the sperm of male mice fed a LPD156. The sperm of mice fed a HFD showed upregulation of tRFs and downregulation of miRNAs154. Downregulation of genes controlled by the long terminal repeats of MERVL (mouse endogenous retrovirus with leucine tRNA primer) was observed in two-cell embryos fathered by LPD mice, and antisense-mediated inhibition of tRF-Gly-GCC resulted in derepression of the MERVL-regulated genes156. Downregulation of metabolic pathway genes was observed in eight-cell embryos and blastocyst-stage embryos of HFD fathers154. Adult F1 offspring of HFD fathers exhibit impaired glucose tolerance, insulin resistance and downregulation of metabolic genes in pancreatic islets154. F1 offspring of LPD fathers exhibit upregulation of a cholesterol biosynthesis enzyme in the liver156. DNA (cytosine-5)-methyltransferase 2 (DNMT2) is a tRNA methyltransferase that participates in the transmission of metabolic phenotypes by altering the secondary structure and stability of tRNAs161. b | F1 progeny (a/a) of obese agouti viable yellow (avy) heterozygous males exhibit impaired glucose tolerance and insulin resistance following HFD challenge (asterisk)155. The transmission of these phenotypes might be caused by altered levels of tRFs and miRNAs such as miR-10, which were present in the F1 sperm of mice fed a normal diet but sired by obese fathers. The impaired glucose tolerance and insulin resistance phenotype was also observed in F2 mice during HFD challenge (asterisk). No metabolic phenotypes were detected in F3 (ref.155).
Conclusions and future perspective
Numerous aspects of MEI in plants and in short-lived organisms, such as C. elegans and D. melanogaster, have been thoroughly described and excellently reviewed24-28,134,135. By contrast, the functions, mechanisms and dimensions of MEI in most animal phyla still remain poorly understood. The recent advent of genomics technologies has enabled the thorough exploration of MEI phenomena across a broad range of species and in different biological contexts. For historical reasons177, and owing to its precise, replication-coupled enzymatic machinery89,90, DNA methylation has garnered much attention as a potential mechanism of MEI in animals. Nevertheless, the links between DNA methylation and MEI remain a topic of debate70,72,116,178. Recent insights from genomics studies suggest that other molecular mechanisms, such as histone PTMs66,120,121,136,137 and small RNAs, including tRFs154-156,161, likely have important roles in the intergenerational transmission of gene-regulatory information in the animal kingdom.
A major criticism related to the study of MEI in mammals is the lack of associated causality88. In other words, it is very challenging to unambiguously demonstrate that the regulatory changes acquired in the parental germ line can be efficiently relayed to the offspring to alter gene expression. An even more challenging aspect of MEI studies is the lack of proof that such epigenetic changes, acquired in one generation and passed on to the next, have any adaptive roles3. The recent developments in CRISPR-Cas9-driven targeted epigenome remodelling applied to easily tractable model organisms such as zebrafish could tackle these challenges. For example, the fusion of the Cas9 protein to catalytic domains of DNMTs179-181 or of histone-modifying enzymes182 could enable targeted epigenetic modification of genomes that could then be monitored through generations. This targeted modification will facilitate precise functional studies that do not depend on often-lethal gene knockouts, which can hamper the interrogation of heritable effects, and will also allow the study of the potential dependence of MEI phenomena on the DNA sequence. It is worth noting that, in many cases, cis-acting factors are required for the initiation of epigenetic inheritance85-87, but in some cases the deletion of the initiating sequence after a chromatin state has been established does not preclude epigenetic inheritance183. Thus CRISPR-Cas9 epigenome and genome editing systems will have the ability to assess such factors in a high-throughput manner and in diverse species. The ever-decreasing cost of sequencing technologies is also expected to result in more whole-genome sequences to complement MEI studies, which will help in differentiating whether the observed inheritance phenomena are epigenetic, genetic or both. Until then, the evidence for MEI that spans multiple generations in mammals remains limited to sporadic examples. To date, the strongest example of such a phenomenon remains the inheritance of the DNA methylation state of the agouti locus68.
In this Review, we discussed various molecular mechanisms of parental reach into the embryonic development of the offspring66,120,121,136,137,154-156. Whether such phenomena are conserved in humans and to what extent awaits further clarification. It is plausible that some of these mechanisms would function in humans owing to the high conservation of the underlying enzymatic machinery184. On the other hand, it is worth noting that considerable differences in sperm nucleosome retention and early embryonic chromatin establishment have been observed between humans and mice118,145. Studying epigenetic inheritance in humans will remain a problem owing to long generation times, which restrict the collection of biological specimens, and owing to the genetic diversity of the human population. Nevertheless, with the reduced amounts of input material required for genome-wide assays and the increased frequency of studies carried out on donated human embryonic material, it is reasonable to expect such proof-of-principle studies sooner rather than later. Overall, the recent revolution in genomics technologies, including targeted genome and epigenome manipulation, is expected to provide long-sought answers to fundamental questions about the functions and extent of MEI in animals.
|
 Fig. 1: DNA methylation, histone post-translational modifications and small non-coding RNAs.
Fig. 1: DNA methylation, histone post-translational modifications and small non-coding RNAs. Fig. 2: The role of placeholder nucleosomes in germline-to-embryo epigenetic reprogramming in zebrafish.
Fig. 2: The role of placeholder nucleosomes in germline-to-embryo epigenetic reprogramming in zebrafish. Fig. 3: Intergenerational inheritance of histone post-translational modifications contributes to gene regulation during embryogenesis.
Fig. 3: Intergenerational inheritance of histone post-translational modifications contributes to gene regulation during embryogenesis.  Fig. 4: Inheritance of metabolic phenotypes through small RNAs in mammals.
Fig. 4: Inheritance of metabolic phenotypes through small RNAs in mammals.