Посещений: 
МИТОХОНДРИАЛЬНЫЕ БЕЛКИ
Биосинтез и функциональные сети
Mitochondrial proteins: from biogenesis to functional networks Nikolaus Pfanner, Bettina Warscheid & Nils Wiedemann
Nature Reviews Molecular Cell Biologyvolume 20, pages267–284 (2019)
| |
|
Митохондрии являются отличтельным признаком и силовыми станциями клеток эукариот; они синтезируют АТФ посредством окислительного фосфорилирования, но также глубоко интегрированы в клеточный метаболизм и сигнальные пути.
Митохондрии состоят из двух мембран и двух жидкостных компартментов (Fig. 1). Поверхностная область митохондриальной внутренней мембраны в несколько раз больше, чем наружная мембрана; поэтому она образует инвагинации, известные как гребешки, которые содержат систему окислительного фосфорилирования, представленную респираторными комплексами I - IV и F1F0-ATP синтазу для продукции АТФ. Лишь небольшой набор белков, кодируемых митохондриальным геномом, и те, что обычно являются гидрофобными мембранными белками, составляющими основную часть комплексов окислительного фосфорилирования внутренней мембраны митохондрий. Приблизительно 99% митохондриальных белков кодируются ядерными генами и зависят от специфических целенаправленных сигналов, которые ими управляют из цитозоля, где они синтезируются, чтобы стать рецепторами митохондриальной поверхности, и затем оказываются в соотв. субкомпартментах митохондрий 1,2.
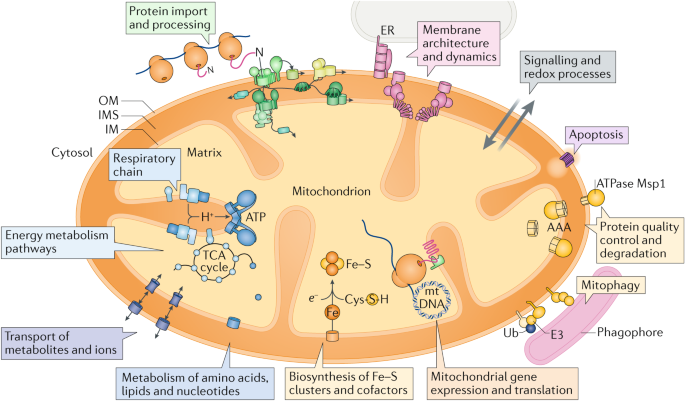 Fig. 1: Overview of mitochondria and their functions.
Fig. 1: Overview of mitochondria and their functions.
Mitochondria consist of four compartments: outer membrane (OM), intermembrane space (IMS), inner membrane (IM) and matrix. A large variety of functions have been assigned to mitochondrial proteins and protein complexes and are indicated in the figure: energy metabolism with respiration and synthesis of ATP; metabolism of amino acids, lipids and nucleotides; biosynthesis of iron-sulfur (Fe-S) clusters and cofactors; expression of the mitochondrial genome; quality control and degradation processes including mitophagy and apoptosis; signalling and redox processes; membrane architecture and dynamics; and the import and processing of precursor proteins that are synthesized on cytosolic ribosomes. AAA, ATP-dependent proteases of the inner membrane; E3, ubiquitin-protein ligase; ER, endoplasmic reticulum; mtDNA, mitochondrial DNA; TCA, tricarboxylic acid; Ub, ubiquitin.
Исследования последних 15-20 лет выявили более значительную, чем ожидалось сложность и разносторонность митохондриальных активностей, интеграцию митохондриальной энергетики с биогенезом белков, метаболических путей, передачи клеточных сигналов, стрессовых реакций и апоптоза. Необходимо показать, что наборы митохондриальных белков, обладающие разнообразными функциями, физически и функционально связаны скорее, чем функционируют разрозненно. Поэтому важно понять принципы, управляющие формированием и поддержанием этих сложный сетей.
Multifunctional mitochondria
Numerous and diverse functions of mitochondria
Учебники обычно описывают митохондрии как респираторные комплексы и F1F0-АТФ синтазы на гребешках внутренней мембраны и транспортеры и каналы для метаболитов и ионов в одбеих митохондриальных мембранах и как места метаболических путей, которые в основном расположены в матриксе и внутренней мембране3 (Fig. 1). Они включают пути энергетического метаболизма, такие как цикл трикарбоновых кислот, а также метаболические пути аминокислот, липидов и нуклеотидов. Электроны, возникающие при окислении метаболитов, подпитывают респираторную цепь, которая генерирует электрохимический градиент путем подкачки протонов из митохондриального матрикса в пространство между мембранами. Возникающий в результате градиент протонов используется для управления синтеза АТФ с помощью F1F0-ATP синтазы и делает возможным импорт белков предшественников и перенос некоторых из метаболитов через внутреннюю мембрану.
Функции митохондрий, существенные для жизнеспособности клеток при всех условиях роста, включают синтез iron-sulfur (Fe-S) кластеров4 и импорт и созревание митохондриальных белков1,2. Митохондриальный матрикс также содержит завершенную генетическую систему, которая включает митохондриальный геном, многочисленные факторы, важные для поддержания и регуляции генома митохондриальных рибосом, которые отличаются размером и составом от цитозольных рибосом5. Белки, кодируемые митохондриальным геномом, вставляются во внутреннюю мембрану с помощью co-translational механизма, путем купирования транслирующих рибосом с oxidase assembly (OXA) insertase1,2,6.
Митохондрии формируют динамическую сеть в большинстве типов клеток, которая постоянно ремоделируется путем слияния и деления органелл7,8. Были идентифицированы некотрые механизмы, контролирующие архитектуру и динамику митохондриальных мембран, которые включают факторы, обеспечивающие слияние или деление, такие как dynamin-related GTPases, расположенные на наружной и внутренней мембранах и компонентах, формирующих мембраны. Mitochondrial contact site and cristae organizing system (MICOS) является критической для поддержания характерной формы гребшков внутренней мембраны9,10,11. MICOS и некоторые др. белковые комплексы образуют места контактов между митохондриальными наружной и внутренней мембранами, чтобы способствовать переносу белков, липидов и метаболитов9,10,12,13.
Вопросы, которые активно исследуются, включают системы контроля качества и регуляции передачи митохондриальных сигналов ( rev. 14-19). Многочисленные цитозольные сигнальные каскады связаны с митохондриями при физиологических и патологических состояниях. Метаболическая активность митохондрий служит в качестве меры их пригодности и качественности 14, и разработанности путей реакций на митохондриальные стрессы, избирательность деградации поврежденных митохондрий с помощью аутофагии (mitophagy) 15,16 и запрограммированной клеточной гибели (apoptosis) 17. Митохондрии содержат набор внутренних протеаз, которые также участвуют в контроле качества и обороте митохондриальных белков 18. Кроме того, митохондрии являются главным местом продукции клетками реактивных видов кислорода (ROS) и содержат многочисленные redox пути 19.
Quantitative analysis of the mitochondrial proteome
Широкий набор митохондриальных активностей делает из изучение затруднительным и приводит к разным выводам относительно того, как митохондрии организованы. Сначала исследования метаболизма и продукции АТФ установили энергетику и метаболизм в качестве характерных особенностей митохондрий. Затем, систематические протеомные исследования митохондрий, нача ты ~15 лет тому назад, привели к идентификации множества новых митохондриальных белков. Сегодня подсчитано, что митохондрии содержат, по крайней мере, от 1000 (у дрожжей) до 1500 (у людей) разных белков20-38. Функциональная классификация этого огромного количества разных белков26,32 показывает, что только ~15% митохондриальных белков непосредственно вовлечены в энергетический метаболизм, включая пути энергетического метаболизма и все структурные субъединицы системы оксидативного фосфорилирования. Подсчитано, что 20-25% митохондриального протеома поддерживают или регулируют митохондриальный геном, который кодирует лишь ~1% митохондриальных белков. того, многочисленные митохондриальные компоненты оказались связанными с различными клеточными сигнальными путями и динамикой мембран. Т.о., митохондрии выступают как сигнальные платформы, которые являются критическими в регуляции клеточной функции, распространяя свою роль за пределы клеточной силовой станции. Наконец, более точное понимание природы и функции митохондриальных белков в разных условиях сделали возможным недавнюю систематическую количественную оценку большей части митохондриального протеома, это позволило количественно оценить абсолютные количества копий митохондриальных белков, присутствующих в определенных клетках26,39-43. Белки, участвующие в энергетическом метаболизме, наиболее многочисленны в дышащих митохондриях дрожжей (Box 1). ~15% митохондриальных белков с непосредственным участием в энергетическом метаболизме и дыхании, упомянутые выше, составляют более половины массы митохондриальных белков при respiratory условиях, подтверждая тем самым оригинальное мнение о митохондриях как клеточных силовых станциях. Учитывая вместе различные метаболические процессы, оксидативное фосфорилирование, переносчиков метаболитов и каналы, ~75% массы белков дышащих (respiring) митохондрий обеспечивают метаболизм и биоэнергетику26.
Эти по виду противоречивые мнения на митохондрии как силовые станции и на митохондрии как органеллы с большим количеством разных функций, необходимо скомбинировать, чтобы понять важность для клеток митохондрий. На основании абсолютной массы белков - т.е., исходя из количественной перспективы - метаболизм и биоэнергетика остаются основными целями митохондрий (силовые станции). Однако, др. функции имеют большое значение для работоспособности митохондрий, клеточного роста и развития. Разительным примером является система биосинтеза Fe-S кластеров, которая использует менее 1% массы respiring митохондрий, но существенна для жизнеспособности всех клеток эукариот 4,26. Столь же важными являются устройства для обеспечения морфологии и динамики мембран, которые представляют менее 1% белковой массы митохондрий 26. Эти белки играют ключевую роль в митохондриальных архитектуре, слиянии и делении и тем самым в поддержании и ремоделировании митохондриальных сетей при разных условиях роста 7,8. Митохондрии можно т. о. рассматривать как супер-силовые станции, которые кроме превалирующих метаболических и энергетических функций глубоко внедрены в клеточную динамику, передачу сигналов и биосинтетические пути за счет осуществления большого числа функций. Эти функции не являются независимыми одна от др., так как участвующие устройства и белки физически связаны в более крупные, динамические сети.
|
Box 1 The mitochondrial proteome: from fermentation to respiration
Recent studies have revealed the absolute copy numbers of mitochondrial proteins per cell26,39-43 (see the figure). Proteins involved in energy metabolism are by far the most abundant classes of mitochondrial proteins26. The abundance of these proteins is strongly regulated by the growth conditions. When shifting yeast from fermentation to respiratory conditions, their protein levels are increased approximately threefold or more. The levels of proteins involved in signalling, redox processes, membrane dynamics and morphology are increased approximately twofold from fermentation to respiration, which is comparable to the increase in the total mitochondrial protein mass. Interestingly, proteins involved in two essential processes - protein import, maturation and turnover, and biosynthesis of iron-sulfur (Fe-S) clusters - are only mildly affected when cells are shifted from fermentation to respiration26. The overall abundance of proteins involved in mitochondrial gene expression and translation and in the metabolism of lipids, amino acids and nucleotides is only mildly affected by different growth conditions; however, differences can be observed for individual classes of protein. For example, proteins involved in lipid metabolism are considerably more expressed under respiratory conditions, whereas proteins involved in amino acid metabolism are more strongly expressed under fermentable conditions26. |
Plasticity of the mitochondrial proteome
Митохондриальное содержимое клеток варьирует существенно при разных состояниях роста и между разными организмами и тканями21,24,26-28,44. Систематический анализ митохондрий дрожжей выявил, что общая белковая массва митохондрий составляет ~9% от массы клеточных белков в условиях брожения (когда необходима более низкая активность митохондрий), но удваивается в состоянии respiratory роста, достигая, ~20% от массы клеточных белков26. Изменения от ферментации к дыханию связаны с совершенно разными митохондриальными белками, относящимися к разным функциональным классам (Box 1). Обнаруживается более чем 3-кратное увеличение количества абсолютных копий на клетку для белков, непосредственно участвующих в энергетическом метаболизме и дыхании (respiration). Белки, участвующие в передаче сигналов, redox процессах и динамике мембран, увеличиваются приблизительно вдовое, как общее увеличение митохондриальной массы26.
Удивительно, белковые классы, участвующие в биогенезе белков и укладке и биосинтезе Fe-S кластеров - в двух митохондриальных процессах, важных для клеточной жизнеспособности во всех типах клеток и условиях роста - изменяются лишь слегка в отношении общего числа их копий, когда дрожжевые клетки переходят от ферментации к респирации 26. Это указывает на то, что клетки хорошо экипированы такими системами в условиях отсутствия дыхания и нуждаются лишь в незначительном увеличении их количества во время дыхания. Напр., аппарат импорта белков импортирует вдвое большее количество белков во время дыхания и это служит доказательством того, что аппарат работает со значительно более низко2й отдачей во время ферментации. Мы полагаем, что аппарат импорта белков и система биосинтеза кластеров Fe-S являются важными системами домашнего хозяйства митохондрий и не участвуют или лишь слегка регулируется с помощью количества их копий. В самом деле, исследования по комплексу translocase of the outer membrane (TOM) - который является основным взходом проникновения белка и состоит из рецепторных белков на цитозольной стороне (Tom70, Tom20 and Tom22) и пору-формирующего белка (Tom40) - показали, что, по крайней мере, четыре разные цитозольные сигнальные системы регулируют комплекс TOM за счет фосфорилирования, приводя к очень сложному паттерну стимулирующих и подавляющих эффектов в зависимости от участия киназы и субъединиц TOM 45-48. Обладая стабильным набором систем поддержания домашнего хозяйства, которые регулируются с помощью обратимых модификаций, таких как фосфорилирование, имеют преимущества в обеспечении быстрых реакций на меняющиеся условия. Система будет, скорее всего, довольно медленной в адаптации к разным потребностям, если она зависит от повышенной экспрессии генов, трансляции и импорта. Сходным образом, подавление происходит быстрее, когда достигается с помощью ковалентной модификации скорее, чем за счет уменьшения копий белка. Напр., во время fermentable роста, когда необходима меньшая транслокация метаболитов в и из митохондрий, активность Tom70, который необходим для импорта носителей метаболитов, подавляется путем фосфорилирования, приводя к непосредственному снижению импорта носителей метаболитов в митохондрии 48. Т.о., значительная стабильность количества копий белка в системах поддержания домашнего хозяйства и их регуляции с помощью пост-трансляционных модификаций, делающих более высокую гибкость во время биогенеза митохондрий и ремоделирования митохондриальной сети.
Assembly of functional protein networks
Исследования импорта белка из цитозоля в митохондрии первоначально базировались на предположении, что все белки транспортируются к своему конечному месту предназначения вдоль одного центрального пути. Однако, характеризация белков предшественников, несущих разные нацеливающие сигналы, показала, что митохондрии используют, по крайней мере, пять крупных пути импорта белков, каждый из которых нацелен с помощью разного типа нацеливающего сигнала. Сложность системы даже выше, т.к. транслоказы белков предшественников не оперируют в качестве изолированных единиц, а соединены с многочисленными митохондриальными белковыми комплексами, участвующими, по-видимому, в неродственных функциях.
Five major import pathways of precursor proteins into mitochondria
Путь presequence является лучше всего охарактеризованным путем, ответственным за ~60% всех митохондриальных белков 49. Белки предшественники несут N-терминальный нацеливающий сигнал, которые формирует позитивно заряженные amphipathic α-спирали. Эти предварительные последовательности (presequences) обычно распознаются с помощью TOM рецепторов Tom20 и Tom22 (refs 50,51) на поверхности митохондрий и транспортируются посредством основного канала транслокации белков наружной мембраны Tom40 (refs 1,2,52,53) (Fig. 2). После прохождения через нарушную мембрану белки предшественники захватываются presequence транслоказой внутренней мембраны (TIM23), которая направляет их движение через внутреннюю мембрану 54-57. Мембранный потенциал (Δ ψ) поперек внутренней мембраны (отрицательный на внутренней стороне) активирует канал TIM23 и направляет позитивно заряженные presequences в направлении матрикса 58-61. С presequence translocase-associated motor (PAM) содержит митохондриальный хитшоковый белок 70 (mtHsp70) в качестве центрального АТФ-управляемого шаперон, который связывает белки предшественники, чтобы способствовать их однонаправленному перемещению 62. Вместе с 5 ко-шаперонами, mtHsp70 транслоцирует полипептидную цепь в матрикс 63-68, где presequences удаляются с помощью mitochondrial processing peptidase (MPP) 1,2,69. Матрикс содержит дополнительные энзимы для преобразования, участвующие в контроле качества, поскольку митохондриальные белки могут быть деградированы с помощью N-end rule пути в зависимости от того, содержат ли они стабилизирующие или дестабилизирующие аминокислотные остатки на своих N-концах 49,70. Промежуточная intermediate cleaving peptidase of 55 kDa (Icp55) и octapeptidyl peptidase (Oct1) удаляют дестабилизирующие аминокислотные остатки с N-конца импортируемых белков после расщепления с помощью MPP, генерируя тем самым N-концы, которые менее склонны к деградации с помощью матричных протеаз 49,71,72. С помощью mtHsp70 и др. шаперонов, таких как Hsp60-Hsp10 chaperonin комплекс 73,74, белки затем укладываются в свою активную форму.
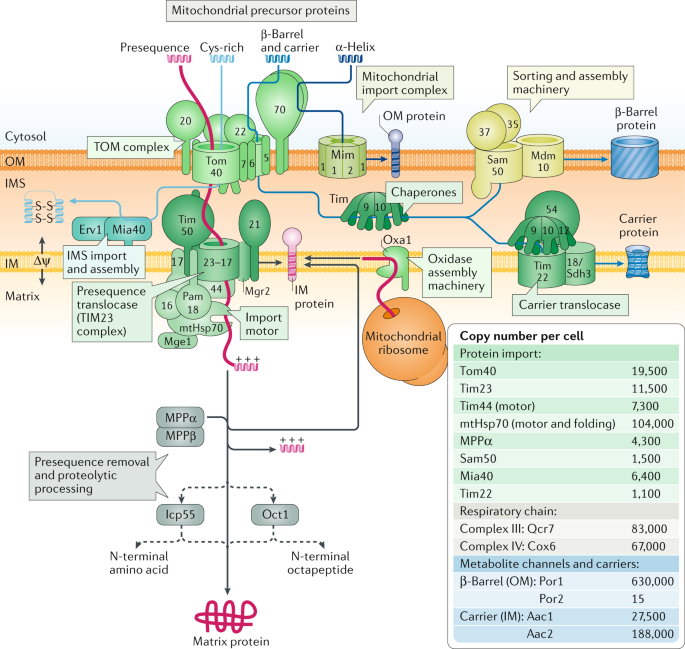
Fig. 2: Protein import pathways into mitochondria.
Five major pathways of mitochondrial protein import have been identified. The protein import machineries have been well conserved from fungi (shown in this figure) to mammals (shown in Box 4). First, the presequence pathway transports presequence-carrying cleavable preproteins through the translocase of the outer membrane (TOM) and the presequence translocase of the inner membrane (TIM23) with the presequence translocase-associated motor (PAM). The membrane potential (??) across the inner membrane (IM) activates the TIM23 channel and drives translocation of the positively charged presequences into the matrix. The presequences are removed by the mitochondrial processing peptidase (MPP), and additional proteolytic processing can occur by intermediate cleaving peptidase of 55?kDa (Icp55) or octapeptidyl peptidase (Oct1). IM proteins are either laterally released from the TIM23 complex or are transported via the matrix and inserted into the IM by the oxidase assembly protein 1 (Oxa1) insertase. IM proteins synthesized on mitochondrial ribosomes are also inserted by Oxa1. Second, cysteine-rich proteins destined for the intermembrane space (IMS) are imported through the TOM complex and are recognized by the mitochondrial IMS import and assembly protein (Mia40), which functions as an oxidoreductase to insert disulfide bonds into the imported proteins. The sulfhydryl oxidase Erv1 forms a disulfide relay with Mia40, transferring disulfides from Erv1 to Mia40 to imported proteins. Third, the precursors of non-cleavable IM proteins such as the carrier proteins are imported by the TOM complex, followed by transfer to the small TIM chaperones in the IMS and insertion into the IM by the TIM22 carrier translocase. Fourth, the precursors of outer membrane (OM) ?-barrel proteins use the TOM complex and small TIM chaperones and are inserted into the OM by the sorting and assembly machinery (SAM). Fifth, many OM proteins with ?-helical transmembrane segments are inserted into the membrane by the mitochondrial import (MIM) complex. ?-Helical OM proteins typically do not use the Tom40 channel, but Tom70 can be involved in their recognition. The inset shows the absolute copy numbers of characteristic translocase components in a respiring yeast cell and, for comparison, the abundance of respiratory complexes, metabolite channels and carriers of the mitochondrial membranes26. The porin isoform porin 1 (Por1) of the OM is one of the most abundant mitochondrial proteins, whereas the isoform Por2 is one of the least abundant proteins. mtHsp70, mitochondrial heat shock protein 70.
Presequence-несущие предшественники, которые оказываются интегрированными во внутреннюю митохондриальную мембрану, следуя двумя самостоятельными путями (Fig. 2). Те, которые обладают гидрофобным сортирующим сигналом, помимо нацеливающего на матрикс сигнала, оказываются арестованными на комплексе TIM23 и затем они высвобождаются с помощью латерального привратника (gatekeeper) Mgr2 во внутреннюю мембрану (stop transfer pathway)75,76. Др. белки внутренней мембраны сначала транспортируются в матрикс и инкорпорируются во внутреннюю мембрану с помощью OXA insertase, которая также используется белками, кодируемыми митохондриями (conservative sorting)6,77-80.
Большинство др. белков импортируются путями, также использующими TOM канал для транслокации preprotein через наружную мембрану81,82 (Fig. 2), но зависимость трех TOM рецепторов Tom20, Tom22 и Tom70 и способа доставки из цитозоля в TOM комплекс может отличаться83-85. Путь переносчик предназначен для импорта гидрофобных многократно пронизывающих внутреннюю мембрану белков. Такие белки не содержат на N-конце presequences; они обладают внутренним нацеливающим сигналом, содержащим гидрофобные элементы, но они не охарактеризованы до конца. Цитозольные шапероны классов Hsp90 и Hsp70 доставляют эти белки предшественники внутренней мембраны на рецептор Tom70 (ref.86). После их высвобождения от цитозольных шаперонов, предшественники проходят через Tom40 канал в петлевом образовании и вступают в пространство между мембранами87,88. Здесь они соединяются с малыми TIM шаперонами, это предупреждает их агрегацию89-92 и приводит их к переносчику translocase of the inner membrane (TIM22) комплексу. Комплекс TIM22 оперирует Δ ψ-зависимым способом, чтобы вставлять эти многократно пронизывающие белки во внутреннюю мембрану93-97 (Fig. 2).
Многие белки в пространстве между митохондриальными мембранами содержат характерные цистеиновые мотивы, которые окисляются, чтобы сформировать стабилизирующие дисульфидные мостики в зрелых белках. В пространство между мембранами митохондрий импортируется и собирается MIA система, которая обеспечивает импорт и оксидативную укладку белков межмембранного пространства, она состоит из двух главных компонентов: oxidoreductase Mia40 (refs98,99) и sulfhydryl oxidase Erv1 (ref.100) (Fig. 2). После прохождения через канал Tom40, Mia40 распознает белки предшественники, которые содержат сортирующий сигнал для межмембранного пространства, обычно состоящий из гидрофобного элемента, окруженного по флангам цистеиновыми остатками101-103. Mia40 образует временные дисульфидные мостики с этими предшественниками и затем передает им дисульфидные мостики, это приводит к образованию дисульфидных связей внутри молекул посредством окисления и стабилизации белков104,105. При каждом переносе дисульфидных связей на белок цистеины Mia40 становятся редуцированными и подвергаются повторному окислению с помощью Erv1. При такой дисульфидной смене дисульфидные мостики т.о. переносятся с Erv1 на Mia40, чтобы импортировать белки.
Наружная мембрана митохондрий содержит мембранные белки разных классов: однократно пронизывающие и многократно пронизывающие мембрану белки с α-спиральными трансмембранными сегментами и β-barrel белки. Предшественники β-barrel белков первоначально транслоцируются с помощью TOM комплекса 106 в межмембранное пространство и взаимодействуют c малыми TIM шаперонами подобно переносчикам предшественников 92 (Fig. 2). Включение β-barrel предшественников в наружную мембрану обеспечивается с помощью sorting and assembly machinery (SAM) 107-109 в виде ступенчато-образного процесса, который осуществляет транслокацию в SAM канал (формируемый с помощью Sam50 субъединицы) и латеральное высвобождение в липидную фазу мембраны 110. С-терминальная β-нить этих белков функционирует как β-сигнал, который управляет инсерцией посредством SAM 111. α-спиральные белки наружной мембраны обычно следуют самостоятельному пути импорта, который не использует канал Tom40. Сортирующий сигнал обычно находится внутри α-спиральных трансмембранных сегментов и фланкирован положительно заряженными аминокислотными остатками. Однопроходные белки с N-терминальным мембранным якорем (signal-anchored proteins) и многократно пересекающие мембрану белки могут использовать mitochondrial import (MIM) канал для внедрения в мембрану при помощи Tom70, по крайней мере, в случае многократно пересекающих мембрану белков 112-117. В случае однопроходных белков с С-терминальным мембранным якорем (tail-anchored proteins) и некоторых многократно пересекающих мембрану белков липидный состав наружной мембраны, по-видимому, важен для внедрения в мембрану, хотя точный молекулярный механизм неизвестен 118-121. Предполагается несколько возможностей, включая независимое от белка прямое внедрение в фосфолипидную мембрану, внедрение с помощью MIM комплекса или при участии неизвестной белковой insertase наружной мембраны.
Abundance and versatility of import machineries
Абсолютные количества копий разнообразных компонентов были установлены26 (Fig. 2). TOM комплекс является наиболее обильной транслоказой, что согласуется с его ролью пополнения предшественниками, по крайней мере, четырех самостоятельных нижестоящих систем транслоказ. Комплекс TIM23 также обилен, т.к. предполагается, что он выполняет основную роль в пути импорта presequence. Интересно, что mtHsp70 приблизительно в десть раз более многочислен, чем Tim23 и др. моторные субъединицы, такие как Tim44. mtHsp70 выполняет двойную роль: небольшая фракция молекул mtHsp70 действует в TIM23-ассоциированном PAM, чтобы управлять импортом preprotein, тогда как большая часть mtHsp70 участвует в укладке белка в митохондриальном матриксе2. Tim22 и Sam50 присутствуют в очень небольших количествах. Однако, их основные субстраты присутствуют в высоких концентрациях, это подчеркивает важность и активность этих транслоказ. Переносчики метаболитов внутренней мембраны, субстраты TIM22 комплекса, очень многочисленны и конечно одним из наиболее многочисленных митохондриальных белков, наружной мембраны является β-barrel канал метаболитов porin 1 (Por1), субстрат для SAM комплекса. Т.о., TIM22 и SAM комплексы являются критическими для биогенеза переносчиков митохондриальных метаболитов и каналов, обеспечивающих экспорт АТФ и связь митохондриального и клеточного метаболизма.
TOM комплексы могут формировать разные типы динамических суперкомплексов: TOM-SAM суперкомплекс для эффективного переноса β-barrel предшественников и дважды пронизывающих мембрану TOM-TIM23-preprotein суперкомплекс122-127. TOM также взаимодейстdввует с малыми TIM шаперонами и у млекопитающих, TIM29 из TIM22 комплекса обнаруживается в ассоциации с TOM82,128,129. Отличающиеся количества транслоказ (Fig. 2) указывают на то, что TOM комплексы оказываются в достаточных количествах, чтобы сформировать разные суперкомплексы. Действительно ли отдельные пулы комплексов TOM существуют для разных путей импорта или TOM комплексы являются свободно обменивающимися в одном крупном динамическом пуле, остается спорным вопросом. Транслокация некоторых белков предшественников межмембранного пространства через наружную мембрану зависит от Tom40 но не нуждается в TOM рецепторных доменах130,131. Эксперименты по конкуренции подтверждают, что предшественники межмембранного пространства и предшественники, несущие presequence, не используют одни и те же TOM комплексы, это подтверждает мнение, что имеются самостоятельные пулы TOM комплексов130. Мы полагаем, что помимо полного размера TOM комплексов, которые представлены Tom40 каналами, всеми тремя рецепторами и три малыми Tom белками82, митохондрии могут также содержать более простые формы комплексов TOM. Эти более простые TOM комплексы могут содержать только Tom40 канал и возможно некоторые из малых субъединиц Tom и могут быть предназначены, напр., для импорта предшественников в межмембранное пространство, которые распознаются с помощью Mia40 и не зависят от классических TOM рецепторов. Дифференциальное фосфорилирование TOM комплексов с помощью цитозольных сигнальных каскадов также вносит вклад в гетерогенность TOM комплексов и подтверждает, что клеточные сигнальные пути контролируют активность разных путей импорта45-48.
У метазоа имеются две формы presequence транслоказ, которые по-разному распределяются по тканям: одна форма содержит стабильно экспрессирующуюся housekeeping субъединицу TIM17B, обнаруживается в скелетных мышцах, а др. форма содержит регулируемую стрессом субъединицу TIM17A, обнаруживается в головном мозге 132. В условиях стресса уровни TIM17A снижаются и как результат снижается синтез и усиливается деградация с помощью АТФ-зависимой AAA протеазы внутренней мембраны, которая обращена в в межмембранное пространство (iAAA protease) (Fig. 3). Это снижение уровня TIM17A способствует mitochondrial unfolded protein response (UPRmt) 133. Поэтому в то время как общие количества аппаратов импорта митохондриальных белков у быстро растущих одноклеточных организмов, подобных дрожжам, довольно стабильны при разных метаболических состояниях, количества ткане-специфичных изоформ варьируют у многоклеточных, подтверждая, что оперируют дополнительные регуляторные механизмы у многоклеточных организмов 132-134.
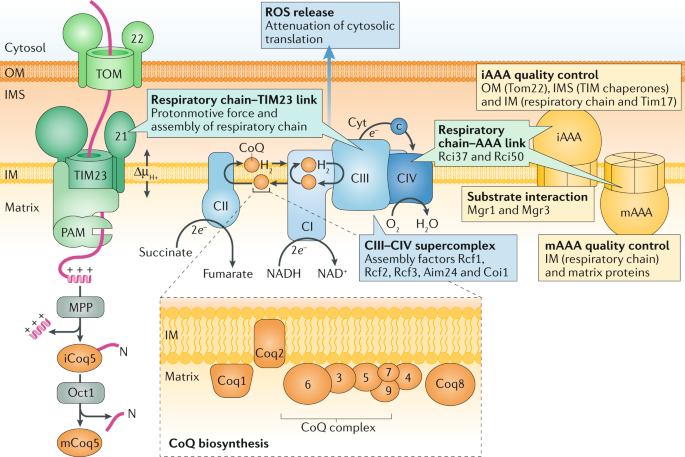 Fig. 3: Interaction network of respiratory complexes, biogenesis and quality control machineries.
Fig. 3: Interaction network of respiratory complexes, biogenesis and quality control machineries.
Supercomplexes of the mitochondrial respiratory chain are integrated into functional networks with the presequence translocase of the inner membrane (TIM23) (see Box 2) and the ATP-dependent AAA proteases of the inner membrane (IM). The ATP-dependent AAA proteases degrade not only several IM proteins but also selected proteins of the matrix, intermembrane space (IMS) and outer membrane (OM), functioning as a quality control system of mitochondria. Several respiratory chain-AAA linker proteins, AAA-substrate adaptor proteins and assembly factors for respiratory supercomplexes were identified in fungi. The coenzyme Q (CoQ) biosynthetic complex on the matrix side of the IM provides CoQ for the respiratory chain and further enzymes. The precursors of the CoQ complex are imported by the translocase of the outer membrane (TOM) and TIM machineries. Proteolytic processing in the matrix can involve two steps, as it does for the precursor of Coq5. The mitochondrial respiratory chain is a main source for the generation of reactive oxygen species (ROS), which can exert harmful effects but also function in signalling. Targeting of the cytosolic translation machinery by ROS leads to decreased protein synthesis, providing a link between the status of the respiratory chain and protein biogenesis. Δµ?H+, electrochemical proton gradient; CI, complex I; CII, complex II; CIII, complex III; CIV, complex IV; iAAA, IMS-exposed AAA; mAAA, matrix-exposed AAA; MPP, mitochondrial processing peptidase; Oct1, octapeptidyl peptidase; PAM, presequence translocase-associated motor.
Элементы разных путей импорта могут быть скомбинированы для создания новых путей. Напр., крупный домен проходящего один раз через внешнюю мембрану белка Om45 экспозируется в межмембранное пространство. Предшественник Om45 сначала транспортируется с помощью presequence пути посредством TOM комплекса и взаимодействует с TIM23 комплексом, но затем проникает в межмембранное пространство, чтобы быть вставленным в наружную мембрану с помощью топологически противоположного действия MIM комплекса 135,136. Отщепляющиеся С-терминальные нацеливающие сигналы являются др. примером многообразия аппаратов митохондриального импорта, поскольку они импортируются посредством presequence пути и удаляются с помощью пептидаз матрикса и межмембранного пространства, что сопровождается дифференциальной сортировкой для целенаправленной доставки внутрь митохондрий 137-139. Т.о., хотя пути импорта и подразделяются на пять основных путей, механизмы импорта значительно более разнообразные и разносторонние и мы ожидаем, что систематический анализ больших количество субстратов позволит открыть новые важные маршруты и возможно новые транслоказы.
Respiratory chain interactions link bioenergetics, biogenesis and quality control
Комплексы дыхательной цепи внутренней мембраны митохондрий являются основой крупной белковой сети, которая соединяет биоэнергетику, регуляцию и процессы оборота (Fig. 3). Респираторные комплексы I (NADH:ubiquinone oxidoreductase), III (cytochrome c reductase) и IV (cytochrome c oxidase) собираются в крупные суперкомплексы I-III-IV, известые также как respirasomes140-144. Сборка в такие суперкомплексы сегодня общепринята, но существуют разные мнения об их функциях141,143. Сверхкомплексы могут влиять на сборку и стабильность респираторных комплексов, регулировать активность комплексов и/или снижать образование ROS. Разные факторы участвуют в формировании респираторных суперкомплексов (Fig. 3), но участвуют ли они исключительно в сборке индивидуальных респираторных комплексов или в формировании суперкомплексов, tot предстоит выяснить141-149.
Не только preprotein транслоказы участвуют в общении др. с др., но они также формируют физические контакты с др. митохондриальными аппаратами, включая устройства, участвующие в энергетическом метаболизма митохондрий. TIM23 комплекс формирует ступицу (hub) для сортировки preproteins на внутренней мембране в кооперации с комплексами импорта TOM и PAM и образует суперкомплекс с респираторными комплексами III и IV, а также с носителями АДФ/АТФ (Box 2; Fig. 3). Эти взаимодействия TIM23 комплекса поддерживают импорт белка в условиях ограничения энергии150-152 и могут также способствовать сборке респираторных комплексов153-155 (Box 2). Респираторные комплексы также как и АДФ/АТФ переносчики в несколько раз более многочисленны, чем TIM23 комплекс26 (Fig. 2), и поэтому только часть из них участвует во взаимодействии с TIM23. Респираторные комплексы преимущественно расположены в мембранах гребешков, хотя значительно меньшая фракция обнаруживается на внутренней границе мембраны, которая соседствует с наружной мембраной156, и может т.о., взаимодействовать с TIM23 комплексами. TIM23 и респираторные комплексы, по-видимому, формируют динамические, не постоянные суперкомплексы150,151.
Связь между митохондриальной респираторной цепочкой и аппаратом для синтеза белка была обнаружена с помощью анализа эффектов генерируемых митохондриями ROS. Респираторная цепочка является основным источником ROS, а стрессовые состояния и дисфункция респираторной цепи могут приводить к повышению продукции ROS, это вызывает оксидативные повреждения белков, ДНК и мембран. Поскольку ROS обладают сигнальными функциями, то продуцируемые митохондриями ROS могут передавать сигналы о функциональном состоянии митохондрий19,143,157. ROS, как было установлено, целенаправленно воздействуют на чувствительные к redox остатки цистеина (redox switches) из цитозольного аппарата трансляции, включая рибосомы и факторы трансляции157. Когда продукция ROS повышается, то эффективность трансляции снижается обратным способом (Fig. 3). Респираторная цепь т. о. участвует в контроле синтаза белков в цитозоле, чтобы понизить белковую нагрузку в условиях митохондриального стресса157.
Coenzyme Q (CoQ), также наз. ubiquinone, является центральной молекулой в функционировании респираторной цепи158,159. CoQ является redox-активным липидом, который обеспечивает перенос электронов с респираторных комплексов I и II на комплекс III (Fig. 3) и действует как кофактор для многих энзимов. Некоторые компоненты биосинтеза CoQ были недавно идентифицированы, используя пролиферирование системной масс-спетрометрии на протеомном, липидомном и metabolomic уровнях26,71,158,159. Комплекс биосинтеза CoQ , расположенный на матричной стороне внутренней митохондриальной мембраны, содержит многочисленные энзимы, участвующие в биосинтезе CoQ. Все белковые субъединицы этого динамичного CoQ биосинтетического комплекса кодируются ядерными генами и импортируются с помощью устройств TOM и TIM158,159. Напр., предшественник methyltransferase Coq5 подвергается преобразованию дважды. Сначала расщепляется с помощью MPP, генерируя нестабильное промежуточное образование и затем расщепляясь с помощью Oct1 генерирует стабильный зрелый фермент Coq5 (Fig. 3). Нарушения преобразования с помощью Oct1 приводят к дефициту CoQ и дефектам дыхания71. Т. о., импорт и специфические преобразования предшественника Coq с помощью аппарата импорта митохондриальных белков функционально связаны с комплексом биосинтеза CoQ. Недавнее исследование показало, что устройство для сборки Fe-S кластеров ассоциирует с респираторной цепью суперкомплексов160, подчеркивая тесную связь между респираторными функциями и биогенезом кофакторов.
Внутренняя мембрана митохондрий несет два крупных АТФ-зависимых протеазных комплекса, iAAA протеазу и matrix-exposed mAAA протеазу18,161-163. Эти протеазы являются главными элементами системы контроля качества для преобразования и оборота белков в митохондриях. AAA протеазы расщепляют или деградируют разные белки внутренней мембраны, так что некоторые субъединицы респираторных комплексов и preprotein транслоказы также участвуют в контроле качества и обороте белков избранной части матрикса, межмебранного пространства и наружной мембраны (Fig. 3). У грибов адапторные белки Mgr1 и Mgr3 ассоциируют с iAAA протеазами и способствую распознаванию субстрата с помощью протеаз161,163. Недавнее протеомное исследование у дрожжей митохондрий выявило белки, взаимодействующие с респираторной цепью, Rci37 и Rci50 и продемонстрировало, что они также взаимодействуют с mAAA протеазой и iAAA протеазой26, соотв., открывая специфические связи между респираторными комплексами III и IV и системой контроля качества внутренней мембраны.
Функциональная сеть митохондриальной респираторной цепи включает т. о. респираторные суперкомплексы и аппарат белкового биогенеза, кофактор биосинтеза и контроль качества митохондрий.
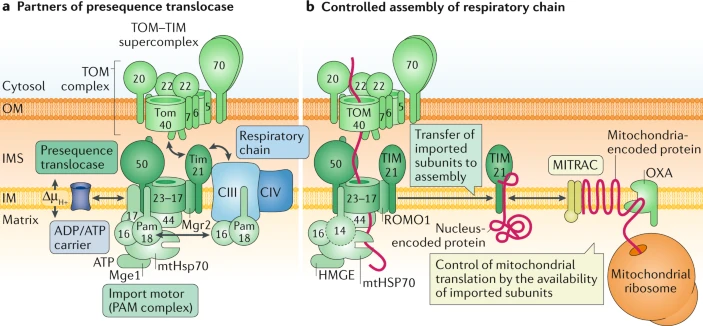
Box 2 Mitochondrial presequence translocase and respiratory chain assembly
Interaction network of the presequence translocase
Транслоказы внутренней мембраны (TIM23) комплекс является центральным соединением пути presequence импорта и взаимодействует с несколькими партнерскими комплексами динамическим способом: при этом транслоказы наружной мембраны (TOM) комплекс во время переноса preprotein с наружной мембраны (OM) на внутреннюю мембрану (IM), формирует TOM-TIM-preprotein суперкомплекс; с АТФ-управляемым presequence translocase-associated motor (PAM); с респираторной цепи комплексами III (CIII) и IV (CIV), которые генерируют электрохимический градиент протонов (ΔµH+)? управляющий инсерцией preprotein150,151; и с носителями ADP/ATP, которые также поддерживают транслокацию preprotein 152,234 (see the figure, part a; interactions depicted by double-headed arrows). Субъединица транслоказы Tim21 функционирует как динамический объединяющий фактор, который взаимодействует с TOM и респираторным суперкомплексом CIII-CIV альтернативным способом. В полностью активных дышащих дрожжевых митохондриях активность presequence транслоказы управляет эффективно импортом preprotein. Однако, когда респираторная активность снижена, то купирование с помощью translocase с аппаратом (machineries), участвующим в биоэнергетике, благоприятно для поддержания действия, зависимых от энергии, транслоказ150-152. Preprotein транслоказы в непосредственной близи накачки протонов респираторных комплексов, скорее всего, поддерживают повышенную движущую силу протонов (localized proton gradients), и тем самым при условиях ограничения энергии инсерция preprotein в IM всё ещё возможна150,151, обеспечивая тем самым продожение биогенеза респираторных комплексов даже в условиях ограниченного поступления пищи.
Coupling of presequence translocase to respiratory chain assembly
Характеристика биогенеза респираторной цепи в митохондриях человека выявила дополнительный уровень сложности в кооперации между аппаратом импорта белка и респираторной цепью, которая обеспечивается с помощью mitochondrial translation regulation assembly intermediate of cytochrome c oxidase (MITRAC) 153-155. MITRAC представлена несколькими образованиями промежуточных комплексов респираторной цепи и играет двойную роль (see the figure, part b). Она связывает presequence транслоказу со сборкой промежуточных образований респираторной цепи посредством TIM21-обеспечиваемого переноса импортируемых белков с TIM23 на MITRAC 154. Более того, MITRAC кооперирует с аппаратом для синтеза и инсерции митохондриальных белков (oxidase assembly (OXA) insertion machinery) путем адаптации эффективности митохондрильной трансляции к импорту кодируемх в ядре белков партнеров (translational plasticity). Факторы сборки MITRAC связаны частично с синтезируемыми белками, вставляемыми в мембраны, такими как чрезвычайно гидрофобным COX1 белком и задержкой из синтеза вплоть до импорта соотв. партнерских белков, чтобы обеспечить баланс субъединиц, кодируемых в ядре и митохондриях 155. Функции человеческого TIM14 (известен также как DNAJC19 или PAM18) и ROMO1 (известен также как MGR2) в TIM23-PAM аппарате не была исследована тщательно (indicated by dashed borders).
|
Mitochondrial membrane architecture and membrane contact sites
Места контактов между наружной и внутренней мембранами митохондрий и эндоплазматическим ретикулумом (ER) являются критическими элементами крупной сети сайтов мембранных контактов, участвующих в белковом и липидном биогенезе, архитектуре и динамике митохондриальных мембран, метаболитов и транспорте ионов и митохондриальном наследовании (Fig. 4). Preprotein транслоказы формируют центральные строительные блоки этой ER-mitochondria organizing network (ERMIONE) 164. Комплексы TOM и SAM наружной мембраны взаимодействуют с крупным MICOS комплексом внутренней мембраны 9-11,13,165-168. MICOS обогащены на соединениях гребешков 169,170 и их крупнейшей субъединице, Mic60, они играют важную роль в формировании контактных сайтов между мембранами. Кроме того, Mic60 временно взаимодействует с рецептором и oxidoreductase Mia40 из аппарата сборки межмембранного пространства 9. MICOS т.о. помогает позиционировать нижестоящие устройства MIA и SAM вблизи канала импорта TOM и способствует эффективному импорту богатых цистеином предшественников в межмембранное пространство и β-barrel предшественники в наружной мембране 9,165.
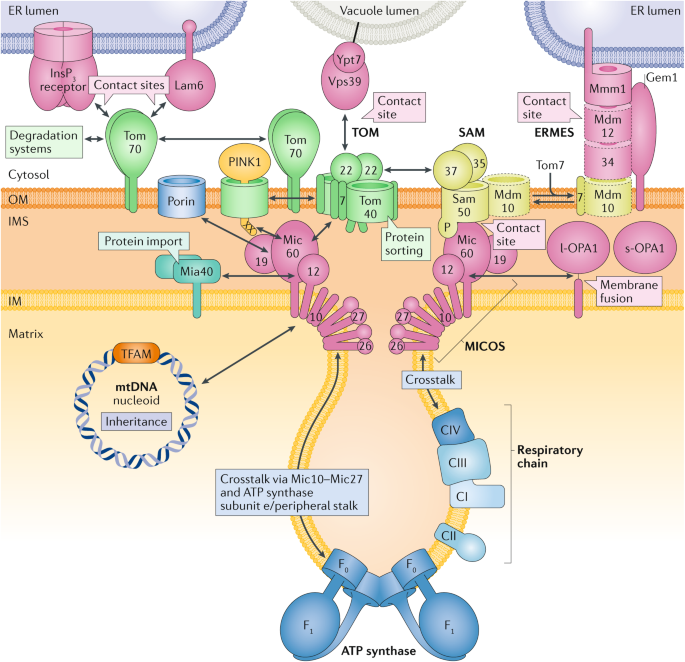
Fig. 4: Mitochondrial organizing network.
The mitochondrial contact site and cristae organizing system (MICOS) of the inner membrane (IM) and the protein translocases translocase of the outer membrane (TOM) and sorting and assembly machinery (SAM) of the outer membrane (OM) form the core of a large endoplasmic reticulum (ER)-mitochondria organizing network (ERMIONE) that includes multiple dynamic interactions: with the ER-mitochondria encounter structure (ERMES); with further ER-mitochondria contact sites that involve the receptor Tom70 and inositol trisphosphate (InsP3) receptors or the lipid transfer protein Lam6, as well as with vacuole-mitochondria contact sites (including Tom40 and the bridging protein Vps39); with the kinase PTEN-induced putative kinase 1 (PINK1) and the metabolite channel porin; with the mitochondrial intermembrane space (IMS) protein import and assembly system (Mia40); with respiratory chain complexes, the F1F0-ATP synthase and the fusion protein optic atrophy 1 (OPA1) of the IM; and with mitochondrial DNA (mtDNA) nucleoids (with the mtDNA packaging factor, termed mitochondrial transcription factor A (TFAM))262 of the matrix. Most components shown have been functionally conserved from yeast to humans; proteins that have been characterized in fungi only are indicated by a dashed border. In sum, ERMIONE forms a membrane-spanning system for the coordination of protein and lipid biogenesis, energetics, inheritance and quality control of mitochondria. CI, complex I; CII, complex II; CIII, complex III; CIV, complex IV.
MICOS-SAM-TOM стержень в ERMIONE взаимодействует с др. устройствами митохондрий, это приводит к созданию крупной, сложной функциональных взаимодействий (Fig. 4). Большинство взаимодействующих с ERMIONE партнеров было идентифицировано биохимически (via direct binding) или генетически (идентифицируя синтетические дефекты роста).
Механизмы, которые регулируют взаимодействия этой сложной сети и их функциональное значение являются предметом интенсивных исследований. Во внутренней мембране, Mic10, стержневой компонент MICOS171,172, и его партнерский белок Mic27 находятся в динамическом контакте с димерной F1F0-ATP синтазой, оформляющей края гребешков, приводя к общению между двумя крупными аппаратами, формирующими мембраны, из внутренней мембраны, MICOS и F1F0-ATP синтаза144,173,174. Сборка Mic10-содержащего субкомплекса из MICOS связана с респираторными комплексами и специфичным для митохондрий димерным фосфолипидом cardiolipin175,176. Кроме того, MICOS соединяется с аппаратами для слияния митохондрий, включая белок слияния внутренней мембраны optic atrophy 1 ( OPA1 у млекопитающих и Mgm1 у дрожжей)144,177,178. Исследования мутантов открыли функциональную связь между MICOS и агрегацией nucleoid и наследованием митохондриальной ДНК (mtDNA)179,180, но лежащие в основе молекулярные механизмы нуждаются в дальнейшем анализе. На наружной мембране комплексы SAM не только непосредственно взаимодействуют с частью комплексов TOM в TOM-SAM суперкомплексах125,127, но также обмениваются Mdm10 с ER-mitochondria encounter structure(ERMES), которая связывает митохондриальную наружную мембрану с ER (Fig. 4). Наружное мембраны β-barrel белок Mdm10 является субъединицей как SAM, где он участвует в биогенезе TOM, а также в ERMES, где он вносит вклад в перенос липидов и поддержание морфологии митохондрий181-184. Снование Mdm10 между SAM и ERMES регулируется с помощью малого белка Tom7. Tom7 имеет двойную локализацию: он в основном располагается в комплексе TOM, но также функционирует и вне комплекса TOM в качестве регуляторного фактора, способствующего переносу Mdm10 на ERMES185-188. Не собранный в ансамбль Tom7 замедляет сборку TOM за счет сдвига Mdm10 с SAM формы в ERMES форму, это составляет регуляторный механизм, активный, когда накапливается избыток non-assembled TOM субъединиц в митохондриях. Главный метаболит наружной мембраны канал porin, также наз. voltage-dependent anion channel (VDAC), взаимодействует c MICOS, а также с TOM комплексом10,189, связывая транспорт метаболитов с ERMIONE. Tom70, один из рецепторов комплекса TOM, обнаруживается также вне комплекса TOM и выполняет критическую роль в формировании мест контактов ER-mitochondria (Fig. 4). Tom70 и его изоформа Tom71 взаимодействуют с Lam6 (известен также как Ltc1), белком, переносчиком липидов, который закреплен на мембранах посредством сайтов, связывающих липиды, и регулирует сайты контактов между митохондриями, ER и др. органеллами190,191. У млекопитающих TOM70 также взаимодействует с inositol trisphosphate (inositol-1,4,5-trisphosphate) рецепторами из ER, чтобы способствовать переносу Ca2+ с ER на митохондрии192. Более того, Tom40 участвует в формировании контактных сайтов между вакуолями и митохондриями, известными как vacuole and mitochondria patch (vCLAMP), содержащими vacuolar GTPase Ypt7 и белок, образующий мостики, Vps39 (известен также как Vam6)190,193. Более того, пузырьки могут быть высвобождены из наружной мембраны митохондрий, чтобы направлять избранные грузы на деградацию в лизосомы194-196, а Tom70 и Tom71 , как было установлено, необходимы для формирования, по крайней мере, некоторых управляемых митохондриями, пузырьков197, связывая аппарат транспорта с контролем качества и системами деградации. AAA-type ATPase Msp1 способствует экстракции неправильно помещенных белков из наружной мембраны198,199. После накопления не импортированных белков предшественников, Msp1 рекрутируется на Tom70 посредством периферического мембранного белка Cis1 (известен также как Atg31), приводя к удалению не импортированных белков и к их деградации с помощью протеосом200. Наконец, TOM и MICOS участвуют в накоплении PTEN-induced putative kinase 1 (PINK1) в наружной мембране не функциональных или поврежденных митохондрий, это способствует их удалению с помощью mitophagy15,16,201,202.
N/j/? митохондриальные мембраны содержат, по крайней мере, две крупные белковые сети, обе содержащие TOM комплексы: TOM-TIM23-respiratory chain-AAA сеть, которая купирует импорт белков с биоэнергетикой и механизмы контроля качества и MICOS-SAM-TOM-ER network (ERMIONE), которая связывает биогенез белков с контактными сайтами мембран и морфологией мембран. В то время как MICOS концентрируется на соединениях гребешков, TOM-TIM23-preprotein суперкомплексы преимущественно обнаруживаются на расстоянии ~30-60 nm от соединений гребешков 124. Остается определить, действительно ли эти две крупные сети функционируют независимо др. от др. или они обмениваются компонентами посредством скоординированного биогенеза белков, энергетики, морфологии мембран и контроля качества. Идентификация сети ERMIONE четко демонстрирует, что митохондрии не функционируют как отдельно стоящие единицы, а скорее интимно сцеплены др. с др.
Protein import and pathophysiology
Эффективность импорта белков в митохондрии является чувствительным индикатором энергетического состояния и годности митохондрий. Различные нарушения дыхания и метаболизма митохондрий приводят к снижению потенциала внутренней мембраны203,204. Т.к. мембранный потенциал является критическим для транслокации белков в и поперек внутренней мембраны, то импорт preproteins снижается1,2. Дефекты белкового гомеостаза в матриксе митохондрий за счет накопления неправильно упакованных белков также приводят к снижению импорта белков, напр., к нарушению импорта мотора с помощью mtHsp70205. Нарушения активности аппарата импорта митохондрильных белков в условиях стресса или митохондрильных болезней являются прямыми указателями на нарушения функции митохондрий и могут вызывать стрессовые реакции или приводить к удалению поврежденных митохондрий с помощью mitophagy (Box 3).
Умеренные нарушения импорта митохондриальных белков могут запускать активацию UPRmt из-за неспособности импортировать транскрипционный фактор ATFS-1 (известен также как ATF5) в митохондрии, приводя к его транспорту в ядро и к транскрипционной стрессовой реакции206,207 , чтобы восстановить частично поврежденные митохондрии (Box 3). Индуцированное стрессом снижение уровней TIM17A также приводит к снижению импорта митохондриальных белков и способствует индукции UPRmt133. Кроме того, накопление митохондрииальных белков предшественников в цитозоле приводит к ослаблению синтеза цитозольных белков и активации протеосом для очистки от неправильно помещенных бюелков из цитозоля208-212. Этот процесс известен как реакция на неупакованные белки (UPRam) или mitochondrial precursor over-accumulation stress (mPOS).
После тяжелых повреждений импорта митохондриальных белков киназа PINK1 не импортируется, не подвергается процессингу и деградирует, но ассоциирует с TOM комплексом как белок полной длины, инициируя каскад, который приводит к удалению поврежденных митохондрий с помощью mitophagy15,16,201,202 (Box 3). Т.к. мутации в PINK1 сцеплены с болезнью Паркинсона, то было предположено, что недостаточность mitophagy может быть одной из причин, лежащих в основе возникновения болезни201. Недавно, PINK1 и MIC60 из комплекса MICOS были найдены взаимодействующими временно, подтверждая тем самым общение между накоплением PINK1 и ремоделированием гребней внутренней мембраны213,214 (Fig. 4).
Недавнее исследование на дрожжах подтвердило, что аппарат импорта митохондриальных белков удаляет неправильно упакованные белки из цитозоля и транспортирует их на деградацию внутри митохондрий215. Этот процесс, которые назван mitochondria as guardian in cytosol (MAGIC), нуждается в дальнейшем исследовании, чтобы определить его значение для гомеостаза клеточных белков (proteostasis) и его связь со стрессовыми реакциями, которые инициируются за счет снижения эффективности импорта митохондриальных белков, таких как UPRmt, UPRam и PINK1-parkin пути.
Протеолитические преобразования белков предшественников также играют роль в контроле качества митохондрий. В одном механизме удаление дестабилизирующего N-концевого аминокислотного остатка с помощью преобразующих энзимов Icp55 или Oct1 снова стабилизирует импорт белков от протеолитической деградации49,71,72 (Fig. 2). В др. механизме импортируемые белки подвергаются разным преобразованиям, двая две или более изоформы с отличающимися N-концами. Напр., белок слияния внутренней мембраны OPA1 сначала подвергается преобразованию с помощью MPP, давая длинную изоформу, а при дальнейшем преобразовании с помощью протеаз внутренней мембраны, таких как AAA протеазы и OMA1 у млекопитающих дает короткие изоформы216-218. Баланс между длинными и короткими изоформами, который важен для слияния и деления мембран, модулируется с помощью стресса и энергетического состояния внутренней мембраны (т.е., митохондриальной активности )216-218.
Нарушения процессинга preproteins оказались связанными в дисфункциями митохондрий при болезни Альцгеймера219. Матричные peptidasome деградируют presequences и др. пептиды, такие как связанные с болезнью Альцгеймера амилоидные- β пептиды. После накопления амилоидных- β пептидов в митохондриях, деградация presequences замедляется competitively, приводя к подавлению processing пептидаз. Как следствие, белки, импортируемые в митохондрии сохраняются в форме предшественников или промежуточных форм, которые не могут правильно укладываться и склонны к быстрой деградации. Накопление амилоидных- β пептидов т.о. вызывает многочисленные изменения в составе митохондриальных белков, это объясняет широкое разнообразие митохондриальных альтераций, наблюдаемых при болезни Альцгеймера.
Исследования последних лет предоставили доказательства участия импорта и процессинга митохондриaлных белков в патогенезе болезней человека. На сегодня, однако, имеются разные мнения относительно дисфункции митохондрий, прямо или косвенно участвующей в возникновении основных нейродегенеративыных болезней, таких как болезнь Паркинсона и болезнь Альцгеймера220. В Box 4, мы предоставили обзор наиболее редких болезней и нарушений, которые сцеплены со специфическими компонентами аппарата митохондрий для импорта белков и созревания, указывая тем самым на участие в патогенезе болезней. Эти болезни в основном затрагивают нервную систему и др. ткани с высокими энергетическими потребностями, такие как сердце, мышцы и почки. (Box 4).
Обнаружение сетей между preprotein транслоказами и др. митохондриaльными устройствами в основном были изучены при физиологических условиях. Мы ожидаем. что эти сети будут играть важные роли в понимании механистической основы митохондриальных стрессовых реакций и патогенезе болезней, исходя из роли TOM и MICOS в накоплении PINK1 на наружной мембране и последующем удалении поврежденных митохондрий с помощью mitophagy 213,221-223.
|
Box 3 Quality control pathways associated with the protein import machinery
Mitochondrial unfolded protein response (UPRmt) |
Активируемый стрессом транскрипционный фактор ATFS-1 содержит сигналы митохондриальной и ядерной локализации. Фактор импортируется в здоровые митохондрии и деградирует. Если митохондриальный импорт нарушен, то транскрипционный фактор накапливается в цитозоле, транслоцируется в ядро и вызывает экспрессию шаперонов, протеаз и др. факторов, чтобы способствовать восстановлению поврежденных митохондрий 206,207.
Unfolded protein response activated by mistargeted mitochondrial proteins (UPRam)
После нарушений импорта митохондриaльных белков белки предшественники накапливаются в цитозоле, запускают стрессовую реакцию, UPRam (также известна как mitochondrial precursor over-accumulation stress (mPOS)), которая снижает эффективность синтеза цитозольных белков и увеличивает активность протеосом, редуцируя тем самым накопление неправильно попавших белков в цитозоль 208,209.
The PINK1-parkin pathway
Мситохондриальная киназа PTEN-induced putative kinase 1 (PINK1) была идентифицирована при семейных случаях болезни Паркинсона. В здоровых митохондриях PINK1 импортируется с помощью presequence пути и преобразуется с помощью mitochondrial processing peptidase (MPP) и presenilin-associated rhomboid-like protease PARL, что сопровождается высвобождением в цитозоль и деградацией с помощью протеосом. Когда импорт белка или процессинг с помощью presequence пути нарушены, то оставшаяся не преобразованной PINK1 накапливается на комплексе translocase of the outer membrane (TOM) 221-223 (Fig. 4), где она фосфорилирует ubiquitin и E3 ubiquitin лигазу parkin, запуская удаление поврежденных митохондрий с помощью mitophagy.
Mitochondria as guardian in cytosol (MAGIC)
Некоторые склонные к агрегации или неправильно упакованные цитозольные белки могут импортироваться в митохондрии и деградировать 215, подтверждая роль митохондрий в цитозольном proteostasis. |
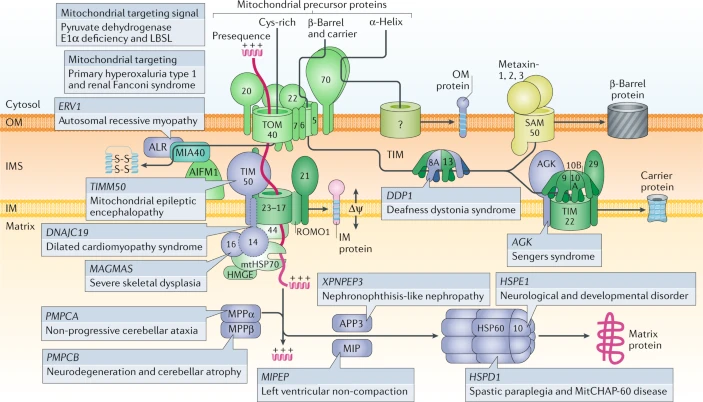
Box 4 Disorders and diseases associated with distinct steps of human mitochondrial protein import and maturation |
Mitochondrial targeting
Мутации сигналов, направляющих в митохондрии, могут нарушать импорт индивидуальных белков, вызывая дефицит pyruvate dehydrogenase E1α 235 или вызывая нарушения импорта митохондриальной aspartyl-tRNA, связанные с leukoencephalopathy с вовлечением ствола головного мозга и спинного мозга и повышением lactate (LBSL) 236. L-Alanine:glyoxylate aminotransferase располагается в пероксисомах у людей; однако, мутации могут генерировать сигнал направляющий белок в митохондрии, приводя к неправильному направлению в митохондрии и преимущественно к hyperoxaluria type 1 (refs237,238). Сходным образом, при почечном типе синдрома Fanconi, мутации генерируют сигнал, направляющий в митохондрии, peroxisomal белка, участвующего в окислении жирных кислот, вызывая неправильное помещение в митохондриях и нарушения продукции митохондриальной энергии в проксимальных канальцах 239.
Mitochondrial intermembrane space import
Мутации в гене ERV1, кодирующем disulfide relay component GFER (известен также как ALR), вызывают нарушения связывания кофактора FAD, приводя к миопатии с катарактой и комбинированным дефицитом респираторной цепи 240,241.
Mitochondrial presequence import pathway
Мутации в TIMM50, гене, кодирующем presequence транслоказу receptor translocase of the inner membrane 50 (TIM50), приводят к нарушениям импорта посредством presequence пути, снижая уровни компонентов оксидативного фосфорилирования, увеличивая продукцию ROS, к тяжелой эпилептической энцефалопатии, 3-methylglutaconic ацидурии и к lactic acidosis 242,243. Мутации в гене DNAJC19, кодирующем транслоказную субъединицу импорта через внутреннюю мембрану (IM) TIM14 (известен также как DNAJC19 ил PAM18), вызывает дилятационную кардиомиопатию с атаксией, анемией и дисгенезом яичек 244,245. Поскольку TIM14 в основном ассоциирует с prohibitin комплексами, затрагивая метаболизм cardiolipin, альтерации cardiolipin, скорее всего, участвуют в патогенезе болезни 246. DNAJC15 (известен также как methylation-controlled J protein (MCJ)), др. гомолог TIM14 человека 247, связан с тумороген6езом. TIM14 и DNAJC15 сцеплены с определенными формами presequence транслоказ 132, пока их точное значение для импорта белков нуждаются в дальнейшем анализе (indicated by a dashed border). Мутации в гене MAGMAS, кодирующем человеческий TIM16 J-подобный co-chaperone (известен также как PAM16) из presequence translocase-ассоциированного мотора для импорта связаны с тяжелой spondylodysplastic dysplasia 248.
Precursor protein processing
Мутации в гене, кодирующем mitochondrial processing peptidase (MPP) субъединицу α (PMPCA) и β (PMPCB) вызывают дефекты преобразования preprotein, что сцеплено с мозжечковой атаксией 249 или ранней детской нейродегенерацией с мозжечковой атрофией 250. Мутации в гене MIPEP, кодирующем octapeptidyl peptidase человека, вызывают в левом желудочке non-compaction кардиомиопатию с гипотонией и задержкой развития 251. Мутации в гене XPNPEP3, кодирующем intermediate cleaving peptidase человека, сцеплены с nephronophthisis-подобной кистозной болезнью почек 252,253.
Chaperones for precursor protein folding
Мутации в HSPD1, кодирующем chaperonin HSP60, приводят к нейродегенеративным нарушениям, спастической параплегии и митохондрильной chaperonin-60 болезни 254,255. Мутации в гене HSPE1, кодирующем co-chaperonin HSP10, ассоциированы с судорагами у детей и задержкой развития 256.
Membrane protein transfer chaperone
Мутации в гене DDP1 (известен также как TIMM8A), кодирующем малый TIM chaperone (субъединицу TIM8A), вызывают синдром deafness dystonia, который известен также как Mohr-Tranebjaerg синдром 257,258.
Carrier translocase
Мутации в гене acyl glycerol kinase AGK приводят к катарактам, кардиомиопатии и скелетной миопатии (Sengers syndrome)259. AGK выполняет двойную роль как липидной киназы и как субъединицы человеческой TIM22 carrier транслоказы, связанной с метаболизмом липидов и импортом белка при Sengers синдроме
260,261.
Conclusions and perspectives
We have discussed that mitochondrial preprotein translocases, respiratory complexes, metabolite transporters, proteases, morphology complexes and membrane contact sites do not function as independent machineries but are physically and functionally connected in large dynamic networks. The protein translocases represent an essential housekeeping system of mitochondria. Not only are the translocases responsible for importing ~1,000-1,500 different proteins; they also form stable building blocks of the mitochondrial protein networks.
The rapid progress in identifying connections between machineries of different functions11,26,144,158,159,224,225 indicates that we have not reached saturation in the analysis of mitochondrial protein networks. In addition to the experimentally established connections described in this Review, interesting further network candidates include scaffold protein complexes that locally organize the protein-lipid composition of the inner membrane, such as the prohibitin ring complexes and stomatin-like protein 2, which associates with protease complexes and regulates the processing of PINK1 and OPA1 (refs11,226); lipid biosynthesis and remodelling enzymes; and cytosolic machineries that are involved in transferring preproteins, lipids or metabolites to mitochondria. Whereas several contact sites between mitochondria and other cell organelles have been identified recently, we have only a limited understanding of the interplay between cytosolic proteins or protein complexes and the mitochondrial outer membrane. This includes the potential involvement of specialized pools of cytosolic ribosomes in protein delivery to mitochondria227, the role of cytosolic chaperones, co-chaperones and potential targeting factors in cytosol-mitochondria crosstalk86,228,229,230, the rerouting of mitochondrial preproteins from the surface of the ER to mitochondria231 and the emerging evidence that numerous mitochondrial proteins possess a dual function and localization26,232.
Important questions concern the dynamics, regulation and turnover of the protein networks. It is likely that partner complexes in networks are turned over at different rates. Examples are the stress-regulated degradation of the TIM17A isoform of metazoan presequence translocases133 and the selective degradation of the outer membrane proteins Tom22 and porin-associated Om45 by the iAAA protease163(Fig. 3), whereas the other subunits of the complexes are turned over by different proteolytic machineries. The differential control of the networks by mitochondrial proteolytic systems, the cytosolic ubiquitin-proteasome system and mitophagy, as well as the role of lipids in establishing and maintaining the networks, will become central topics of research.
The large number of distinct functions observed in mitochondrial protein networks may give the initial impression that collaborations of protein machineries have developed in a random manner. The mechanistic studies performed so far, however, indicate that the interactions are highly specialized and specifically regulated, such as those between presequence translocase and respiratory supercomplexes and those between MICOS, TOM, SAM and the ER-mitochondria contact sites. To date, the studies have been mainly performed in yeast and partially in human mitochondria, which both belong to the same supergroup of eukaryotes, opisthokonts, including fungal and metazoan kingdoms. As the characterization of the mitochondrial protein import machinery in different supergroups yielded remarkable insight into core machineries and the high variability of transport complexes233, a systematic analysis of mitochondrial protein networks in the five eukaryotic supergroups will represent a rich source for defining core principles and variable parts of mitochondrial organization.
|
 Fig. 1: Overview of mitochondria and their functions.
Fig. 1: Overview of mitochondria and their functions. 



