Посещений: 
МОРФОГЕНЕТИЧЕСКИЕ ВОЛНЫ
Гаструляция эмбрионов дрозофилы
Genetic induction and mechanochemical propagation of a morphogenetic wave • Anais Bailles,
• Claudio Collinet,
• Jean-Marc Philippe
et al.Nature volume 572, pages467–473(2019)
| |
|
Онтогенетическая информация регионализует и поляризует клеточное поведение. Существует объяснение, как генетическая и биохимическая информация контролирует механику клеток1,2. Напр., у ранних эмбрионов Drosophila экспрессия мезодермальных транскрипционных факторов Twist и Snail вызывают сужение апикальных частей клеток и инвагинацию ткани в вентральном регионе эмбриона3. Такое поведение возникает за счет пространственного и временного контроля контрактильности актомиозина1,4. Активация не мышечного MyoII в медио-апикальном регионе клеток управляет их апикальным сжатием и инвагинацией ткани5-8. Малая GTPase Rho1 активирует MyoII посредством нижестоящей киназы Rok9-12 и контролирует саму себя посредством разных сигнальных путей, включая G-protein-coupled receptors (GPCRs)13,14. Во время гаструляции у Drosophila, локальная транскрипция и секреция GPCR лиганда Fog контролирует активацию Rho1 и зависимые от MyoII апикальные сужения15,16. Т.о., формирование онтогенетического паттерна контролирует сократимость актомиозина и тканевую динамику посредством контроля передачи сигналов Rho.
Однако, во время морфогенеза сети актомиозина и Rho GTPases обнаруживают известную динамику, которая не строго управляется вышестоящими генетическими программами. Сети актомиозина являются пульсирующими 5-7,12,17-20 или текучими 17,18,21,22 у широкого разнообразия видов, тогда как кортикальные волны активности RhoA возникают в кортексе крупных клеток 12,23,24. Далее, актомиозиновые сети могут ощущать и реагировать на механическое окружение 25-28. Как генетическая информация и механика интегрируются, чтобы координировать сократимость актомиозина и морфогенез на тканевом уровне, малопонятно.
A wave of MyoII activation travels anteriorly
Задняя энтодерма у Drosophila находятся на заднем полюсе эмбриона и подвергается инвагинации и перемещениям в направлении кпереди в результате удлинения зародышевого диска 29,30 (Fig. 1a). Зависимые от MyoII апикальные сужения управляют локальной инвагинацией энтодермы 15,31,32, но как энтодерма перемещается в направлении кпереди, неизвестно. Мы метили MyoII (используя mCherry-labelled MyoII regulatory light chain (MRLC)) и маркером клеточных контуров (E-cadherin-GFP) на дорсальной задней стороне эмбриона (Fig. 1b and Supplementary Video 1). Во время первых 6 мин после начала активации MyoII, MyoII появлялся в медио-апикальном регионе клеток и индуцировал инвагинацию внутрь региона, энтодермального примордия, который представлен 7 ± 1 (mean ± s.d.) рядами клеток полюса (Fig. 1b, c). В последующие 25 мин., апикальная активация MyoII и инвагинация клеток распространяется кпереди через домен из 8 ± 1 (mean ± s.d.) рядов клеток, впоследствии названного propagation регионом (Fig. 1b, c). Т.о. регион, в котором MyoII активируется и клетки инвагинируются, расширяется кпереди. Это контрастирует с мезодермой Drosophila, в которой апикальные сужения возникают в фиксированном домене, определяемом экспрессией twist и snail2.

Fig. 1: Propagation of MyoII activation in the posterior endoderm.
a, Endoderm morphogenesis during embryonic axis extension. b, Time-lapse of MyoII during endoderm morphogenesis in the region outlined in a. Top, dashed outline, the primordium region; cells outlined in yellow and white, different medio-lateral rows; white arrows, MyoII activation. n = 13 embryos. Scale bars, 15 ?m c, Primordium and the propagation regions mapped on the dorsal epithelium at the onset of gastrulation. The size of each domain is indicated. n = 13 embryos. d, e, Kymograph heat maps of median integrated MyoII intensity (d) and projected apical cell area (e). Dashed line, border between the primordium and propagation regions; black line, constant speed of the MyoII wave (value shown). n = 947 cells, 5 embryos. f, Time course of projected apical area and integrated MyoII intensity in cells in the propagation region. n = 456 cells, 6 embryos. t = 0 is time of MyoII activation. Data in c, d and f are mean ± s.d. A, anterior; P, posterior; D, dorsal; V, ventral.
Мы отслеживали положения клеток. Kymographs высокотемпературных карт показали, что волна активации MyoII перемещается с постоянной скоростью в 2.2 ± 0.2 µm min-1 (mean ± s.d.) (что соответствует примерно 1 клетке в каждые 3 мин., Fig. 1d) и что ей предшествует волна анизотропной клеточной деформации, в результате которой апикальные области клеток (измеряемой по их проекции на плоскость изображения) (Extended Data Fig. 1g-i) увеличиваются вдоль передне-задней осси перед инвагинацией (Fig. 1e, f and Extended Data Fig. 1e, f). Очевидно, что в то время как клетки примордия рекрутируют MyoII ступенчато-образным способом (Extended Data Fig. 2a, b and Supplementary Video 2), клетки в регионе propagation рекрутируют MyoII с кинетикой достоверно более быстрой, чем в примордии (Extended Data Fig. 2c), это указывает на то, что они используют другой механизм активации MyoII.
Затем мы измеряли активацию Rho1 и Rok с помощью Rho1-GTP биосенсора 10 и Rok-GFP 9. Обе молекулы активировались вместе с MyoII в домене propagation (Extended Data Fig. 3a-d and Supplementary Videos 3 and 4). Т.о., волна активации Rho1, Rok и MyoII распространялась вдоль дорсальной части эпителия. Это заставило нас исследовать лежащие в основе механизмы.
The wave does not require sustained transcription
Медио-апикальная активация MyoII в энтодерме примордия зависит от локальной транскрипции и секреции Fog 15,16, который контролирует рецепторную тирозин киназу Torso (Tor) и её мишени транскрипционные факторы Huckebein (Hkb) и Tailless (Tll) 15,33,34 (Extended Data Fig. 4a). У мутантов по tor, активация fog или concertina (the G-protein Gα 12/13 стоят ниже GPCRs 16), MyoII отсутствует в примордии, как и ожидалось, а также в регионе propagation (Extended Data Fig. 4b and Supplementary Video 5). Поэтому тестировали, может ли экспрессия tll и fog распространяться кпереди подобно MyoII (Fig. 2a). Иммуномечение показало, что Fog и Tll присутствуют в примордии, где активируется MyoII, и что домены их экспрессии не расширяются со временем, когда новые клетки вступают в инвагинацию (Fig. 2b, Extended Data Fig. 4c). Напротив, MyoII был обогащен во всех клеточных верхушках по фронту инвагинации на всех стадиях (Fig. 2b), отражая распространение его активации. .

Fig. 2: MyoII propagation does not depend on gene transcription.
a, Schematic of the dorsal epithelium in a sagittal section, illustrating the hypothesis of propagation in gene expression controlling MyoII propagation. b, Sagittal sections of immunostainings for Fog and MyoII at the indicated stages. White arrows, boundaries of the fog expression domain; yellow arrowheads, cells recruiting MyoII at the anterior boundary of the furrow. n = 7 embryos for primordium contraction and n = 5 embryos for propagation stages from 2 independent experiments. c, Time-lapse imaging showing fog expression in the posterior endoderm visualized with the MS2-MCP system35. White dashed rectangles, positions of the magnified areas (right); yellow lines, region shown in the XZ view. n = 11 embryos. d, MyoII wave propagation in embryos injected with α-amanitin or water (control). Yellow outline, cells in the propagation region. e, Quantification of MyoII propagation in embryos injected with α-amanitin or water. The number of cell rows activating MyoII in the propagation region over time was measured. Data are mean ± s.d. In d, e, n = 11 embryos (control) and n = 10 (?-amanitin). In e, t = 0 marks the beginning of MyoII propagation. Scale bars, 15 ?m (b, c (left), d); 5 ?m (c, (right)).
Мы отслеживали транскрипцию fog с MyoII у живых эмбрионов, используя систему MS2-MCP 35. Транскрипты fog (bright GFP dots in the nuclei marked with His2B-RFP) присутствовали в примордии в начале гаструляции, но отсутствовали в регионе propagation, в котором индуцировался MyoII (Fig. 2c, Extended Data Fig. 5a and Supplementary Video 6). Это указывает на то, что в то время как транскрипция fog в примордии необходима для активации MyoII, волна последующей активации не связана с волной транскрипции fog. Распространение активации MyoII может зависеть от распространения транскрипции др. генов. Чтобы проверить, мы инъецировали α-amanitin, ингибитор RNA polymerase II, в эмбрион непосредственно перед началом гаструляции. Это приводило к быстрому исчезновению (в течение 2-3 мин) ядерных фокусов транскриптов fog (Supplementary Video 7), тогда как волна MyoII протекала с нормальной скоростью (Fig. 2d, e and Supplementary Video 8). Два процесса, нуждающихся в острой транскрипции, были затронуты в этой ситуации: клеточные деления в митотических доменах (зависимые от транскрипции cdc25string 36) были блокированы, а клеточные интеркаляции, требующие транскрипции, были даже пропущены, toll-2 (известен также как 18 wheeler), toll-6 и toll-8 (известен также как tollo) 37 в вентро-латеральной эктодерме были подавлены (Extended Data Fig. 5b and Supplementary Video 8). Следовательно, в то время как волна MyoII была инициирована с помощью транскрипции fog в примордии, её прогрессия обеспечивается др. механизмом, независимым от транскрипции.
MyoII wave dynamics is independent of Fog delivery
Fog может действовать посредством паракринной передачи сигналов15. Поэтому распространение Fog прочь от примордия, где он продуцируется и секретируется, может в принципе лежать в основе распространения активности Rho1-MyoII (Extended Data Fig. 6a). В соответствии с этим Fog белок был обнаружен, хотя и на низких уровнях, апикально в регионе propagation вблизи борозды (Extended Data Fig. 6b, c). В противоположность наблюдаемой kinematics волны, общая модель диффузии секретируемых лигандов предсказывает фронт волны, который разглаживается, отходя от источника. Базируясь на предыдущих работах38,39, модель, которая связана с диффузией Fog и насыщаемым связыванием рецептора, с активацией MyoII, может продуциовать динамику бегущей (travelling) волны MyoII, независимую от высвобождения Fog, волну острой активности MyoII (Extended Data Fig. 6d, e and Supplementary Information). Эта модель предсказывает, что увеличение скорости продукции лиганада увеличивает скорость распространения волны (Extended Data Fig. 6e). Чтобы повысить экспрессию Fog в примордии, мы использовали дополнительные копии fog под контролем промотора hkb40 (Extended Data Fig. 6f and Supplementary Video 9). Более ранее рекрутирование и более высокие уровни MyoII в примордии (Extended Data Fig. 6g, i) согласовывались с повышенными уровнями Fog. Уровни MyoII в регионе propagation также были увеличены, но в меньшей степени (Extended Data Fig. 6h, i). В противоположность предсказаниям модели, скорость волны оставалась неизменной (Extended Data Fig. 6j) , а активация MyoII происходила с то же самое время на одинаковых расстояниях от примордия, как и в контроле (Extended Data Fig. 6h). Это указывает на то, что диффузия Fog не контролирует распространение MyoII.
Формирование сигнального паттерна волн Fog осуществляется с помощью др. механизмов (напр., транспорта лиганда или регуляции GPCR) активирующих MyoII в регионе propagation посредством передачи сигналов GPCR или Rho1. Для проверки мы вызывали избыточную экспрессию Fog униформно в эмбрионе (Extended Data Fig. 7a, b, e and Supplementary Video 10). Хотя уровни MyoII в дорсальном эпителии были повышены, паттерн на тканевом уровне с высокими концентрациями MyoII в задней части эмбриона и низкой MyoII более кпереди, сохранялся (Extended Data Fig. 7c). Это не было вызвано эндогенным fog, из-за униформной экспрессии Fog у fog-/- эмбрионов, дававших сходные результаты (Extended Data Fig. 7f, g). Очевидно, высокие уровни MyoII распространялись точно также, как у эмбрионов дикого типа (Extended Data Fig. 7a, d). Отключение регуляции GPCR также было неспособно предупредить распространение волны. Униформная экспрессия постоянно активного Gα 12/13 и Rho1 привели к полярности на тканевом уровне MyoII, а распространение высоких уровней MyoII происходило по-прежнему (Extended Data Fig. 7a-d and Supplementary Video 10). Экспрессия постоянно активного Gα 12/13 привело к распространению на большее количество рядов клеток, возможно из-за обширного тканевого складывания, ассоциированного с этим нарушением. Т.о., формирование сигнального паттерна Fog не предопределяет динамику волны MyoII. Fog может быть необходим, но активация MyoII не управляется исключительно Fog-зависимой активацией Rho1 в регионе propagation.
Mechanical regulation of the Rho1-MyoII wave
Поскольку MyoII может реагировать на механические стимулы 25,27, то механические напряжения или стрессы (действующие непосредственно на концентрацию или стабилизацию MyoII 41 или косвенно посредством передачи чувствительных к механическим воздействиям сигналов 42,43) могут участвовать в распространении активации MyoII (Fig. 3a). Прежде чем рекрутировать MyoII, клетки в регионе propagation деформируются анизотропно (Extended Data Figs. 1e, f, 2a), и подвергаются действию анизотропного стресса (Extended Data Fig. 8a, b). Чтобы проверить, необходима ли MyoII-зависимая деформация ткани для распространения активации Rho1, мы инъецировали эмбрионам перед гаструляцией ингибитор Rok (H-1152) и отслеживали Rho1-GTP. После инъекции ингибитора Rok, активация Rho1 в примордии оставалась неизменной, но распространение активации Rho1 было сильно снижено и ограничено примерно 4 рядами клеток (Fig. 3b, c and Supplementary Videos 11, 12). Т.о., активность MyoII в примордии необходима для нормального распространения волны.
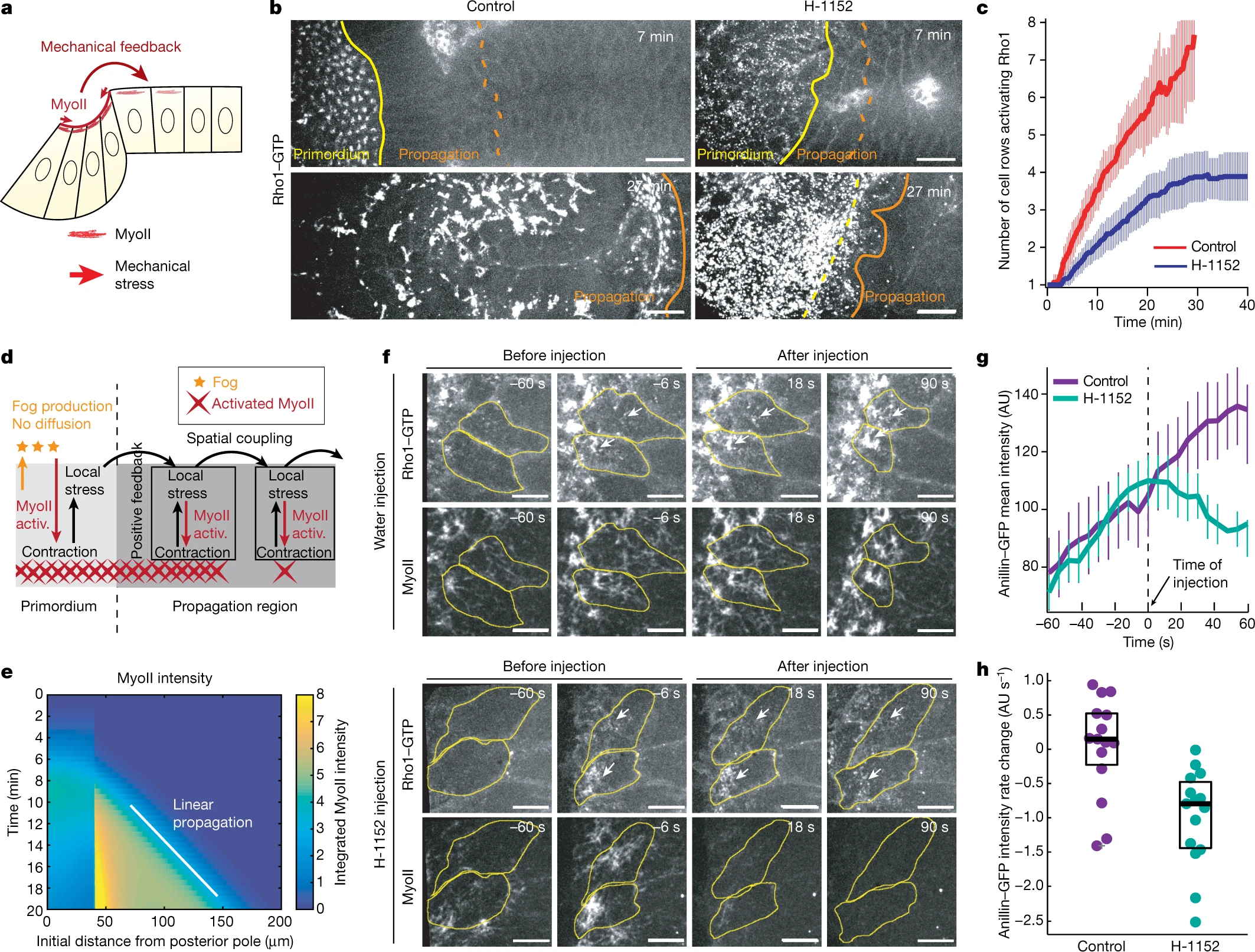
Fig. 3: The MyoII wave is mechanically regulated and feedback from MyoII promotes Rho1 activation in cells.
a, Schematic of the dorsal epithelium in a sagittal section illustrating the hypothesis of mechanical feedback controlling MyoII propagation. b, Time-lapse imaging of Rho1-GTP (using a GFP fusion of the anillin Rho-binding domain (RBD)) in embryos injected with water (control, n = 10 embryos) or H-1152 (n = 12 embryos) at end of cellularization. Yellow and orange lines highlight the primordium and propagation regions respectively. Scale bars, 15 µm. c, Quantification of the Rho1-GTP wave, as in Fig. 2e. Data are mean ± s.d. n = 10 (control) and n = 12 (H-1152). d, Model used to study the effects of stress-based feedback on MyoII (Supplementary Information). Fog produced in the primordium activates MyoII but cannot diffuse. Instead, stress locally activates MyoII and propagates within the tissue. Activ., activation. e, Kymograph heat map of activated MyoII. MyoII concentration is integrated over the unit volume taking into account its local deformation (Supplementary Information) from one simulation of the model in d. f, Time-lapse imaging of Rho1-GTP (using anillin(RBD)-GFP) and MyoII in embryos injected with water or H-1152 during propagation. Yellow, cell outlines; white arrows, accumulations of Rho1-GTP. n = 15 cells, 3 embryos per condition. Scale bars, 5 µm. g, h, Quantification of the mean intensity of Rho1-GTP before and after injections. n = 15 cells, 3 embryos per condition. g, Mean intensity over time. Data are mean ± s.d. h, Difference in recruitment rate after injection following injection of H-1152. P = 7.8 x 10-4; two-sided Mann-Whitney test. Box plots show median, and 25th and 75th percentiles. The grey cross labels an outlier. In c, t = 0 marks the beginning of MyoII propagation; in f, g, t = 0 is time of injection.
Затем мы механически повреждали дорсальный эпителий и исследовали эффекты на распространение MyoII (Extended Data Fig. 9a and Supplementary Video 13). Сначала, генерируя лазером обусловленные cauterizations ткани 29,44, мы генерировали фиксированные механические препятствия приблизительно на расстоянии 20-30 рядов клеток кпереди от примордия. Это создавало механическое препятствие движению кпереди задней энтодермы. Затем, мы использовали дорсализованных эмбрионов, у которых дорсо-вентральная полярность отсутствовала, а зависимые от MyoII апикальные сужения в энтодерме примордия становились ротационо симметричными (Supplementary Video 14), блокируя перемещения кпереди задней энтодермы. В обоих случаях волна активации MyoII замедлялась (Extended Data Fig. 9b) и клетки нуждались в рекрутировании более высоких уровней MyoII по сравнению с клетками дикого типа (Extended Data Fig. 9c). Скорость апикальных сужений клеток в регионе propagation существенно снижалась, несмотря на более высокие уровни MyoII (Extended Data Fig. 9d), подтверждая усиление сопротивления инвагинации. Сходные пертурбации с помощью механических препятствий происходили в латеральной энтодерме, не затрагивая активации MyoII 29, демонстрируя уникальную механическую чувствительность клеток задней энтодермы. Итак, эти эксперименты выявили специфический механический контроль над уровнями MyoII и скоростью распространения волны в регионе propagation.
Feedback and spatial coupling sustain the wave
Мы полагаем, что распространение волны зависит от механической передачи (relay), при которой клетки во главе борозды активируют MyoII в ответ на tensile or shear стрессы и, в свою очередь, инвагинируют - вызывая тем самым распространение деформаций глобально на ткань, стресс и активацию MyoII. Мы использовали 1D модель, чтобы абстрагировать минимальные инградиенты, необходимые для генерации волны активности MyoII при постоянной скорости за счет совместного действия механических сил и химической активации. Мы полагали, что локальные контрактильные стрессы, продуцируемые MyoII передаются с помощью натяжения апикального кортекса противодействуя сопротивлению трения, и что передаваемый стресс активирует множество MyoII45 (Fig. 3d and Supplementary Information). Мы смоделировали прямую зависимость активации MyoII от стресса, не обращая внимания на лежащие в основе детеали или точную природу (tensile or shear) стресса. Моделирование (Fig. 3e) подтвердило, что два ключевых элемента достаточны для распространения активации MyoII при постоянной скорости: сильная нелинейная позитивная обратная связь, при которой MyoII локально генерирует стресс, а стресс локально активирует MyoII, давая динамику с двумя устойчивыми (bistable) состояниями; и механизм пространственной связи (coupling) , тонко управляемый с помощью механических свойств системы, в которой деформация в одной клетке генерирует стресс на ограниченном расстоянии, тем самым запуская распространение далее активации MyoII.
Чтобы понять оба ли элемента участвуют в волне активации, мы инъецировали Rok ингибитор во время распространения. Это сразу же блокировало распространение активации Rho1 по ткани (Extended Data Fig. 10a-c and Supplementary Video 15) и быстрое увеличение Rho1-GTP в клетках в процессе активации (Fig. 3f-h and Supplementary Video 16), подтверждая существование локальной позитивной обратной связи контрактильности, действующей прямо или косвенно на активацию Rho1. Эти результаты демонстрируют существование как присущей клеткам (локальной амплификации) , так и внешней для клеток (обусловленной пространственным сцеплением) обратной связи контрактильности на Rho1-GTP.
A cycle of 3D cell deformations underlies the wave
Чтобы исследовать механические основы пространственных связей (coupling), мы получали изображения эмбрионов в сагитальных поперечных срезах и идентифицировали характерные последовательности 3D клеточных деформаций, которые сопровождают волну MyoII wave (Fig. 4a and Supplementary Video 17). По мере продвижения борозды наиболее передние клетки, базальные концы клеток сужаются и движутся всё более вперед и вверх, тогда как их апикальные концы распространяются по вителлиновой мембране (Fig. 4a, yellow cell in insets). Клетки затем сужаются апикально, когда они соединяются с бороздой. Активация MyoII инициируется в клетках, которые распространяют свои апикальные поверхности по вителлиновой мембране и увеличиваются когда клетки отсоединяются (Extended Data Fig. 11a-c and Supplementary Video 18). Во время перемещения (spreading) апикальных концов клеток слипчивые соединения перемещаются апикально, сначала в задней, а затем и в передней части каждой клетки (Fig. 4b and Supplementary Video 19). Когда они достигают вителлиновой мембраны, их скорость продвижения вперед заметно снижается (Fig. 4c and Extended Data Fig. 11d), указывая, что трение (frictional coupling) верхушек клеток о вителлиновую мембрану сопротивляется перемещению вперед верхушек клеток ,которое связано с толкающими сзади силами. Чтобы оценить свободные пространства между клетками и вителлиновой мембраной, мы инъецировали флуоресцентный dextran а превителлиновое пространство. Dextran оказался исключенным из передней части борозды (Fig. 4d, Extended Data Fig. 12a, b and Supplementary Video 20), указывая на толкание (pushing) в противовес вителлиновой мембране.

Fig. 4: Three-dimensional cycle of cell deformations accompanying and sustaining MyoII activation.
a, Side views of MyoII recruitment and cell deformations during wave propagation. Left, wide view. Right, cropped view of the boxed region. Dashed white lines, cell outlines; dashed yellow line, vitelline membrane; solid white line, basal side of epithelium. The yellow and magenta dots label two cells. White arrows, apical side of cells; yellow arrows, basal side of cells. n = 2 embryos. Scale bars, 20 ?m (left), 10 ?m (right). b, Side views of E-cadherin during apical spreading of a cell in the propagation region. Dashed yellow line, vitelline membrane. Dashed white line, cell outline. White asterisks, E-cadherin junctions. n = 50 cells, 3 embryos. Scale bar, 5 µm. c, Kymograph showing the movement and deformation along the anterior-posterior axis of a cell in the propagation region. Red trace, posterior edge of cell; blue trace, anterior edge of cell; pink box, rapid cell displacement phase of the posterior edge; green box, immobilization phase of the posterior edge. n = 456 cells, 6 embryos. d, Dextran injection in the perivitelline space during MyoII propagation. Dashed white lines, region of MyoII activation and dextran exclusion. n = 3 embryos. Scale bar, 5 ?m. e, Three-dimensional mechanical cycle associated with the MyoII wave. Green arrows, MyoII contractility; purple zone, zone of apical adhesion; red arrows, pushing forces. Three cells undergoing the cycle at consecutive time points are labelled in different colours. In c, t = 0 is arbitrary. T1, T2, T3 in b and t1, t2, t3 in e indicate consecutive time points. Мы предполагаем морфоген6етический цикл следующим (Fig. 4e). MyoII активируется в клетках непосредственно спереди от борозды; эти клетки, в свою очередь, инвагинируют, а MyoII контрактильность в борозде генерирует на тканевой шкале контрактильные силы (green arrows). Это приводить к толкающим силам в направлении вперёд (red arrows), благодаря цитоплазматической несжимаемости46. Т.о., базальные регионы соседних передних клеток смещаются в направлении вперед и сжимаются с боков, смещая свою цитоплазму вверх. Это, в свою очередь, заставляет клетки перемещать свои апикальные поверхности по вителлиновой мембране, активируя в конечном счете MyoII, чтобы завершить цикл.
Мы наблюдали тесную корреляцию между скоростями 3D клеточной деформации и волн активации MyoII у дикого типа, dorsal-мутантов и прижженных (cauterized) эмбрионов (Extended Data Fig. 12c-e), это подтверждает модель, согласно которой MyoII как управляет, так и, в свою очередь, индуцируется с помощью цикла клеточных деформаций и прикреплений к вителлиновой мембране. Поэтому блокирование активации MyoII должно приводить к аресту всех ступеней этого цикла перемещения, как это наблюдалось при подавлении Rok во время распространения MyoII (Extended Data Fig. 12f and Supplementary Video 21). Т.о., цикл деформаций нуждается в устойчивой активности MyoII.
The role of integrin adhesion in wave propagation
Ключевым свойством модели является локальное сопротивление вителлиновой мембраны, приводящее к апикальному распределению в клетках передней части борозды. Иногда клетки, устойчивы к отсоединению от вителлиновой мембраны (Fig. 5a and Supplementary Video 22), это указывает на то, что их апикальные поверхности специфически слипаются (adheres) с вителлиновой мембраной. αPS3 integrin (кодируемый scab) специфически экспрессируется в регионе propagation и необходим для удлинения зародышевого диска 47,48 (Fig. 5b). RNA-mediated interference (RNAi) против scab приводит к заметным изменениям скорости перемещения клеток в регионе propagation (Fig. 5c-f and Supplementary Video 23), это согласуется с ролью клеточной адгезии с вителлиновой мембраной посредством αPS3 integrin. У эмбрионов дикого типа клетки впереди борозды с постоянно низкими скоростями перемещения. У scab RNAi эмбрионов клетки сначала перемещаются быстрее в направлении вперед по сравнению с диким типом, а инвагинация ткани задерживается и происходит на меньшую глубину. В дальнейшем, как только сформируется глубокая инвагинация, клетки движутся в направлении кзади в инвагинацию. Это указывает на то, что у дикого типа эмбрионов клеточная адгезия с вителлиновой мембраной сначала облегчает инвагинацию ткани с помощью противостояния силам, толкающим в направлении вперед. Затем адгезия обеспечивает закрепление на MyoII-зависимых контрактильных силах, способствующих устойчивому смещению вперед борозды.

Fig. 5: Integrin-dependent adhesion underlies posterior endoderm movement and MyoII activation during wave propagation.
a, The apical side of cells during MyoII propagation. White arrow, cell attachment to the vitelline membrane. The plasma membrane is labelled with GAP43-mCherry. n = 4 embryos. Scale bar, 5 ?m. b, Schematic of scab expression (purple) in the embryo. c, d, Time-lapse image of control (water) (c) and scab-targeting RNAi (d) embryos. The yellow arrows are proportional in size to the velocities of cells in the propagation region. Two representative cells of the propagation region are marked in yellow. n = 4 embryos each. Scale bars, 15 µm. e, f, Kymograph heat maps of integrated MyoII intensity and cell velocities in control (e) and scab-targeting RNAi (f) embryos. Dashed line, boundary between primordium and propagation regions. n = 622 cells from 4 control embryos; and n = 693 cells from 4 scab-targeting RNAi embryos. AU, arbitrary unit.
Безусловно , RNAi против scab также снижает уровни MyoII в регионе propagation во время прохождения волны (Fig. 5c-f), демонстрируя роль базирующейся на интегрине адгезии в активации MyoII в этих клетках.
Итак, локальные силы, продуцируемые с помощью MyoII, управляют инвагинацией, которая толкает клетки в направлении кпереди, а их последующая адгезия с вителлиновой мембраной генерирует силы, которые приводят к более передней активации MyoII и инвагинации клеток. Эти повторяющиеся циклы связывают MyoII контрактильность в инвагинирующей борозде с перемещениями в направлении вперед энтодермы (Fig. 4e).
Discussion
Мы описали на тканевом уровне волны активации MyoII т клеточной инвагинации, лежащих в основе морфогенеза задней энтодермы во время удлинения зародышевого диска у Drosophila. Такая морфогенетическая волна инициируется в пространственно ограниченной генетической исходной точке (input), это сигнал Fog, транскрибируемый внутри зачатка энтодермы, который активирует Rho1-MyoII-зависимую инвагинацию ткани. Волна в дальнейшем распространяется посредством механохимической эстафеты (relay), в которой локальная инвагинация управляет смещением клеток, апикальной адгезией, индуцируемыми стрессом контракциями и инвагинацией борозды. Такая активация Rho1-MyoII обеспечивает обратную связь для амплификации и пространственного купирования, чтобы передавать локальную контрактильность, приводя к перемещению волны контрактильности, сходной с пусковыми волнами в возбудимой среде9,50. Механические стрессы могут активировать MyoII множественными способами: прямо посредством зависимой от стресса стабилизации MyoII в актомиозиновом кортексе41, косвенно посредством ощущения натяжения мембраны51 и/или посредством передачи механических сигналов42,43.
Integrin-обеспечиваемое закрепление на вителлиновой мембране, как было установлено ранее, влияет на то, как тканевые потоки возникают из паттернов контрактильности MyoII48. Здесь мы выяснили молекулярную роль интегриновой адгезии в оформлении динамичных паттернов MyoII. Интегрины действуют как адгезивные молекулы и как потенциальные молекулярные эффекторы механизма механической обратной связи во время распространения волны. А то время как адгезия формирует фиксированные точки прикрепления, необходимые для тканевых потоков48 у Tribolium castaneum, адгезия у Drosophila временная и распространяется как волна по мере продвижения ткани борозды.
Многие годы преобладающая модель показывала, что существуют генетические и биохимические паттерны контроля клеточного поведения во время морфогенеза2. Сравнительно недавно, были продемонстрированы также механохимические сигналы, влияющие на динамику тканей2,4. Наши наблюдения подчеркивают, что пространственные паттерны и коллективная динамика клеток возникают благодаря сильному динамичному купированию (coupling) механических обратных связей и биохимической активности. Др. примером такого сцепления (coupling) является процесс zippering у Ciona intestinalis52, у которой последовательные контракции MyoII в начале застежки (zipper) управляют тканевыми деформациями (возникновением новых межклеточных контактов), которые умножают передачу сигналов и контрактильность внутри ткани. Эти результаты подтверждают необходимость дальнейших исследований, как передача механохимических сигналов не только индуцирует изменения клеточной формы, но и как формирует пространственно-временные паттерны деформаций клеток и тканей.
|




