Посещений: 
ЭВОЛЮЦИЯ ОРГАНОВ У РАЗНЫХ ВИДОВ
Различия в экспрессии генов
Gene expression across mammalian organ development Margarida Cardoso-Moreira,
Jean Halbert, et al. Nature volume 571, pages505–509 (2019)
| |
|
Фенотипы взрослых предопределяются во время развития1-3 и поскольку онтогенетические процессы сильно запутаны. von Baer отмечал в 19 столетии, что морфологические отличия между видами увеличивают по ходу развития4 и подтверждающие доказательства накапливаются4,5. Необходимо понять общие принципы, лежащие в основе фенотипической эволюции.
Здесь мы предоставляем ресурс объемных транскриптомов на разных стадиях развития, охватывающих множество органов от раннего органогенеза до зрелого возраста у семи видов, что позволяет проводить прямые сравнения паттернов экспрессии в развитии органов у млекопитающих и между ними (http://evodevoapp.kaessmannlab.org). Этот ресурс позволяет нам анализировать эволюцию экспрессии генов внутри органов млекопитающих на разных стадиях развития.
Organ developmental transcriptomes
Мы установили время экспрессии для 6 млекопитающих (человека, макаки резус, мышей, крыс, кролика и опоссума) и птиц (red junglefowl, далее обозначаемых как 'цыплята') с использованием РНК секвенирования. Мы получали выборки из 7 органов, которые представляли три зародышевых слоя: головной мозг (передний мозг/большой мозг) и мозжечок (задний мозг/мозжечок) (эктодерма); сердце, почки, яичники и семенники (мезодерма); и печень (энтодерма) (Fig. 1a). Выборки получали с момента раннего эмбриогенеза и до взрослой стадии, плюс старение у приматов. Мы получали выборки с одинаковыми интервалами во время пренатального развития (напр., ежедневно у грызунов, каждую неделю у человека), постнатально мы получали выборки у новорожденных, 'infants', юношей и взрослых (Fig. 1). Были и исключения: мы лишены ранних пренатальных данных для макак резус и постнатальных данных для развития человека (Supplementary Table 1). Поскольку развитие органов у сумчатых происходит преимущественно постнатально 6, то все выборки за исключением одной были получены постнатально. База данных содержит 1893 библиотек (Supplementary Table 2).
 Fig. 1: Organ developmental transcriptomes.
a, Species, organs and stages sampled. Red slashes highlight two sampling gaps: human development is not covered between 20 and 38 weeks post-conception (WPC), and rhesus macaque development between embryonic (E) days 130 and 160. b, PCA based on 7,696 1:1 orthologues across all species. Each dot represents the median across replicates (approximately 2-4). Fig. 1: Organ developmental transcriptomes.
a, Species, organs and stages sampled. Red slashes highlight two sampling gaps: human development is not covered between 20 and 38 weeks post-conception (WPC), and rhesus macaque development between embryonic (E) days 130 and 160. b, PCA based on 7,696 1:1 orthologues across all species. Each dot represents the median across replicates (approximately 2-4).
Общие взаимоотношения между всеми выборками могут быть использованы посредством анализа принципиальных компонент (PCA) (Fig. 1b). первый принципиальный компонент (PC1), объясняет наибольшую разницу в экспрессии генов, разделяет выборки в зависимости от зародышевого листка, из которых возникают органы. PC2 разделяет выборки по стадии развития (от раннего к позднему развитию). PC3 и PC4 разделяют выборки по видам (Extended Data Fig. 1a). В PCAs индивидуальных органов, PC1 и PC2 упорядочивают выборки по стадии развития и разделяют их по виду (Extended Data Fig. 1b). При глобальном PCA (Fig. 1b), самые ранние выборки от разных органов собираются вместе в кластеры, подтверждая строгую унификацию (commonalities). Мы полагаем, что программы развития всё ещё в основном общие для органов на этих ранних стадиях и установили, что транскриптомы органов и в самом деле довольно сходные на этих стадиях (Extended Data Fig. 1c). В ходе развития экспрессия транскрипционных факторов отличается всё больше между органами, по сравнению с экспрессией всего транскриптома (Extended Data Fig. 1c), это согласуется с транскрипционными факторами, управляющими органогенезом.
Затем мы идентифицировали гены с достоверными изменениями во времени экспрессии в каждом органе, обозначив их developmentally dynamic genes (DDGs; Extended Data Fig. 2a; Supplementary Tables 3-9; Methods). DDGs отражают изменения в регуляции генов во время развития, концентрации типов клеток и/или пропорцию клеток, подвергающихся делениям1. Соотв., между 79% и 91% белок-кодирующих генов в каждом виде являются DDGs (Extended Data Fig. 2b), включая гены с функциями генов домашнего хозяйства. DDGs обычно связаны с фенотипами, ассоциированными с развитием, анатомией и физиологией каждого органа, плюс общий рост и формирование паттерна (false discovery rate (FDR) < 0.01, hypergeometric test; Supplementary Tables 10, 11). DDGs находятся под более строгим функциональным контролем (constraints)7-10, чем не-DDGs, и ограничения возрастают у ряда органов, в которых гены обнаруживают временную динамику экспрессии (Extended Data Fig. 2c). Увеличение ограничений расширяется на дозовые изменения, при этом DDGs оказываются менее терпимыми к вариантам дупликаций и делеций11 (Extended Data Fig. 2d).
У каждого вида 6-15% генов (расширенные данные, рис. 2b) являются DDG только в одном органе и постоянно обогащены органоспецифическими фенотипами (FDR < 0.01, hypergeometric test; Supplementary Table 12). Фракция экспрессируемых органспецифических DDGs увеличивается во время развития (Extended Data Fig. 2e), коррелируя с дифференцировкой и созреванием органа. Противоположное наблюдается для транскрипционных факторов, вклад которых наивысший на более раннем развитии (Extended Data Fig. 2f).
Developmental correspondences and heterochrony
Эмбриональное развитие подразделяется на 23 Carnegie стадии, которые совпадают у видов 12-15 (Extended Data Fig. 3a). Однако межвидовые соответствия во время внутриутробного и постнатального развития неизвестны. Поэтому мы использовали онтогенетические транскриптомы, чтобы установить соответствие стадий между видами в ходе всего развития (Methods; Fig. 2a; Extended Data Fig. 3b). Мы воспроизвели соответствие стадиям Carnegie (у кроликов сдвиг на 1-2 дня; Methods; Extended Data Fig. 3a) и установили, напр., что экспрессия генов у новорожденного опоссума наиболее близка к эмбриональному дню (E)11.5 мыши, подтвердив предыдущие подсчеты 16.
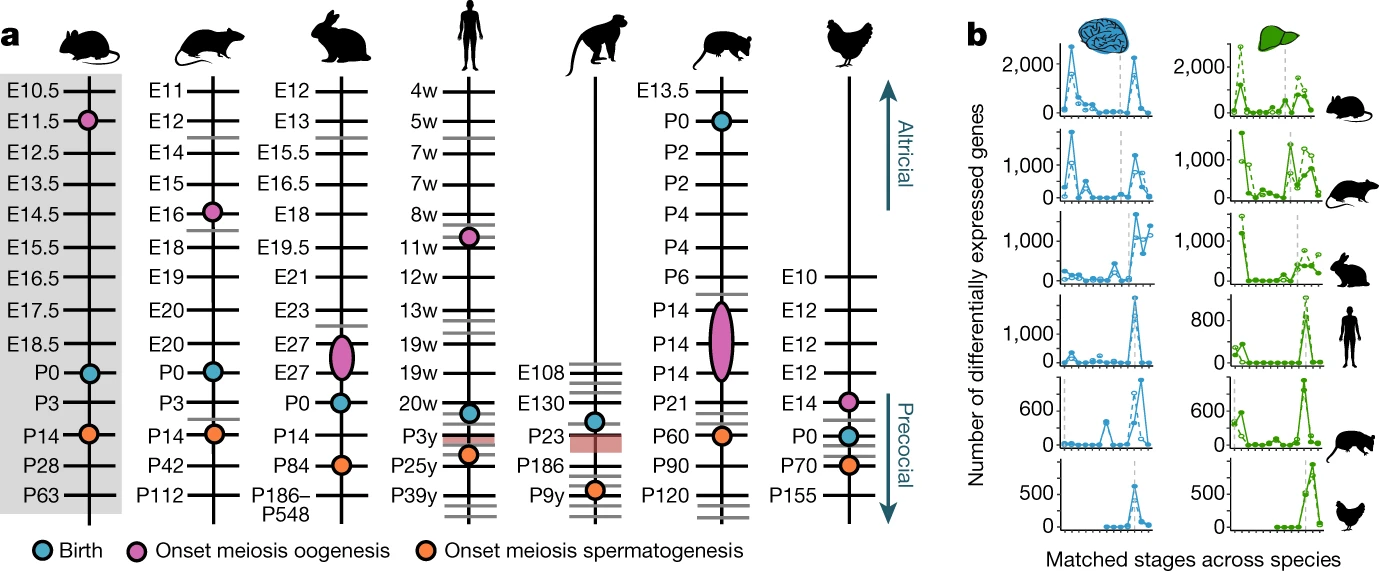 Fig. 2: Developmental correspondences. Fig. 2: Developmental correspondences.
a, Stage correspondences across species. Grey bars represent additionally sampled stages. Red shading highlights sampling gaps. In rhesus macaque, male meiosis starts at 3-4 years36. Because we did not detect expression of meiotic genes in the 3-year-olds, we placed the onset of meiosis between 3 and 9 years. b, Number of genes differentially expressed between adjacent, species-matched, stages for brain and liver (log2 fold change ~ 0.5; other organs in Extended Data Fig. 5). Solid lines mark genes that increase in expression and dashed lines genes that decrease. Vertical dotted line marks birth. Развитие органов включает периоды более значительных изменений в транскрипции17. Мы идентифицировали и охарактеризовали эти периоды у разных видов, используя наше соответствие стадий. Эти периоды появляются на одинаковых стадиях у разных видов и обогащены ортологическими генами (P < 0.001, hypergeometric test; Fig. 2b; Extended Data Figs. 4, 5). В соматических органах имеются два основных периода изменений транскрипции. Первый происходит во время эмбрионального развития определяется по усилению экспрессии генов с ранними органспецифическими функциями и по снижению экспрессии генов, участвующих в клеточных делениях и общем морфогенезе (Fig. 2b; Extended Data Figs. 4, 5; Supplementary Table 13). Второй возникает или постнатально или во время родов в зависимости от уровня зрелости новорожденных у разных видов. Млекопитающие наибольшей изменчивостью в их уровне независимо от рождения, они классифицируются как altricial (рождающиеся менее зрелыми) или precocial (более зрелые)6. Эти классификации воспроизводятся с помощью онтогенетических транскриптомов, при этом altricial новорожденные опоссума на одном конце спектра созревания, а precocial макаки резус на другом (Fig. 2a). Этот второй период более значительных изменений транскрипции определяется по увеличению экспрессии генов с поздними органспецифическими функциями и, опять же по снижению экспрессии генов, участвующих в делениях клеток и морфогенезе (Fig. 2b; Extended Data Figs 4, 5; Supplementary Table 13). Т.о., в то время как у altricial видов этот период интенсивного созревания органов происходит постнатально, у precocial видов он перекрывается с рождением.
Онтогенетические программы могут меняться благодаря сдвигам во времени событий - т.е. благодаря 'heterochrony'1. Если развитие органа сдвигается у одного вида, то онтогенетическое соответствие для этого органа будет другим по сравнению с глобальным соответствием. В целом органспецифическое соответствия согласуются с глобальным соответствием, за исключением развития раннего сердца у опоссума и развития ранних яичников у людей и кроликов (Extended Data Fig. 6; Methods).
Однако, гетерохрония не распространяется на весь орган, она может возникать в онтогенетических модулях внутри органов. В самом деле, гетерохрония появляется во время продукции гамет 18, процессе, зависимом мейоза. Stra8 является привратником (gatekeeper), препятствующим вступлению зародышевых клеток в мейоз и его роль законсервирована у позвоночных 3,19. Поэтому мы анализировали экспрессию Stra8 и др. мейотических генов, чтобы идентифицировать начало мейоза у каждого вида и выявить различия во времени их действия у видов (Fig. 2a; Extended Data Fig. 7a-d). Во время оогенеза мейотические гены экспрессируются во время эмбрионального развития (мыши), на границе между эмбриональным и плодным развитием (крысы и человек), или во время позднего плодного развития (кролики) (Fig. 2a; Extended Data Figs. 6, 7a, b). Хотя и менее часто нам удавлось идентифицировать гетерохронию начала мейоза во время сперматогенеза (Fig. 2a; Extended Data Fig. 7c, d). При сперматогенезе начало мейоза маркирует начало заметных изменений в клеточном составе 20, при этом резко меняются транскриптомы семенников (Extended Data Fig. 7e). Начиная с рождения у грызунов и позднее у кроликов отмечаются также выраженные изменения в транскриптомах яичников (Extended Data Fig. 7e), это совпадает с разрывом гнезд зародышевых клеток и формированием фолликулов 21. Гетерохрония поэтому значительна во время развития гонад млекопитающих, она представляет др. механизм, лежащий в основе чрезвычайной изменчивости морфогенеза гонад 3.
Relationships between evolution and development
После phylotypic периода, наиболее консервативной стадии эмбриогенеза, морфологические различия между видами увеличиваются по ходу развития - дивергенция von Baer's4,5 (Extended Data Fig. 8a). Предыдущие исследования оценивали взаимоотношения между развитием и молекулярной дивергенцией всего эмбриона и установили, что молекулярная дивергенция возрастает в ходе развития22-25. Мы воспроизвели это наблюдение ена индивидуальных органах, главным образом обнаружив корреляции транскриптомов между видами, которые уменьшались по ходу развития (Extended Data Fig. 8b).
Две не исключающие др. др. гипотезы могут объяснить увеличение молекулярной и морфологической дивергенции во время развития 26. Во-первых, раннее развитие д. быть в более тесных функциональных рамках (constraints) и более устойчивым к изменениям. Во-вторых, дивергенция д. управляться с помощью адаптивных изменений, которые, скорее всего, возникают позднее в развитии, когда влияние окружающей среды становится сильнее 26. Чтобы оценить различия в функциональных ограничениях по ходу развития, мы сравнивали толерантность к функциональным мутациям генов, сравнивая раннее и позднее развитие. Среди всех органов гены, используемые в раннем развитии, оказывались менее устойчивыми к мутациям потери функции (P < 10 -10, two-sided Wilcoxon rank-sum test; Fig. 3a; Extended Data Fig. 8c). Соотв., используя набор известных нейтральных нокаутов у мышей 27, мы наблюдали для всех органов, что процент экспрессируемых генов, ассоциированных с летальностью, снижается в ходе развития (Fig. 3b; Extended Data Fig. 8d). Оба наблюдения подтверждают, что раннее развитие является предметом более строгих функциональных ограничений. Затем мы оценивали взаимоотношения между адаптацией и развитием путем проверки временной экспрессии генов, идентифицированных, как несущих характеристики (signature) положительного отбора 28. Органы отличались в отношении пропорции позитивно отбираемых генов: она является наивысшей в печени и семенниках и наинизшей в тканях головного мозга (Fig. 3c). Однако, среди всех органов фракция экспрессии позитивно отбираемых генов возрастает в ходе развития (Fig. 3c). Т.о., увеличение положительного отбора, по-видимому, также вносит вклад в прогрессирующие молекулярные и морфологические различия органов во время развития.
.
 Fig. 3: Relationships between evolution and development.
a, Intolerance to functional mutations (probability that a gene is intolerant to a loss-of-function mutation, known as 'pLI' score) for human genes whose expression decreases (blue) or increases (orange) during development (4,589/4,478 genes that decrease/increase in brain, 2,673/3,442 in heart, and 2,290/3,794 in testis; all P < 10 -10, two-sided Wilcoxon rank-sum test). b, Percentage of lethal genes expressed at each stage (out of 2,676 knockouts). Weighted average Spearman correlation coefficient is ?0.89 (P = 1 х 10 -12); all organ-specific Spearman correlations are significant (P < 0.04). c, Percentage of positively selected genes expressed at each stage (out of 13,362 genes tested for positive selection). Ovary excluded owing to lack of postnatal data. Weighted average Spearman correlation coefficient is +0.57 (P = 5 х 10 -11); all organ-specific correlations are significant (P < 0.05). d, Phylogenetic age of the transcriptomes of organs throughout development for rat (n = 18,695 genes), human (n = 18,820) and chicken (n = 15,155). Higher values indicate larger contributions of lineage-specific genes (that is, younger transcriptomes). Weighted average Spearman correlation coefficients are +0.87 (P = 1 x 10 -12) for rat, +0.77 (P = 1 ? 10?12) for human and +0.96 (P = 1 x 10 -12) for chicken. All Spearman correlations are significant except for rat brain and cerebellum (ρ: +0.53 to +0.99, P: 0.03-1 x 10 -15). Testis plotted separately because of the young age of sexually mature transcriptomes. e, Tissue-specificity, time-specificity (median across organs) and intolerance to functional mutations (pLI) of human orthologues of mouse genes identified as lethal, subviable and viable (n = 2,686; two-sided Wilcoxon rank-sum test). NS, not significant. Box plots depict the median ± 25th and 75th percentiles, with whiskers at 1.5 times the interquartile range. f, Tissue-specificity for mouse genes of which the expression decreases (blue) or increases (orange) during development (3,981/5,164 genes that decrease/increase in brain, 4,631/5,051 in kidney, and 4,270/4,026 in liver; all P < 10 -15, two-sided Wilcoxon rank-sum test). In b-d, the x axes show samples ordered by stage (Fig. 1a). In b and c, lines were estimated by linear regression; in d by LOESS regression. In b-d, the 95% confidence interval is shown in grey. Транскриптомы органов также могут дивергировать между видами благодаря видоспецифичным генам29. Поэтому мы исследовали, каков вклад недавних дупликаций генов а изменения в ходе всего развития. Для каждой стадии мы определяли индекс, который комбинирует филогенетический возраст генов с их экспрессией, который имел наивысшее значение, соответствующее более молодым транскриптомам (Methods). Мы идентифицировали различия между органами, сходные с теми, что наблюдаются для позитивно селектируемых генов: , головной мозг самые старые (Fig. 3d). Однако, среди органов транскриптомы становятся моложе во время развития, указывая тем самым, что удвоения генов оказывают всё увеличивающиеся и все более важные роли (Fig. 3d).
Вместе с тем этот анализ подтвердил, что увеличение молекулярной и морфологической дивергенции, наблюдаемое между видами во время развития, управляется за счет уменьшения функциональных ограничений по мере развития (Fig. 3a, b), и за счет конкурентного увеличения положительного отбора (Fig. 3c) и добавления новых генов (Fig. 3d).
Pleiotropy and the evolution of development
Широта экспрессии по ткани и временным точкам (которую мы здесь обозначаем как плейотропию) оказывает влияние на эволюцию генов30,31. Поэтому мы подсчитывали тканевую и временную специфичность каждого гена в ходе развития (Extended Data Fig. 9a; Methods; Supplementary Tables 3-9). Временная и тканевая специфичность сильно скоррелированы: тканеспецифичные гены наиболее вероятно экспрессируются в узком временном промежутке и наоборот (коэффициент корреляции Pearson, r = 0.63-0.89, P < 10-15). Гены также стремятся обладать сходной временной шкалой среди органов (r = 0.48-0.92, P < 10-15). Как известно32,33, плейотропия коррелирует с уровнями функционального ограничения: наиболее широко экспрессируемые являются более неустойчивыми генами и подвержены функциональным вариациям (r = 0.29, P < 10?15; Extended Data Fig. 9b). Соотв., гены, ассоциированные с летальностью27 экспрессируют более широко, чем гены, ассоциированные с пониженной жизнеспособностью (all P< 2 x 10-8, two-sided Wilcoxon rank-sum test; Fig. 3e; Extended Data Fig. 9c). Это контрастирует с измерениями толерантности к функциональным мутациям, котрая отличает гены, ассоциированные с летальностью и пониженной жизнеспособностью, от отвечающих за жизнеспособность (P = 2 х 10-12), но не выявляет различий между летальностью и пониженной жизнеспособностью (Fig. 3e; Extended Data Fig. 9d). Выраженность плейотропии, следовательно, уникально скоррелирована с фенотипическими проявлениями.
Плейотропия, как полагают, объясняет консервацию phylotypic периода 24,34 и является детерминантом типов мутаций, которые позволительны в условиях отбора 30,31. Поэтому мы тестировали различия в плейотропии между генами, используемыми в раннем или позднем развитии и установили, что гены, используемые наиболее рано обладают более широкой пространственной и временной экспрессией, чем гены, экспрессирующиеся позднее (all P < 10 -6, two-sided Wilcoxon rank-sum test; Fig. 3f; Extended Data Fig. 9e). Поскольку уменьшение плейотропии может объяснить как снижение функциональных ограничений, так и увеличение адаптации 30,31, поэтому мы полагаем, что это может давать основной вклад в увеличение морфологической и молекулярной дивергенции между видами во время развития.
Evolution of developmental trajectories
Различия между видами в развитии органов часто скоррелированы с изменениями в экспрессии генов. Соотв., мы попытались идентифицировать гены, участвующие в новых онтогенетических траекториях. Мы сравнивали внутри филогенетического остова временные профили ортологичных DDGs и идентифицировали те с изменением траектории между видами (Fig. 4a, b; Supplementary Tables 14-18; Methods).
 Fig. 4: Evolution of developmental trajectories.
a, Example of two genes that evolved new trajectories in the human cerebellum. GRIA3 is a glutamate receptor associated with intellectual disability. MDGA1 encodes a cell surface glycoprotein important for the developing nervous system. b, Pie charts depict the number of genes in each organ that evolved new trajectories in each phylogenetic branch (3,980 genes tested in brain, 3,064 in cerebellum, 1,871 in heart, 2,284 in liver and 3,191 in testis). Bar charts depict the total number of trajectory changes in each species. For mouse, that meant adding the changes that occurred at the base of the glires (I), those shared by mouse and rat (II) and those that are mouse specific (III). **P < 10?10, binomial test.
Головной мозг обладает наименьшим процентом изменения траекторий (11% DDGs), печень и семенники наивысшим (23% и 27%, соотв.; Extended Data Fig. 10a). Эти различия между органами согласуются с наблюдаемыми для позитивно селектируемых генов и для дупликаций генов. Т.о., среди всех оцененных механизмов эволюционных изменений головной мозг является самым медленно эволюционирующим органом, тогда как печень и семенники самыми быстрыми.
У мышей крыс и кроликов распределение изменений траекторий среди органов сходно (Extended Data Fig. 10b). По сравнению с этими видами люди обладают избытком изменений траекторий в головном мозге (20% изменений у человека по сравнению с 12-13% у др.; P = 1 х 10-5, binomial test) и мозжечке (26% у человека по сравнению с 21-22% у др.; P = 0.02), и низким количеством в семенниках (21% у человека по сравнению с 34-37% у др.; P = 1 х 10-10) (Extended Data Fig. 10b). Хотя заманчиво привлечь адаптацию, избыток изменений в головном мозге человека может частично обусловливаться различиями во взятии выборок (Methods). В целом грызуны сформировали высокие количества изменений траекторий по сравнению с человекаом и кроликами to human and rabbit (P < 10-10; Fig. 4b).
Ортологи, протестированные на изменения траекторий, являются более полейотропными, чем полный набор генов в каждом виде, которые также включают клонспецифичные гены (all P < 10?12, two-sided Wilcoxon rank-sum test; Extended Data Fig. 10c). Однако, среди тех протестированных гены с новыми траекториями являются плейотропными как и гены с законсервированными траекториями (Extended Data Fig. 10d). Очевидно, хотя гены с измененными траекториями широко экспрессируются, сами изменения являются органспецифическими (Extended Data Fig. 10e). Изменения траекторий ограничены одним органом в 93-96% случаев. Это согласуется с лежащими в основе мутациями, затрагивающими регуляторные элементы, которые контролируют субнабор всего пространственно-временного профиля каждого гена, и в соответствии с эволюционной теорией, мутации, затрагивающие несколько органов, менее склонны к фиксации в популяциях 30,31. Однако, не все изменения траекторий непосредственно обусловлены регуляторными мутациями; они могут также вызываться изменениями в клеточном составе.
Discussion
Мы получили профили развития 7 основных органов, начиная с раннего органогенеза до взрослой стадии у многих млекопитающих, чтобы создать обширный рессурс (http://evodevoapp.kaessmannlab.org). Мы использовали онтогенетические транскриптомы, соответствующие стадиям у разных видов и выявили обширную гетерохронию во время развития гонад. Мы установили, что эволюция органов млекопитающих является сложным образом связанной с их развитием. Органы являются по большей части сходными у разных видов в раннем развитии, а затем становятся всё более и более отличными, это, скорее всего, объясняется изменениями в плейотропии во время развития. Рано в развитии активные гены стремятся функционировать во многих органах и на разных стадиях, это делает их более устойчивыми к изменениям. Как только орган дифференцируется и созревает, активные гены обнаруживают более ограниченные пространственно-временные профили, это может снижать функциональные ограничения и облегчать эволюционные изменения. Возрастание дивергенции видов в ходе прогрессивного развития также было описано при развитии конечностей млекопитающих35 и целых эмбрионов4,5 и мы полагаем, это происходит в онтогенетических системах, в которых плейотропия снижается как функция времени.
Следующим затруднением стала идентификация молекулярных драйверов новых онтогенетических траекторий, которые могут лежать в основе эволюции фенотипов органов. Важно оценить степень, с которой эти изменения траекторий вызываются изменениями в регуляции генов и/или клеточного состава. Это может быть завершено с получением данных и результатов подобного исследования по получению баз данных транскриптомов одиночных клеток и данных эпигеномики и процедур биоинформационной deconvolution. Такие попытки в свете будущих успехов продвинут наше понимание генетических и оногенетических основ эволюции фенотипов млекопитающих.
|
 Fig. 1: Organ developmental transcriptomes.
a, Species, organs and stages sampled. Red slashes highlight two sampling gaps: human development is not covered between 20 and 38 weeks post-conception (WPC), and rhesus macaque development between embryonic (E) days 130 and 160. b, PCA based on 7,696 1:1 orthologues across all species. Each dot represents the median across replicates (approximately 2-4).
Fig. 1: Organ developmental transcriptomes.
a, Species, organs and stages sampled. Red slashes highlight two sampling gaps: human development is not covered between 20 and 38 weeks post-conception (WPC), and rhesus macaque development between embryonic (E) days 130 and 160. b, PCA based on 7,696 1:1 orthologues across all species. Each dot represents the median across replicates (approximately 2-4).  Fig. 2: Developmental correspondences.
Fig. 2: Developmental correspondences. 
