Посещений: 
ПРОТЕОСОМЫ
Сборка и функциональность
Regulation of proteasome assembly and activity in health and disease Adrien Rousseau & Anne Bertolotti
 Nature Reviews Molecular Cell Biology volume 19, pages 697–712 (2018)
|
The proteasome degrades most cellular proteins in a controlled and tightly regulated manner and thereby controls many processes, including cell cycle, transcription, signalling, trafficking and protein quality control. Proteasomal degradation is vital in all cells and organisms, and dysfunction or failure of proteasomal degradation is associated with diverse human diseases, including cancer and neurodegeneration. Target selection is an important and well-established way to control protein degradation. In addition, mounting evidence indicates that cells adjust proteasome-mediated degradation to their needs by regulating proteasome abundance through the coordinated expression of proteasome subunits and assembly chaperones. Central to the regulation of proteasome assembly is TOR complex 1 (TORC1), which is the master regulator of cell growth and stress. This Review discusses how proteasome assembly and the regulation of proteasomal degradation are integrated with cellular physiology, including the interplay between the proteasome and autophagy pathways. Understanding these mechanisms has potential implications for disease therapy, as the misregulation of proteasome function contributes to human diseases such as cancer and neurodegeneration.

|
Белки находятся в динамическом равновесии, определяемым балансом между синтезом и деградацией белка1. Уровни клеточных белков зависят от белкового синтеза, упаковки и деградации, а неспособность к аккуратной регуляции и координации этих процессов приводит к болезням. Во время роста клеток и организма белковый синтез превосходит деградацию, тогда как во время неблагоприятных условий, таких как отсутствие питательных веществ, деградация может превышать синтез. При нормальных условиях пищевые аминокислоты составляют около 20% аминокислот, предоставляемых для построения белков, которые взрослый человек синтезирует ежедневно, чтобы удерживать постоянный вес2. Оставшиеся ~80% аминокислот получаются в результате рециклинга аминокислот вследствие деградации белка.
В клетках деградация белка достигается с помощью двух систем: ubiquitin-proteasome system (UPS) (Fig. 1) и аутофагия-лизосомной системы. Аутофагия - это процесс самопоедания, с помощью которого клетки деградируют часто крупные клеточные компоненты, такие как органеллы или белковые агрегаты, путем поглощения их в компартмент из двойной мембраны, аутофагосомы, которые сливаются с лизосомами 3. Это основная форма аутофагии, известная как макроаутофагия. Др. формы, такие как микроаутофагия и обеспечиваемая шаперонами аутофагия, рассматриваются в др. работе 4. Клеточные уровни аутофагии варьируют существенно в зависимости от условий; при этом аутофагия индуцируется недостатком пищи 3. Аутофагия усиливается в ответ на голодание, чтобы подвергнуть переработке внутриклеточные компоненты в питательных веществах, особенно аминокислоты, чтобы поддержать синтез белков и сделать клетки способными к выживанию в этих условиях 5.
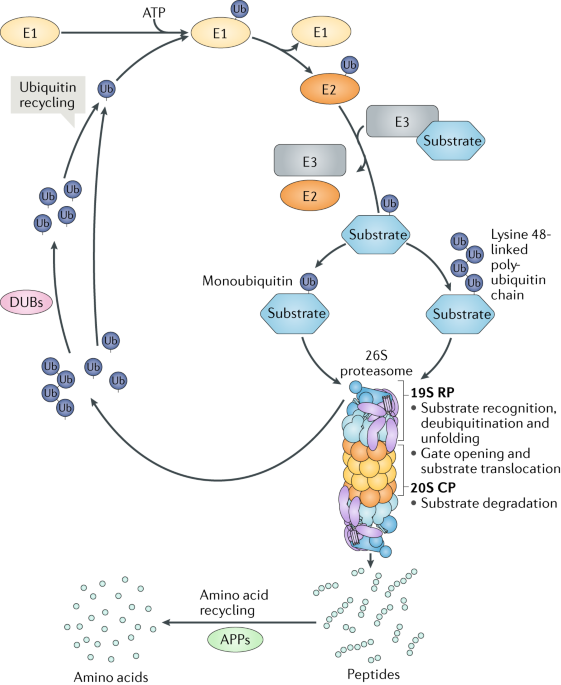 Fig. 1: The ubiquitin-proteasome system.
Fig. 1: The ubiquitin-proteasome system.
Ubiquitylation consists of the covalent binding of ubiquitin (Ub) to lysine residues exposed at the surface of targeted substrates. Ub is first activated by the ubiquitin-activating enzyme (E1) in the presence of ATP, before being bound to E1. The ubiquitin is then transferred from E1 to the ubiquitin-conjugating enzyme (E2). A ubiquitin ligase (E3) recruits the ubiquitin-bound E2 enzyme and a substrate to transfer the ubiquitin from E2 to the substrate. The formation of lysine 48-linked polyubiquitin chains, the main signal for proteasomal degradation, is mediated by successive cycles of ubiquitin conjugation. Monoubiquitylation may be sufficient for proteasome targeting. When targeted to the proteasome, substrates are degraded into short peptides, which are further broken down into amino acids by aminopeptidases (APPs). The monoubiquitin and polyubiquitin molecules are usually removed from the substrate by the proteasome by deubiquitylating enzymes (DUBs) before substrate degradation. Released free ubiquitin molecules are recycled for another round of ubiquitylation. CP, core particle; RP, regulatory particle. Когда питательные вещества обильны, клетки могут выживать без аутофагии, а мутации и делеции в генах аутофагии, кодирующих компоненты аппарата аутофагии и его регуляцию, не угрожают жизнеспособности клеток6. В противоположность ганам аутофагии огромное большинство генов, кодирующих протеосомные субъединицы, являются существенными7 , поскольку оборот белков, обусловливаемый с помощью UPS, является высоким даже ели пища обильна. UPS, как полагают, деградирует тысячи коротко живущих и регуляторных белков, а также поврежденные и неправильно упакованные белки, чтобы регулировать различные клеточные функции, включая клеточный цикл, жизнеспособность клеток, клеточный метаболизм и контроль качества белка8-11. Протеосомы также важны для гомеостаза аминокислот12. Чтобы обеспечить эти критические функции, активность UPS д. тонко регулироваться.
Два типа сигналов воздействуют на белки для деградации с помощью протеосом: убиквитинирование обычно в форме lysine 48-прицепленных цепочек polyubiquitin7,13-15, и присутствие неструктуированной области белков, которая служит как инициатор для деградации16,17 (Fig. 1). Убиквитинирование, которое использует сложное взаимодействие убиквитинирующих и деубиквитинирующих энзимов (DUBs), является важным элементом контроля UPS7,13,14,18.
Помимо селективного целенаправленного воздействия белков на протеосомы, клетки имеют и др. путь регуляции протеосомной деградации, который заключается в наладке количества протеосом. Недавние находки показали, что количество протеосом контролируется на уровне сборки протеосом и является тонко регулируемым процессом, нацеленным на клеточный метаболизм. p
Components of the 26S proteasome
26S протеосомы эукариот являются 2.5 MDa протеолитическими комплексами, состоящими из двух разных субкомплексов: в 20S стержневой частицы core particle (CP) и в 19S регуляторной частицы regulatory particle (RP) 19-23 (Fig. 1). CP по флангу с одной или обеих сторон ограничена RP, формируя одиночную (RP1-CP) или дважды (RP2-CP) покрытую протеосому, соотв. (Fig. 1). Функциональные различия между ними неизвестны. Дополнительные регуляторные комплексы могут замещать RP для сборки альтернативной формы протеосом. Функция этих альтернативных форм RPs, включая протеосомный активатор PA200 (известен также как PSME4) млекопитающих (Bml10 у дрожжей) 19,24,25 и в 11S регуляторный комплекс PA28 (известен также как PSME3) или REG у млекопитающих, менее ясна, чем функция RP 7. Описаны три типа субъединиц PA28 , α-субъединица и β-субъединица, которые формируют гетерогептамер, PA28α-β (со стоихометрией α4β3) и γ-субъединицы, индуцируемые с помощью interferon-γ (IFNγ), который формирует гомогептамерa 26-28. Поскольку одна или две RPs могут быть связаны с CP, то это создает ряд возможных гибридных ансамблей протеосом, функции которых еще предстоит установить. Мы используем стандартизированную номенклатуру, названия дрожжевых и человеческих субъединиц приведены в Supplementary table 1.
The 20S core particle
Деградация белков происходит внутри узкой протеолитической камеры из CP, бочкообразного цилиндра, состоящего из α-субъединиц и β -субъединиц, уложенных в 4 складные гетерогептамерные кольца со стоихометрией из α1-7β1-7β1-7α1-7 (refs10,29-31). Два наружных α-кольца действуют как ворота, предупреждающие неконтролируемый доступ внутрь протеолитической камеры из двух β-колец. Ворота образуются накрепко переплетенными N-терминальными хвостами из α-субъединиц, которые блокируют проникновение субстрата 7. Открытые ворота контролируют доступ внутрь каталитической камеры протеосом и выполняют важную роль в регуляции протеосомной деградации 7. Среди семи β-субъединиц только β1,β2 и β5 обладают протеолитической активностью, которая известна как caspase-подобная активность, trypsin-подобная активность и химотрипсин-подобная активность, соотв. 32-34. Три дополнительные β-субъединицы, β1i, β2i и β5i, индуцируются в результате воздействия IFNγ у млекопитающих и замещают свои конструктивные аналоги, чтобы сформировать иммунопротеосомы 35,36 (Box 1). Др. ткане-специфичные субъединицы β5t и α4s, были описаны как часть thymoproteasome и тестис-специфических протеосом, соотв. 37,38 (Box 1).
|
Box 1 Tissue-specific proteasomes
Одной из ключевых ролей протеосом в иммунной системе является генерация антигенных пептидов для презентации на major histocompatibility complex (MHC) class I молекулах. Этот процесс главным образом обеспечивается с помощью специализированного типа протеосом, известных как immunoproteasome. Протеолитические субъединицы иммунопротеосом отличаются от таковых у обычных протеосом (see the figure, parts a and b). β1, β and β5 замещены β1i (известна также как proteasome subunit-β type-9 (PSMB9)), β2i (известна также как PSMB10) и β5i (известна также как PSMB8), соотв.192-197. Эти иммуно-субъединицы постоянно экспрессируются в разных иммунных тканях, включая тимус и селезенку, но они также индуцируются в широком круге типов клеток после воздействия способствующих воспалению цитокинов, таких как interferon-γ198,199. Иммунопротеосомы обладают повышенной chymotrypsin-подобной и trypsin-подобной активностью, в результате которой возникают антигенные пептиды, обладающие гидрофобными остатками, которые хорошо связываются MHC class I молекул. Недавнее исследование расширило роль иммунопротеосом на дифференцировку B и T клеток, в ответ на инфекцию и активацию в дендритных клетках199,200. Они были также ассоциированы с разными болезнями человека, включая рак, иммунные и воспалительные нарушения198-200.
Др. типом специализированных протеосом, обнаруженных в эпителиальных клетках коры тимуса являются thymoproteasome (see the figure, part c). Эти специализированные протеосомы содержат две иммуно-субъединицы, β1i и β2i, а также тимус-специфическую β-субъединицу, обозначаемую как β5t 201. Экспрессия субъединицы β5t контролируется с помощью forkhead box protein N1 (FOXN1), транскрипционного фактора, регулирующего развитие тимуса 38. Thymoproteasome существенны для позитивной селекции развивающихся T клеток, процесс, который использует отбор Т клеток, способных взаимодействовать с MHC 38,202,203. Субъединица β5t обладает предпочтением к субстрату , к пептидам, обладающими гидрофильными боковыми цепочками, генерирующими разные пулы пептидов из β5 и β5i субъединиц 37. Как этот специфический пул пептидов используется для положительного отбора Т клеток, предстоит установить. Специфичные для тестисов протеосомы (see the figure, part d) содержат α4s субъединицу вместо обязательной α4 субъединицы. Предполагается, что эта α?4s субъединица может предпочтительно взаимодействовать со специфическими комплексами, такими как протеосомный активатор PA200 (refs204,205).
CP, core particle.
![]()
|
The 19S regulatory particle
RP обладает критическими функциями, контролирующими распознавание субстрата, разглаживание складок и транслокацию в узкую CP после открытия ворот, образуемых α-ring 7,20,39. RP состоит из двух субкомплексов, основания и покрышки. Основание состоит из 6 самостоятельных, но родственных AAA +-ATPase субъединиц, которые обозначаются как RP triple-A protein 1 (Rpt1)-Rpt6. Эти 6 AAA +-ATPase белков образуют гетерогексамерное кольцо, которое непосредственно контактирует с поверхностью наружного α-кольца CP. Основание имеет 4 дополнительные не-ATPase субъединицы: RP non-ATPase 1 (Rpn1), Rpn2, Rpn10 и Rpn13 (refs40,41). Покрышка состоит из 9 non-ATPase субъединиц: Rpn3, Rpn5-Rpn9, Rpn11, Rpn12 и Sem1. Rpn10, как полагают, важна для ассоциации основания и покрышки 42. Однако, недавно крио-электронная микроскопия структуры выявила, что др. субъединицы основания взаимодействуют с крышкой, демонстрируя. что ассоциация основания мс покрышкой в основном обеспечивается субъединицами покрышки Rpn3, Rpn7, Rpn8 и Rpn11, которые имеют обширные контакты с субъединицами основания, включая пару Rpt3-Rpt6 и Rpn2 (refs22,43,44,45).
Mechanisms of core particle assembly
Сборка CP является сложным процессом, которые может быть подразделен на три ступени у эукариот: образование α-кольца, формирование β-кольца и димеризация половин протеосом и созревание (Fig. 2). Все эти ступени обеспечиваются с помощью пяти шаперонов, участвующих в сборке протеосом, наз. proteasome biogenesis-associated 1 (Pba1)-Pba4 у дрожжей и (proteasome assembly chaperone 1 (PAC1)-PAC4 у человека) и underpinning maturation of proteasome 1 (Ump1) (proteasome maturation protein (POMP) у человека) 21,31,46.
 Fig. 2: Models of 20S core particle assembly.
Fig. 2: Models of 20S core particle assembly.
The assembly of the core particle (CP) is initiated by the assembly of the α-ring, which serves as a platform for the assembly of the β-ring. CP assembly is assisted by five assembly chaperones referred to as proteasome biogenesis-associated 1 (Pba1)-Pba4 and underpinning maturation of proteasome 1 (Ump1). These assembly chaperones prevent aberrant dimerization of α-rings as well as premature association with the regulatory particle (RP). They also ensure that α-subunits and β-subunits are properly incorporated. Two half-proteasomes (15S) associate to form a nascent CP, which is remodelled by the successive removal of amino-terminal propeptides from β1, β2, β5, β6 and β7 subunits. Ump1 is then degraded by the newly formed CP while the Pba1-Pba2 complex is recycled.
α-Ring formation
Среди 5 протеосомы собирающих шапероны 4 предназначены для сборки α-кольца, это указывает на то, что сборка из 7 разных α-субъединиц в гептамерное кольцо является критической ступенью сборки CP. Эти 4 участвующие в сборке шапероны образуют две гетеродимера, Pba1-Pba2 (ref.47) и Pba3-Pba4 (refs48,49). Комплекс Pba1-Pba2 обеспечивает соотв. включение α5 и α6 субъединиц α-кольца и, как было установлено, предупреждает преждевременное соединение RP с α-кольцом 50,51 (Fig. 2). У человека, кроме того, предупреждает преждевременную ассоциацию с RP, соединение PAC1-PAC2 гетеродимера с промежуточным α-кольцом предупреждает также аберрантную димеризацию α-колец 47,50-52. У дрожжей комплекс Pba3-Pba4 взаимодействует с α5 субъединицей промежуточного образования, чтобы контролировать правильность интеграции α3 и α4 субъединиц . Делеция Pba3 или Pba4 вызывает тем самым накопление промежуточных образований протеосом и продуцирует разнообраные аберрантные протеосомы, включая протеосомы, лишенные α4 и протеосомы? обладающие второй копией α4 вместо α3 (обозначаемые как α4-α4 протеосомы) 53. Такие аберрантные α4-α4 протеосомы были описаны также в клетках млекопитающих 54.
β-Ring formation
α-Кольцо служит в качестве платформы для сборки β-кольца, которая начинается с последовательного рекрутирования β2, β3 и β4 субъединиц. Ump1 инкорпорируется вместе с первыми β-субъединицами, тогда как комплекс Pba3-Pba4 диссоциирует от α-кольца после интеграции β3 55,56. Возникающее в результате промежуточное образование, известное как 13S комплекс, рекрутирует затем β5, β6, β1 и β7 , чтобы сформировать 15S комплекс, наз. также как полу-протеосома (Fig. 2). Димеризация полу-протеосом инициируется непосредственно после инкорпорации β7 55-57.
Half-proteasome dimerization and maturation
Ump1 предупреждает неуместную димеризацию полу-протеосом вплоть до того, когда всеβ-субъединицы не будут инкорпорированы соотв. образом 56,58. После димеризации полу-протеосом возникающие в результате CP ремоделируются путем удаления N-терминальных пропептидов из β1, β2, β5, β6 и β7 субъединиц. Ump1 затем деградирует с помощью вновь сформированной CP, тогда как комплекс Pba1-Pba2 рециклируется для нового раунда сборки CP 48,58,59 (Fig. 2). В противоположность дрожжевым комплексам Pba1-Pba2 гетеродимер PAC1-PAC2 у человека, как было установлено, деградирует после завершения сборки CP 48.
Mechanisms of regulatory particle assembly
Сборка RP является многоступенчатым процессом и два крупных субкомплекса, основание и покрышка, могут собираться независимо (Fig. 3). В противовес покрышке, которая или само-собирается 60 или с помощью факторов, которые пока не обнаружены, сборка основания, как известно, обеспечивается 5 RP assembly chaperones (RACs): Nas2 (p27 у человека), Nas6 (p28 у человека), DNA mismatch repair protein Hsm3 (S5b у человека), Rpn14 (proteasomal ATPase associated factor 1 (PAAF1) у человека) и ATPase, предназначенная для шаперона в 17kDa (Adc17; известна также как TMA17)) 61-66. Потеря одиночного RAC не является летальным, но делеция комбинации RACs вредна для жизнеспособности клетки, особенно в условиях стресса 61,63,66. Это указывает на то, что существует до некоторой степени функциональное перекрывание между разными RACs. Кстати, предположены две модели сборки RP. Согласно одной модели, сборка RP не зависит от CP 61,62, тогда как согласно др. модели CP используется в качестве платформы для сборки основания RP 66-68.
 Fig. 3: Models of 19S regulatory particle assembly.
Fig. 3: Models of 19S regulatory particle assembly.
The assembly of the regulatory particle (RP) base and the assembly of the RP lid occur independently of each other. The base is composed of ten subunits, six regulatory particle triple-A (Rpt) proteins and four regulatory particle non-ATPase (Rpn) proteins, and the lid is composed of nine Rpn proteins. The assembly of the base is assisted by five RP assembly chaperones (RACs), which ensure that the base subunits are properly assembled together. The lid is suggested to self-assemble through the formation of a helical bundle consisting of the C-terminal helices of lid subunits. After completion of the base and the lid, these two subassemblies associate to form a mature RP. Adc17, ATPase dedicated chaperone of 17?kDa; Hsm3, DNA mismatch repair protein Hsm3.
RP base assembly
Гексамерное ATPase кольцо RP в точности упорядочено в Rpt1-Rpt2-Rpt6-Rpt3-Rpt4-Rpt5 конфигурацию и строится после сборки трех модулей, состоящих из двух AAA+-ATPase пар, связанных с избранными RACs, которые предохраняют от преждевременного соединения промежуточных образований RP в CP 66,69,70 (Fig. 3). Rpn14, Nas6, Nas2 и Hsm3 связывают C-терминальные хвосты их родственных Rpt белков, образуя три модуля: Rpn14-Rpt6-Rpt3-Nas6, Rpt4-Rpt5-Nas2 and Hsm3-Rpt1-Rpt2-Rpn1 (refs21,41). Первые два модуля ассоциируют др. с др. прежде чем включить Hsm3-Rpt1-Rpt2-Rpn1 комплекс, вместе с Rpn2 и Rpn13. Rpn10 рекрутируется после, чтобы завершить сборку основания RP (Fig. 3). Инкорпорация Hsm3-Rpt1-Rpt2-Rpn1 комплекса запускает высвобождение Nas2 из основания, тогда как Rpn14, Nas6 и Hsm3 удаляются после ассоциации между RP и CP 68,71-73. Дрожжи имеют дополнительных RAC, наз. Adc17 (ref.65). В отличие от др. RACs, которые соединяются с C-терминальными хвостами Rpts, Adc17 помогает сборке RP путем связывания N-терминального региона Rpt6, чтобы способствовать спариванию Rpt6 с Rpt3 (Fig. 3). Промежуточное образование Rpt6-Rpt3 не обнаруживается в клетках, поскольку др. модуль, Rpt4-Rpt5, уже доступе 65. Это указывает на то, что разные модули собираются независимо, а образование модуля Rpt6-Rpt3 может быть скорость ограничивающей ступенью при сборке RP 65. В лизатах клеток Adc17 обнаруживается в комплексе с Rpt6 , а не в ансамблях более высокого порядка, подтверждая, что Adc17 быстро исчезает после образования пар Rpt6-Rpt3 65.
RP lid assembly
Рекомбинантные субъединицы покрышки RP могут собираться в отсутствиеe CP или основания RP 22,74. Образование верхней части инициируется образованием двух промежуточных структур: одна состоит из Rpn5-6, Rpn8-9 и Rpn11 а др. состоит из Rpn3, Rpn7 и Sem1 (refs74,75). Самообразование промежуточных структур осуществляется посредством спиральных пучков, формируемых с помощью C-терминальных спиралей субъединиц покрышки 76. После ассоциации этих двух промежуточных образований, инкорпорируется последняя субъединица верхней части, Rpn12 (Fig. 3). Включение Rpn12 запускает конформационные изменения в верхней части, которые становятся компетентными к соединению с основанием 77.
Association between the CP and the RP
Ассоциация RP на одном или обоих концах CP является критической для функции 26S протеосом, поскольку RP контролирует существенные ступени в протеосомной деградации: распознавание субстрата, деубиквитилирование, удаление складок, транслокация и открытие ворот CP (Fig. 1). Все эти ступени обеспечивают избирательную деградацию белков. Ассоциация RP-CP обеспечивается с помощью инсерции C-терминального HbYX (Hb: hydrophobic; Y: tyrosine or phenylalanine; X: any amino acid) мотива Rpt белков в α-карманы 67,78. Это взаимодействие вызывает конформационные изменения в CP, смещая N-терминальные хвосты α-субъединиц от центра канала CP, чтобы открыть ворота CP, когда субстрат обнаружен 7. Интересно, что Pba1 и Pba2 также содержат мотивы HbYX, это объясняет как Pba1-Pba2 гетеродимер предупреждает от преждевременной ассоциации RP-CP 52. Сходным образом, Nas6, путем взаимодействия с Rpt3, стерически участвует в связывании CP, это предупреждает установку RP на CP 66,79. Кроме того, Nas6 мешает ассоциации RP основания и покрышки и поэтому обладает двумя функциями в сборке протеосом 71. Структурная информация в RP, как было установлено, также важна, т.к. субъединицы покрышки Rpn5 и Rpn6 образуют пальце-подобные структуры, которые контактируют с субъединицами CP α1 и α2, соотв. 22. Это неожиданное взаимодействие между верхней частью и CP подтверждает, что Rpn5 и Rpn6 усиливают и стабилизируют ассоциацию между RP и CP 22.
Substrate recognition by the proteasome
Важным аспектом регуляции протеосомной деградации является контроль поставки субстрата внутрь протеосом. Убиквитинированные белки непосредственно распознаются протеосомами с помощью трех убиквитиновых рецепторов, которые являются прирожденными и стоихометическими субъединицами протеосом Rpn1, Rpn10 и Rpn13 (refs7,14,80). Rpn10 и Rpn13 не существенны у дрожжей81, указывая, что они обладают перекрывающимися функциями, в отличие от Rpn1, который является жизненно важным80. Специфичная для печени делеция или Rpn10 или Rpn13 у взрослых мышей переносима, тогда как потеря обеих субъединиц вызывает серьезные повреждения печени с накоплением полиубиквитинированных конъюгатов82. Однако, делеция Rpn10 у эмбрионов мышей вызывает эмбриональную гибель, указывая, что специфическая функция Rpn10 важна для развития млекопитающих83. У дрожжей челночные факторы репарации эксцизий, вызываемых УФЛ, белкок Rad23, содержащий ubiquitin домен белок Dsk2 и DNA damage-inducible protein 1 (Ddi1) сопровождают убиквитинированные субстраты в протеосомы7,14,80. Челночные факторы являются UBL-UBA белками; они соединяются с протеосомами посредством ubiquitin-like (UBL) домена и с цепочками ubiquitin с помощью ubiquitin-associated (UBA) домена. Эти челночные факторы и присущие рецепторы субстратов координируют дегенерацию субстрата, а потребность в них варьирует для разных белков.
Деградация субстрата сцеплена с деубиквитинированием7, которое является важным элементом контроля протеосомной деградации, осуществляемой с помощью ассоциированных с протеосомами DUBs84. Способом, концептуально сходным с рецепторами ubiquitin, один энзим DUB является внутренне присущей субъединицей протеосом, а др. являются ассоциированными факторами. Rpn11 является протеосомным DUB, который отщепляет цепочки ubiquitin после того, как субстрат оказывается необратимо застрявшим в узком протеосомном входном канале84. Ubiquitin C-terminal hydrolase 14 (USP14; Ubp6 у дрожжей) и ubiquitin C-terminal hydrolase UCH37 (also known as UCHL5) являются DUBs, которые ассоциируют с протеосомами и путем деубиквитинирования субстрата, модулируют его судьбу84. Такие энзимы были исследованы в качестве потенциальных мишеней для лекарств, т.к. они играют жизненно важную роль в регуляции деградации85.
Описана также ubiquitin-независимая деградация с помощью стержневых 20S протеосом 86,87, хотя значительно меньше известно о механизмах, с помощью которых белки могут подвергаться целенаправленному воздействию т деградировать с помощью 20Sв отсутствие 19S и ubiquitin. Независимо от способа целенаправленного воздействия т.е. присутствие неструктуированного региона является предварительным условием для инициации деградации субстрата 14,16, расправление белка также может быть прямым способом контроля деградации.
Regulation of proteasome subunit abundance
Поскольку продукция протеосом является энергетически затратной и нарушения протеосомной деградации ведут к клеточной гибели88, то клетки обладают механизмами для поддержания адекватных количеств протеосом.
Экспрессия многих разных протеосомных субъединиц д. быть тонко скоординирована для продукции правильных количеств каждой из субъединиц. Это достигается посредством контролируемой экспрессии протеосомных субъединиц с помощью обычного транскрипционного фактора, Rpn4 у дрожжей 89,90. Rpn4 соединяется с nonamer box (5'-GGTGGCAAA-3') известным как proteasome-associated control element (PACE), который присутствует в промоторах большинства протеосомных субъединиц, а также в некоторых др. стрессовых генах 89 (Fig. 4a). Удивительно, Rpn4 обладает очень коротким периодом полу=жизни (t1/2 ~2 min) благодаря быстрой протеосомной деградации. Как результат, количество Rpn4 увеличивается, когда функция протеосом нарушена, приводя к усилению экспрессии протеосомных единиц 90 (Fig. 4). Поэтому делеция rpn4 мешает приспособленности клетки 90. Количество Rpn4 регулируется не только её быстрой протеосомной деградацией, но и также транскрипционно с помощью различных индуцируемых стрессами транскрипционных факторов, таких как Yap1, Pdr1, Pdr3 и Hsf1, показывая, что увеличение экспрессии протеосомных субъединиц может быть общим механизмом адаптации к разным затруднительным состояниям 91.
 Fig. 4: Transcriptional regulation of proteasome subunits.
Fig. 4: Transcriptional regulation of proteasome subunits.
a | Transcriptional regulation of proteasome subunits in yeast. Regulatory particle non-ATPase 4 (Rpn4) is a transcription factor with an extremely short half-life (t1/2 ~2 min). It is constantly degraded by the proteasome through both ubiquitin-dependent and ubiquitin-independent pathways under normal growth conditions. Ubiquitin-dependent degradation of Rpn4 is mediated by a complex formed by the ubiquitin-conjugating enzyme E2 2 (Rad6) and the E3 ubiquitin-protein ligase Ubr2. Upon proteasome inhibition or overload, Rpn4 is stabilized and translocates to the nucleus, where it binds to a nonamer box (5?-GGTGGCAAA-3?) referred to as the proteasome-associated control element (PACE), which is present in the promoters of most proteasomal subunit genes. This increases expression of proteasome subunits. b | Transcriptional regulation of proteasome subunits in mammals. Nuclear factor erythroid 2-related factor 1 (NRF1) controls proteasome subunit expression in mammals. NRF1 is constantly retrotranslocated to the cytosol, where it is rapidly ubiquitylated and degraded by the ubiquitin-proteasome system (UPS) with a half-life of only ~12 minutes. When the proteasome is inhibited or overloaded, the stabilization of NRF1 after retrotranslocation allows NRF1 to be cleaved by the aspartyl protease protein DDI1 homologue 2 (DDI2). The resulting active form of NRF1 translocates to the nucleus where it binds antioxidant response elements (AREs) and activates the transcription of its target genes, including those encoding the proteasome subunits. This response is referred to as the proteasome bounce-back response. ER, endoplasmic reticulum; Ub, ubiquitin.
Млекопитающие также совместное увеличение экспрессии протеосомных субъединиц в ответ на ингибирование протеосом92. 2 транскрипционных фактора млекопитающих, как полагают, выполняют функцию дрожжевого Rpn4: nuclear factor erythroid 2-related factor 1 (NRF1 (известен также как NFE2L1; Skn1 у дрожжей) и NRF2 (refs93,94). Подобно Rpn4, NRF2 является нестабильным белком, который стабилизируется после redox стресса, чтобы усиливать экспрессию протеосомных генов93,95. NRF2 , как было первоначально предположено, усиливает экспрессию протеосомных субъединиц, если протеосомы ингибируются96. Однако, более позднее исследование выявило индукцию протеосомных субъединиц после ингибирования протеосом с помощью NRF1 (ref.94).
NRF1 является интегральным мембранным белком эндоплазматического ретикулума (ER), которые в нормальных условиях постоянно обратно транслоцируется с ER в цитозоль, где он быстро убиквитинируется и деградируется протеосомами (Fig. 4b). Если функция протеосом нарушена, то NRF1 избегает протеосомной деградации и расщепляется с помощью aspartyl protease protein DDI1 homologue 2 (DDI2), чтобы продуцировать снова активную форму NRF1 (refs97,98). Активный NRF1 затем транслоцируется из цитозоля в ядро, чтобы вызвать экспрессию протеосомных субъединиц94,97(Fig. 4b). NRF1 и NRF2 являются членами семейства Cap'n'Collar транскрипционных факторов, обладающих доменом basic-leucine zipper (bZIP), который связывает antioxidant response elements (AREs), обнаруживаемые в промоторах генах антиоксидантного ответа99. Интересно, что промоторы генов нескольких протеосомных субъединиц содержат AREs, следовательно, возникает возможность, что NRF белки повышают уровни протеосом в условиях стрессов93,10-102 путем связывания с этими AREs и что NRF1 и NRF2 активируются при разных стрессах.
У растений Arabidopsis thaliana два NAM/ATAF1/CUC2 (NAC) транскрипционных фактора, NAC53 (известен также как ANAC053) и NAC78 (известен также как ANAC078), были идентифицированы в качестве ключевых регуляторов генов, кодирующих протеосомные субъединицы. NAC53 и NAC78 индуцируют экспрессию компонентов протеосом в условиях протеотоксических стрессов, это существенно для растений, чтобы пережить ингибирование протеосом 103-105. Т.к. эти транскрипционные факторы, по-видимому, участвуют в обеспечении, что протеосомный гомеостаз адаптируется к нуждам растений, то было бы интересно открыть физиологические пути, которые особенно чувствительны к пертурбациям реакций на протеосомные стрессы.
Regulation of proteasome subunits assembly
После скоординированной индукции протеосомных субъединиц с помощью предназначенных для этого факторов, субъединицы нуждаются в правильной сборке, чтобы сгенерировать функциональные протеосомы. Сборка протеосом, как полагали, процессом поддержания домашнего хозяйства, но недавние исследования установили, что этот процесс сложный и тонко регулируется.
Regulation of RP assembly
Первым доказательством, что сборка субъединиц RP может регулироваться, стала идентификация дрожжевого RAC Adc17 (ref.65). При генетическом скрининге путей, которые могут компенсировать дисфункцию протеосом, был идентифицирован Adc17 в качестве мощного супрессора дефектов протеосом, вызываемых с помощью термочувствительной мутации в Rpt6 (ref.65).
Adc17 индуцируется при стрессовых состояниях, таких как тепловой шок и ER стресс, независимо от Rpn4 (ref.65). Путь, контролирующий стрессом индуцированную экспрессию Adc17, был недавно обнаружен, как использующий передачу сигналов посредством центрального контролера стресса и роста TOR (Box 2; Fig. 5). Подавление TOR complex 1 (TORC1), фармакологически или генетически достаточно, чтобы повысить уровни Adc17, и эта индукция, как было установлено, зависит от MAP киназы Mpk1 (ref.106). Удивительно, активация Mpk1 после подавления TORC1 также индуцирует все др. известные RACs дрожжей (Nas2, Nas6, Hsm3 и Rpn14). Это скоординированное увеличение RACs является важным для усиления сборки протеосом и для выживания клеток в затруднительных состояниях, которые нуждаются в повышенной протеолитической активности 106(Fig. 5).
 Fig. 5: Regulation of proteasome assembly.
Fig. 5: Regulation of proteasome assembly.
The transcription of proteasome-related genes is coordinated by the transcription factors regulatory particle non-ATPase 4 (Rpn4) in yeast and nuclear factor erythroid 2-related factor 1 (NRF1) and NRF2 in mammals. Under challenging conditions, inhibition of the stress and growth controller TOR complex 1 (TORC1) signals to MAP kinase Mpk1 to increase assembly of the regulatory particle (RP). Core particle (CP) assembly is also a regulated process, with the transmembrane domain recognition complex (TRC) pathway and inactive rhomboid protein 1 (iRhom1) promoting CP assembly while miR-101, targeting proteasome maturation protein (POMP) mRNA, interferes with CP assembly. The association of the RP at one or both ends of the CP will form the singly and doubly capped proteasome, respectively. RP-CP association is mediated by the insertion of the carboxy-terminal HbYX (Hb: hydrophobic; Y: tyrosine or phenylalanine; X: any amino acid) motifs of regulatory particle triple-A protein (Rpt) proteins into the pockets formed by two adjacent ?-subunits. Various proteins have been proposed to play a role in the regulation of RP-CP association both in yeast (Ecm29 and heat shock protein 90 (Hsp90)) and in mammals (HSP90 and RPN6). Hsm3, DNA mismatch repair protein.
Несколько линий доказательств указывают, что Mpk1 действует пост-транскрипционно путем координации экспрессии RACs и протеосомных субъединиц на трансляционном уровне, чтобы повысить количества протеосом и усилить протеолиз106. Этот путь адаптивной сборки протеосом эволюционно законсервирован, т.е. mTOR и ERK5 (известен также как MAPK7; гомолог Mpk1) регулирует сборку RACs и 26Sпротеосом в клетках млекопитающих106.
В соответствии с усилением трансляции компонентов протеосом вследствие подавления TORC1 106, определение количественного профиля инициации рибосом показало. что трансляция протеосомных компонентов и протеосомная активность резко увеличиваются после голодания 107. Т. о., имеется доказательства, показывающие, что клеточные уровни функциональных протеосом регулируются и что эта регуляция важна для жизнеспособности и физиологии клеток.
|
Box 2 TORC1 complex in yeast and mammals
The Saccharomyces cerevisiae TOR complex 1 (TORC1) is composed of three essential components, TOR1 or TOR2, kontroller of growth protein 1 (Kog1) and lethal with Sec13 protein 8 (Lst8), and one non-essential protein, Tco89 (refs159,206,207). The TOR1 and TOR2 subunits harbour the kinase catalytic activity, whereas the other components regulate the assembly and stability of TORC1 as well as its subcellular localization and substrate recruitment158,159. The mammalian complex, mTORC1, comprises three orthologues of the essential subunits of the yeast TORC1 complex, mTOR (TOR1 and TOR2 in yeast), regulatory protein associated with mTOR (Raptor; Kog1 in yeast) and mammalian Lst8 (mLST8; Lst8 in yeast)208-210, and two additional inhibitory subunits, proline-rich AKT substrate of 40?kDa (PRAS40) and DEP domain-containing mTOR interacting protein (Deptor)211-213 (see the figure).
TORC1 is a stress-responsive and nutrient-responsive complex that adapts cell metabolism to the cell requirements, and one essential trigger of its activation is amino acid availability. TORC1 does not sense amino acid availability directly but instead through sensors. For example, sensors for arginine and leucine have been recently identified and referred to as cellular arginine sensor for mTORC1 (CASTOR1) and sestrin 2, respectively214-217. It is possible that more sensors will be discovered. Under nutrient-rich conditions, mTORC1 activation favours growth in part by promoting the synthesis of new cellular components, including proteins. Well-characterized mTORC1 targets controlling translation in mammals are the ribosomal protein S6 kinase ?1 (S6K1) and the eukaryotic translation initiation factor 4E (eIF4E) binding proteins (4E-BPs)158,159. mTORC1 also promotes anabolism by repressing the two degradative machineries, the autophagy-lysosome system and the ubiquitin-proteasome system (UPS). Under various stress conditions, such as nutrient scarcity, mTORC1 is inhibited, which decreases global protein synthesis while derepressing degradative machineries106,158,159,167. This well-orchestrated response is essential to maintain an adequate and functional proteome in cells.
|
Regulation of CP assembly
Эктопическая избыточная экспрессия Rpn4, которая способствует транскрипции генов, кодирующих субъединицы протеосом, ещё больше повышает уровни функциональных протеосом в клетках дикого типа, которые уже содержат высокой базовый уровень протеосом108. Неожиданно избыточная экспрессия Rpn4 , как было установлено, увеличивает также транскрипцию генов, кодирующих сборку протеосом шаперонов в разной степени, хотя не был обнаружен элемент PACE в их промоторных областях, за исключением Nas6 (ref.108). Это увеличение особенно выражено для CP шаперонов, которые содержат минимальную последовательность, обозначаемую как PACE-стержневую, которая д. функционировать как элемент, чувствительный к Rpn4108. Было бы интересно выяснить, действительно ли это обусловленное Rpn4 увеличение является прямым или косвенным, т.к. это может означать новый узел регуляции.
Недавно несколько исследований подчеркнули, что сборка CP также регулируется106,109; однако, лежащие в основе молекулярные механизмы остаются не охарактеризованными. Указания на регуляцию сборки CP получены от наблюдения, что количество дрожжевых шаперонов, участвующих в сбоке протеосом, Pba1 и Pba2 увеличиваются с помощью tunicamycin, который вызывает накопление неправильно упакованных белков в ER, тогда как уровни Pba3-Pba4 димеров остаются неизменными. Такое увеличение Pba1 и Pba2 ассоциирует с усилением сборки CP106. Было бы интересно идентифицировать путь, контролирующий стрессовую индуцибельность экспрессии Pba1 и Pba2. Уровни Pba3 и Pba4, как было установлено, увеличиваются вследствие нарушений импорта митохондриального белка, как следствие накопления митохондриальных предшественников в цитозоле110.Более того, стабильность и димеризация шаперонов сборки CP PAC1 и PAC2 (человеческие гомологи Pba1 и Pba2,соотв.), также как и активность протеосом, обнаруживали увеличение после ER стресса и это увеличение, как полагают, обеспечивается с помощью inactive rhomboid protein 1 (iRhom1)111. iRhom1 является членом rhomboid-like семейства протеаз, которые лишены протеазной активности 112. iRhom1 располагается в ER и участвует в доставке мембранных белков и в деградации ассоциированных с ER белков (ERAD)112-114. Как iRhom1 регулирует стабильность PAC1-PAC2 димеров и способствует активности протеосом, остается неизвестным.
Путь transmembrane domain recognition complex (TRC), который контролирует инсерцию в мембрану прикрепляющихся хвостами белков, как полагают, регулирует также сборку CP (Fig. 5), т.к. потеря или TRC40 или шаперона крупного богатого пролином BAG6, двух компонентов TRC млекопитающих, приводит к дефектам сборки CP115. Хотя точные механизмы, с помощью которых путь TRC регулирует сборку CP неизвестен, предполагается, что TRC40 aи BAG6 могут облегчать инкорпорацию β субъединиц на α-кольцо или стабилизирует сборку промежуточных образований CP115.
miR-101, являющаяся мощным опухолевым супрессором, также регулирует сборку протоеосом109, подчеркивая возможную связь между сборкой протеосом и раком. miR-101 целенаправленно воздействует на мРНК, кодирующую шаперон сборки CP POMP, чтобы быстро снижать уровни белка POMPи тем самым подавлять сборку протеосом109 (Fig. 5).
В последние годы стало очевидным, что накопление неправильно упакованных белков приводит к увеличению сборки протеосом. Регулируемая сборка протеосом и в результате мощное повышение способности протеосомной деградации важны для обеспечения очистки неправильно упакованных белков, которые могут быть вредными для клеток. Хотя уже давно известно, что убиквитинирование протеосомных субстратов диктует скорость их деградации, находка, что численность протеосом и сборка могут тонко настраиваться на клеточные потребности, показывает, что механизмы, регулирующие протеосомную деградацию, идут навстречу нуждам клеток и поддерживают клеточную жизнеспособность являются более сложными, чем предполагалось.
Regulation of RP-CP association
Ассоциация RP-CP является критической для активации протеосом, поскольку N-терминальные хвосты от α-субъединиц формируют ворота, предупреждающие доступ в центр α-кольца32,116,117. Ассоциация RP-CP обратима, т.к. 26S протеосомы могут разбираться на стабильные RP и CP118-120 (Fig. 5).
Т.к. чистые RP и CP могут ассоциировать in vitro без добавления дополнительных факторов, то считается, чт ассоциация RP-CP происходит спонтанно121,122. Это может отличаться в клетках, учитывая, что некоторые факторы, регулирующие ассоциацию RP-CP все-таки идентифицированы. Одним из таких факторов является шаперон и хитшоковый белок 90 (Hsp90), которые участвуют разными способами в поддержании целостности 26S протеосом123-126(Fig. 5). Субъединица основания RP Rpn6 также может регулировать ассоциацию RP-CP , поскольку она связывается непосредственно с α2 субъединицей CP22 (Fig. 5). Эктопическая экспрессия PN-6.1 у Caenorhabditis elegans, как было установлено, усиливает активность протеосом и улучшает резистентность к протеотоксическим стрессам127. RPN6 является также важной для поддержания высоких уровней протеосом в эмбриональных стволовых клетках человека 128.
Белок с HEAT-like повторами Ecm29 ассоциирует с протеосомами дрожжей и распознает аберрантную сборку RP-CP, которая накапливается в линиях с нарушениями сборки протеосом или созревания, таких как клетки ump1Δ 58,129 или у α-pocket lysine мутантов, в которые включены незрелые β-субъединицы130. Будучи связанным с несовершенными протеосомами Ecm29 репрессирует протеосомную деградацию с помощью подавления протеосомной активности АТФ и открытия ворот CP129=132. Более того, Ecm29 способствует диссоциации RP-CP в условиях оксидативного стресса путем вмешательства в связывание между RP и CP120,133. Возникает вопрос, как Ecm29 специфически рекрутируется в 26S протеосомы в условиях оксидативного стресса и может ли Ecm29, связанный с аберрантными протеосомами, отсоединяться или деградировать.
Тонко регулируемая деградация большинства клеточных белков осуществляется посредством 26S протеосом. Было предположено, что CP может деградировать белки, которые врожденно нестабильны или неструктуированы и что такая деградация происходит самопроизвольно (default) 134. Было показано, что деградация с помощью CP протеосом не нуждается в загрузке ubiquitin, но зависит от присутствия неструктуированных регионов белков; но мало известно о CP-обусловленной деградации белка 87.
Regulation of RP-CP association by post-translational modifications
Пост-трансляционные модификации протеосом предоставляют дополнительные возможности для регуляции протеосомной деградации135,136. Фосфорилирование белка является одной из наиболее распространенных модификаций, и разнообразные киназы и фосфатазы регулируют протеосомы137. Свидетельством важности этой модификации для сборки протеосом является то, что столкновение очищенных протеосом с щелочной фосфатазой приводит к её диссоциации на CP и RP138. Одна из первых киназ, описанных как фосфорилирующая протеосомные субъединицы, стала cAMP-dependent protein kinase A (PKA)139. Serine 120 (S120) в Rpt6 , как было установлено, фосфорилируется с помощью PKA и дефосфорилируется с помощью protein phosphatase 1-γ (PP1γ). Фосфорилирование Rpt6 с помощью PKA регулирует 26S протеосомы138,140,141, возможно путем облегчения взаимодействия между Rpt6 м субъединицей CP α2 (ref.138).
Активация PKA, как было установлено, усиливает активность протеосом и как следствие оказывает защитный эффект в нескольких моделях нейродегенеративных болезней140,142,143. Однако, этим находкам противоречит наблюдение, что фосфорилирование Rpt6 не происходит после rolipram-обусловленной активации PKA, тогда как RP субъединица Rpn6 избирательно фосфорилируется по серину 14 (ref.144). Избыточная экспрессия phosphomimetic Rpn6-S14D мутанта стимулируется деградацией коротко живущего протеосомного субстрата и белков, склонных к агрегации, тогда как phospho-dead Rpn6-S14A мутант обнаруживает противоположный эффект144. Фосфорилирование Rpn6 ассоциировано с повышенными уровнями 26S протеосом, особенно RP2-CP144, это согласуется с предполагаемой функцией Rpn6 как медиатора ассоциации RP-CP22. В свете этих расхождений, хорошо бы прояснить вклад каждой PKA мишени в PKA-обеспечиваемое увеличение RP-CP протеосом.
Др примером фосфорилирования и дефосфорилирования, регулирующих протеосомы, является ubiquitin-подобный домен, содержащий CTD phosphatase 1 (UBLCP1)145. UBLCP1, как было установлено, соединяется с Rpn1 посредством своего UBL домена и затем дефосфорилирует субъединицу AAA+-ATPase Rpt1 . UBLCP1 является протеосомной фосфатазой, регулирующей сборку ядерных протеосом, особенно ассоциацию между RP и CP145,146. Скрининг библиотеки, базирующейся на salicylic фрагментов, выявил мощный ингибитор UBLCP1 (соединение 13; half-maximal inhibitory concentration (IC50) из 1 µM), который увеличивает активность ядерных протеосом в клетках. Терапевтический потенциал этого соединения, заключающийся в коррекции состояний, вызываемых неправильной упаковкой белков, пока не установлен.
АДФ рибозилирование является др. пост-трансляционной модификацией, которая регулирует белок, связывающий протеосомы, PI31. С АДФ ribose связанный PI31, как полагают, избирательно взаимодействует с двумя RACs, dp27 и dS5b (мушиные гомологи дрожжевых Nas2 и Hsm3, соотв.), чтобы способствовать сборке 26S протеосом147. Однако, др. работа не воспроизвела эту находку in vivo148, тем самым поставила под вопрос физиологическое значение PI31 в регуляции 26S протеосом.
Крупномасштабный анализ пост-трансляционных модификаций протеосом выявил более 345 пост-трансляционных модификаций 26S протеосом, которые могут быть подразделены на 11 раных типов: phosphorylation, ubiquitylation, succinylation, N-acetylation, N-myristoylation, N-methylation, oxidation, O-glycosylation, sumoylation, poly(ADP-ribosyl)ation и truncation 149. Функциональные последствия этих модификаций в большинстве своем остаются полностью неизвестными 149.
Proteasomal degradation and autophagy
Давно известно, что нарушения деградации вызывает аутофагию. Это показано на многочисленных экспериментальных системах, от клетки до организма, от дрожжей до млекопитающих150. Молекулярные связи между этими двумя системами деградации осуществляются на многих уровнях. Одним из примеров является накопление протеосомных субстратов, при этом нарушения протеосомной деградации могут быть компенсированы с помощью аутофагии.
В дополнение к массовой аутофагии, которая индуцируется после пищевого голодания и рассматривается как неизбирательная аутофагия, может существовать и избирательная. Важно, что ubiquitin служит в качестве сигнала для целенаправленной деградации белка в обеих системах151. Избирательная аутофагия задействует аутофагические рецепторы для целенаправленного воздействия на груз аутофагосомами. Сюда входят p62, next to BRCA1 gene 1 белок (NBR1), nuclear domain 10 protein 52 (NDP52; известен также как CALCOCO2), valosin-containing protein (VCP) и optineurin, которые являются модулярными белками, которые соединяются одной стороной с ubiquitin на грузе, а др. стороной с белками, связанными с аутофагосомами, членами семейства LC3, посредством региона взаимодействия LC3151.
Поскольку неупакованные белки нуждаются в протеосомной деградации, то считается, что это протеосомная деградация растворимых белков, тогда как органеллы или агрегаты белков деградируются с помощью аутофагии. Хорошо известный пример связан с действием между этими двумя пааратами деградации является устранение многих склонных к агрегации белков, таких как huntingtin или α-synuclein152. Протеосомы ответственны за деградацию большинства неправильно упакованных белков, чтобы помешать им образовывать крупные агрегаты. Если протеосомы дефектны или разбиты, то неправильно упакованные белки накапливаются и формируют крупные олигомеры и агрегаты, которые подвергаются целенаправленному воздействию аутофагии151. Т.о., оба аппарата деградации взаимодействуют при устранении неправильно упакованных белков и поддержания функциональности протеома.
Остается неясным, действительно ли ингибирование аутофагии может вызвать компенсаторную активацию протеосом. Популярное мнение, что протеосомы деградируют растворимые субстраты, а аутофагия деградирует крупные клеточные субстраты, поэтому трудно представить , что протеосомная деградация функционально замещать аутофагию. Форма взаимодействия между аутофагией и протеосомами происходит когда 26S протеосомы деградируются с помощью аутофагии, процесс, обнаруженный у растений и наз. proteaphagy153. Протеоаутофагия происходит у растений после азотного голодания и ингибирования протеосом и это обусловливается с помощью Rpn10, который соединяется с убиквитинированной протеосомой и с ATG8, действующим как рецептор протеоаутофагии153. Сходным образом, это наблюдалось у дрожжей, при этом с ubiquitin связанный белок Cue5 является рецептором протеоаутофагии154,155. Протеоаутофагия описана также в клетках человека, при этом p62 является важным для целенаправленного воздействия аутофагии на 26S протеосомы156. Т. о., аутофагия может контролировать уровни протеосом и таким способом может влиять, хотя и косвенно, на протеосомную деградацию.
Описанные механизмы подчеркивают взаимодействие между протеосомами и аутофаагией на уровне деградации субстрата. Однако, поскольку деградация субстрата вызывает рециклинг аминокислот, то важным компонентом общения между этими двумя путями деградации является контроль за гомеостазом нуклеиновых кислот. TORC1 объединяет метаболизм аминокислот и уровни деградации белка посредством протеосом и аутофагии.
TORC1 controls proteasome biogenesis
Широкая доступность питательных веществ способствует росту и анаболическим процессам, тогда как бедность питательных веществ способствует катаболическим процессам, чтобы сохранить и преобразовать имеющиеся ресурсы для выживания клеток. TORC1 является центральным контролером клеточного роста и клеточного гомеостаза у эукариот 157,158. TORC1 определяет доступность аминокислот, чтобы сбалансировать синтез и деградацию белков (Fig. 6). В условиях, богатых пищей, активация TORC1 способствует росту, частично способствуя синтезу новых белков (Box 2; Fig. 6). Это усиление анаболических процессов связано с репрессией клеточного катаболизма посредством фосфорилирования и ингибирования serine/threonine-protein kinase ULK1 и транскрипционного фактора EB (TFEB), которые участвуют в формировании аутофагосом и транскрипции autophagy-lysosome генов, соотв. 159-162. Напротив, в условиях ограниченного питания, ингибирование TORC1 репрессирует анаболические процессы и клеточный рост, при этом стимулируется катаболизм, чтобы мобилизовать сохраненную энергию и ресурсы для поддержания важных клеточных процессов и обеспечения выживания клетокl (Fig. 6).
 Fig. 6: TORC1 integrates protein and amino acid homeostasis.
Fig. 6: TORC1 integrates protein and amino acid homeostasis.
Under nonlimiting nutrient conditions, TOR complex 1 (TORC1) is activated to promote anabolic processes, such as the synthesis of nucleotides, lipids and proteins. This elevated production of the building blocks of cellular components is associated with the repression of catabolic processes to favour cell growth. Diverse stresses, including nutrient scarcity, inhibit TORC1 to decrease cellular anabolism and increase catabolic processes, including the autophagy system and the ubiquitin-proteasome system (UPS). Elevated protein catabolism enables the degradation of unwanted proteins into free amino acids, which will support the synthesis of new stress proteins. This metabolic reprogramming of the cells is essential to maintain cell viability. Kog1, kontroller of growth protein 1; Lst8, lethal with Sec13 protein 8.
Хорошо известно, что подавление TORC1 индуцирует аутофагию151,163. Кроме того, недавно было показано, что ингибирование TORC1 усиливает сборку протеосом и их численность106. Эти находки указывают на то, что TORC1 координирует сборку протеосом и их количество с ростом и клеточным метаболизмом (Fig. 6), сто является временным106. Сходное временное повышение активности протеосом наблюдалось после голодания, обусловленного подавлением TORC1 (ref.164). Интересно, что возвращение к базовому уровню протеосом после подавления TORC1 сопровождается усилением аутофагии, подкрепляя, что аутофагическая деградация протеосом или протеоаутофагия является одной из причин преходящей природы увеличения численности протеосом. А согласии с этой моделью, , как было установлено, являются субстратом для autophagy-lysosome системы153-156.
Др. исследование установило, что неконтролируемая активация TORC1 в клетках млекопитающих истощает TSC2 (кодирующий tuberous sclerosis complex 2; известен также как tuberin, негативный регулятор TORC1) и становится объектом сывороточного голодания, увеличивая уровень активных протеосом NRF1-зависимым способом165.Одно из возможных объяснений этих противоречивых наблюдений заключается в специфических экспериментальных условиях165, поскольку продолжительная гиперактивность TORC1 в клетках, культивируемых в отсутствие сыворотки, д. приводить в действие адаптивные механизмы, приводящие к повышению уровней протеосом.
В соответствие с репрессией TORC1 запускаются разнообразные репрессирующие катаболические процессы, подавление mTORC1 усиливает убиквитинирование белков и их деградацию в клетках человека. mTORC1-зависимое убиквитинирование скорее избирательное, т.к. оно преимущественно затрагивает факторы, связанные с ростом, такие как 3-hydroxy-3-methylglutaryl (HMG)-CoA синтаза166,167.
Гомеостаз аминокислот играет центральную роль в интеграции сборки и численности протеосом с ростом и клеточным метаболизмом. Протеосомы важны ка для деструкции белков, и как преобразователь (recycler) аминокислот и подавление протеосом приводит к накоплению аминокислот12,168 (Fig. 6). Важность поставки аминокислот подчеркивается наблюдением, что ингибирование протеосом является летальным для клеток и организмов83,169,170, но дрожжи и клетки млекопитающих, как и мух переживают ингибирование протеосом, если добавляются аминокислоты12.
Недостаток аминокислот в результате подавления протеосом вызывает ассоциированные с голоданием стрессы, которые действуют как сигнал индукции интегрированной стрессовой реакции и аутофагии 12 в попытке восстановить гомеостаз аминокислот. Интегрированная стрессовая реакция заключается в снижении скорости синтеза белка, тем самым понижается потребление аминокислот, когда их доставка ограничена. Параллельно клетки индуцируют аутофагию, чтобы подвергнуть рециклингу внутриклеточные компоненты и тем самым обеспечить питательными веществами, чтобы компенсировать накопление, возникающее в результате подавления протеосом (Fig. 6). Т.о., недостаток аминокислот является сигналом к активации аутофагии, когда протеосомы подавлены и это осуществляется через TORC1 (ref.12). Подобно подавлению протеосом, подавление регулятора протеосомной деградации p97 также нарушает гомеостаз аминокислот и соотв., белковый синтез 171. Это еще больше подтверждает мнение, что одной из жизненно важных функций протеосом является рециклинг аминокислот.
Proteasome deregulation in ageing and disease
Протеосомы деградируют очень большие количества клеточных белков и тем самым контролируют многие клеточные процессы. Неудивительно, что дисфункция протеосом ассоциирует с разными болезнями.
Neurodegeneration
Дисфункция протеосом ассоциирует с широким кругом болезней. Неспособность деградировать аномальные, неправильно упакованные, мутантные или поврежденные белки приводит к их накоплению, которое может быть вредным для клеток. Накопление белков аномальной конформации в форме нерастворимых агрегатов является характерным для нейродегенеративных болезней153,172, подтверждая, что способность клеток нейтрализовать белки, склонные к агрегации, с возрастом снижается. В самом деле, хотя старение является многокомпонентной проблемой, снижение протеосомной деградации связано со старением (см. ссылки173-175).
Т.к. деградация белков играет критическую роль в предупреждении накопления склонных к агрегации белков, то разумным бы было попытаться усилить способность клеток к деградации белков, это могло бы замедлить старение или нейродегенеративные болезни. Напр., усиление клеточной атрофической способности путем подавления mTOR1, привлекло много внимания 151. Поскольку белковые агрегаты, ассоциированные с нейродегенеративными болезнями слишком велики для деградации протеосомами. Однако, подавление TORC1 усиливает аутофагию и протеосомную деградацию 106,167. Поэтому было бы интересно оценить снова вклад протеосомной деградации о пользе ингибиторов TORC1. Также важно иметь в виду, что поскольку агрегаты белков могут быть слишком велики для деградации протеосомами, то предшественники этих агрегатов, мутантный huntingtin, α-synuclein и superoxide dismutase (SOD1), являются субстратами для протеосом 176. Т.о., усиление протеосомной деградации контролируемым способом для снижения накопления неправильно упакованных белков перед тем, как они сформируют крупные включения, является привлекательной возможностью. Ингибиторы ассоциированного с протеосомами DUB USP14, как полагают, может служить такой цели 85, хотя это служит предметом споров 177. Открытие новых узлов регуляции протеосомной деградации предоставит новые возможности для манипуляций с этой системой с терапевтическим потенциалом.
Targeting the proteasome in cancer
Старение также является огромным фактором риска рака178,179 благодаря зависимому от возраста накоплению геномных мутаций180. Такие мутации могут вызывать изменения с уровнях экспрессии белков и/или нарушения стохастического баланса в экспрессии субъединиц белковых комплексов. Это, в свою очередь может вызывать накопление неправильно упакованных белков или сверх продукцию белков, это могло бы объяснить. почему раковые клетки часто 'склонны' к обладанию высокими уровнями протеосом. Поэтому используются ингибиторы протеосом для лечения некоторых раковых опухолей180,181. Недавние успехи в использовании протеосомных ингибиторов для терапии рака рассмотрены в др. работах180,181.
Bortezomib стал первым протеосомным ингибитором, примененным в клинике и был использован для лечения множественной миеломы180,181. Хотя и обнаруживается определенный успех, часто возникают рецидивы, поскольку часто возникает резистентность к лечению. Т.о., понимание механизмов, лежащих в основе резистентности к ингибиторам протеосом стало областью интенсивных исследований. Интересно, что нокдаун RP субъединиц повышает резистентность к протеосомным ингибиторам182. В свете недавних находок, что клетки, приспособившие изобилие протесом к своим нуждам, позволяет предположить, что клетки адаптируются к снижению субъединиц RP путем индукции реакции. которая приводит к устойчивости к подавлению протеосом. Было бы интересно идентифицировать такие механизмы.
Несколько линий доказательств подчеркивают мнение, чт пертурбации сборки протеосом могут оказывать эффект на туморогенез. Это первое указание, полученное с помощью наблюдений, что два из 4-х RACs, p27 (известен также как PSMD9; Nas2 к дрожжей) и p28 (известен также как PSMD10; Nas6 у дрожжей), способствуют прогрессированию рака183-186. Напр., потеря p27 в клетках рака груди снижает клеточную резистентность к радиотерапии183,184, экспрессия согласуется с тем, что RACs регулируются разными стрессами97. Существует также сильная связь между RAC p28 и раком, при этом p28 считается онкобелком185,186. Роль p28 при раке обнаружена задолго до того, как была установлена его функция шаперона в сборке протеосом. Недавно было сообщено, что миссенс мутации клеточного опухолевого антигена p53 кооперируют с NRF2 в активации транскрипции протеосомных генов, а также генов, кодирующих RACs, приводя к более высоким уровням протеосомной активности187. Эти находки подкрепляют важность регуляции сборки протеосом в раковых клетках.
miR-101, которая целенаправленно воздействует на мРНК CP шаперона POMP, быстро снижает белок POMP, она является мощным опухолевым супрессором, который подавлен в разных раковых опухолях188. Функция опухолевого супрессора miR-101 полностью устраняется с помощью экспрессии резистентного к miR-101 POMP, демонстрируя, что целенаправленное воздействие на POMP необходимо для miR-101-обеспечиваемой опухолевой супрессии109. Удивительно, подавление POMP преодолевает резистентность опухолевых клеток к протеосомному ингибитору bortezomib109. Более того, независимо было показано, что избыточная экспрессия POMP в drug-naive клетках обеспечивает резистентность к bortezomib и ассоциирует с повышенными уровнями NRF2, который создает позитивную петлю обратной связи путем соединения с промотором POMP189. Kh./ возможный уровень вмешательства был идентифицирован с помощью димеризации избирательного пептидного ингибитора PAC3190, который обнаруживает долговременную цитотоксичность в клетках карциномы шейки матки человека191.
Т.о., подавление сборки протеосом может быть обещающей противоопухолевой стратегией. Вмешательство в сборку протеосом может быть ценной терапевтической стратегией по усилению протеосомной функции или в отдельности или совместно с существующими лекарствами, подавляющими каталитическую активность протеосом, таких как bortezomib.
Conclusions and perspectives
The identification of proteasome assembly chaperones has revealed that proteasome assembly is a highly complex and tightly regulated process that is integrated with cellular metabolism via the stress and growth controller TORC1. The regulation of proteasome homeostasis is an emerging field of research, and it is likely that more nodes of regulation of proteasome assembly and activity remain to be elucidated. It is interesting to note that ribosome biogenesis requires more than 200 factors. By analogy, one might wonder how many more proteasome assembly factors remain to be discovered. As the proteasome has a crucial role in regulating cell function that is relevant to diseases, understanding and modulating assembly mechanisms could open up valuable therapeutic intervention opportunities relevant to diverse human age-related diseases, including cancer and neurodegeneration.
|
 Fig. 1: The ubiquitin-proteasome system.
Fig. 1: The ubiquitin-proteasome system.