Посещений: 
ТРАНСДИФФЕРЕНЦИРОВКА
Гепатоциты в холангиоциты
De novo formation of the biliary system by TGFβ-mediated hepatocyte transdifferentiation • Johanna R. Schaub,
• Kari A. Huppert,
• Simone N. T. Kurial,
et al.  • Nature volume 557, pages247–251 (2018) • doi:10.1038/s41586-018-0075-5
| |
|
В регенерирующих органах у взрослых животных дифференцированные клетки могут пополнять др. типы дифференцированных клеток с помощью трансдифференцировки, как в случае панкреатических островков10, желез желудка11, альвеол легких12 и кишечных крипт13. Действительно ли трансдифференцировка у млекопитающих может строить эти и др. структуры de novo неизвестно. В печени гепатоциты могут подвергаться дифференцировке в желчные протоки, чтобы сформировать реактивные мелкие протоки (ductules) у людей14-17 и животных при cholestatic повреждении печени3,-6,18-21. Однако, получаемые из гепатоцитов желчные клетки, обнаруживают неполную желчную и сохраняют остаточную гепатоцитарную дифференцировку, т.е. это не зрелые холангиоциты и возвращаются к своему исходному качественному состоянию после устранения повреждения3-6. Более того, происходящие из гепатоцитов мелкие протоки (ductules) не участвуют в дренировании желчи5. Эти находки согласуются с метаплазией, но не с трансдифференцировкой и возникают вопросы относительно их функциональной важности. Однако, все исследования пластичности гепатоцитов, проведенные на животных с полностью развитой желчной системой, у которых остаточные холангиоциты способны регенерировать поврежденные желчные протоки, по-видимому, указывают на недостаточность трансдифференцировки. Мы использовали мышей с отсутствием внутрипеченочной желчной системы.
В частности, мы использовали мышей, воспроизводящих печеночный фенотип, характерный для болезни ALGS людей, вызываемой нарушениями передачи сигналов NOTCH 22-24 в результате делеции floxed аллеля из NOTCH сигнального эффектора RBPJ и препятствующего компенсации 25, транскрипционного фактора HNF6 (известен также как ONECUT1) в предшественниках эмбриональной печени, используя Cre, экспрессирующийся с промотора albumin (Alb )2. Такие Alb-cre+/-Rbpjf/fHnf6f/f мыши являются сильно cholestatic, поскольку они лишены периферических желчных протоков (pBDs), веточек внутрипеченочного желчного древа при рождении, однако, более, 90% мышей выживают и формируют pBDs и функциональное желчное древо на postnatal day (P) 120 26 (Fig. 1a). Хотя Alb-cre +/-Rbpj f/fHnf6 f/f мыши имеют hilar bile ducts (hBDs), ствол желчного древа, мы полагаем, что новые pBDs возникают из гепатоцитов поскольку печень Alb-cre +/-Rbpj f/fHnf6 f/f мышей содержит гибридные клетки, экспрессирующие маркеры гепатоцитов и желчных клеток 2,26. Чтобы проверить эту гипотезу мы разработали отслеживание судьбы Cre-независимых гепатоцитов. Для этого мы активировали Flp-репортер (GFP) у R26ZG +/+ мышей специфически в гепатоцитах путем внутривенных инъекций вектора adeno-associated virus (AAV) serotype 8, экспрессирующего Flp с промотора transthyretin (Ttr) (AAV8-Ttr-Flp) (Fig. 1a and Extended Data Fig. 1a-g).
 Fig. 1: Hepatocytes can convert into peripheral cholangiocytes and form pBDs contiguous with preexisting hBDs.
a, De novo pBD formation and hepatocyte fate tracing in Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mice. Cells identified by dolichos biflorus agglutinin (DBA) lectin labelling and wsCK and GFP immunofluorescence. b, Immunofluorescence of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n?=?7). c, Biliary tree visualized by retrograde ink injection into the common bile duct of P30 (n=6), P120-P138 (n?=?6) and ?P334 (n?=?6) Alb-cre+/-Rbpjf/fHnf6f/f mice, and P30 (n=3) and P120-P138 (n=5) Rbpjf/fHnf6f/f mice. d, Maximum projection (top) and 3D reconstruction (bottom) of z-stack image of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n=2). e, Immunofluorescence and bright-field images of hepatocyte-fate-traced P468 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+mouse liver after retrograde ink injection into the common bile duct (>P334, n=3). Scale bars, 2 mm (c, P30, P395 left), 500 µm (c, P138 left), 250 µm (c, P138 right), 100 µm (b, c, P395 right, d, e, left), 25 µm (e, middle).
Fig. 1: Hepatocytes can convert into peripheral cholangiocytes and form pBDs contiguous with preexisting hBDs.
a, De novo pBD formation and hepatocyte fate tracing in Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mice. Cells identified by dolichos biflorus agglutinin (DBA) lectin labelling and wsCK and GFP immunofluorescence. b, Immunofluorescence of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n?=?7). c, Biliary tree visualized by retrograde ink injection into the common bile duct of P30 (n=6), P120-P138 (n?=?6) and ?P334 (n?=?6) Alb-cre+/-Rbpjf/fHnf6f/f mice, and P30 (n=3) and P120-P138 (n=5) Rbpjf/fHnf6f/f mice. d, Maximum projection (top) and 3D reconstruction (bottom) of z-stack image of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n=2). e, Immunofluorescence and bright-field images of hepatocyte-fate-traced P468 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+mouse liver after retrograde ink injection into the common bile duct (>P334, n=3). Scale bars, 2 mm (c, P30, P395 left), 500 µm (c, P138 left), 250 µm (c, P138 right), 100 µm (b, c, P395 right, d, e, left), 25 µm (e, middle).
Чтобы отслеживать гепатоциты во время формирования pBD, мы внутривенно вводили Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ мышам AAV8-Ttr-Flp на ст. P17, который появляется прежде, чем клетки начнут экспрессировать желчные маркеры на периферии печени2,26. На ст. P120, вновь сформированные pBDs, идентифицируются по широкому спектру (ws) иммунофлюоресценции cytokeratin (CK), при этом позитивные по GFP указывают на происхождение из гепатоцитов (Fig. 1a, b). Напротив, pBDs которые формируются нормально во время развития печени, у Cre-негативных потомков, оказывались негативными по GFP (Extended Data Fig. 2a, b). В большинстве pBDs у Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ мышей все клетки были позитивны по GFP, тогда как эффективность общего мечения периферических холангиоцитов составляла 39.2 ± 7.2% (mean ± s.e.m.); однако, это количество коррелировало с эффективностью мечения гепатоцитов (36.6 ± 4.8%; P=0.48, paired two-sided Student's t-test) (Extended Data Fig. 2c), указывая, что все периферические холангиоциты происходят из гепатоцитов. Мы также наблюдали происходящие из гепатоцитов периферические холангиоциты у мышей, у которых гепатоциты были мечены после отнятия от груди (P39) (Extended Data Fig. 2d, e). Эти результаты указывают на то, что гепатоциты могут формировать pBDs de novo.
Чтобы исследовать функцию происходящих из гепатоцитов pBDs (HpBDs), мы определяли действительно ли они встраиваются во внепеченочную желчную систему. На ст. P30, ретроградные инъекции чернил в общий желчный проток заполняли только hBDs, отражая сильно укороченное желчное древо, лишенное pBDs; однако, инъекции чернил на ст. P120 определялось желчное древо нормальных размеров, демонстрируя, что HpBDs соединены с hBDs (Fig. 1c). Трехмерная реконструкция (3D) конфокального изображения подтвердила, что HpBDs образуют непрерывные просветы с меченными dolichos biflorus agglutinin (DBA) hBDs (Fig. 1d and Supplementary Video 1). Соотв., HpBDs оказались эффективными в дренировании желчи, на это указывает нормализация сывороточных маркеров cholestasis (уровни общего bilirubin и alkaline phosphatase; Extended Data Fig. 3a-c) и повреждения гепатоцитов (уровни alanine aminotransferase и aspartate aminotransferase; Extended Data Fig. 3d, e) и исчезновение холеостазом вызываемого фиброза печени (Sirius red staining; Extended Data Fig. 3f). Немногие мыши, чторые продолжали иметь повышенные уровни сывороточного общего bilirubin и печеночного фиброза, показали обилие wsCK-позитивных гепатоцитов, но не HpBDs (Extended Data Fig. 3a, b, g). В противовес временным происходящим из гепатоцитов ductules, наблюдаемым у др. мышиных моделей, с холистатическим повреждением печени3-6, HpBDs оставались стабильными после момента, когда холестаз и повреждения печени были устранены и сохранялись всю жизнь (P334) (Fig. 1c, e). Эти результаты показывают, что HpBDs приобретают нормальную стабильную желчную функцию.
Мы также исследовали аутентичность и зрелость холангиоцитов, формирующих HpBDs. Клетки обладали acetylated tubulin-маркированные первичные реснички (Fig. 2a), указывая на переключение с гепатоцитов на холангиоциты 19, и somatostatin receptor 2 (SSTR2) (Fig. 2b), маркер желчной функции 27. Они также экспрессируют зрелые желчные маркеры epithelial cell adhesion molecule (EPCAM) и CK19 (Fig. 2c), экспрессия которых отсутствует или находится на низком уровне в желчных клетках, возникших в результате метаплазии гепатоцитов 3,5. Мы осуществили также RNA-sequencing (RNA-seq) анализ периферических холангиоцитов, происходящих из гепатоцитов, изолированных как EPCAM-позитивные DBA-негативные клетки с помощью FACS у >P115 Alb-cre +/-Rbpj f/fHnf6 f/f мышей (Extended Data Fig. 4a). Rbpj и Hnf6 отсутствовали в этих клетках (Extended Data Fig. 4b, c), это ожидалось, поскольку Alb-cre активен с эмбриональных предшественниках печени до того, как они выберут судьбу гепатоцитов или холангиоцитов 2,9. Анализ принципиальных компонентов показал, что происходящие из гепатоцитов кластеры периферических холангиоцитов близки обычным периферическим холангиоцитам из Cre-негативных собратьев, но не родительским гепатоцитам (Fig. 2d, e and Supplementary Table 1). Соотв., происходящие из гепатоцитов периферические холангиоциты экспрессировали нормальные уровни маркеров зрелых желчных клеток, которые фактически необнаружимы в желчных клетках после метаплазии гепатоцитов, индуцированной диетой с 3,5-diethoxycarbonyl-1,4-dihydrocollidine (DDC) 3, за исключением CFTR, который встречается в меньшем количестве в холангиоцитах, чем др. маркеры (Fig. 2f). Происходящие из гепатоцитов периферические холангиоциты экспрессируют также обычно используемые маркеры желчной дифференцировки 3,5,20,25,27,28 на нормальных или почти нормальных уровнях 3,29,30 (Fig. 2g and Extended Data Fig. 4d). Следовательно, периферические холангиоциты являются аутентичными и зрелыми периферическими холангиоцитами.
 Fig. 2: Hepatocyte-derived peripheral cholangiocytes are equivalent to normal mature peripheral cholangiocytes.
Fig. 2: Hepatocyte-derived peripheral cholangiocytes are equivalent to normal mature peripheral cholangiocytes.
a-c, Immunofluorescence of hepatocyte-fate-traced P120 Alb-cre+/?Rbpjf/fHnf6f/fR26ZG+/+mouse liver (n?=?3 each). acTUB, acetylated tubulin. Scale bars, 100?µm (c), 20?µm (a, b). d-g, RNA-seq analysis of normal peripheral cholangiocytes (pC; n?=?3 mice), hepatocyte-derived peripheral cholangiocytes (HpC; n?=?4 mice) and RBPJ- and HNF6-deficient hepatocytes (H; n?=?3 mice). d, Principal component analysis. e, Venn diagram showing the number of genes significantly differentially up- and downregulated in pC or HpC versus H. f, Heat maps of genes reflecting cholangiocyte differentiation, including genes lacking in DDC diet-induced hepatocyte-derived metaplastic biliary cells (top) and other marker genes (bottom). g, Heat maps of genes reflecting hepatocyte differentiation, including all differentially expressed cytochrome P450 (CYP) genes enriched in adult mouse liver (top) and other marker genes (bottom). One-way ANOVA, false-discovery rate (FDR)-corrected P??3 (e-g). Two-sided Student's t-test; bold genes P?
Затем мы установили, что HpBDs образуются при незначительной пролиферации и поэтому поликлональны, подтверждая тем самым что воротные (hilar) холангиоциты не вносят вклад в образование HpBD.
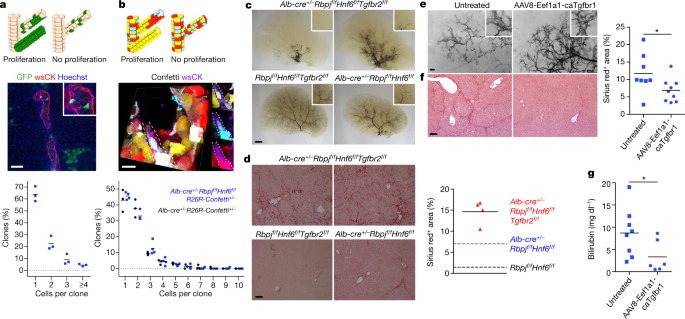 Fig. 3: HpBD formation entails little proliferation and is driven by TGFβ signalling.
Fig. 3: HpBD formation entails little proliferation and is driven by TGFβ signalling.
a, Possible outcomes, maximum projection image and size distribution of clones in hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mice (n=3). b, Possible outcomes, image stack volume projection and size distribution of clones in P150 Alb-cre+/?Rbpjf/fHnf6f/fR26R-Confetti+/? (n?=?4) and Alb-cre+/?R26R-Confetti+/? (n?=?3) mice. c, Ink visualization of biliary tree of?>P120 Alb-cre+/?Rbpjf/fHnf6f/fTgfbr2f/f (n?=?16), Rbpjf/fHnf6f/fTgfbr2f/f (n?=?4) and Alb-cre+/?Rbpjf/fHnf6f/f (n?=?1) mice. d, Sirius red staining with quantification in?>P120 Alb-cre+/?Rbpjf/fHnf6f/fTgfbr2f/f (n?=?4), Rbpjf/fHnf6f/fTgfbr2f/f (n?=?2) and Alb-cre+/?Rbpjf/fHnf6f/f (n?=?2) mice. Dotted lines represent the mean values of the indicated P120 mice from Extended Data Fig. 3f. e, f, Ink visualization of biliary tree and Sirius red staining with quantification in P100 Alb-cre+/?Rbpjf/fHnf6f/f mice that did (n?=?9) or did not (n?=?8) receive AAV8-Eef1a1-caTgfbr1. *P?=?0.045, two-sided Student's t-test. g, Serum total bilirubin in P36 Alb-cre+/?Rbpjf/fHnf6f/f mice that did (n?=?6) or did not (n?=?8) receive AAV8-Eef1a1-caTgfbr1. *P?=?0.047, two-sided Welch's t-test. Horizontal lines in a, b, d, f and gdenote mean values. Scale bars, 2?mm (c), 500?µm (e), 100?µm (d, f), 50?µm (a), 20?µm (b).
В отличие от HpBDs, мы обнаружили существенную пролиферацию из гепатоцитов произошедших реактивных ductules, которая обнаруживается у Alb-cre+/=Rbpjf/fHnf6f/fR26ZG+/+ мышей во время cholestasis (Extended Data Fig. 5b). Мы полагаем, что эти пролиферирующие клетки являются происходящими из гепатоцитов метапластическими желчными клетками3-6. В самом деле, мы установили, что 93.51±0.81% пролиферирующих желчных клеток, экспрессируют KI67 и osteopontin (OPN) иммунофлюоресценцию у Alb-cre+/-Rbpjf/fHnf6f/f мышей на пике холестаза (P54) и они были негативными по CK19 (Extended Data Fig. 5d). Мы также установили, что HpBDs после индукции холестатических повреждений печени, формируют реактивные ductules на 2 недели позднее, чем у Cre-негативных собратьев (littermates), эти в основном OPN-позитивные EPCAM-негативные клетки указывают на метаплазию гепатоцитов (Extended Data Fig. 5e). Эти результаты подтверждают, что передача сигналов NOTCH является важной для пролиферации холангиоцитов31, это объясняет нашу находку ограниченной роли пролиферации в формировании HpBD и подчеркивает аутентичность происходящих из гепатоцитов периферических холангиоцитов.
Как показывает отсутствие pBDs у Alb-cre+/=Rbpjf/fHnf6f/fR26ZG+/+ мышей (Fig. 1c), передача сигналов NOTCH необходима для развитие желчных протоков7-9, как же сигнальный путь управляет формированием HpBD при их отсутствии (Extended Data Fig. 4b, c). Мы сфокусировались на передаче сигналов TGFβ? которая способствует желчной дифференцировке и морфогенезу во время развития32, хотя она не существенна при развитии нормального желчного древа у мышей с отсутствием TGFβ type II receptor (TGFBR2) в предшественниках эмбриональной печени (Extended Data Fig. 6a). Мы полагаем, что передача сигналов TGFβ индуцируется в гепатоцитах Alb-cre+/=Rbpjf/fHnf6f/f мышей из-за парадоксальной роли HNF6 в развитии печени - он активирует желчные транскрипционные факторы HNF1β b SOX925,33, но подавляет TGFBR232,34. Подтверждена активная передача сигналов TGFβ в произошедших из гепатоцитов периферических холангиоцитах (Supplementary Table 1, down pC versus HpC). Более того, мы установили высокие уровни фосфорилирования SMAD3 (pSMAD3) в ядрах перипортальных эпителиальных печеночных клеток, позитивных по HNF1 и и в ядерных экстрактах печени Alb-cre+/=Rbpjf/fHnf6f/f мышей на ст. P60 (Extended Data Fig. 6b, c).
Мы показали, что TGFβ ингибитор SB-431542 блокирует дифференцировку желчных протоков и морфогенез гепатоцитов, лишенных RBPJ и HNF6 in vitro (Extended Data Fig. 6d-f). Более того, на ст. >P120, HpBDs всё ещё отсутствовали или были сильно укорочены и присутствовал фиброз печени у 14 из 16 Alb-cre+/=Rbpjf/fTgfbr2f/f мышей, которые подобно Alb-cre+/=Rbpjf/fHnf6f/f мышам были холестазными на ст. P34-P53 (Fig. 3c, d and Extended Data Fig. 6c, g). Мы внутривенно вводили P19-P24 Alb-cre+/=Rbpjf/fHnf6f/f мышам с помощью вектора AAV serotype 8, экспрессирующего непрерывно активный TGFBR1 с эукариотического промотора translation elongation factor 1α1 (Eef1a1) (AAV8-Eef1a1-caTgfbr1). На ст. P80-P100, 9 из 11 обработанных мышей имели взрослую иерархическую сеть желчных протоков, тогда как 9 из 9 необработанных мышей всё ещё имели незрелую гомогенную желчную сеть35 (Fig. 3e). Мы исключили возможрность, что AAV8-Eef1a1-caTgfbr1 является фиброгенным у Rbpjf/fHnf6f/f мышей (Extended Data Fig. 6h). Эти результаты указывают, что передача сигналов TGFβ служит движущей силой трансдифференцировки и морфогенеза HpBD.
Мы изучали, могут ли взрослые гепатоциты формировать HpBDs. Мы делетировали Rbpj и Hnf6 и активировали GFP в гепатоцитах на ст. P75 Rbpj f/fHnf6f/fR26ZG +/+ мышей путем совместной инъекции AAV8-Ttr-Cre и AAV8-Ttr-Flp и трансплантировали клетки спустя 1 неделю в P31 Alb-cre +/-Rbpj f/fHnf6 f/fRag2 -/-Il2rg -/- мышей (Fig. 4a). После P120, мы обнаружили происходящие из донорских гепатоцитов зрелые периферические холангиоциты в 5.2±0.8% портальных областей, содержащих донорские клетки (Fig. 4b). Мы также трансплантировали компетентные к передаче сигналов NOTCH гепатоциты дикого типа, которые продуцировали происходящие из доноров HpBDs в 78.3±13.9% таких портальных регионов поскольку 31.6±7.9% из трансплантированных клеток пролиферировали после трансдифференцировки в холангиоциты (Fig. 4a, c, d). Эти результаты показывают, что взрослые гепатоциты и трасплантированные гепатоциты реагируют на морфогенетические сигналы, вызывающие трансдифференцировку в печени, лишенной желчных канальцев, и формирование HpBDs.
 Fig. 4: Clinical relevance and therapeutic potential of HpBD formation.
Fig. 4: Clinical relevance and therapeutic potential of HpBD formation.
a, Experimental design for hepatocyte transplantation. b, Immunofluorescence of P127 mouse (n?=?5) transplanted with adult GFP-expressing RBPJ- and HNF6-deficient hepatocytes. c, Immunofluorescence of P152 mouse (n?=?4) transplanted with adult RFP-expressing hepatocytes. d, Immunofluorescence of liver of P72 mouse (n?=?2) transplanted at P43 with hepatocytes isolated from P287 Alb-cre+/?R26R-ZsGreen+/+ mouse. e, f, Immunohistochemistry (e) and immunofluorescence (f) of ALGS (n?=?2) and normal (n?=?1) human livers. Arrowheads indicate nuclear pSMAD3 in pBDs. Scale bars, 100?µm (b, c, e, f), 50?µm (d). Как показано на Fig. 4e TGFβ-обеспечиваемый механизм образования HpBD, идентифицированный у Alb-cre+/-Rbpjf/fHnf6f/f мышей активен также у пациентов с ALGS.
Итак, показав. что гепатоциты могут превращаться в зрелые холангиоциты и формировать функциональную и стабильную системы желчных протоков, наши находки подтвердили, что пластичность гепатоцитов не ограничивается метаплазией, но и задействует трансдифференцировку. Хотя воротные (hilar) холангиоциты присутствуют у наших мышиных моделей, они неспособны распространяться, приводя в результате к тяжелым cholestatic повреждениям печени и сильному давлению на гепатоциты, понуждающему к трансдифференцировке в периферические холангиоциты. Аналогично холангиоциты трансдифференцируются в гепатоциты только когда пролиферация гепатоцитов полностью подавлена37. Неспособность воротных холангиоцитов пролиферировать, по-видимому, вызывает высокий уровень передачи сигналов TGFβ в печение со стазом желчи в печени38. Соотв. мы идентифицировали передачу сигналов TGFβ как движущую силу трансдифференцировки гепатоцитов и формирования HpBD у модельных мышей и в принципе также у пациентов с ALGS. Напротив, для развития желчных протоков необходима передача сигналов NOTCH7-9. Используя клинически пригодные вектора AAV и трансплантации гепатоцитов, мы показали, что наши находки в принципе могут быть использованы для терапии ALGS и др. болезней, ассоциированных с отсутствием желчных протоков.
|
 Fig. 1: Hepatocytes can convert into peripheral cholangiocytes and form pBDs contiguous with preexisting hBDs.
a, De novo pBD formation and hepatocyte fate tracing in Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mice. Cells identified by dolichos biflorus agglutinin (DBA) lectin labelling and wsCK and GFP immunofluorescence. b, Immunofluorescence of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n?=?7). c, Biliary tree visualized by retrograde ink injection into the common bile duct of P30 (n=6), P120-P138 (n?=?6) and ?P334 (n?=?6) Alb-cre+/-Rbpjf/fHnf6f/f mice, and P30 (n=3) and P120-P138 (n=5) Rbpjf/fHnf6f/f mice. d, Maximum projection (top) and 3D reconstruction (bottom) of z-stack image of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n=2). e, Immunofluorescence and bright-field images of hepatocyte-fate-traced P468 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+mouse liver after retrograde ink injection into the common bile duct (>P334, n=3). Scale bars, 2 mm (c, P30, P395 left), 500 µm (c, P138 left), 250 µm (c, P138 right), 100 µm (b, c, P395 right, d, e, left), 25 µm (e, middle).
Fig. 1: Hepatocytes can convert into peripheral cholangiocytes and form pBDs contiguous with preexisting hBDs.
a, De novo pBD formation and hepatocyte fate tracing in Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mice. Cells identified by dolichos biflorus agglutinin (DBA) lectin labelling and wsCK and GFP immunofluorescence. b, Immunofluorescence of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n?=?7). c, Biliary tree visualized by retrograde ink injection into the common bile duct of P30 (n=6), P120-P138 (n?=?6) and ?P334 (n?=?6) Alb-cre+/-Rbpjf/fHnf6f/f mice, and P30 (n=3) and P120-P138 (n=5) Rbpjf/fHnf6f/f mice. d, Maximum projection (top) and 3D reconstruction (bottom) of z-stack image of hepatocyte-fate-traced P120 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+ mouse liver (n=2). e, Immunofluorescence and bright-field images of hepatocyte-fate-traced P468 Alb-cre+/-Rbpjf/fHnf6f/fR26ZG+/+mouse liver after retrograde ink injection into the common bile duct (>P334, n=3). Scale bars, 2 mm (c, P30, P395 left), 500 µm (c, P138 left), 250 µm (c, P138 right), 100 µm (b, c, P395 right, d, e, left), 25 µm (e, middle).  Fig. 2: Hepatocyte-derived peripheral cholangiocytes are equivalent to normal mature peripheral cholangiocytes.
Fig. 2: Hepatocyte-derived peripheral cholangiocytes are equivalent to normal mature peripheral cholangiocytes. Fig. 3: HpBD formation entails little proliferation and is driven by TGFβ signalling.
Fig. 3: HpBD formation entails little proliferation and is driven by TGFβ signalling.  Fig. 4: Clinical relevance and therapeutic potential of HpBD formation.
Fig. 4: Clinical relevance and therapeutic potential of HpBD formation.