Посещений: 
МОРФОГЕНЕЗ ЧЕРЕПНО-ЛИЦЕВЫХ СТРУКТУР
Роль механических воздействий
FACEts of mechanical regulation in the morphogenesis of craniofacial structures • Wei Du,
• Arshia Bhojwani &
• Jimmy K. Hu
International Journal of Oral Science volume 13, Article number: 4 (2021)
|
Учёные обнаружили, что на ранних этапах развития эмбриона лицо и мозг формируются в тесной связи друг с другом. Важно то, что это не влияет на поведение и особенности человека.
Кратко о работе учёных рассказывает Naked Science. Международная команда исследователей определила 76 генетических участков, которые одновременно влияют и на форму мозга, и на форму его лица.
Это они обнаружили по данные МРТ-сканирования мозга и генетической информации почти 20 тысяч людей. Также учёные доказали, что формирование мозга и лица происходит скоординировано.
При этом генетическая связь между лицом и формой мозга не оказала никакого влияния на поведенческие и когнитивные особенности человека. Не влияет она и на риск развития таких заболеваний, как болезнь Альцгеймера, шизофрения и биполярное расстройство. То есть новые данные учёных опровергают мифы о том, что лицо может рассказать о характере человека.
https://www.ferra.ru/news/techlife/
uchyonye-nashli-svyaz-mezhdu-licom-i-formoi-mozga-cheloveka-06-04-2021.htm
|
Голова позвоночных замысловатая и сложная часть тела животных, состоит из органов с разными функциями. Эти черепно-лицевые структуры, включая череп, сенсорные органы, нижнюю челюсть, temporomandibular joint (TMJ), нёбо, мышцы и зубы, все они сконструированы в соответствии с их уникальными формами и очертаниями, чтобы облегчить их функцию. Сложность формы черепно-лицевого скелета была прекрасно оценена ранними натуралистами, такими как Johann Wolfgang von Goethe (1749-1832), который предложил понятие "morphologie". 1 Исследования Goethe's морфологических свойств заложили основание для работ D'arcy Thompson, который формально установил роль физических правил в образовании формы биологических структур, таких как череп позвоночных во время развития и в ходе эволюции. 2 Сегодня спустя столетие после морфометрических исследований Thompson's, черепно-лицевые структуры с их разнообразными формами и архитектурой опять стали служить важной моделью для изучения процессов развития и событий клеточной биологии. С появлением новых способов изображений и биомеханических техник, мы получили возможность более глубокого понимания того, как механические силы и др. физические величины регулируют черепно-лицевой морфогенез. Эти исследования выявили взаимодействия между биохимическими и механическими сигналами во время формирования органов и предоставили целенаправленные пути и руководящие принципы для развития новой регенеративной стратегии.
Part I. Sources and transduction of mechanical signals during organ morphogenesis Морфогенез органов является физическим процессом, который интегрирует механическую и биохимическую информацию для регуляции скоординированных изменений клеточных свойств и поведения. 3,4 Существуют 4 основные категории механических импульсов во время развития: (1) тканевые изменения объема; (2) генерация клеточных сил с помощью цитоскелета; (3) крупно-масштабные силы от сокращений мышц; и (4) тканевые свойства материалов (Fig. 1).
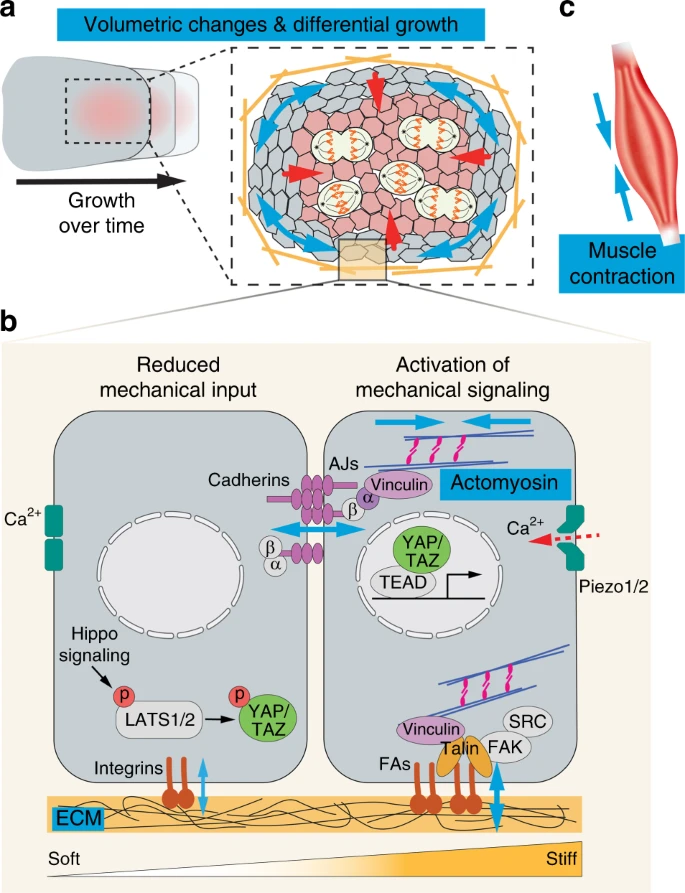
Fig. 1
Force generation and signal transduction. Organ morphogenesis is modulated by several different physical quantities: volumetric changes, actomyosin contractility, tissue material property, and muscle contraction. a Anisotropic distribution of proliferating cells within a tissue contributes to its directional growth. If the tissue surrounding the proliferating zone does not expand in the same rate, the proliferating zone will experience compression (red arrows); while the surrounding cells will experience tension (blue arrows). b Cells generate active forces via actomyosin contractility. Actin cytoskeletons are connected to adherens junctions (AJs) and focal adhesions (FAs), which are mechanosensitive and can mediate increased cell-cell and cell-extracellular matrix (ECM) adhesions, respectively upon increased actomyosin tension and/or substrate stiffness. Both cell adhesion and ECM composition help determine the tissue material properties. The Hippo/YAP/TAZ pathway can also respond to mechanical signals. When there is low mechanical input, the transcription cofactors YAP and TAZ are phosphorylated and restricted in the cytoplasm. When there is high mechanical input, YAP/TAZ are localized to the nucleus and bind to TEAD transcription factors to drive the expression of target genes. Finally, mechanical deformation of cell membranes open up the mechanosensitive Piezo 1 and Piezo 2 ion channels, leading to calcium (Ca2+) influx and activation of downstream signaling. c Muscle contraction generates large tissue forces that can impact morphogenesis of nearby musculoskeletal elements. Blue arrows represent force directions. α, α-catenin; β, β-catenin; FAK, focal adhesion kinase; p, phosphorylation
Differential tissue growth and volumetric changes В развивающемся органе клетки предшественники могут делиться, подвергаться апоптозу и меняться в размерах; всё это вносит вклад в общий рост ткани. Пространственно-временная регуляция этих процессов может поэтому приводить к дифференциальному росту и изменению формы. Напр. пространственно расположенная пролиферация обнаруживается на вентральном крае развивающегося opercle, дермальной косточки черепно-лицевого скелета рыбок данио и это негомогенное распределение делящихся клеток отвечает за "лепку" (sculpting) правильной формы кости.5 Сходным образом, во время формирования клюва птиц, существует зона локальной пролиферации в фронто-назальном отростке разных видов птиц, а пространственно-временной контроль локализации и размера этой зоны пролиферации прямо детерминирует форму клюва птиц.6 Дифференциальный рост затрагивает также тканевую механику. Т.к. количества клеток и объем ткани увеличиваются в пространстве, сдавливаемом окружающими накрепко соединенными клетками и/или внеклеточным матриксом (ECM), то расширяющаяся популяция д. испытывать повышенное давление (сдавливание) и растягивать окружающие клетки, которые будут испытывать повышенное натяжения7 (Fig. 1). Изменения этих сил, как было установлено, функционируют как механическая ответная реакция, чтобы в дальнейшем менять поведение клеток и индуцировать дифференцировку, пролиферации или перестройку клеток.8-13
Пролиферация может также возникать направленным (анизотропным) способом. Т.к. клетки часто делятся вдоль длинной оси элонгации ткани, так во время роста зачатка конечности позвоночных или крылового диска дрозофилы, ориентированные клеточные деления без сомнения вносят вклад в удлинение ткани. 14-16 Однако, ориентация делений может быть ответом клеток на рассеяние предсуществующие анизотропные стрессовые воздействия (силы) внутри ткани, 17 в противоположность непосредственным изменяющим форму движениям. В самом деле, рандомизированные клеточные деления не влияют существенно на морфогенез, как это было продемонстрировано на развивающихся крыловых дисках Drosophila и во время гаструляции рыбок данио. 18,19 В соответствии с этими находками, пролиферация сама по себе не может объяснить морфологические изменения в развивающихся зачатках конечностей позвоночных и нижнечелюстной дуге, 20,21 подчеркивая важность др. механических стимулов, таких как напряжения actomyosin и тканевые материальные свойства в регуляции морфогенеза органа.
Force generation by cytoskeletons Актиновые микрофиламенты и микротрубочки являются динамичными структурами цитоскелета и компонентами машинерии, генерирующей силы, которая превращает энергию с помощью гидролиза ATP или GTP в толкающие или контрактильные силы. Эти силы приводят в движение разные клеточные процессы, включая миграцию клеток, изменения клеточной формы и транспортации органелл. Толкающие силы возникают, когда эти филаменты полимеризуют стоящий напротив барьер, такой как клеточная или ядерная мембрана.22,23 Контрактильные силы преимущественно продуцируются за счет взаимодействий между актином и моторным белком, non-muscle myosin II (MyoII), когда активированный MyoII собирается в биполярные филаменты, которые поперечно связывают и заставляют скользить филаментозный актин в противоположных направлениях.24 Напряжение актомиозина является критическим для многих морфогенетических событий и пространственно-временного контроля за контрактильным аппаратом (machinery), а активность MyoII лежит в основе важного механизма для генерации анизотропных стрессов, необходимых для деформации клеток и морфогенеза развивающейся ткани.25,26 Одним из таких примеров является апикальное сужение во время инвагинации эпителия. Перед инвагинацией сигнальные импульсы организуют актомиозиновые кабели на апикальной стороне клетки в эпителиальном монослое и апикально активируемое MyoII-зависимое сокращение происходит посредством малых GTPase RhoA и Rho-associated coiled-coil kinase (ROCK), эффективно сокращающих апикальную поверхность клетки и управляющих прогибом эпителия.27,28 Такое управляемое актомиозином изменение формы участвует в вычленении хрусталика и плакод внутреннего уха, а также в образовании circumvallate сосочков языка.29-31 Поляризованная активность Rho и MyoII наблюдается также в ткаенях формирование паттерна которых происходит с помощью планарной клеточной полярности, как, напр., во время элонгации оси тела. В этом контексте, Rho киназа и активный MyoII концентрируются на клеточных соединениях перпендикулярно оси элонгации.32-34 В результате возрастает анизотропное натяжение актомиозина, которое укорачивает границу между клетками и это позволяет соседним клеткам интеркалировать в направлении сокращения границы, генерируя тем самым движение конвергентного вытягивания и элонгацию ткани.32-38
Изменение формы ткани, такое как управление апикальным сокращением и конвергентное удлинение, нуждаются в передаче и координации сил, продуцируемых индивидуальными клетками, на надклеточном уровне. В эпителии клетки, соединены др с др., посредством адгезивных белков, включая располагающийся в мембране E-cadherin и P-cadherin в слипчивых соединений (AJs). Цитоплазматические хвосты кадгеринов соединяются с β-catenin, который соединяет с актиновые филаменты с кадгеринами посредством α-catenin.39 Созревание AJs и их устойчивое прикрепление к актиновым кабелям являются чувствительными к механическим воздействиям. Силы растяжения, передаваемые посредством cadherins и actins выводят α-catenin из автоматически подавленного состояния, чтобы обеспечить открытую конформацию, которая позволяет присоединение vinculin; vinculin, в свою очередь, становится активированным, чтобы стабилизировать конформацию α-catenin и способствовать дальнейшей сборке актина на AJs.40-44 Одновременно клеточная контрактильность может менять функцию cadherin и целостность соединений.45-47 Механосенсорная функция AJs т.о. позволяет клеткам динамически реагировать и координировать механические силы над клеточным уровнем и настраивать адгезивные силы для моделирования ткани.
Помимо базирующейся на актине клеточной механики, силы, возникающие из не-центросомных микротрубочек также могут вносить вклад в морфогенетические изменения. Микротрубочки характеризуются своей высокой жесткостью при изгибе и способны выдерживать сжимающие напряжения для поддержания формы клеток. 48,49 Во время морфогенеза эпителия у Drosophila, сигналы клеточной полярности, как было установлено, реорганизуют апикально-базальное перераспределение или планарную ориентацию не-центросомных микротрубочек в эпителиальных клетках. Это делает возможной координацию на тканевом уровне анизотропных движущих сил, генерируемых за счет полимеризации микротрубочек или зависимого от dynein скольжения микротрубочек, чтобы модулировать клеточные формы и морфологию ткани в целом. 50,51 Помимо прямого механического контроля клеток, микротрубочки могут также косвенно влиять на механику ткани за счет транспортировки компонентов клеточной адгезии к регионам мишеням способствовать локальной активации MyoII , чтобы управлять формированием кластеров E-cadherin. 52,53 Интересно, что мутации в генах, кодирующих факторы, которые участвуют в сборке и динамике микротрубочек и могут затрагивать развитие некоторых- черепно-лицевых структур позвоночных и было бы желательно определить, действительно ли зависимая от микротрубочек механическая регуляция играет роль в этих процессах. 54-57
Forces from muscle contraction
Мышцы генерируют силы посредством скольжения актина и мышечных миозиновых филамент, и сил мышечного сокращения и составляют ключевые механические сигналы, чтобы регулировать морфогенез скелета, сухожилий, связок и соединений. 58 Исследования с использованием эмбрионов кур с химически парализованными мышцами и мышиные эмбрионы, несущие мутации, ингибирующие формирование мышц или сокращения продемонстрировали, что функциональная мускулатура необходима для поддержания собственно роста костей и округлой формы длинных костей, 59-61 для стимулирования увеличения костных гребней, к которым прикрепляются сухожилия, 62-64 для регуляции размера и развития сухожилий, 65,66 и для поддержания судьбы клеток предшественников суставов во время морфогенеза суставов. 67 Сходные результаты были получены в черепно-лицевой системе нескольких экспериментальных моделей. Напр., механические импульсы от мышц вносят вклад в становление видо-специфической формы нижней челюсти у птиц; 68 тогда как мышечные силы необходимы и для морфогенеза как фарингеальных хрящей, так и краниальных сухожилий у рыбок данио. 69,70 В согласии с этими находками у мышей и людей с мышечной дистрофией, уменьшается рост черепа и изменяются формы черепно-лицевого скелета, скорее всего, как результат ослабления жевательных мышц. 71-73 Сокращения, следовательно, являются интегральной частью морфогенеза и их функции частично регулируют клеточные перестройки или ремоделируют ECM. Напр., мышечные силы облегчают удлинение костей предоставляя возможность интеркаляции хондроцитов и генерируя тем самым укладывание клеток стопками во время роста кости. 69 На механические свойства развивающегося хряща могут также повлиять мышечные сокращения, т.к. сила натяжения может изменять состав ECM, контролируя уровень экспрессии коллагенов и протеогликанов из хондроцитов. 74,75 Наконец, во время развития хрящей мышечные силы могут непосредственно воздействовать на организацию ECM и стимулировать высвобождение активного Tgf β bp ECM? чтобы регулировать удлинение и разветвления сухожилий. 70
Material properties of developing tissues
Поскольку рост ткани и цитоскелеты продуцируют силы, которые делают возможными клеточные перемещения во время морфогенеза, то степень обеспечения клеточных перестроек и деформаций тканей ( т.e., rheological реакции на силы) зависит от свойств материала развивающейся ткани. Такие физические свойства, как жесткость и вязко-эластичность предопределяются с помощью биохимических и биомеханических состояний составляющих и окружающего их ECM. Пространственно-временная регуляция этих свойств тканевого материала, может поэтому руководить морфогенетическими событиями и различными клеточными процессами. Напр. ткани стремятся быть мягкими и схожими с жидкостью во время ранних ст. морфогенеза, но клетки постепенно увеличивают сетчатую структуру из актина и натяжение, это усиливает жесткость и поддерживает архитектуру созревающей ткани.76-78 Вязко-эластичность ткани в дальнейшем контролируется с помощью cadherin-зависимой адгезии, т.к. сильная межклеточная адгезия может увеличивать вязкость и приводить к пределу текучести ткани (делая её более твердой); тогда как уменьшение адгезии позволяет ткани становиться более текучей.79-81 В удлиняющейся ткани, такой как во время удлинения оси тела позвоночных, становление пространственного градиента cadherin-обусловленной вязко-эластичности т.о., проводит клетки предшественники через переход от жидкого к солидному состоянию, при этом клетки первоначально допускают перестройки и расширение ткани кзади в жидкость-подобном состоянии, но становятся постепенно зажатыми ("jammed") спереди, чтобы созранять архитектуру ткани.81,82 Такой механизм может подобным образом функционировать, чтобы управлять удлинением ткани во время черепно-лицевого развития, поскольку дифференциальная вязкость приводит к различиям в интеркаляции клеток, как это наблюдается по время элонгации нижней челюсти.21
ECM состоит из протеогликанов и фиброзных белков (напр., коллагенов, фибронектина и ламининов), и его состав и структура передают критическую биохимическую и механическую информацию для осуществления пролиферации клеток, их дифференцировки и перемещений во время развития. 83 Адгезия клеток с ECM и сигнальная трансдукция осуществляются в первую очередь посредством ECM белков соединяющихся с трансмембранными гетреодимерными интегриновыми рецепторами, которые являются частью focal adhesions (FAs). В зарождающихся FAs, talin соединяется посредством цитоплазматических хвостов субъединиц β-integrin с актиновым цитоскелетом. Подобно α-catenin в AJs, регуляция конформации и функции talin является механочуствительной. В ответ на оптимальную жесткость субстрата клетки могут развивать большие усилия в FAs за счет усиления актомиозиновой сократимости. Растягивающие силы в FAs затем растягивают талин и обнажают критические участки для связывания винкулина, что механически усиливает связь талин-актин и способствует созреванию FA. Активация интегрина 84,85 также рекрутирует фокальную адгезионную киназу (FAK) и SRC-киназу, а растягивающие усилия в FAs затем растягивают talin и открывают скрытые сайты для связывания vinculin, что усиливает механически сцепление talin-actin и способствует созреванию FA. 84,85 Активация integrin рекрутирует focal adhesion kinase (FAK) и SRC kinase, которые активируют нижестоящие передачи биохимических сигналов, чтобы регулировать организацию цитоскелета и экспрессию генов. 83 FAs, следовательно, позволяют клеткам ощущать и реагировать на механические свойства ECM, и, в свою очередь, клетки могут контролировать жесткость матрикса посредством сократимости актомиозина или посредство модулирования содержимого и поперечных связей ECM. 86 Один из примеров ECM-управляемого изменения тканевой формы является морфогенез ветвления подчелюстной железы. Некоторые исследования показали, что коллагены и фибронектин накаливаются в точках разветвления 87,88, где сигналы активации integrin посредством FAK и RhoA индуцируют сокращения актомиозина. 89,90 Это приводит к двум последствиям: Во-первых, это усиливает клеточную подвижность, чтобы облегчить ветвление; во-вторых, это реципрокно запускает дальнейшую сборку локального фибронектина для поддержания структуры разветвления и чтобы способствовать клеточной пролиферации. 56,89,90 ECM также может трансдуцировать механические силы ткани, напр., во время инициации миграции клеток цефалического нервного гребня. 91 В этом случае конвергентное удлинение головной мезодермы приводит к повышению плотности клеток и жесткости ткани. Эта информация затем транслируется посредством ECM, чтобы активировать передачу сигналов integrin/vinculin в лежащих поверх клетках нервного гребня и индуцировать их миграцию. ECM т.о., играет важные роли во время черепно-лицевого развития. Принимая во внимание, что ECM и передача сигналов integrin участвуют в морфогенезе некоторых черепно-лицевых структур , которые развиваются из инвагинирующего эктодермального эпителия, включая зубы, глазные, отические и обонятельные плакоды 92-98, вполне вероятно, что изменения механических свойств ECM модулируют поведение клеток, чтобы облегчить их эпителиальную инвагинацию в этих развивающихся органах.
Sensing and integrating mechanical information with biochemical signaling via the Hippo pathway and Piezo proteins Выше мы рассматривали роль передачи сигналов integrin в восприятии жесткости субстрата и затем превращения этой информации в биохимические сигналы, чтобы регулировать поведение клеток. Др. важным путем механотрансдукции нижестоящим FAs и AJs является передача каскада сигналов Hippo, которая контролирует транскрипцию генов путем регуляции активации и транслокации в ядро транскрипционных кофакторов Yes Associated Protein (YAP) и его паралога WW Domain Containing Transcription Regulator 1 (TAZ)99 (Fig. 1). Расположение YAP/TAZ в цитоплазме или ядре (и тем самым из транскрипционной функции) зависит от их состояния фосфорилирования. Когда путь Hippo активен, то некоторые события фосфорилирования приводят к активации LATS1 и LATS2 киназ, которые затем фосфорилируют YAP/TAZ по некоторым аминокислотным остаткам. Это удерживает YAP/TAZ в цитоплазме посредством связывания с белками, ассоциированными с адгезивными комплеексами, такими как 14-3-3 и angiomotin, и способствует деградации YAP/TAZ.100,101 Напротив, инактивация передачи сигналов Hippo позволяет не фосфорилированным YAP/TAZ накапливаться внутри ядра и действовать вместе с др. транскрипционными факторами, чтобы управлять экспрессией генов, которые регулируют пролиферацию и дифференцировку клеток. Необходимо отметить, что др. киназы, включая FAK и SRC, также могут непосредственно фосфорилировать YAP/TAZ,102,103 и разные сигнальные механизмы могут использоваться для контроля функции YAP/TAZ. Биохимически, talin-вызываемое натяжение, воспринимаемое в FAs, позволяет клеткам реагировать на жесткость субстрата и запускать зависимую от actomyosin активацию YAP.104,105 После привлечения integrin, FAK и SRC могут дополнительно передавать сигналы посредством PI3K, чтобы ингибировать LATS1/2 и индуцировать локализацию в ядре YAP.106 Силы, предаваемые посредством FAs также способны непосредственно деформировать ядро, делая возможным проникновение в ядро YAP через растянутые ядерные поры.107 Помимо FAs, AJs также являются важными местами для интеграции механических сигналов с передачей сигналов Hippo. Напр., при низкой плотности клеток, зависимое от натяжения рекрутирование LIM доменовых белков Jub (у Drosophila) или LIMD1 и TRIP6 (у млекопитающих) в AJs запускает формирование комплексов LATS1/2 на AJs, ингибируя тем самым функцию LATS1/2 и способствуя активности YAP.108,109 Путем анализа мышиных мутантов с орган-специфической делецией Yap, было показано, что YAP очень необходим для развития некоторых черепно-лицевых структур, включая краниальный нервный гребень, зубы и нёбо.110-112 Однако, действительно ли YAP опосредует механические сигналы, чтобы контролировать аспекты их формирования, еще предстоит исследовать.
Помимо клеточных соединений, механические силы также обнаруживаются чувствительными к механическим воздействиями ионными каналами, такими как белки семейства Piezo (Piezo1 and Piezo2), а мутации в Piezo2 известны как причина некоторых черепно-лицевых синдромов. 113 Функция Piezo белков обеспечивается реакцией на давление и механически деформированные клеточные мембраны, чтобы открывать их поры для притока положительно заряженных ионов, таких как Ca2+, которые в свою очередь активируют нижестоящую передачу Ca2+-зависимых сигналов. 114 Piezo каналы, т.о., позволяют клеткам в ткани ощущать напорные усилия (crowding forces) и контролировать плотность клеток посредством вытеснения клеток, 115 и модулировать пролиферацию и дифференцировку стволовых клеток в ответ на механические изменения в ткани. 116,117 Механочувствительность посредством Piezo белков также взаимодействует с передачей сигналов Hippo 21, но как эти пути координируются, чтобы вызывать специфические клеточные реакции во время развития - область будущих исследований.
Part II. Shaping craniofacial structures by forces and material properties Как механические силы и свойства тканей контролируют морфогенез органов и клеточную дифференцировку является важным вопросом и некоторые черепно-лицевые структуры послужили в качестве модели для исследований этих вопросов. Эти исследования привели к парадигме, что описываемая механическая регуляция разных морфогенетических событий, также как и интеграция биохимических сигналов обеспечивают эти процессы.
Mandibular arch Фарингеальные дуги являются временными метамерными структурами, состоящими из мезенхимной сердцевины и наружного одиночного слоя эпителия, которые формируются на каждой из сторон развивающеся головы у мышей примерно на день эмбриогенеза 8-8.5 (E8-8.5).118,119 Вместе с фронто-назальным выпячиванием в медиальном аспекте головы, эти структуры подвергаются интенсивному росту и морфологическим изменениям, чтобы в конечном итоге дать лицо и шею животных. Среди них первая фарингеальная дуга (также наз. нижнечелюстной дугой) подразделяется на дорсально расположенное верхнечелюстное выпячивание и вентрально расположенное нижнечелюстное выпячивание на ст. E9.5. Когда верхнечелюстной отросток позднее образует верхнюю челюсть и небо, то нижнечелюстной отросток становится предшественником нижней челюсти. Эпителий, ассоциированный с этими выпячиваниями, дает др. черепно-лицевые структуры, включая зубы и слюнные железы. Неправильное развитие нижнечелюстной дуги может вызывать многие черепно-лицевые аномалии с дефектами лица и нижней челюсти.120
Инициальный морфогенез нижнечелюстной дуги у мышей связан с элонгацией ткани и изгибанием в направлении срединной линии между E8.5 и E9.5. Во время элонгации нижнечелюстная дуга также приобретает морфологию, характеризующуюся узкой центральной средней частью и дистальным луковицеобразным регионом. Т.к. пролиферация клеток и жизнеспособность безусловно необходимы для роста дуги , 121-123, то как изменения объема ткани могут управлять её удлинением, изучено недостаточно. Однако, т.к. длина клеточного цикла одинаков во всей средней и дистальной части нижнечелюстного отростка, само по себе количество которых не отвечает за инициальный морфогенез нижнечелюстного выпячивания. 21 На уровне регуляции передачи сигналов, не-канонический Wnt лиганд Wnt5a, как было установлено, обязателен для роста инкапсулированной в эпителий мезенхимной ткани, такой как нижнечелюстная дуга и зачаток конечности. 124 Мутации в Wnt5a т.о., могут вызывать черепно-лицевые аномалии (и укороченные конечности) как у мутантных мышей, так и пациентов с синдромом Robinow. 125 Функционально, Wnt5a регулирует полярность клеток и контролирует направление клеточных перемещений и ориентированных клеточных делений, чтобы обеспечить удлинение ткани. 15,126,127 В центральном сегменте развивающегося нижнечелюстного отростка, Wnt5a действует, как стоящий выше YAP/TAZ и чувствительного к механическим воздействиям Ca2+ канала, Piezo1, чтобы индуцировать полярность актомиозина и осцилляции кортикального натяжения , как показано с помощью измерений генетически кодируемого vinculin tension sensor 21 (Fig. 2). Это снижение локальной тканевой вязкости и облегчает клеточные интеркаляции для осуществления конвергентного удлинения дуги. Средняя часть дуги, как полагают, более текучая "liquid-like". В дистальной части дуги, снижение клеточной перестройки жескости ткани, которое было продемонстрировано путем измерения смещения магнитных кусочков в средней и дистальной областях дуги с использованием магнитных щипчиков. 128 Кроме того, дистальная часть дуги экспрессирует более высокие количества fibronectin, который также обладает медио-латеральной угловой склонностью. Такая пространственная изменчивоть количества и ориентации в ECM может в принципе вносить дальнейший вклад в регуляцию свойств материала дуги и направленного перемещения клеток. 128
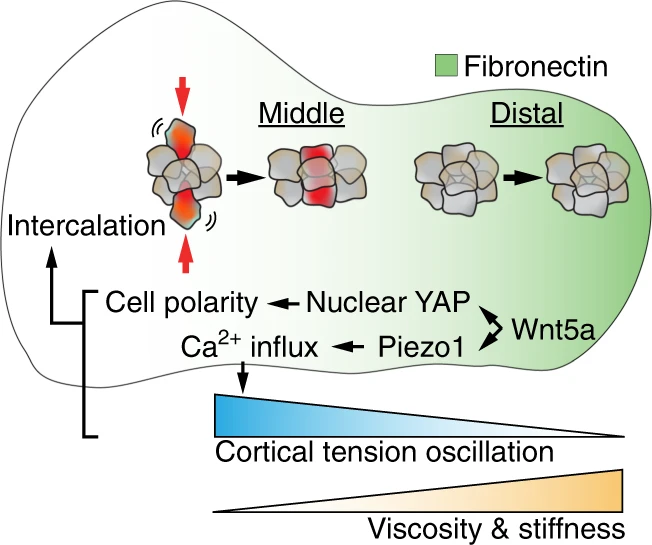
Fig. 2 Branchial arch elongation. In the developing mandibular arch, Wnt5a acts upstream of YAP and Piezo1 to control cell polarity and cortical tension oscillations in the middle segment of the arch. This results in increased cell intercalation and tissue fluidity, driving arch elongation. In comparison, the distal arch is stiffer as a result of reduced cell movement and increased deposition of fibronectin
Tooth Морфология зубов удивительно разнообразна у разных видов позвоночных, но их развитие у всех начинается с формирования dental lamina, которая различается по толщине эпителия рта, как мест будущих зубов. 129 У мышей развитие зубов начинается приблизительно на ст. E11, когда наслаивается dental lamina и инвагинирует, чтобы сформировать зубные плакоды. 130 Стратифицированный зубной эпителий затем растет далее в подлежащую, происходящую из нервного гребня мезенхиму и прогрессирует посредством все увеличивающихся сложных морфологических изменений в течение времени вплоть до прорезывания зубов. Отличия в форме зубного эпителия используются для наименования каждой ст. развития зубов : зачаток (E12.5-13.5), шапочка (cap) (E13.5-E15), колокол (E15-postnatal day 7) (Fig. 3). У взрослых поверхность коронок зубов из эмали, которая генерируется амелобластами, происходящими из зубного эпителия во время развития. Ниже эмали находится дентин, который откладывается одонтобластами, происходящими из нервного гребня, и заключает пульпу зуба и нейроваскулярные пучки в ней. 131 Поскольку зубы относительно простые структуры во время раннего развития и подходят для ex vivo получения вживую изображений, мышиные зубы стали прекрасной системой для изучения клеточного поведения и ассоциированных биомеханических импульсов, управляющих изгибанием эпителия. 132 это позволило открыть взаимодействия реципрокных передач сигналов между зубными эпителием и мезенхимой, 131 обеспечив исчерпывающее понимание того, как механические и биохимические сигналы работают сочетанно, чтобы регулировать клеточные движения, деления и выбор судеб во время развития зубов.
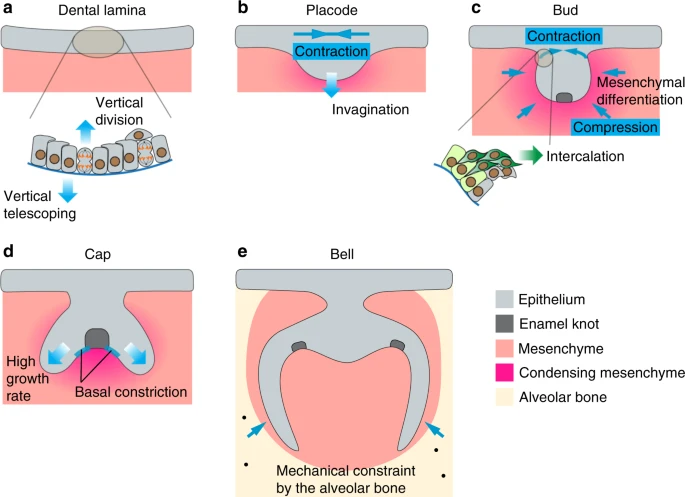
Fig. 3
Mechanical regulation of the developing molar. The tooth epithelium undergoes progressive shape changes during its development. a At the lamina stage, cells in the epithelial monolayer extend centripetally oriented protrusions to migrate vertically and push neighboring cells towards the mesenchyme (vertical telescoping). Concurrently, vertical cell divisions contribute to epithelial delamination and generation of suprabasal cells. b, c During the placode and bud stages, suprabasal cells organize their actomyosin cables in the planar orientation and cells (dark green) intercalate towards the center of the bud to generate planar contractile stresses. This mechanically seals the top of the tooth bud and facilitates epithelial invagination by bringing the connecting basal layer cells (light green) towards the center. Concomitantly, mesenchymal cells condense around the dental epithelium and increased compressive stress due to cellular crowding triggers mesenchymal differentiation. d The cap shape is postulated to arise as a result of differential tissue growth between the enamel knot (EK) and non-EK epithelium. Basal constriction has also been observed in basal cells neighboring the EK, potentially resulting in the upward buckling of those cells. e Mechanical constraints from the alveolar bones play a role in establishing the alignment offsets between the lingual and buccal cusps. Solid blue arrows represent force directions and gradient arrows represent cell or tissue movements
Подобно др. происходящим из эктодермы органам, зубной эпителий начинается как эпителиальный монослой, который сначала изгибается в направлении мезенхимы, а затем стратифицируется.133 поскольку апикальные сужения ответственны за изгибание некоторых эпителиальных органов,134 зубная плакода четко использует иной механизм, т.к. отсутствует апикальная локализация актомиозина и клетки имеют цилиндрическую форму без апикальных сужений.135 Вместо этого клетки зубного эпителия у мышей подвергаются процессу, наз. "vertical telescoping", когда клетки отсылают определенным образом ориентированные (centripetally) апикальные выпячивания, которые толкают своих центрально расположенных соседей и коллективно деформируют эпителий вниз.135 Формирование этих выпячиваний зависит от полимеризации и ветвления актина и нуждается как в hedgehog (Hh), так и в передаче сигналов fibroblast growth factor (FGF), т.к. химическое ингибирование любого из этих процессов уменьшает количества выпячиваний и устраняет инвагинацию эпителия. Тот же самый механизм таже делает возможной инвагинацию слюнных желез эпителиального монослоя.135 При развитии моляров инвагинации эпителия сопровождаются вертикальными клеточными делениями, чтобы продуцировать suprabasal клетки и функции передачи сигналов FGF, как необходимые сигналы для индукции клеточной пролиферации и стратификации эпителия.136 Увеличение объема ткани в suprabasal пространстве может теоретически вызывать давление, необходимое для будущего изгибания эпителия. Однако, чтобы направить это давление на управление лишь инвагинацией, необходимы физические барьеры, чтобы осуществлять апикально ограниченный прогиб ткани вверх. Это частично достигается с помощью планарно-ориентированного натяжения ткани в suprabasal клетках, которые обладают выраженными актомиозиновыми пучками на надклеточном уровне в том же самом направлении, что и натяжение.133 Доказательства тканевого натяжения были продемонстрированы с помощью серии экспериментов по механическому рассечению, в которых первоначально напряженные ткани должны были отпрянуть от точки разреза. Напр., после надреза, сделанного в середине молярного suprabasal слоя у мышей, разрезанные ткани отдергивались в противоположных направлениях и степень эпителиального изгиба снижалась, указывая на присутствие сократительных сил, облегчающих инвагинацию. Дополнением к этой находке стали надрезы, сделанные вне зубного эпителия, которые приводили к дополнительному изгибанию эпителия, поскольку suprabasal сокращения боле не оказывали сопротивления. Напротив, ели надрезы делались сначала в suprabasal слое, чтобы ослабить локальное натяжение, и которое сопровождалось боковым разрезом вне зубного зародыша, то отдергивания не наблюдалось. Сходным образом, если боковой разрез приходился на ткани, культивируемые в присутствии Blebbistatin, который подавляет функцию MyoII, то отдергивания также не наблюдается. Эти результаты показывают, что зависимые от актомиозина контракции эпителия являются обязательными для процесса инвагинации зубов.
По мере увеличения в объеме молярной плакоды и постепенной трансформации в форму зачатка, то части suprabasal слоя продолжают сужаться и формируют область шейки, которая соединяет зачаток с поверхностным эпителием. Полученные изображения вживую молярного зачатка у мышей показали, что это возникает в результате конвергентного удлинения типа клеточного движения.133 В этом контексте suprabasal клетки мигрируют в направлении центра плакоды и интеркалируют одна с др. В то же самое время базальные клетки по краю плакоды прикреплены к своим соседям и присоединены к соседним suprabasal клеткам посредством E-cadherin, тащат самих себя в направлении центра плакоды. В целом, эти движения генерируют, довольно сильную контракцию планарной ткани, которая не только уплотняет (seals) верхушку зубной плакоды, но и также толкает базальные клетки в район шейки в направлении др. др. вызывая её ущемление, эффективно управляя прогибом эпителия в направлении мезенхимы.
На E12.5 развития зубов у мышей зачаток зуба одновременно индуцирует подлежащую мезенхиму к конденсации. Мезенхимные клетки мигрируют в направлении инвагинирующего эпителия в ответ на дально-действующий химический аттрактант FGF8, испускаемый зачатком зуба, который также продуцирует SEMA3F, коротко-действующий отталкивающий сигнал, чтобы усиливать компакцию мезенхимы с помощью эпителия.137 Давление сжатия из-за тесноты клеток, как полагают, действует как механический сигнал, чтобы инициировать дифференцировку мезенхимных клеток, в результате сдавливания разделенная мезенхима нижней челюсти в культуре способствует экспрессии одонтогенных маркеров Pax9 и Msx1. Теснота клеток во время конденсации также модулирует состав ECM путем индукции экспрессии коллагена VI.93 Присутствие структурно организованного ECM безусловно важно для поддержания дифференцировки мезенхимы, т.к. химическое подавление lysyl oxidase, которая катализирует поперечные связи коллагена и тем самым регулирует жесткость ECM, приводит к уменьшению мезенхимной конденсации, а также к экспрессии Pax9.93 Следовательно, конденсацией вызываемая компрессия и изменения свойств ECM вносят вклад в регуляцию одонтогенеза. Остется неясным, действительно ли мезенхимные конденсации и связанные с этим свойства материала также создают механические сигналы, чтобы контролировать развитие лежащего поверх эпителия.
Переход эпителия от ст. зачатка к ст. шапочки между E13 и E13.5 у мышей совпадает с формированием зубного сигнального центра, известного как первичный enamel knot (EK).138,139 EK состоит из группы пост-митотических клеток, которые специализированы на секрецию сигналов, экспрессируют разные лиганды, включая sonic hedgehog (SHH), bone morphogenetic proteins (BMPs) и FGFs, которые поддерживают пролиферацию и непрерывное увеличение эпителия, окружающего EK (наз. cervical loop).140 Форма шапочки, как полагают, возникает в результате дифференциальной пролиферации между неделящимся EK и пролиферирующими соседними цервикальными петлями.141 Подтверждение этой идеи получено при отслеживании развития культивируемых моляров на слайдах, которые показали более высокие скорости роста в эпителии, соседствующем с EK, чем в самом EK.142 Компьютерное моделирование в комбинации с этими экспериментальными данными с учетом физических ограничений, касающихся менее пролиферативной мезенхимы и дифференциальной адгезии между мезенхимой и эпителием, предсказывают, что зачаток зуба, контролируемый этими факторами, чтобы обеспечить прогиб в презумптивной области цервикальной петли и рост вниз от этого места.142-144 Неожиданно химическое подавление клеточной пролиферации на культуральных срезах не препятствовало морфогенезу перехода зачаток-к-шапочке,145 , подтвердив, что поскольку дифференциальная пролиферация может вносить вклад в форму шапочки, она фактически не нужна для этого процесса. Независимые от пролиферации механизмы д. существовать, чтобы инициировать изменения формы при переходе bud-to-cap. Один из возможных механизмов, как полагают, базальные сужения клеток на любой из сторон от EK.145 Перед ст. шапочки myosin heavy chain IIB и actin пучки накапливаются на базальной поверхности клеток, которые соседствуют с формирующимся EK. Количественная оценка формы этих клеток в разные временные моменты развития между E13.5 и E15.5 у мышей далее показала, что они приобретают со временем пониженную толщину основания.145 Как результат, вполне возможно, что контракции напряженного актомиозина на базальной поверхности окружения EK и управляет эвагинацией внутреннего зубного эпителия прочь от мезенхимы, создавая тем самым форму шапочки. Однако, это нуждается в дальнейшем экспериментальном подтверждении. В том же исследовании было показано, что подавление передачи сигналов FAK устраняет переход bud-to-cap145 и тем самым вообще региональную активацию передачи сигналов integrin/FAK посредством взаимодействий между эпителием и мезенхимой, важных для оформления эпителия на этой ст. В то же самое время, принимая во внимание, что формирование EK зависит от α-catenin-обеспечиваемого подавления активности YAP,146 было бы интересно исследовать, как тканевые силы генерируются изменениями клеточной формы, такими как базальные контракции, описанные выше, регулируя локализацию YAP и активность по контролю дифференцировки EK.
Между ст. шапочки и колокола цервикальный шейки инвагинируют глубже в мезенхиму и это может механически воздействовать за счет актин-зависимой повышенной клеточной активности и ориентированных клеточных делений вдоль оси увеличивающегося эпителия.142 Во время ст. колокола развитие моляров мышей между E15.5 и E16.5, первичный EK подвергается апоптозу и формируются вторичные EKs.142,147-149 Вторичные EKs играют важную роль в предопределении местоположения зубных выступов и морфологии коронки у зубов со многими выступами.150 В зубах с одним выступом, таких как резцы, образуется только один EK. Механические сжатия от альвеолярной кости, которая окружает развивающиеся моляры, по-видимому, играет роль в становлении количества offsets (или их расположении) между языковыми и щечными выступами (cusps).151 Это происходит когда моляры мышей и полевок культивируются как ex vivo экспланты без окружающей кости, тогда они теряют свой offset паттерн, но могут его восстановить при боковом сжатии, накладываемом на них искусственным механическим сдавливанием. Томография мягких тканей также показывает, что морфология и рост моляров строго связаны с этими альвеолярными костями, подчеркивая одновременное развитие этих тканей и возможное механическое взаимное воздействие, обусловленное их тесной близостью. У diphyodont животных (животных, которые сначала имеют молочные зубы, которые позднее замещаются постоянными зубами), таких как миниатюрные свиньи, давление сжатия, обусловленное альвеолярной скованностью, также участвует в определении времени активации развития постоянных зубов из состояния ареста.152 Напряжение при сжатии генерируется в результате того, что молочные зубы растут быстрее, чем расширяются альвеолярные ложа и действуют как механический сигнал для индукции оси передачи сигналов integrin β1-ERK1-RUNX2 в соседнюю мезенхиму, которая в свою очередь содержит в подвешенном состоянии эпителий постоянных зубов в стадии ареста. Как только сдавливание прекращается после удаления зуба, передача сигналов integrin β1-ERK1-RUNX2 снижается и постоянные зубы начинают развиваться.
Эти исследования в целом подчеркивают важность тканевых сил во время морфогенеза зубов и подчеркивают необходимость учитывать эти механические факторы. Напр., разработка гидрогеля, который воспроизводит эластичный модуль зубной ткани, поддерживает формирование biomimetic зачатков зубов из первичных зубных клеток свиней. 153 Когда мы будем знать больше, как механические сигналы контролируют развития зубов, то будут предложены очень утонченные механические манипуляции на базе новых биоинженерных платформ с использованием фотохимии и оптогенетики, которые облегчат пространственно-временной контроль благодаря свойствам гидрогеля 154 и клеточным силам. 155 Путем воссоздания механических микроусловий и биохимических-механических сигнальных взаимодействий, наблюдаемых при развитии зубов, мы будем способны более точно управлять пролиферацией клеток зубных предшественников и дифференцировки в культуре и создании биоинженерных зубов правильной формы и архитектуры. Наконец, т.к. зубная мезенхима четко реагирует на механические сигналы, 137,156,157 то глубокое понимание механических модификаторов, влияющих на выбор ими решения, то потенциал будет реализован полностью путем создания базирующейся на стволовых клетках терапии и регенерации ткани.
Palate Нёбо формирует крышу рта млекопитающих и физически разделяет ротовую полость от носовой полости. Анатомически нёбо состоит из первичного и вторичного нёба; первичное нёбо соответствует треугольной области между резцовым отверстием и альвеолярным гребнем, окружающим верхние резцы, а вторичное нёбо представлено остатками твердой и мягкой пластинки сзади. первичное и вторичное нёбо имюет разное эмбриологическое происхождение. В то время как первичное нёбо происходит из фронто-назального выпячивания в ростральной передней части рта, вторичное нёбо развивается из выростов из ротовой поверхности парных верхнечелюстных отростков на каждой из сторон рта. Эти выросты в основном состоят из мезенхимы, происходящей из краниального нервного гребня и окружающего слоя ротового эпителия.158 У мышей выросты вторичного нёба становятся видимы примерно на ст. E11.5, отмечая начало палатогенеза. Между E11.5 и E13.5, половинки вторичного нёба увеличиваются в размере и сначала растут вертикально по отношению к нижней челюсти по сторонам языка, в то же время они обнаруживают стереотипическую морфологию, которая отличается вдоль передне-задней оси. С E13.5 по 14.5, развивающееся вторичное нёбо характеризуется подъемом нёбных створок и переориентацией их из вертикального в горизонтальное положение выше языка. Две нёбные створки затем растут в направлении др. др. и приходят в контакт по срединной линии. Оказывающиеся бок о бок эпителиальные выстилкизатем сливаются, чтобы сформировать эпителиальный шов по срединной линии (MES), который маркирует начало сливания нёбных половин приблизительно на ст. E14.75. MES постепенно дезинтегрируется и мезенхимные половинки нёба становятся единой структурой . В то же самое время вторичное нёбо сливается с первичным нёбом впереди и с носовой перегородкой спереди и дорсально, чтобы сформировать полностью нёбо на ст. E17.159 Т.о., развитие нёба связано с серией скоординированных тканевых перемещений и моделирований, которые достигают кульминации соединением первоначально разделенных тканей. Нарушение этого процесса может быть обусловлено мутациями или внешне-средовыми факторами, приводя к расщеплению нёба, одному из наиболее частых черепно-лицевых врожденных дефектов у людей.160 Напр., мутации в Tgfb3 или Irf6 затрагивают собственно распад MES и эпителиальную адгезию, приводя в результате к неспособности слияния нёба у людей и мышей.161-165 Фактически, мутации в Irf6 наиболее распространенная причина расщепления губы и/или нёба у людей.166
Множественные аспекты палатогенеза, как известно, нуждаются в скоординированной генерации сил на уровне клеток и тканей, чтобы направлять их перемещения (Fig. 4). Во время подъема нёбных половинок передние их части подвергаются быстрому маху вверх , приводящему половинки из их вертикального положения к горизонтальной позиции; тогда как медиальные и задние части нёбных половинок достигают подъема путем контролируемого тока и организации клеток, меняющих форму ткани. 167,168 Т.к. точный механизм остается неизвестным, многие физические свойства, такие как альтерации в плотности мезенхимных клеток, 169 региональные изменения пролиферации, 170 и ремоделирование ECM и цитоскелета, 171,172, как полагают, генерируют подъемные силы. Напр., у Osr2 нулевых эмбрионов мыши, у которых подъем створок задерживается, пролиферация редуцируется специфическим образом в медиальных половинах направленных вниз нёбных выростов. 170 Сходные фенотипы также наблюдались у мутантных эмбрионов с кондиционной делецией Fgfr1 в клоне краниального нервного гребня. 173 Снижение пролиферации в теории может нарушать горизонтальную экспансию нёбных половинок и влиять на увеличение анизотропного давления, которое управляет изменениями половинок. Др. возможный участник в подъеме нёбных половинок является ремоделирование ECM. Одним из основных компонентов ECM нёбных створок является гликозаминогликан hyaluronic acid (HA), которая составляет около 60% от массы ECM. 174 перед подъемом створок HA накапливается в небной мезенхиме и было предположено, что гидратация HA увеличивает объем ECM и создает давление, необходимое для подъема нёбных пластинок. 175,176 Эта идея недавно была подвергнута сомнению в экспериментах по подавлению синтеза HA особенно в мезенхиме створок посредством Osr2-Cre-обусловленной кондиционной делеции Has2 (кодирующего hyaluronic acid synthase 2). 177 У этих мутантов нёбные половинки были редуцированы в размере и испытывали задержку, но обеспечивали полный подъём половинок. Было также показано, что в то время как накопление HA необходимо от природы для экспансии небных половинок перед их подъемом, это не единственный источник генерации подъемных сил. Интересно, что эмбрионы с делецией Has2 в обеих половинках и нижнечелюстной мезенхиме или только в нижнечелюстной мезенхиме, обнаруживают гипоплазию нижней челюсти, а также неспособность к подъему половинок, это может быть устранено путем культивирования мутантной верхней челюсти без нижней челюсти и языка. 177,178 Следовательно, нижняя челюсть и язык также нуждаются в HA для их правильного морфогенеза, это собственно обеспечивает подъем нёбных половинок. Будучи аномальными эти структуры остаются физическими препятствиями и вторичным блоком для подъема половинок. Напротив, силы. генерируемые гидратацией HA в небных половинках могут помочь в преодолении инициальной блокады с помощью языка во время нормального палатогенеза, позволяя нёбу смещаться дорсальнее языка своевременным способом; хотя эти силы не нужны для действительного подъема половинок. 178,179
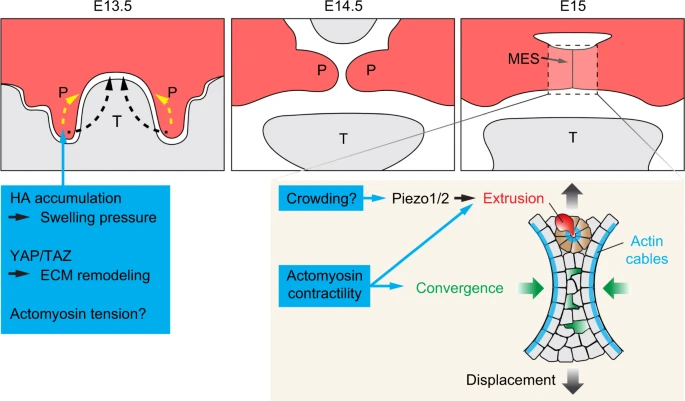
Fig. 4 Mechanical regulation of palatal shelf elevation and fusion. Palatal shelves elevate either through a swinging motion (black arrows) or cell reorganizations (yellow arrows). Increased hydration and ECM expansion due to hyaluronic acid (HA) accumulation in the mesenchyme, ECM remodeling, and actomyosin tension have all been postulated to provide the elevating forces. Palatal fusion takes place at the midline epithelial seam (MES). Actomyosin tension is required to promote epithelial cell convergence (green cells and arrows) towards the midline and the subsequent cell displacement (black gradient arrows) towards the periphery. Actomyosin contractility and signaling through Piezo1/2 facilitate the formation of cellular rosettes (brown cells) and cell extrusion (red cell), leading to the removal of MES cells. Lastly, the actin cables at the edge of the MES contract and contribute to MES breakage. P, palatal shelf; T, tongue
Организация коллагена также, по-видимому, важна для подъема нёбных половинок, т.к. делеция коллагенового crosslinker, lysyl oxidase-like 3 (LOXL3) приводит к неспособности подъема.180 Сходным образом, у мутантных эмбрионов мышей отсутствие кофакторов транскрипции YAP и TAZ в нёбной мезенхиме, приводит к задержке подъема и экспрессии Loxl4, который кодирует др. белок семейства lysyl-oxidase family, LOXL4, а также к задержке экспрессии коллагеновых белков.112 Эти результаты подчеркивают важность ремоделирования ECM во время палатогенеза, хотя механистическая регуляция остается важным открытым вопросом. Кроме того, принимая во внимание роль YAP/TAZ в механотрансдукции,104 оказывается вполне возможным, что YAP/TAZ могут быть частью механистической петли обратной связи, которая воспринимает и модулирует механические свойства развивающегося нёба. Необходимо отметить, что специфичная для хряща делеция Yap/Taz с использованием Col2a1-Cre также приводит к расщеплению нёба у мышей, возможно из-за уродливости хряща Meckel's , который предупреждает собственно опускание (descent) языка.181 Однако, т.к. активность Col2a1-Cre фактически обнаруживается в субнаборе мезенхимы в задней части нёба на ст. E12.5, а мутантные нёбные половинки неспособны к подъему и сливаются в культивируемых эксплантах всей верхней челюсти без нижней челюсти и языка,112 , поэтому функции нижней челюсти и языка по физическому блокированию подъема половинок нуждаются в дальнейшем исследовании. Наконец, помимо HA и коллагенов, некоторые и др. молекулы, ECM также, как было установлено, экспрессируются в ткани развивающегося нёба. Напр., Tenascin-C и Tenascin-W преимущественно экспрессируются в медиальной порции мезенхимы половинок перед их подъемом, в принципе внося вклад в дифференциальные механические свойства вдоль медио-латеральной оси ткани.171 Сеть tenascin также сопровождает актиновые пучки и длинную ось ядер, которая ориентирована в направлении nasomedial стенки поднимающихся средней и задней частей нёбных половинок. Эти наблюдения, т.о. подтверждают, что контрактильность актомиозина и свойства тканевого материала могут играть важную роль в формировании средней и задней частей нёбных половинок во время подъема. Будущие исследования определят функциональные потребности в базирующихся на актомиозине клеточных силах переориентации нёбных половинок и роль свойств тканевого материала в модуляции этого процесса.
Поскольку ECM играет важную роль во время подъема небных половинок, апоптоз и actomyosin-управляемая экструзия (выталкивание) клеток выступают как интегральная часть слияния нёбных половинок. В последнее время получена важная информация о клеточных процессах, облегчающих слияние нёбных половинок. Предложные три возможных механизма, управляющих распадом MES: (1) эпителиально-мезенхимный переход (EMT),182-185 (2) апоптическая гибель клеток,186-188 и (3) миграция клеток.189,190 Среди них апоптоз вообще-то, является одним из наиболее изученных механизмов удаления MES. Когда нёбные половинки приходят в контакт по срединной линии, то запускается апоптоз в MES и происходит передача сигналов ретиноевой кислоты и Tgfβ3, а также функционирует Irf6, которые являются критическими для индукции апоптоза в клетках MES и слияния нёбных половинок.187,191-194 В соответствии с этими результатами 45% из Bok-/-;Bax-/-;Bak-/- тройных нокаутных мышей имели прирожденно заблокированный апоптоз, приводящий к полному расщеплению нёба.195 Однако, слияние по MES специально не изучали, поэтому остались вопросы, действительно ли аномальный фенотип нёба вызван дефектами этой ступни палатогенеза или ткане-неавтономными эффектами.
Как тогда регуляция апоптоза интегрирована с клеточными процессами, которые управляют слиянием эпителиальных клеток во время формирования MES? Это частично достигается с помощью управляемых натяжением актомиозина клеточной конвергенцией и экструзией. Изображения вживую мутантных мышей с кондиционной делецией non-muscle myosin heavy chains IIA и IIB в эпителии нёба показали, что контрактильность актомиозина необходима для клеточных интеркаляций в направлении срединной линии, в результате смещаются клетки от центра первоначально мультислойного MES в направлении ротовой поверхности.196 Сходным образом, во время подавления MyoII вышестоящих регуляторов, ROCK и myosin light chain kinase (MLCK), в культуре эксплантов также блокирует клеточные взаимодействия и слияние нёбных половинок.196 Следовательно, натяжение актомиозина делает возможными скоординированные клеточные перестройки, способствующие истончению эпителия. Напротив, т.к. многие клетки сдвигаются в направлении периферии MES, они д. испытывать повышенную давку и д. активно выталкивать клетки из эпителия. В этом контексте зависимое от актомиозина формирование клеточных розеток облегчает экструзию как апоптических, так и жизнеспособных клеток, а механочувствительные Piezo ионные каналы, как было установлено, способствуют этому процессу, возможно в ответ на увеличение плотности клеток.196 Клеточные силы, генерируемые с помощью контракций актомиозина, поэтому являются критическими для слияния нёбных половинок на многих уровнях.
Позднее вследствие слияния вторичного нёба, давление, генерируемое сосанием детей, также связано с формированием временной хрящевой структуры, подобной ростовой пластинке в середине шва нёба, которая оссифицируется в первую очередь посредством внутримембранозной оссификации. 197 Используя моделирование конечных элементов, компьютерные паттерны генерируемые сосанием деформирующие и гидростатические напряжения в нёбе коррелируют с паттерном экспрессии хондрогенных генов. Кроме того, разные части структуры нёба обладают отличающимися механическими свойствами, 197 согласующимися с пространственно-временной регуляцией разных белков ECM во время паталогенеза. 172 Итак, было продемонстрировано, что силы разного типа и на разных шкалах регулируют многие аспекты развития нёба.
Jaw and temporomandibular joint (TMJ) Развитие нижней челюсти впервые обнаруживается, когда мезенхимные клетки, происходящие из краниального нервного гребня дифференцируются в хондроциты и формируют палочко-образный хрящ, известный как хрящ Meckel's примерно на ст. E12.5 у мышей.198 Meckel's хрящ затем увеличивается в длину на обоих концах хряща. В то же самое время мезенхимные клетки, соседствующие с хрящом Meckel's начинают конденсироваться и дифференцироваться в остеобласты, которы подвергаются внутримембранозной оссификации, чтобы сформировать ряд костных тканей, которые впоследствии накладываются поверх постепенно дегенерирующего Meckel's хряща. Функционально Meckel's хрящ, по-видимому, не нужен для первоначального формирования нижней челюсти, т.к. оссификация нижней челюсти происходит и в отсутствие Meckel's хряща, как у нулевых эмбрионов Sox9.199 Однако, мутантная Sox9 нижняя челюсть оказывается меньших размеров, указывая тем самым, что Meckel's хрящ может контролировать размер и форму нижней челюсти во время её развития.200 В соответствии с этим, пониженная механическая целостность деформированного Meckel's хряща у Ctgf нулевых мышей ведет к укорочению нижней челюсти.199
На проксимальном конце нижней челюсти TMJ связывается кость челюсти с височной костью черепа и это делает возможными движения и жевание. TMJ включает мыщелковую головку нижней челюсти и нижнечелюстную ямку на височной кости; обе возникают в результате эндохондральной оссификации. Фиброзный суставной диск подразделяет TMJ на два компартмента, разделяющие мыщелок и ямку. Развитие TMJ начинается на ст. E13.5, когда мезенхимные клетки конденсируются, чтобы сформировать бластему мыщелка и ямки височной кости, которые затем растут в направлении др. др. до тех пор, пока не образуется диск, разделяющий конденсаты на ст. E16.5. Вторичный хрящ мыщелка также соединяет развивающуюся нижнюю челюсть и продуцирует новые косточки, которые обеспечивают непрерывный рост нижней челюсти.
Подобно многим костям тела позвоночных морфогенез челюсти и TMJ тесно связан с функциями мышц. Поэтому не удивительно, что механические силы являются важными модификаторами развития нижней челюсти и морфологии у эмбрионов и постнатально в соответствии с правилом Wolff's,201, которое гласит, что форма и структура кости зависит от функциональных сил мышц. У эмбрионов мышей движение челюсти начинается на ст. E14 , а ограничение подвижности челюсти с помощью exo utero suturing челюсти на ст. E15.5 приводит к формированию более меньшего суставного диска и к более короткой, но толстой нижней челюсти на ст. E18.5 в результате снижения пролиферации предшественников хондроцитов и аномальной дифференцировки хондроцитов в TMJ и хряще мыщелка.202,203 Во время развития кости обратная связь между Indian hedgehog (Ihh) и Parathyroid hormone-related peptide (PTHrP) является центральной в регуляции пролиферации хондроцитов и их экспрессия подавляется в хряще мыщелка закрепленной нижней челюсти.204 Интересно, что экспрессия Ihh может быть индуцирована с помощью cyclic stress в культивируемых хондроцитах,205 подтверждая, что регуляция транскрипции Ihh является механочувствительной и может отвечать на механические стимулы, чтобы токо контролировать рост кости во время развития нижней челюсти. У рыбок данио, мышечные функции также оказываются сцеплены с развитием челюстного сустава, т.к. иммобилизация мышц посредством анестезии вызывает дисморфологию сустава челюсти, особенно в регионах высокого компрессирующего давления.206,207 В этом контексте передача сигналов Wnt активируется механическими стрессами и биохимически передает механические сигналы, чтобы регулировать пролиферацию, миграцию, интеркаляцию и клеточную морфологию хондроцитов , чтобы сформировать форму Meckel's хряща и челюстного сустава.208
Мышечные силы продолжают формировать очертания нижней челюсти и после рождения. Напр., размеры мышц и сила укуса связаны с изменениями формы нижней челюсти у людей, а у пациентов со сниженной функцией мышц развиваются изменения морфологии черепа,209 а пациенты с сниженной функцией мышц дают измененную черепно-лицевую морфологию.210 Сходным образом, снижение жевательной нагрузки у мышей путем кормления их жидкой пищей приводит к наследованию через поколение изменений формы нижней челюсти, хотя точный механизм неизвестен.211 В соответствии с этими наблюдениями изменения механических сил, оказываемых на нижнюю челюсть и мыщелковый хрящ путем питания животных жидкой пищей, уменьшает их зубы или принудительное открытие рта, влияют на биологию хондроцитов у нескольких разных модельных животных.212-218 Эти исследования показали, что механические усилия необходимы для осуществления пролиферации хондроцитов, поддержания адекватной дифференцировки и поддержка продукции ECM. Подобно развивающейся нижней челюсти, экспрессия Ihh также реагирует на механическую нагрузку в мыщелковом хряще взрослого человека,219, подчеркивая общий механизм, который способен продолжать адаптивные изменения в росте нижней челюсти, чтобы менять механическое окружение. Важно, т.к. первичные реснички, как было установлено, необходимы для активации передачи сигналов Ihh в ответ на гидростатическое сжатие в первичных эпифизарных хондроцитах220, поэтому первичные реснички существенны для коррекции развития TMJ,221 было бы интересно в будущем оценить действительно ли первичные реснички могут обеспечивать механические сигналы, чтобы контролировать пролиферацию хондроцитов в нижней челюсти.
Различия в механических нагрузках приводят в результате к дифференциальному паттерну мышц, что имеет и эволюционные последствия. Напр., при сравнении эмбрионов перепела и кур, относительно более крупные нижнечелюстные adductor мышцы у эмбрионов уток генерируют видо-специфические механические условия, которые передают сигналы посредством передачи сигналов FGF и TGF β, чтобы индуцировать образование специфичного для уток coronoid отростка для вставки adductor на кости нижней челюсти. 68,222 Др. пример, потеря суставного диска в TMJ у млекопитающих без потери зубов и соотв. изменений жевательных мышц. 223,224 У однопроходных, таких как утконос, примордиальный диск формируется, но остается незрелым и сходный фенотип наблюдается у мутантных мышей с сильно уменьшенной краниальной мускулатурой из-за делеции Tbx1 в мезодерме. 225 Как результат видо-специфические мышечные силы могут участвовать в эволюционных изменениях формирования диска в TMJs.
Cranium
Череп позвоночных состоит из свода черепа (или calvaria, включая frontal, parietal и occipital кости) и основание черепа (включая ethmoid, sphenoid, temporal и часть frontal и occipital кости), вместе эти кости покрывают и защищают головной мозг. Анатомия черепа и головного мозга хорошо подогнаны и приспособлены др. к др. в терминах объемов и форм, в результате скоординированного роста во время развития.226 В то время как головной мозг происходит из нейроэктодермы, кости черепа происходят из мезенхимных клеток, которые происходят или из краниального нервного гребня (напр., предшественники лобной кости) или головной мезодермы (напр., предшественники теменной кости).227 У эмбрионов мышей эти мезенхимные клетки начинают конденсироваться на ст. E12.5 и формируют рудименты лобной и теменной кости выше и позади глаз, соотв.228,229 Затем, рудименты свода черепа подвергаются экспансии в бок и вверх, как результат остеогенные предшественники мигрируют из зачатков костей.229,230 Кости свода черепа затем формируются благодаря процессу, известному как внутримембранозная оссификация, когда остеобласты в рудиментах далее дифференцируются и непосредственно откладывают матрикс, чтобы инициировать минерализацию костей без прохождения промежуточной хрящевой ступени.228 Увеличивающиеся кости свода черепа затем сближаются др. с др. В месте сближения фронта противостоящих остеогенных костей, содержащие остеогенные предшественники и вставленные недифференцированные мезенхимные клетки становятся формирующимся швом.231
В то время как головной мозг увеличивается в размере в ходе эмбионального и постнатального развития, свод черепа также соответственно увеличивается. Швы как фиброзные соединения между костями свода, остаются patent (или неслитыми) во время этого процесса и функционируют как активные места для формирования новой кости, это позволяет расширение свода черепа.232 У эмбрионов это достигается посредством поддержания пролиферации остеогенных предшественников в фронты костей свода черепа, которые могут генерировать новые остеобласты и присоединять добавляемые новые кости.233 У постнатальных животных, мезенхимный шов, как было установлено, содержит группу мезенхимных стволовых клеток, экспрессирующих Gli1, Prx1 и Axin2, а стволовые клетки шва ответственны за постнатальный рост и оборот свода черепа, а также за репарацию повреждений.234-236 Поддержание клеток швов в недифференцированном состоянии поэтому является критическим для одновременного развития черепа и головного мозга. Некоторые сигнальные пути, включая Fgf, BMP, Notch, Ephrin, Wnt и Hh, все являются ключевыми регуляторами этого процесса, а мутации генов, кодирующих компоненты пути приводят к патологическому слиянию швов или краниосиностозу, нарушению нормальной морфологии и развития как черепа, так и головного мозга.237,238
Помимо биохимических сигналов важно также учитывать роль тканевых механических сил по контролю раскрытого состояния (patency) швов и морфологии черепа (Fig. 5), принимая во внимание, что механические сигналы регулируют развитие костей и в др. местах. 239 Начиная со ст. E13 у мышей, свод черепа физически соединен с головным мозгом посредством твердой оболочки (dura mater) которая является частью мозговых оболочек. В то время как dura mater является источником секреции биохимических лигандов, чтобы контролировать как оссификацию, так и открытость (patency) швов, 240,241 она также может теоретически заставлять релейные механические силы, вызванные увеличением объема мозга, контролировать биологию вышележащих мезенхимных и костных клеток, как это первоначально было предположено Moss. 242 Идея заключается в том, что увеличение головного мозга внутри ограниченного пространства черепа может постепенно вызывать давление и деформировать ECM и клетки в развивающемся черепе, это д. ощущаться как деформация из-за растяжения (tensile strain) (главным образом quasi-static или очень медленно). В самом деле, измерения внутричерепного давления у мышей показало, что давление увеличивается с возрастом у постнатальных животных между P3 и P70 ,т.к. головной мозг увеличивается в размере. 243 Умеренное tensile strain присутствует как в твердой мозговой оболочке, так и швах, хотя оно снижается с возрастом преимущественно благодаря повышению жесткости швов. 244,245 у пациентов с гидроцефалией избыточное шунтирование спинно-мозговой жидкости может вызывать преждевременное слияние швов (синостоз) и, как полагают, это результат уменьшения внутричерепного давления и снижения tensile strain в швах. 246 Сходным образом, синостоз ассоциирует и с др. патологическими состояниями, такими как микроцефалия или внутроиматочное сжатие головы, 247 при этом давление на швы также , скорее всего,
снижено. Эти наблюдения т.о., указывают на то, что силы растяжения могут играть роль в регуляции развития свода черепа и слияния швов.
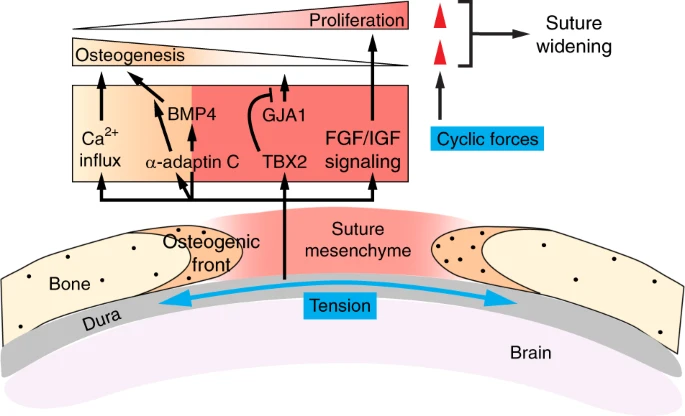
Fig. 5
Integration of mechanical and biochemical signals at cranial sutures. In the developing calvaria, mesenchymal cells in the suture midline are proliferative and give rise to osteoprogenitors and osteoblasts in the osteogenic front. The calvaria sits on top of the dura mater and experiences a quasi-static tensile strain (blue arrows) due to the expansion of the growing brain underneath and the intracranial pressure. Such force then signals through FGF and IGF signaling to maintain mesenchymal cell proliferation, as well as TBX2 to inhibit GJA1 and premature differentiation. In the osteogenic front, tensile forces signal through BMP4 and Ca2+ influx to promote osteogenesis. ?-adaptin C-dependent endocytosis also functions downstream of the tensile stress to promote osteogenic differentiation, possibly by enhancing BMP signals. Cyclic forces generated by masticatory muscle contraction promote both mesenchymal proliferation and osteogenic differentiation (red arrowheads), leading to suture widening
Большая часть нашего понимания того, как силы растяжения регулируют возникновение швов, исходит из экспериментов, связанных с воздействием эктопических сил с использование воздействия от спиральной пружины на экспансию швов в эксплантах свода черепа или непосредственно на кости черепа in vivo.248,249 Эти эксперименты показали, что клетки в швах могут реагировать на увеличение давления и ориентировать самих себя в направлении силы, а также менять свой потенциал пролиферации и дифференцировки, чтобы увеличивать кости. В этом контексте мезенхимные клетки швов испытывали повышенную пролиферацию в ответ на натяжение.250,251 Соотв. увеличивалась экспрессия Insulin-like growth factor I (IGF-1), его рецептора и рецепторов FGF в клетках срединного сагитального шва, вместе с усилением высвобождения белка FGF2 из шва, всё это указывает, что напряжение может контролировать пролиферацию клеток шва посредством передачи сигналов IGF и FGF 251-253 (Fig. 5). Силы натяжения индуцируют также экспрессию TBX2 в клетках срединного сагитального шва, где TBX2 может действовать, чтобы поддерживать недифференцированное состояние мезенхимных клеток и открытость шва путем подавления экспрессии белка щелевых соединений Connexin 43 (GJA1), который обычно способствует остеогенной дифференцировке.254,255 Напротив, силы натяжения способствуют экспрессии BMP4 в мезенхимных клетках и их дифференцировке в направлении клона остеобластов в качестве доказательства увеличения количества osteopontin (OPN)-экспрессирующих и osteocalcin (OCN)-экспрессирующих клеток, которые рекрутируются в места удлинения остеогенных фронтов кости.250,256,257 α-adaptin C, компонент комплекса adapter protein 2 (AP-2) для clathrin-зависимого эндоцитоза, был также найден активным в мезенхимных клетках и может играть роль в модуляции сигнальной трансдукции, чтобы способствовать остеогенной дифференцировке, т.к. блокирование эндоцитоза супрессирует силами натяжения индуцируемую дифференцировку остеобластов.258 В др. исследовании было показано, что натяжение швов приводит к немедленному притоку внутриклеточного Ca2+ .253 Т.к. функциональное значение изменения концентрации Ca2+ остается неясным в этом контексте, но приток Ca2+ приводит к дифференцировке остеобластов в др. месте.259,260 Поскольку кондиционная делеция механо-чувствительного Ca2+ ионного канала Piezo1 в остеобластах вызывает неполное закрытие черепных швов,261 , то можно предположить, что тканевые силы могут передавать сигналы посредством Piezo1 , а его нижестоящая Ca2+-зависимая передача сигналов регулирует клеточную дифференцировку в швах. Однако, роль эндогенного напряжения (или сдавления) во время развития свода черепа и швов остается неясной.
Помимо quasi-static натяжения, рассмотренного выше, к костям черепа также прикрепляются мышцы, которые прикладывают силу циклическим способом, напр., во время кормления. В то время как некоторые данные подтверждают, что мышечные силы безразличны для формирования швов во время эмбрионального развития (и поэтому отличаются от синовиальных соединений, таких как TMJ, в этом отношении),262 мышечные нагрузки у постнатальных животных могут модулировать морфологию швов и их interdigitation паттерн. Напр., хирургическое удаление височной мышцы может вызывать снижение сложности interdigitations сагитального шва у крыс.263 Животные, прикладывающие меньше жевательных сил или из-за приема щадящей диеты или в результате отсутствия прорезывания зубов, а иногда и синостоза.264,265 Напротив, если сила укуса увеличивается, как у Gdf-8 нулевых мышей, которые теряют ингибитор миогенеза myostatin и формируют достоверно более крупные челюстные мышцы, то обнаруживается повышенная сложность швов.266 У тех же самых мутантов, наблюдаются также зависимые от возраста изменения в морфологии свода черепа, подтверждающие, что мышечные силы могут ремоделировать кости свода черепа.267,268 Чтобы специфически исследовать эффекты циклических сил на развития черепа, проведена серия экспериментов путем прикладывания эктопических растягивающих или компрессивных сил к животным каждый день.269-274 Животные, получающие статическую нагрузку, циклические усилия, независимо от растяжения или сжатия, вызывали расширение швов, повышая количество клеток в швах и усиливая остеогенез.269,273 Циклические усилия также запускали экспрессию matrix metalloproteases MMP-1 и MMP-2 в швах, что было важно для минерализации костей, а также развития лица, черепа и швов.271,275 Интересно, что клетки, изолированные из швов, новорожденных крыс были механочувствительными к циклическим растяжениям в культуре и обнаруживали повышенный остеогенез с активацией экспрессии RUNX2 и OPN.276 Программа такой механически индуцируемой остеогенной дифференцировки зависит от активности ROCK, которая способствует локализации в ядре TAZ и последующей активации им экспрессии Runx2. Вполне возможно, что тот же самый путь механотрансдукции может отвечать за передачу механических сигналов in vivo, чтобы регулировать остеогенез в швах. Кроме того, из-за актомиозинового растяжения и локализации TAZ возможна модуляция с помощью жесткости субстрата,104 и более жесткий субстрат способствует дифференцировке клеток швов,277 и это может быть важным для будущего понимания того, как тканевые силы ремоделируют состав и жесткость ECM швов и как изменяются в швах свойства материалов, модулирующие изменения в передаче сигналов, включая те, что обеспечиваются путем передачи сигналов Hippo и ионными каналами Piezo, чтобы контролировать дифференцировку клеток швов.
|
 Fig. 1
Force generation and signal transduction. Organ morphogenesis is modulated by several different physical quantities: volumetric changes, actomyosin contractility, tissue material property, and muscle contraction. a Anisotropic distribution of proliferating cells within a tissue contributes to its directional growth. If the tissue surrounding the proliferating zone does not expand in the same rate, the proliferating zone will experience compression (red arrows); while the surrounding cells will experience tension (blue arrows). b Cells generate active forces via actomyosin contractility. Actin cytoskeletons are connected to adherens junctions (AJs) and focal adhesions (FAs), which are mechanosensitive and can mediate increased cell-cell and cell-extracellular matrix (ECM) adhesions, respectively upon increased actomyosin tension and/or substrate stiffness. Both cell adhesion and ECM composition help determine the tissue material properties. The Hippo/YAP/TAZ pathway can also respond to mechanical signals. When there is low mechanical input, the transcription cofactors YAP and TAZ are phosphorylated and restricted in the cytoplasm. When there is high mechanical input, YAP/TAZ are localized to the nucleus and bind to TEAD transcription factors to drive the expression of target genes. Finally, mechanical deformation of cell membranes open up the mechanosensitive Piezo 1 and Piezo 2 ion channels, leading to calcium (Ca2+) influx and activation of downstream signaling. c Muscle contraction generates large tissue forces that can impact morphogenesis of nearby musculoskeletal elements. Blue arrows represent force directions. α, α-catenin; β, β-catenin; FAK, focal adhesion kinase; p, phosphorylation
Fig. 1
Force generation and signal transduction. Organ morphogenesis is modulated by several different physical quantities: volumetric changes, actomyosin contractility, tissue material property, and muscle contraction. a Anisotropic distribution of proliferating cells within a tissue contributes to its directional growth. If the tissue surrounding the proliferating zone does not expand in the same rate, the proliferating zone will experience compression (red arrows); while the surrounding cells will experience tension (blue arrows). b Cells generate active forces via actomyosin contractility. Actin cytoskeletons are connected to adherens junctions (AJs) and focal adhesions (FAs), which are mechanosensitive and can mediate increased cell-cell and cell-extracellular matrix (ECM) adhesions, respectively upon increased actomyosin tension and/or substrate stiffness. Both cell adhesion and ECM composition help determine the tissue material properties. The Hippo/YAP/TAZ pathway can also respond to mechanical signals. When there is low mechanical input, the transcription cofactors YAP and TAZ are phosphorylated and restricted in the cytoplasm. When there is high mechanical input, YAP/TAZ are localized to the nucleus and bind to TEAD transcription factors to drive the expression of target genes. Finally, mechanical deformation of cell membranes open up the mechanosensitive Piezo 1 and Piezo 2 ion channels, leading to calcium (Ca2+) influx and activation of downstream signaling. c Muscle contraction generates large tissue forces that can impact morphogenesis of nearby musculoskeletal elements. Blue arrows represent force directions. α, α-catenin; β, β-catenin; FAK, focal adhesion kinase; p, phosphorylation
 Fig. 2 Branchial arch elongation. In the developing mandibular arch, Wnt5a acts upstream of YAP and Piezo1 to control cell polarity and cortical tension oscillations in the middle segment of the arch. This results in increased cell intercalation and tissue fluidity, driving arch elongation. In comparison, the distal arch is stiffer as a result of reduced cell movement and increased deposition of fibronectin
Fig. 2 Branchial arch elongation. In the developing mandibular arch, Wnt5a acts upstream of YAP and Piezo1 to control cell polarity and cortical tension oscillations in the middle segment of the arch. This results in increased cell intercalation and tissue fluidity, driving arch elongation. In comparison, the distal arch is stiffer as a result of reduced cell movement and increased deposition of fibronectin  Fig. 3
Mechanical regulation of the developing molar. The tooth epithelium undergoes progressive shape changes during its development. a At the lamina stage, cells in the epithelial monolayer extend centripetally oriented protrusions to migrate vertically and push neighboring cells towards the mesenchyme (vertical telescoping). Concurrently, vertical cell divisions contribute to epithelial delamination and generation of suprabasal cells. b, c During the placode and bud stages, suprabasal cells organize their actomyosin cables in the planar orientation and cells (dark green) intercalate towards the center of the bud to generate planar contractile stresses. This mechanically seals the top of the tooth bud and facilitates epithelial invagination by bringing the connecting basal layer cells (light green) towards the center. Concomitantly, mesenchymal cells condense around the dental epithelium and increased compressive stress due to cellular crowding triggers mesenchymal differentiation. d The cap shape is postulated to arise as a result of differential tissue growth between the enamel knot (EK) and non-EK epithelium. Basal constriction has also been observed in basal cells neighboring the EK, potentially resulting in the upward buckling of those cells. e Mechanical constraints from the alveolar bones play a role in establishing the alignment offsets between the lingual and buccal cusps. Solid blue arrows represent force directions and gradient arrows represent cell or tissue movements
Fig. 3
Mechanical regulation of the developing molar. The tooth epithelium undergoes progressive shape changes during its development. a At the lamina stage, cells in the epithelial monolayer extend centripetally oriented protrusions to migrate vertically and push neighboring cells towards the mesenchyme (vertical telescoping). Concurrently, vertical cell divisions contribute to epithelial delamination and generation of suprabasal cells. b, c During the placode and bud stages, suprabasal cells organize their actomyosin cables in the planar orientation and cells (dark green) intercalate towards the center of the bud to generate planar contractile stresses. This mechanically seals the top of the tooth bud and facilitates epithelial invagination by bringing the connecting basal layer cells (light green) towards the center. Concomitantly, mesenchymal cells condense around the dental epithelium and increased compressive stress due to cellular crowding triggers mesenchymal differentiation. d The cap shape is postulated to arise as a result of differential tissue growth between the enamel knot (EK) and non-EK epithelium. Basal constriction has also been observed in basal cells neighboring the EK, potentially resulting in the upward buckling of those cells. e Mechanical constraints from the alveolar bones play a role in establishing the alignment offsets between the lingual and buccal cusps. Solid blue arrows represent force directions and gradient arrows represent cell or tissue movements  Fig. 4 Mechanical regulation of palatal shelf elevation and fusion. Palatal shelves elevate either through a swinging motion (black arrows) or cell reorganizations (yellow arrows). Increased hydration and ECM expansion due to hyaluronic acid (HA) accumulation in the mesenchyme, ECM remodeling, and actomyosin tension have all been postulated to provide the elevating forces. Palatal fusion takes place at the midline epithelial seam (MES). Actomyosin tension is required to promote epithelial cell convergence (green cells and arrows) towards the midline and the subsequent cell displacement (black gradient arrows) towards the periphery. Actomyosin contractility and signaling through Piezo1/2 facilitate the formation of cellular rosettes (brown cells) and cell extrusion (red cell), leading to the removal of MES cells. Lastly, the actin cables at the edge of the MES contract and contribute to MES breakage. P, palatal shelf; T, tongue
Fig. 4 Mechanical regulation of palatal shelf elevation and fusion. Palatal shelves elevate either through a swinging motion (black arrows) or cell reorganizations (yellow arrows). Increased hydration and ECM expansion due to hyaluronic acid (HA) accumulation in the mesenchyme, ECM remodeling, and actomyosin tension have all been postulated to provide the elevating forces. Palatal fusion takes place at the midline epithelial seam (MES). Actomyosin tension is required to promote epithelial cell convergence (green cells and arrows) towards the midline and the subsequent cell displacement (black gradient arrows) towards the periphery. Actomyosin contractility and signaling through Piezo1/2 facilitate the formation of cellular rosettes (brown cells) and cell extrusion (red cell), leading to the removal of MES cells. Lastly, the actin cables at the edge of the MES contract and contribute to MES breakage. P, palatal shelf; T, tongue  Fig. 5
Integration of mechanical and biochemical signals at cranial sutures. In the developing calvaria, mesenchymal cells in the suture midline are proliferative and give rise to osteoprogenitors and osteoblasts in the osteogenic front. The calvaria sits on top of the dura mater and experiences a quasi-static tensile strain (blue arrows) due to the expansion of the growing brain underneath and the intracranial pressure. Such force then signals through FGF and IGF signaling to maintain mesenchymal cell proliferation, as well as TBX2 to inhibit GJA1 and premature differentiation. In the osteogenic front, tensile forces signal through BMP4 and Ca2+ influx to promote osteogenesis. ?-adaptin C-dependent endocytosis also functions downstream of the tensile stress to promote osteogenic differentiation, possibly by enhancing BMP signals. Cyclic forces generated by masticatory muscle contraction promote both mesenchymal proliferation and osteogenic differentiation (red arrowheads), leading to suture widening
Fig. 5
Integration of mechanical and biochemical signals at cranial sutures. In the developing calvaria, mesenchymal cells in the suture midline are proliferative and give rise to osteoprogenitors and osteoblasts in the osteogenic front. The calvaria sits on top of the dura mater and experiences a quasi-static tensile strain (blue arrows) due to the expansion of the growing brain underneath and the intracranial pressure. Such force then signals through FGF and IGF signaling to maintain mesenchymal cell proliferation, as well as TBX2 to inhibit GJA1 and premature differentiation. In the osteogenic front, tensile forces signal through BMP4 and Ca2+ influx to promote osteogenesis. ?-adaptin C-dependent endocytosis also functions downstream of the tensile stress to promote osteogenic differentiation, possibly by enhancing BMP signals. Cyclic forces generated by masticatory muscle contraction promote both mesenchymal proliferation and osteogenic differentiation (red arrowheads), leading to suture widening