Трансплантация органов является окончательным вариантом лечения для пациентов, страдающих от неподдающихся лечению заболеваний. Однако донорских органов не хватает, и разрыв между доступными донорами и ожидающими реципиентами продолжает увеличиваться (Giwa et al., 2017). В 2017 году примерно 114 000 пациентов в Соединенных Штатах ожидали пересадки органов (Sykes and Sachs, 2019). В настоящее время в Соединенных Штатах в список на пересадку органов добавляется еще один человек каждые 10 минут, 17 человек умирают каждый день в ожидании доноPSCsих органов, и приблизительно 105 800 пациентов находятся в очереди на пересадку органов, согласно данным Управления медицинских ресурсов и администрации здравоохранения (HRSA). Чтобы преодолеть этот значительный кризис, исследователи изучают различные подходы, включающие прямую ксенотрансплантацию, органоиды, децеллюляризацию и рецеллюляризацию, а в последнее время - биоинженерию органов с использованием комплементации бластоцисты (BC). В зависимости от состояния здоровья пациента, пациент с рефрактерным заболеванием также нуждается в своевременном селективном подходе, таком как менее инвазивные варианты клеточной терапии или лечебная трансплантация органа, который может функционировать сразу после трансплантации. В этом отношении генерация целых органов с помощью метода BC имеет большие перспективы с готовым ресурсом (скот) для клеточной терапии и в качестве радикального варианта лечения для большинства неизлечимых заболеваний. Однако, несмотря на то, что BC становится потенциальным вариантом трансплантации органов, проблемы, связанные с масштабируемостью размеров органов, несовместимостью иммунной системы, долгосрочным поддержания, потенциальной эволюционной дистанции или нераскрытых механизмов между клетками донора и хозяина. Эти проблемы могут быть преодолены с помощью многогранного подхода, особенно путем заполнения
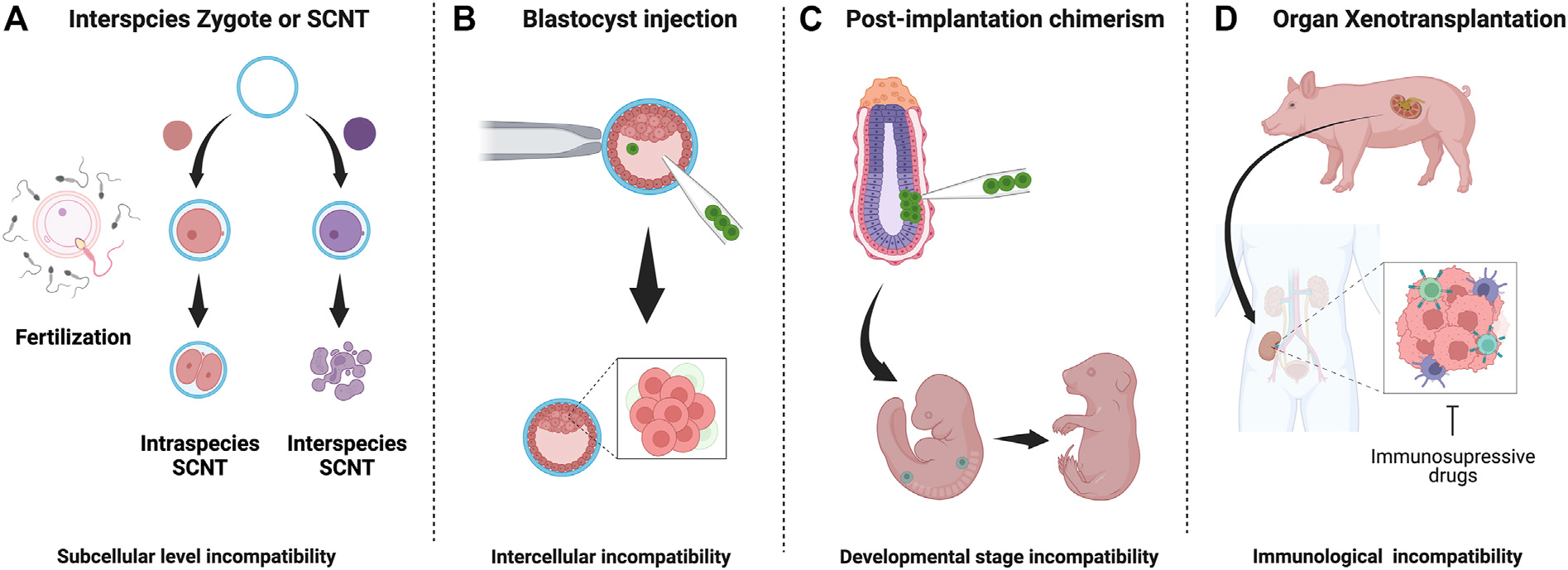
FIGURE 1
Interspecies embryo incompatibilities and barriers in interspecies chimerism: (A) Interspecies zygotes cannot reprogram and fail to develop due to
subcellular level incompatibilities (B) Cell competition eliminates less fit (donor) cells donor cells in host blastocyst (C) Stage-matching of donor cells is
challenging and unknown factor contribute to apoptosis of donor cells (D) Recipient immune system reacts strongly against graft tissue/organ. Despite longterm
immunosuppression, organ failure occurs. 2 Hybrids vs. chimeras
В древней истории люди использовали термин "chimera" для описания
мифических существ и гибридов. Животные, получившиеся половым путем в результате слияния гамет двух разных организмов, например, мулов, считаются "гибридами." С другой стороны, химера определяется как организм, в который были введены клетки из двух или более различных организмов, которые объединились. В природе гибриды и химеры встречаются редко из-за несовместимости и расхождения в развитии в ходе эволюции.
На организменном уровне эволюционное расстояние определяется гомологией геномных последовательностей между видами. Люди и другие виды, такие как мыши, свиньи, птицы и т.д., дивергировали друг от друг от друга. Молекулярная программа, которая формирует межвидовой барьер может быть независимой от эволюции всего генома. Вместо этого, она может зависеть от молекулярных сходств или различий между хозяином и донором, критических для программы органогенеза. Например, человеческий LIF белок может передавать сигналы через рецепторы LIF для поддержания высокой степени стволовости у мышей и крыс, но обратное действие неэффективно (Daheron et al., 2004). Как эволюционное расстояние влияет на образование гибридов и химер - это открытый вопрос, который может варьировать от от ситуации к ситуации.
3 Interspecies barriers in clone technologies via somatic cell nuclear transfer (SCNT)
В 1997 году было сделано прорывное открытие: овечка Долли. Долли была первым млекопитающим, клонированным из взрослой клетки с помощью переноса ядер соматических клеток (SCNT) (Wilmut et al., 1997). Это исследование доказало, что дифференцированная клетка способна производить точные копии своих исходных животных. SCNT была успешно применена для клонирования 24 видов млекопитающих, включая мышей, коров, свиней, кошек, крыс, собак и обезьян (Rodriguez-Osorio et al., 2012). Однако SCNTs оказались безуспешными в межвидовых попытках. Процесс был протестирован с помощью электрического слияния с использованием ядра соматической клетки донора в цитоплазму энуклеированной межвидовой яйцеклетки хозяина, но неудачно. Неудача, по-видимому, связана с перепрограммированием и уничтожением митохондрий донора митохондриями хозяина и неспособностью активировать программу эмбриогенеза донора после слияния (Chang et al., 2003; Chen et al., 2003; St John and Lovell-Badge, 2007; Jiang et al., 2011). Исследования межвидовых SNCT предполагают, что существуют критические межвидовые барьеры на субклеточном уровне тотипотентной зиготы, в отличие от межвидовых химер, которые находятся на межклеточном уровне (Рисунок 1А). Изучение межвидовых SCNTs, фокусируется на внутриклеточных компартментах, таких как межвидовой процесс перепрограммирования, конкуренция митохондрий между донором и хозяином, и стабильность генома после электрического слияния, может открыть новые пути для лучшего понимания субклеточных межвидовых барьеров в SCNT.
4 Interspecies barriers in chimeras
Область исследований химер возникла почти 50 лет назад, когда были проведены пионеPSCsие эксперименты с использованием смеси плюрипотентных стволовых клеток (PSCs) внутри- или межвидовым способом. Вкратце, клетки из рюкюской мыши (Mus caroli), при пересадке в бластоцисты домовой мыши (Mus musculus), показали очень высокий химеризм по сравнению с по сравнению с клетками, полученными из бластоцист крысы (Stanny et al., 1980). С другой стороны, клетки, полученные от банковской полевки (Clethrionomys glareolus), более эволюционно далекого грызуна от мышей, не показали никакого обнаруживаемого химеризма даже на поздних эмбриональных стадиях (Mystkowska, 1975). Подобные исследования также проводились у близкородственных видов млекопитающих, таких как овцы и козы. Комбинированные бластоцисты от козлов и
TABLE 1 Chimerism between various donor and host-derived organisms.
овцы могли успешно генерировать химеры козы и овцы (Fehilly et al., 1984). Аналогичным образом, химерные телята, полученные от двух близкородственных видов коров - Bos indicus и Bos taurus - также были жизнеспособны. (Williams et al., 1990). Эти ранние эксперименты позволили провести четкое различие между межвидовым и внутривидовым химеризмом. Другими словами, эволюционное расстояние между двумя видами может обратно коррелировать со степенью химеризма (de Los Angeles and Wu, 2022).
В данном разделе рассматриваются различные показатели образования межвидовых химер и химеризм в процессе развития. Частота образования химер характеризуется процентом животных-хозяев с донорскими клетками. Оценка образования химер требует проверки маркеров выживания донорских клеток, пролиферации и дифференцировки донорских клеток, а также доказательства того, что донорские клетки реагируют на программу развития животных-хозяев. Химеризм, с другой стороны, указывает на % вклада донорских клеток в определенную нишу развития или организма. В целом, эффективность внутривидового химеризма и образования химер значительно выше, чем межвидового (Таблица 1). Выяснение межвидовой барьерной несовместимости между животными-хозяевами и человеческими клетками во время развития является важным прорывом в в области создания человеческих органов у животных-хозяев.
4.1 Human chimeras in chick
Куриные модели обладают значительными преимуществами в изучении биологии развития и химеризма. Стадии развития стадии развития могут быть точно определены, а эмбрионами можно манипулировать для таких экспериментов, как пересадка тканей, резекция и генетическая модификация (Hamburger and Hamilton, 1951; Spurlin and Lwigale, 2013; Cloney and Franz-Odendaal, 2015). В ранних экспериментах с эмбрионами цыплят использовали внутривидовые химеры для проверки концепции "организатора" позвоночных и его роли в гаструляции, известной как эмбриональная дифференцировка. При пересадке в другой организм, часть клеток передней полоски от одного эмбриона давала начало эктопической нервной пластинке, состоящую из зачатков нервной трубки и хорды и сомитов. (Addington, 1932; Waddington and Schmidt, 1933; Waddington, 1934). Спустя десятилетия были получены первые доказательства птичьего межвидового химеризма было продемонстрировано Nicole le Douarin с коллегами, приживив клетки нервного гребня, полученные от перепелов, в область нервной пластинки эмбрионов цыплят (Couly and le Douarin, 1985). Эмбриональные стволовые клетки человека (hESC) пересаженные в ствол эмбриона цыпленка, также дифференцировались в β-III тубулин-положительные нейроны в микроокружении хозяина (Goldstein, 2010). Более того, нейрогенный потенциал hESC был протестирован на мутантных цыплятах, модели открытых дефектов нервной трубки (ONTDs). ONTDs были существенно восстановлены у эмбрионов цыплят благодаря трансплантации hESC, по сравнению с контрольными группами, уже в послеоперационный 3-й день (Lee et al., 2004). В другом исследовании инокулированные донорские hESC адекватно способствовали развитию заднего мозга и областей спинного мозга у эмбрионов цыплят-хозяев (Boulland et al., 2010). Аналогичные результаты наблюдались также при инъекции hESC интраамнионально в эмбрионы цыплят с дефектом нервной трубки и спустя 24 часов после индукции поражения, имитировали клиническую ситуацию с ONTDs у человека (Lee et al., 2006). Недавно, в рамках новаторской попытки, человеческие клетки RUES-GLR (репортер зародышевого слоя), обработанные Wnt3a и Activin, были пересажены в эмбрионы цыплят, чтобы оценить их способность служить в качестве "организаторов". Эта трансплантация привела к образованию эктопической вторичной оси внутри эмбриона цыпленка, способного индуцировать нейронную ткань (отмеченную экспрессией Sox2/Sox3) в соседних областях (Martyn et al., 2018). Эти исследования на цыплятах показали относительно более высокий химеризм, чем химеры грызун-человек или свинья-человек, хотя точная степень химеризма не была описана. Хотя время инъекции отличалось от BC, куриные эмбрионы-хозяева были спасены человеческими происходящими из PSC клетками. Они показали маркеры дифференцировки с высоким уровнем химеризма после стадии бластоцисты в месте введения донорских клеток. Интригует то, что ранние эмбрионы человека имеют дисковидную форму, близкую к куриной, в то время как эмбрионы мыши имеют более цилиндрическую форму (Akhlaghpour et al., 2021). Это позволяет предположить, что молекулярная программа ранних эмбрионов у человека и курицы может быть сходной, вероятно связанная с полярностью и планом тела, что позволяет человеческим PSCs дифференцироваться в нейрональные линии. С другой стороны, эволюционная дистанция между птицами и человеком составляет более 300 миллионов лет, в то время как различия между грызунами и людьми составляет около 96 миллионов лет (Nanda et al., 1999; Nei et al., 2001). Имплантированная куриная ниша может иметь уникальный характер ниши, которая секретирует или экспрессирует белки или другие молекулы пригодные для преодоления межвидовых барьеров неывзирая на эволюционные отличия. Предположим, что эти потенциальные механизмы совместимости человеческих клеток являются общими для всех видов птиц. В таком случае, исследования химер человека с гигантскими птицами, такими как страус (Struthio camelus), являются интригующим вариантом для изучения генерации органов. Однако птицы имеют совершенно отличную от человека анатомию и систему кровообращения, что необходимо учитывать. Химеризм между мышью и птицей также был бы интереен, чтобы прояснить значение таких физических ограничений в отношении механизмов межвидовой несовместимости в раннем эмбриогенезе.
4.2 Human chimeras in mice
Эффективность химер зависит от подготовки донорских клеток и генетического фона хозяина. В результате попыток различных групп был достигнут значительный прогресса в поддержании плюрипотентности нативных, primed, промежуточных и расширенных PSCs в различных условиях клеточной культуры. Нативное плюрипотентное состояние может быть лучше всего описано клетками внутри внутренней клеточной массы бластоцисты мыши. Клетки на стадии морулы или на стадии 16 клеток считаются обладающими тотипотентностью или расширенной потенциальной плюрипотентностью, поскольку они могут вносить вклад как в эмбриональные и внеэмбриональные линии. Концепция primed-типа плюрипотентности обычно ассоциируется с клетками в пост-имплантационном эпибласта мышиных эмбрионов с очень низким химеризмом при введении в бластоцисту хозяина. Наконец, недавно разработанная концепция промежуточной плюрипотентности относится ко многим возможным состояниям клеток, которые перекрываются между маркерами нативного состояния и маркерами primed стадии. В следующем разделе мы обсудим, как химерный потенциал PSCs в различных плюрипотентных состояниях варьирует в пределах эмбрионов мыши-хозяина.
4.2.1 Naïve type pluripotency
Что касается подготовки донорских клеток, то ученые успешно поддерживают эмбриональные стволовые (ES) клетки из бластоцист мыши и выявили их способность подвергаться дифференцировке в различные клональные линии более 4 десятилетия назад (Evans and Kaufman, 1981; Martin, 1981; Martello and Smith, 2014). В последующие годы, по мере усовершенствования условий культивирования, реагентов и специфических ингибиторов, используя среду "2i", комбинацию ингибитора MEK и ингибитора GK3β, мышиные PSCs можно поддерживать и размножать в состоянии нативной плюрипотентности (Ying et al., 2008). Для внутривидовой инъекции в бластоцисты, нативное плюрипотентное состояние донорских клеток является основополагающим фактором
FIGURE 2
Scenarios of organ transplantation derived from various swine models: Schematic: [(A), left] In BC, vacant organ niche formation by a niche-specific transgene depletion through genome editing is essential. [(A), right] Injection of human patient-derived (or MHC-matched human) iPS cells (green) into a blastocyst of a host animal with an organ failure phenotype. [(A), right, and (B)]. (A) Transplantation of human organs by BC is unlikely to fail because most cells are of human origin. Immunosuppression may be necessary if the porcine host origin remains in the graft component. (B) Organs transplanted from human-derived cells created in humanized pigs are assumed to function long-term in recipients with minimal or no immunosuppression because humanized pigs are designed to minimize immune rejection. Using humanized swine as host animals for the BC will work as a safety guard system for immune rejection.
необходимым для достижения высокой степени химеризма (Silva and Smith, 2008). Гены мишени мышиных ES клеток были успешно использованы в многочисленных исследованиях их способность формировать химеры зародышевой линии (Mansour et al., 1990; Bradley, 1991; Robertson, 1991). Однако, длительная культура PSCs в среде 2i вызывала необратимые эпигенетические изменения, приводящие к дефектам в потенциале развития (Choiet al., 2017; Yagi et al., 2017). Чтобы преодолеть эти проблемы, мы разработали определенный коктейль сред, названный a2i VPA LIF, который позволяет поддерживать PSCs с самой высокой способностью к образованию химер, способных формировать функциональные легкие (Mori et al., 2019). Для генерации человеческих нативных PSCs были разработаны среды 5iLAF, ReST и t2iLGoY (Theunissen et al., 2014; Pastor et al., 2016; Liu et al., 2017). Дальнейший сравнительный одноклеточный транскриптомный анализ индуцированных плюрипотентных стволовых клеток (iPSCs), культивируемых в этих средах
показал выраженную нативную плюрипотентность.
4.2.2 Primed type pluripotency
Было предпринято множество усилий по созданию и поддержанию различных типов PSCs у человека. Человеческие ES клетки были впервые охарактеризованы как primed (Thomson et al., 1998). В отличие от мышей, человеческие ESC не могут поддерживаться в нативном плюрипотентном состоянии в условиях 2i-культуры (Chan et al., 2013; Gafni et al., 2013; Takashima et al., 2014; Theunissen et al., 2014; Ware et al., 2014; Wu et al., 2015). Это фундаментальное различие, вероятно, является фактором, способствующим низкому химеризму человеческих ES в мышиных эмбрионах, примеры которых рассматриваются ниже (Theunissen et al., 2014; Weinberger et al., 2016). Первые доказательства химер между человеком и мышью были получены в исследовании, в котором клетки RUES1 были пересажены в бластоцисты мыши и исследовались на предмет химерного вклада in-vivo. Хотя степень химеризма была низкой, клетки человеческого происхождения вносили всё же вклад в проспективный эпителий передней кишки и нейроэпителий на ст. E8.5 (James et al., 2006). В последующем Chan et al., 2013; сообщили о специальной среде 2i-LIF, дополненной лигандами FGF2 и TGFβА1, а также ингибиторами p38 и JNK, которая может придать нативную плюрипотентность ESCs и iPSCs человека. Кроме того, они сообщили, что клетки, выращенные в условиях культуры, прочно способствовали формированию черепно-лицевых тканей и эмбриональных нервных складок в химерах мышь-человек (Gafni et al., 2013). Хотя этот результат был признан определяющим функциональным показателем для нативной человеческой плюрипотентности, другие группы, испытавшие этот метод, не смогли получить химеры (Takashima et al., 2014;
Theunissen et al., 2014).
4.2.3 Intermediate type pluripotency
Во время эмбриогенеза конкуренция между клетками является одним из значимых факторов барьеров межвидовой несовместимости, которые вызывают региональную элиминацию клеток с низкой приспособленностью, составляющих почти 35% всех клеток, производимых и удерживаемых посредством баланса между пролиферацией и апоптозом (Рисунок 1B) (Claveria and Torres, 2016; Merino et al., 2016; Bowling et al., 2019; Hashimoto and Sasaki, 2020). Этот механизм, первоначально выявленный у дрозофилы, включает относительно более высоко приспособленные клетки "winner", экспрессирующие MYC, они доминируют в развивающемся эмбрионе, вытесняя соседние клетки эмбриона, заставляя соседние, относительно с более низким уровнем MYC "loser" клетки подвергаться апоптозу (de La Cova et al., 2004; Moreno and Basler, 2004; Claveria et al., 2013; Sancho et al., 2013; Diaz-Diaz et al, 2017). Во избежание элиминации донорских клеток на основе клеточной конкуренции в химерном эпибласте, Belmonte с коллегами целенаправленно воздействовали на пост-имплантационные эмбрионы мыши E7.5 мышиных эмбрионов для приживления человеческих PSCs и эффективно получили химеризм клеток (Рисунок 1С). Путем кондиционирования человеческих ESC с региональной селекцией достигли состояния primed, характеризующего транскриптомом, который близко соответствует транскриптому эмбриона мыши, находящегося на стадии поздней полоски/стадии без зародыша (late-streak/no-bud) мышиного эмбриона, авторы сообщили об эффективном химеризме в эндодерме, эктодерме и мезодерме (Wu et al., 2015). Mascetti and Pedersen далее проиллюстрировали идею поэтапного сопоставления hPSCs с соответствующим эмбриональным состоянием мыши для повышения эффективности химеризации. Однако, в отличие от исследования Belmonte's исследование не требовало специальной предварительной обработки для человеческих PSCs перед их введением в эмбрионы на ранней и поздней стадиях гаструляции. Тем не менее, клетки праймированного (primed) типа могли очень эффективно дифференцироваться в ткани, происходящие из всех трех зародышевых слоев (Mascetti and Pedersen, 2016). Такой разброс в экспериментальных результатов подчеркивает масштабы технических проблем и требование надежного генетического или эпигенетического ориентира для оценки линий человеческих PSCs, которые эффективно формируют химеру, перед инъекцией.
Состояние плюрипотентности может оказывать глубокое влияние на эффективность химер. Например, PSCs праймированного типа, соответствующие стволовым клеткам эпибласта, не могут образовывать химеры даже во внутривидовом контексте (Nichols and Smith, 2009). С другой стороны, клетки нативного типа обнаруживают профили экспрессии генов, схожие с клетками внутренней клеточной массы бластоцисты и могут способствовать образованию межвидовых химер (Kobayashi et al, 2010). Хотя это различие хорошо обосновано для моделей грызунов, эта концепция не имеет четкого определения в контексте крупных животных (Rashid et al., 2014; Graham, 2017). Wu и коллеги изучили все доступные условия культивирования для праймированных и нативных состояний человеческих iPSCs (Wu et al., 2017). В дополнение к праймированным и нативным, человеческие iPSCs были также охарактеризованы и в промежуточном состоянии плюрипотентности, ранее было показано, что они обладают потенциалом давать химеры в зародышевой линии мыши (Tsukiyama and Ohinata, 2014). Репортерные человеческие iPSCs были готовы принимать такое состояние плюрипотентности и показали значительно более высокий вклад в химеризм эмбрионов свиней по сравнению с клетками в других нативных или нативно-подобных плюрипотентных состояниях (Wu et al., 2017). Недавнее исследование также показало, что человеческие iPSCs с промежуточной плюрипотентностью способствуют спецификации первичных половых клеток в химерных эмбрионах (Yu et al., 2021).
4.2.4 Extended type pluripotency
В 2017 году Deng и его коллеги представили концепцию расширенной плюрипотентности, состояния стволовости, которое транскрипционно отлично от обычных нативных и праймированных клеток. Состояние расширенного потенциала существует между тотипотентным 1-клеточным эмбрионом и бластоцистой в развивающемся эмбрионе. Как у мышей так и у людей extended pluripotent stem cells (EPSCs), как было обнаружено, обладают очень высоким потенциалом химеризма, это подтверждается тем фактом, что одиночная клетка EPS мыши может генерировать как эмбриональные, так и вне-эмбриональные клоны in vivo (Yang Y. et al., 2017). Далее развивая эту концепцию, было показано, что человеческие EPSCs являются примерно в 20 раз более эффективны в продукции химеризма, чем нативные hPSCs при введении в пре-имплантационные бластоцисты мышей (Yang Y. et al., 2017). Самые последние данные подчеркивают важность ингибирования пути mTOR в донорских человеческих PSCs, что позволяет им достигать высокой степени химеризма в мышиных эмбрионах (Hu et al., 2020; Zhang et al., 2021). Во многих примерах, рассмотренных выше, модифицированные hPSCs были пересажены мышам-хозяевам дикого типа, и неудивительно, что степень химеризма была низкой (Freedman, 2018). Основываясь на этих результатах, требование нативной плюрипотентности человеческих доноских клеток для достижения химеризма в организме-хозяине является спорным в контексте получения химер человека и мыши. Это связано с тем, что трудно поддерживать химерно-компетентное нативное качество человеческих iPSCs в течение длительного времени даже в среде поддержания нативности (5iLAF, ReST, и t2iLGoY) или 2i-среде, и нативная плюрипотентность глубоко различается у разных видов (Silva and Smith, 2008). PSCs промежуточного или расширенного типа являются привлекательными, однако для эффективного химеризма требуются значительные усилия (Yang J. et al., 2017; Gao et al., 2019). Как поддерживать органогенную компетентность в человеческих iPSC, то есть способность формировать функциональные органы после введения клеток животным-хозяевам, остается вопросом, и это может зависеть как от плюрипотентности, так и от программы развития животного-хозяина.
4.3 Human chimeras in rats
Крысы также использовались для изучения межвидового химеризма в различных контекстах для разработки гуманизированных моделей крыс, хотя и не в такой степени, как мышей. В ранних исследованиях 1980-х годов использовалась модель голых (nude) крыс для изучения приживления человеческой кожи и иммунных клеток (Vos et al., 1980). У этих крыс наблюдался умеренный иммунодефицит, характеризующийся снижением количества лимфоцитов с возрастом, но сохраняющий высокие показатели по количеству нейтрофилов, эозинофилов и моноцитов (Vos, 1980). Поэтому эта модель могла поддерживать кожные трансплантаты взрослого человека в течение короткого времени до опосредованного хозяином отторжения (Brungger et al., 1984; Gilhar et al., 1986; 1990). Человеческие CD45+ клетки были обнаружены в различных тканях крыс, таких как печень, тимус, почки, селезенка и т.д., до 6 месяцев после внутриутробной трансплантации посредством пуповинной крови (Sun et al., 2007). Успех этой модели в первую очередь зависит от permissive природы иммунодефицитного эмбрионального состояния крыс. Недавние исследования еще больше укрепили эту концепцию, показав высокую эффективность приживления человеческих iPSCs и раковых клеток человека в двух крысиных моделях тяжелого комбинированного иммунодефицита (Yang et al., 2018; He et al., 2019; Noto et al., 2020). Степень иммунного надзора за конкретной тканью также также вносит свой вклад в эффективность образования химер. Регионы мозга крысы, такие как стриатум, при трансплантации стромальных клеток человеческого костного мозга, демонстрируют замечательную 20% эффективность приживления в течение 72 дней в отсутствии воспалительной реакции (Azizi et al., 1998). В дополнение к иммунной антипатии, различные патологические состояния или повреждения формы тканей повышают шансы на химеризм. Клетки-предшественники нейронов, полученные из ES клеток человека, дифференцируются в нейроны и глиальные клетки в области головного и спинного мозга взрослых крыс (Tabar et al., 2005; Yan et al., 2007). Нейральные стволовые клетки человека выполняют нейропротекторную функцию в крысиных моделях болезни Parkinson's и в условиях и ишемии, вызванной инсультом (Yasuhara et al., 2006; Bliss et al., 2007; Andres et al., 2011). Другие типы стволовых клеток человека, такие как мезенхимные стволовые клетки, также демонстрируют локальный химеризм в крысиных органах, таких как печень, сердце и поджелудочная железа (Grinnemo et al., 2004; Sato et al., 2005; Laporte et al., 2019). Эти исследования в первую очередь пытаются создать гуманизированные крысиные модели различных патологических состояний и повреждений тканей без использования методов BC. С появлением новых гуманизированных крысиных моделей будущее функционального межвидового химеризма между человеком и крысой открывает отличные перспективы, в то время как допустимость не-ракового, нормального эпителиального химеризма человека необходимо хорошо продумать (Agarwal et al., 2020).
4.4 Human chimeras in monkeys
Тесные эволюционные связи между обезьянами и людьми делают их подходящей моделью для изучения долгосрочных последствий межвидового органного химеризма (Gibbs et al., 2007; Stevens et al., 2013). Несмотря на их относительно большие размеры по сравнению с мелкими грызунами, длительный период беременности и логистику, период беременности, и логистические трудности, такие как затраты на рабочую силу и затраты на содержание, обезьяны могут быть ценными моделями для изучения межвидового химеризма в различных условиях. Takahashi и коллеги провели трансплантацию ткани сетчатки глаза, полученной из стволовых клеток человека, на двух обезьяньих моделях дегенерации сетчатки, вызванных травмой (Shirai et al., 2016). Хорошо известно, что вероятность иммунного отторжения значительно снижается при трансплантации iPSC, сопоставленных по антигену с человеческими лейкоцитарными антигенами (Sugita et al., 2016; Morizane et al., 2017). На основе этого наблюдения Mandai и его коллеги использовали человеческие iPSCs для создания долговременно функционирующих химерных ретин в тех же моделях дегенерации сетчатки у приматов с меньшей иммуносупрессии. В другом доклиническом исследовании, полученные из iPS-клеток человека дофаминергические нейроны человека обнаруживали функциональное приживление в нейротоксин-индуцированной модели болезни Паркинсона (Kikuchi et al, 2017). Кроме того, при использовании миллиардных доз человеческих ES клеток кардиомиоциты могут регенерировать сердца в модели ишемии миокарда не-человекообразных приматов (Chong et al., 2014). Несмотря на такой успех, некоторые аспекты химеризма между обезьяной и человеком остаются малоизученными. Например, полученные из человеческих ES-клеток сердечно-сосудистые предшественники не смогли вызвать регенерацию мышечной ткани в сердцах приматов с инфарктом (Zhu et al., 2018). С точки зрения развития, Belmonte и коллеги показали способность человеческих EPSCs дифференцироваться в гипобласт и эпибласт в обезьяно-человеческих химерах ex vivo (Tan et al., 2021). Также были предприняты попытки создать обезьян, генетически предрасположенных к иммунодефициту (Niu et al., 2014). Такие модели могут быть полезны для достижения высокого химерного успеха приживления донорских клеток. Однако использование химер обезьяна-человек для изучения сложных заболеваний человеческого мозга потребует более осторожных исследований и надежных этических методов для преодоления межвидового барьера (Greely and Farahany, 2021). Различия в размерах органов между людьми и обезьянами также могут стать еще одним значительным барьером для создания химерных органов обезьяны и человека особенно для солидных органов, которые требуют анатомически и физиологически функционального размера для трансплантации, таких как глаза, кости, почки, сердца, легкие и желудочно-кишечный тракт.
4.5 Human chimeras in pigs
Ранее в основном использовались крупные животные, такие как крупный рогатый скот и свиньи для разработки ксенотрансплантационных моделей человек/животное. Основная цель заключалась в получении механистических знаний о взаимодействии тканей трансплантата и хозяина которые можно было бы использовать для достижения долгосрочного клинического успеха трансплантации органов. Моделирование таких событий на мелких животных было невозможным из-за более короткой продолжительности жизни и анатомической непропорциональности. Flake и коллеги продемонстрировали специфическую дифференцировку пересаженных человеческих мезенхимных стволовых клеток при трансплантации в эмбрионы овец (Liechty et al., 2000; Almeida-Porada et al., 2004). Среди крупных животных свиньи были предложены в качестве идеального хозяина для изучения межвидового химеризма, прежде всего из-за очень близкого анатомического и физиологического сходства с человеком (Cooper et al., 2016; Nagashima and Matsunari, 2016). В следующем разделе обобщаются имеющиеся в настоящее время модели свиней и перспективы использования генно-модифицированных свиней для ксенотрансплантации (Рисунок 1D).
5 Blastocyst complementation
"Комплементация бластоцисты" (BC) является важной концепцией для
создания органов в качестве регенеративного подхода. BC использует программу развития хозяина для включения донорских PSCs. Донорские PSCs, при введении в морулу или бластоцисту реципиента, лишенную критических генов для органогенеза, могут замещать дефектные ниши органов и компенсировать функциональные дефекты реципиентных клеток. Alt и коллеги впервые проиллюстрировали внутривидовую BC , когда они ввели ES-клетки мыши дикого типа в RAG2-дефицитные бластоцисты. Зрелые В- и Т-клетки, полученные из донорских ESC, спасли адаптивные иммунные реакции у мышей-хозяев, которые были с нехваткой ниш с точки зрения разнообразия лимфоцитов (Chen et al., 1993). Примерно два десятилетия спустя, Nakauchi и коллеги продемонстрировали первые доказательства межвидовой генерации органов поджелудочной железы у мышей с использованием крысиных PSCs (Kobayashi et al., 2010). Примечательно, что они также показали, что крысиные ткани поджелудочной железы, созданные у мышей с помощью BC , можно пересаживать в реципиентную модель заболевания крысы и восстановили ее фенотип (Yamaguchi et al., 2017).
Недавно эта концепция была распространена на крупных животных, однако, межвидовой и другие барьеры, такие как плюрипотентность донорских клеток, конкуренция клеток и другие потенциальные ксеногенные несовместимости приводят к низкой эффективности химер (Wu et al., 2017; Garry and Garry, 2019; de Los Angeles and Wu, 2022; Roodgar et al, 2022). Химеризм во время и после пост-имплантационной стадии развития представляет собой отдельный комплекс проблем (рис. 1). Во-первых, этап подбора донорских клеток в определенную тканевую нишу требует тщательной оптимизации для обеспечения пролиферации приживленных клеток или тканей (Cohen et al., 2018; Thomas et al., 2021). Во-вторых, донорские клетки требуют хорошей приспособленности для выживания в условиях клеточной конкуренции (Wu and Barbaric, 2021). Наконец, ткани, полученные из донорских клеток, должны избегать иммунного отторжения у реципиентов трансплантата и при лечении с помощью иммуносупрессивных препаратов (Lu et al., 2019). Критические барьеры межвидового химеризма, соответствующие стадии его развития обобщены на рисунке 1.
5.1 Blastocyst complementation in pigs
До настоящего времени BC проводилась в основном на мышах. Это объясняется тем, что относительно легко создать органную нишу у мышей благодаря хорошо отработанному методу создания нокаутных мышей и с точки зрения экономии времени и средств на проведение эксперимента. Однако клиническое применение BC требует создания органов такого размера, которые могут быть пересажены человеку. BC , с помощью домашнего скота, была попытались преодолеть эту проблему. С новыми разработками в области гуманизированных животных моделей и все более глубокого понимания плюрипотентности у различных видов, межвидовая BC является одним из наиболее перспективных биоинженерных подходов для создания пригодных к трансплантции органов человека (Рисунок 2A) (Garry and Garry, 2021).
До появления технологии редактирования генома CRISPR-Cas9, свиней массово редактировали в течение нескольких десятилетий с помощью классических методов редактирования генома, чтобы создать иммунную систему, схожую с человеческой. С успехом CRISPR-Cas9 и связанных с ней технологий редактирования генома, создания химер между свиньей и человеком и внутривидовых подходов BC , потенциал для выращивания органов человеческого размера органов у свиней больше не является далекой мечтой (Matsunari et al, 2013; Chang et al., 2018; Hamanaka et al., 2018; Mori et al., 2019; Kitahara A. et al., 2020; Kobayashi et al., 2021; Ruiz-Estevez et al, 2021; Wen et al., 2021). Тем не менее, для этого потребуется: 1) создание высокохимерных компетентных доноров человеческих ESC/iPSC, которые могут выживать и размножаться внутри свиного эмбриона, и 2) создание свободной ниши органов у свиней с использованием CRISPR-Cas9 редактирования генома. Когда эмбрион свиньи может быть генетически сконструирован для формирования дефектной органной ниши для органов мишеней, клетки человеческого происхождения могут демонстрировать локальный и целенаправленный химеризм для формирования соответствующего органа (Rashid et al., 2014; Kano et al., 2022).
Nakauchi и его коллеги успешно создали донорскую поджелудочную железу у PDX1-нокаутных лишенных поджелудочной железы свиней методом BC (Matsunari et al., 2013). В этой статье было показано получение эмбрионов свиньи-хозяина с апанкреатическим фенотипом путем SCNT, а бластомеры свиньи Kusabira Orange+ дополнили освободившуюся нишу. В другом исследовании, Nagashima и коллеги создали различные фенотипы с нарушением органогенеза в таких органах, как почки, печень и кровеносные сосуды, путем целенаправленного воздействия на такие гены, как KDR (FLK1), SALL1 и HHEX1, соответственно. (Matsunari et al., 2020). Недавно Zhou и коллеги успешно заполнили нишу для глаз, используя бластомеры дикого типа в свином глазу дефицит которых был вызван мутацией гена MITF у свиньи-хозяина. (Yao et al., 2021). Garry и коллеги ввели человеческие iPSCs в эмбрионы свиней с нокаутом ETV2 (Das et al., 2020). Хотя человеческие клетки могут встраиваться в бластоцисты свиного хозяина, многие эмбрионы сначала отторгали человеческие iPSCs. Они преодолели эту проблему путем избыточной экспрессии BCL2, анти-апоптического гена, в донорских человеческих iPSC. Примечательно, что все TIE2+ эндотелиальные клетки были получены из человеческих iPSCs в химерных свиных эмбрионах на день беременности 17-18 (Das et al., 2020). Эта группа также сообщила об эффективном добавлении (комплементации) нокаутированных TP53 человеческих ESC в скелетных мышцах свиных эмбрионов с нокаутом MYF5, MYOD и MYF6 на двух различных стадиях развития: на 20 и 27 день беременности (Maeng et al., 2021). Однако степень химеризма у этих эмбрионов была очень различной, это говорит о том, что межвидовая BC нуждается в дальнейшей оптимизации и технической согласованности.
5.2 Blastocyst complementation in large animals
Методология BC у крупных животных включает свиней и крупный рогатый скот. Sendai, Aoyagi и коллеги вызвали NANOS3 KO у Wagyu крупного рогатого скота, у которых отсутствуют половые клетки в яичниках, используя метод SCNT. Им также удалось создать химерные яичники крупного рогатого скота, способные производить половые клетки, полученные из донорских (NANOS3+/+) бластомеров Holstein (Ideta et al., 2016). Преимуществом использования крупного рогатого скота является схожий период беременности, аналогичный человеческому, и потенциально более низкая ксеногенная несовместимость при межвидовой конкуренции клеток. Крупный рогатый скот также по своей природе обладает уникальными тканями, идентичными человеческим. Например, кости конечностей и мышцы имеют лучшую совместимость по размерам с человеком, чем со свиньями. Большой размер внутренних органов также может благоприятствовать трансплантации. Однако крупный рогатый скот имеет более низкую плодовитость для надежного применения во всем мире, чем свиньи, а долгосрочная высокозатратная производительность является центральным вопросом.
В экспериментальных системах с культурой ex-vivo Belmonte и коллеги сообщили, что человеческие EPSCs, культивируемые в исходной среде, могут способствовать развитию как эмбриональных, так и вне-эмбриональных клонов в ex-vivo культивированных эмбрионов обезьян. Однако вклад человеческих iPSCs составляет в лучшем случае 7,08% для эпибласта и 4,96% для гипобласта (Tan et al., 2021). Были предприняты попытки создать межвидовых химер среди крупных животных, отличных от человека. Snyder и коллеги недавно сообщили, что избыточная экспрессия BCL2 усиливает пролиферацию iPSC у шимпанзе и свинохвостых макак в резус-бластоцистах. Через два дня после инъекции большинство контрольных iPSC, в которых отсутствовала избыточная экспрессия BCL2, не выжили (33,3%, шимпанзе; 54,5%, свинохвостая макака).
В отличие от этого, почти 100% избыточно экспрессирующих BCL2 свинохвостых макак и шимпанзе выжили после инъекции (Roodgar et al., 2022). Эти результаты демонстрируют целесообразность использования BC в качестве метода создания человеческих органов в органных нишах крупных животных или не-человекообразных приматов. В отличие от этого, эффективность образования химер с универсальностью генетических модификаций у крупных животных остается низкой по сравнению с попытками на грызунах. Большинство современных исследований ограничивают наше понимание химеризма ранними стадиями развития. Следовательно, было бы интересно изучить межвидовой химеризм на различных стадиях развития - от от бластоцисты до пост-имплантационного периода - для подтверждения эффективности моделей хозяев и донорских клеток.
Несмотря на большие перспективы, успешная BC не гарантирует создание функциональных органов. До недавнего времени только три органа - мозг, легкое и поджелудочная железа, были успешно получены таким образом, чтобы получить жизнеспособных взрослых животных фенотипически неотличимых от сородичей WT (Kobayashi et al., 2010; Chang et al., 2018; Mori et al., 2019). Барьер для создания функциональных органов еще более высок в случае межвидовых химер. Единственные функциональные органы, созданные с помощью межвидового химеризма, являются поджелудочная железа и тимус (Kobayashi et al., 2010; Isotani et al., 2011). Генерация функциональных органов путем внутривидовой или межвидовой BC требует не только совместимых донорских клеток, но и подходящих моделей хозяев, в которых функцию каждого органа-мишени можно оценить у живых взрослых животных (Kobayashi et al., 2010; Chang et al., 2018; Mori et al., 2019).
6 Swine as a model for xenotransplantation
В 1964 году доктор James D. Hardy провел одну из первых ксенотрансплантации в современной медицине, заменив сердце 68-летнего пациента на сердце шимпанзе. Несмотря на то, что первый пациент не прожил более 2 часов и погиб от острого иммунного ответа, был достигнут огромный прогресс в области ксенотрансплантации за последние шестьдесят лет. В начале этого года была проведена первая трансплантация сердца от свиньи к человеку, который не был кандидатом на обычную аллогенную трансплантацию сердца, и пациент прожил 2 месяца (Griffith et al., 2022). Значительный прогресс может быть обеспечен более глубоким изучением иммунной системы и относительной простотой редактирования генов (Ekser et al, 2017; Niu et al., 2017). Хотя рассматривались многие крупные животные рассматривались, свиньи являются более предпочтительными для ксенотрансплантации в основном из-за простоты разведения (с большим и частым приплодом) и физиологического сходства органов и размеров с человеком. Трансплантаты свиного происхождения выживали в течение месяцев и, в некоторых случаях, даже лет после пересадки не-человекообразным приматам. Однако трансплантация обезьянам ксено-органов, таких как легкие, островки поджелудочной железы, сердце и почки, требует применения системных иммуноподавляющих препаратов в течение длительного времени и большинство органов в конечном итоге отторгаются (Sykes and Sachs, 2019). Поразительно, но thymokidney подход может обеспечивать толерантность через аллогенные барьеры, продлить жизнь ксенотрансплантата при трансплантации и в конечном итоге может быть использован для снижения интенсивности иммуносупрессии для ксенотрансплантированных органов (Yamada et al., 1999; 2000; Shimizu et al., 2005; Rivard et al., 2018).
Если орган от свиньи дикого типа пересаживается непосредственно человеку или не-человекообразному примату, орган будет отторгнут в течение нескольких минут. Эта форма отторжения, также известная как гипер-острая иммунная реакция, возникает в результате взаимодействия между предварительно сформированными хозяином естественными антителами (Nabs) с антигенами галактозо-α1,3-галактозой (Gal) , экспрессируемыми на клетках свиного трансплантата (Platt et al., 1991). Используя метода поглощения антител, острое отторжение может быть отсрочено до нескольких часов, но в конечном итоге трансплантат отторгается (Kozlowski et al., 1997). Чтобы преодолеть врожденные реакции и non-Gal преформированные антитела в дополнение к Т-клеточно-зависимым реакциям против трансплантата, исследователи продолжают модифицировать геном свиньи 1) целенаправленно воздействуя на не-Gal естественные антитела и 2) исправляя видовую несовместимость коагуляции, фагоцитоза и комплемента регуляторных белков у свиней и приматов. К ним относятся ингибирование коагуляции путем избыточной экспрессии анти-коагуляционных факторов hCD39 и hCD141, которые экспрессируются на поверхности эндотелиальных клеток, а также путем добавления трансгенов человеческого белка регуляции комплемента (Lee et al., 2018; Singh et al., 2019; Kemter et al., 2020). С помощью серийной SCNT, дополнительные мутации были размещены у свиней, чтобы избежать противовоспалительных и анти-апоптотических ответов (Fischer et al., 2016). Для получения подробной информации о различных инженерных стратегиях идеальной гуманизированной свиньи, пожалуйста, обратитесь к последним обзорам Qin коллег (Lu et al., 2020).
Если это допустимо, то модель гуманизированной свиньи может стать идеальным фоном для создания моделей хозяев с обедненной нишей с использованием подхода BC (Рисунок 2B). После комплементации донорскими человеческими PSCs, полученный орган будет пригоден для создания гуманизированных органов, т.е. смеси человеческих клеток и гуманизированных клеток хозяина, у MHC-совместимых пациентов, ожидающих трансплантации органов. Предположим, что вся ниша органа мишени, включающая эндодерму, мезодерму, и производные эктодермы, будет дополнена человеческими iPSC-производными клетками. Это будет идеальное лечение для MHC-совместимых пациентов, ожидающих трансплантации органов, с минимальными или вообще без иммуносупрессивных подходов.
Пересаженные органы теоретически должны превосходить гуманизированные органы, полученные от свиньи, по функциям и способам избегать краткосрочных и долгосрочных иммунных реакций, поскольку все клетки получены от соотв. отдельного пациента или MHC-совместимого донора.
(Рисунок 2B).
7 Other efforts for organ generation
С появлением технологии клеток iPSC область органоидной биологии расширилась, чтобы обеспечить простое и эффективное получение органов. Биология органоидов расширилась, чтобы обеспечить простое, но мощное понимание лежащих в основе знание развития тканей человека и, что более важно, моделирования патофизиологических состояний (Rossi et al., 2018; Kim et al., 2020). Различные органы, такие как печень, легкие, почки, мозг, кишечник, и даже специализированные ткани, такие как эндометрий, были смоделированы с помощью органоидов, полученных из iPSC человека, гистологически схожих с человеческими органами (Lancaster et al., 2013; Takasato et al., 2015; Turco et al., 2017; Fujii et al., 2018; Hu et al., 2018; Sachs et al., 2019). С растущим успехом трансплантаций органоидов, полученных из iPSC человека, изучение приживления органоидов в нечеловеческом организме, таком как мыши, является интересным. Органоиды печени и почек, полученные из человеческих iPSCs, индуцировали васкуляризацию из тканей мыши-хозяина и поддерживали функцию тканей хозяина (Takebe et al., 2013; van den Berg et al., 2018). Аналогичным образом, органоиды кишечника человека показали устойчивую жизнеспособность при имплантации в брыжеечные ткани мыши (Cortez et al., 2018). В другом ряде исследований органоиды мозга, полученные из клеток iPSC и ESC человека, органоиды мозга создавали подкорковые проекции и функционально интегрировали их в предсуществующие нейроны мыши (Dong et al, 2020). Клетки нервного гребня человека дифференцируются в меланоциты и производят пигментированные волосы на фоне мутантной мыши c-kit, у которой не хватает меланобластов (Cohen et al., 2016). Приживление человеческих полученных из iPSC нейросфер восстанавливает двигательную функцию, характеризующуюся образованием синапсов и увеличение локальной миелинизации у мышей nude, моделирующих травмы спинного мозга (Nori et al., 2011). В двух моделях острой печеночной недостаточности органоиды печени человека, полученные из hiPSCs, восстанавливали печеночные функции и улучшили показатели выживаемости у мышей (Nagamoto et al., 2016; Nie et al., 2018). Органоиды головного мозга, полученные из ES-клеток человека при трансплантации в поврежденную кору головного мозга мышей, показали высокую эффективность выживания, прочную васкуляризацию от тканей хозяина и восстановление аксональных структур ткани и восстановление аксональных проекций вдоль кортикоспинальных трактов (Daviaud et al., 2018; Kitahara T. et al., 2020). Трансплантация человеческих iPSC-производных эндотелио-подобных клеток в мышиной модели ишемии задней конечности вызвала значительное улучшение постнатальной васкуляризации (Cho et al., 2007). Трансплантация сконструированного человеческого iPSC-derived органоида в дефектную тканевую нишу, особенно в нишу иммуно-привилегированных тканей, таких как подпочечные регионы, семенники, глаза, печень и мозг, имеет большие перспективы для оценки стволовых клеток и моделирования заболеваний на мышах в качестве следующего поколения персонализированной медицины нового поколения (Harrison et al., 2014; Paquet et al., 2016; Driehuis and Clevers, 2017; Artegiani et al., 2020). В целом, человеческие органоиды, полученные из iPSC, являются убедительными моделями заболеваний in vitro и in vivo. Однако основными проблемами основанных на органоидах подходов являются отсутствие методов трансплантации, масштабируемость для создания целых органов и воспроизводимость для создания всех типов клеток для воспроизведения функции органа. Если эти вопросы не будут решены, то целесообразность использования органоидов для трансплантации органов будет низкой и будет в значительной степени зависеть от стадии заболевания; (чем раньше, тем лучше), но маловероятен успех на терминальной стадии.
Тканевая инженерия - это еще один подход к созданию трансплантируемых органов. При таком подходе целью является выращивание всего или части органа in vitro. Если сконструированный орган может быть получен из аутологичных клеток реципиента, шансы на отторжение будут близки к нулю. Создание механически, анатомически, физиологически, и биологически совместимых органов, аналогичных нативным органам, является идеальным вариантом. В этом отношении децеллюляризация внеклеточного матрикса сохраняет сосудистую сеть и структурный каркас (Crapo and Wang, 2011). Теоретически, децеллюляризированный каркас органа может функционировать как штрих-код для клеточной репопуляции. После того, как оптимальное количество клеток заселяет каркас органа, используется биореактор, чтобы облегчить формирование органа. Биореакторы - это устройства, в которых биологические и/или биохимические процессы развиваются в тщательно контролируемых и жестко контролируемых условиях окружающей среды (Martin et al., 2004). Децеллюляризированные каркасы были изготовлены для различных органов, включая легкие, сердце, почки, печень, кишечник, мочевой пузырь, роговицу, конечностей, поджелудочную железу и сосудистую систему (Ott et al., 2008; Hashimoto et al., 2010; Petersen et al., 2010; Yang et al., 2010; Quint et al., 2011; Totonelli et al., 2012; Song et al., 2013a; Gerli et al., 2018; Goh et al,
2019).
Для тканевой инженерии легких Niklason и его коллеги заселили лишенные клеток каркасы крысиного легкого эпителиальными клетками легких новорожденных крыс и эндотелия микрососудов. Они генерировали жизнеспособную легочную ткань в течение 1 недели в условиях in-vitro (Petersen et al., 2010). Ott и коллеги сообщили, что перфузионная децеллюляризация легких трупов дает неповрежденные каркасы, засеваемые клетками для создания биоискусственных легочных трансплантатов. После трансплантации таких биоискусственных легких крысам, трансплантаты приживались и поддерживали дыхательную функцию в течение 7 дней (Song et al., 2011). Также были проведены испытания на крупных животных в надежде на доклиническое применение. Cortiella и его коллеги создали каркасы из легких свиньи с использованием аутологичных клеток от свиных реципиентов. В течение 2 недель после пересадки легочные трансплантаты сформировали альвеолярные ткани с поддерживающей сосудистой сетью без каких-либо признаков иммунного отторжения (Nichols et al., 2018). Ott и коллеги засеяли свиные децеллюляризированные легочные каркасы эпителиальными клетками предшественниками дыхательных путей человека, полученными из человеческих донорских легких, и группами человеческих эндотелиальных клеток из пупочной вены. Заселяя свиной внеклеточный матрикс каркасов человеческими эндотелиальными клетками, они создали легочную сосудистую сеть со зрелой эндотелиальной выстилкой, дополненной анти-тромботической функцией для обеспечения кровоснабжения. Они создали функционирующий трансплантат для газообмена, заселив эпителиальную поверхность человеческими эпителиальными клетками-предшественниками. Этот трансплантат мог выдерживать физиологический кровоток легочного кровообращения от реципиента и обменивал газы при вентиляции в течение 1 часа после трансплантации (Zhou et al., 2018).
Первоначальные исследования по тканевой инженерии почек были сосредоточены на методах децеллюляризации тканей. Soker и его коллеги децеллюляризировали свиные почечные каркасы с помощью метода, который поддерживал кровяное давление до 2 недель после имплантации свиньям-реципиентам (Orlando et al., 2012). Лишенные клеток почки обезьян также были функционально эффективны и биосовместимыми (Nakayama et al., 2010). Как и в случае с легкими, тканевая инженерия почек также требует повторного наполнения клетками децеллюляризированных каркасов, как показали различные исследования с использованием свиных, обезьяньих, крысиных и человеческих органов. При трансплантации биоинженерная почка хорошо снабжается кровью после ортотопической трансплантации лишенным почек крысам и демонстрировала выделение мочи (Song et al., 2013b).
Taylor и коллеги сообщили о перфузионной децеллюляризации целого сердца крысы, создав тем самым основу для изучения этого метода другими группами для крупных животных, таких как свиньи (Ott et al., 2008; Wainwright et al, 2010; Weymann et al., 2011; Momtahan 2016). Также были разработаны человеческого размера децеллюляризованные сердца свиней, которые продемонстрировали заселение клетками коронарных сосудов и миокарда с измеримой электрической активностью в децеллюляризированном каркасе (Weymann et al., 2014). Shimizu и коллеги сообщили о гетеротопической трансплантации децеллюляризованного каркаса свиного сердца с мезенхимными стволовыми клетками свиньям-реципиентам. Каркасы могли переносить хирургические процедуры и обеспечивать кратковременное кровоснабжение с помощью коронарной артерии (Kitahara et al., 2016).
Биоинженерные методы создания органов, включающие подходы децеллюляризации-рецеллюляризации могут быть сложными во многих отношениях. Например, существующие протоколы не могут гарантировать полное удаление остаточных токсичных продуктов из децеллюляризированной ткани. Кроме того, при пересадке биоинженерной ткани в организм реципиента скорость деградации децеллюляризированных каркасов должна быть синхронна с ремоделированием соединительной ткани, мешающей трансплантации. Тем не менее, несмотря на свои ограничения, биоинженерия имеет отличные перспективы для создания органов. Дальнейшие усилия по оптимизации рецеллюляризации в сочетании с медикаментозным или геномным редактированием для долгосрочного поддержания органов, особенно эндотелиальных компонентов, необходимы для трансплантации органов пациентам, страдающим от рефрактерных заболеваний.
8 Future perspectives
Предпринимаются различные химерные, гибридные и биоинженерные исследования в рамках многих инициатив, которые могут быть применены для генерации человеческих органов. Хотя в большинстве областей они несовершенны, но влияние успешного воздействия огромно. Среди них, BC является одной из наиболее перспективных технологий, особенно для генерации целых органов для трансплантации. Одним из критических элементов для успешной генерации целых органов с помощью BC является лучшее понимание механизма межвидового химеризма между клетками человека и хозяина в процессе программы развития. Однако исследования химер человек-животные ограничены нехваткой ресурсов и этическими проблемами. В частности, вклад человеческих PSCs в нейрогенез и репродуктивные ткани у химерных животных может иметь глубокие этические последствия (Bourret et al., 2016; Kwisda et al., 2020). Эти опасения могут быть смягчены путем инженерии клеток, неспособных к дифференцировке связанных с этикой клонов.
Другим важным шагом для успеха BC's является подготовка человеческих iPS клеток с органогенным потенциалом. Сравнительный геномный и эпигеномный анализ плюрипотентности животных-хозяев с человеческими iPS-клетками может дать критически важное руководство. Помимо поддержания человеческой плюрипотентности в iPSCs человека, недавно были также получены ES-клетки от крупных животных, таких как свиньи, коровы и овцы (Bogliotti et al., 2018; Choi et al., 2020; Vilarino et al., 2020; Kumar et al., 2021). Однако, за исключением одного исследования с использованием бластомеров свиньи, технически сложно точно определить нативное состояние плюрипотентности и компетентность стволовых клеток зародышевой линии крупных животных (Matsunari et al., 2013). Чтобы преодолеть несовместимость на молекулярном уровне для получения эффективного межвидового химеризма и последующей ксенотрансплантации, необходимо создать гуманизированные модели крупных животных, и такие попытки уже начинают появляться (Yang et al., 2016; Boettcher et al., 2020). Совсем недавно Wu и коллеги получили дальнейшие доказательства участия межвидовой конкуренции клеток во время раннего эмбриогенеза. В этой работе было продемонстрирована активация подобного воспалению пути передачи сигналов Myd88-p65-NFkB в донорских iPS-клетках человека. Потеря функции Myd88 приводила к преодолению клеточной конкуренции в раннем эмбриогенезе (Zheng et al., 2021). Общая особенность конкуренция донорских внутри- и межвидовых PSCs, включая ES и iPSC клетки, которые формируют функциональные органы у крупных животных-хозяев, все еще остается открытым вопросом.
Трансплантация биоинженерных органов - еще один вариант решения проблемы нехватки доноров. На пути к трансплантации у человека, создание каркасов на основе свиных, адаптированных к человеческим условиям, или человеческих органоидов, полученных из iPSC, является многообещающим. Однако изготовление целых органов, способных выдержать клиническое использование, пока не реализовано. Необходимы дальнейшие концептуальные и технологические прорывы, помимо штрих-кодов децеллюляризированных органов и самосборки органоидов. В этом отношении метод BC имеет перспективные преимущества перед органоидами и децеллюляризированными органами с точки зрения масштабируемости, животноводства и хирургических показаний к трансплантации органов, применимых к большинству конечных стадиях рефрактерных заболеваний. Преимущество систем на основе децелляризации-рецелляризации или органоидных систем по сравнению с подходом BC является возможность создания xeno-free среды и меньшая инвазивность во время трансплантации. В будущем, в зависимости от реципиента и статуса рефрактерного заболевания, преимущества и недостатки каждой технологии должны дополнять друг друга, чтобы предоставить нам несколько подходящих вариантов.
