 | WMZ: Z191701361450 WMR: R209318204033 |
Без рекламы только Браузер Uran (скачать )
 | WMZ: Z191701361450 WMR: R209318204033 |
rDNA Transcription in Developmental Diseases and Stem Cells | |
|---|---|
|
|
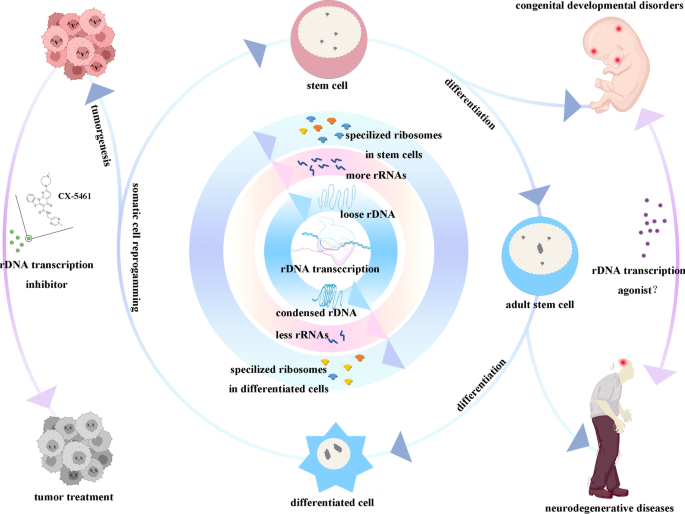 Являясь первым и лимитирующим шагом в биогенезе рибосом, транскрипция рДНК претерпевает значительные динамические изменения во время изменения плюрипотентности клеток. За последние десятилетия активность рДНК продемонстрировала динамические изменения, но большинство людей рассматривают ее как пассивное соответствие клеточным потребностям. Доказательства транскрипционной активности рДНК, определяющей плюрипотентность стволовых клеток, растут по мере развития исследований, что приводит к остановке эмбрионального развития и нарушению стволовости линий стволовых клеток путем ингибирования транскрипции рДНК. Точный механизм, посредством которого активация рДНК влияет на плюрипотентность, остается неизвестным. Первая цель данной статьи - описать изменения рДНК в патологическом и физиологическом течении жизни, включая болезни развития, генезис опухолей и дифференцировку стволовых клеток. После этого мы предлагаем три гипотезы относительно регуляции плюрипотентности с помощью рДНК: 1) специализированные рибосомы, синтезируемые из варианта рДНК; 2) нуклеолярный стресс, индуцированный падением транскрипции рДНК; 3) межхромосомные взаимодействия между рДНК и другими генами. Ожидается, что центр регуляции плюрипотентности будет сильно сфокусирован на рДНК. Ингибитор рДНК в виде маленькой молекулы используется для лечения опухолей, вызванных аномальной активацией плюрипотентности. Понимая, как рДНК регулирует плюрипотентность, мы надеемся лечить болезни развития и безопасно применять перепрограммирование соматических клеток в клинических условиях. 
|