Dynamin at the actin-membrane interface Current Opinion in Cell Biol. V. 15. P. 31-39, 2003 | |
|
Многочисленные белки участвуют в связывании плазматической мембраны с цитосклетом, включая еханоэнзимы, такие как семейство миозинов и структурные белки, такие как спектрин, анкирин, талин, α-актинин и др. Эти компоненты упругой сети (meshwork) обеспечивают форму плазматической мембраны и др. органелл. Новое семейство белков, динамины (dynamins), обладающее механохимическими свойствами, используется, чтобы tubulate и вырезать мембраны. Семейство динаминов содержит три конвенциональных члена (Dyn1, -2, -3), обладаеющие 70% гомологией. Они содержат N-терминальный GTPase домен, pleckstrin Homology (PH) домен, который связывает phodphotidylinositol липиды, что делает возможным ассоциацию динамина с мембраной, и С-терминальный proline/arginine-rich domain (PRD), который непосредственно связывается с Src homology 3 (SН3) доменами множественных ассоциированных с актином белков. Эти белки вместе с их партнерами по связыванию, включая белки нуклеации и организации актина N-WASP (neuronal Wiscott-Aldrich syndrome protein) и Arp2/3 (actin-related protein 2/3) комплекса, привлекли интерес как важные игроки в реструктуировании субкортиалькой сети актина. | |
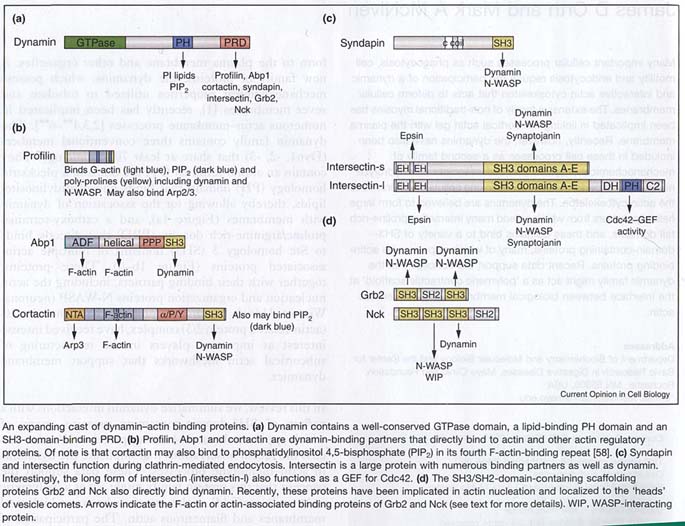
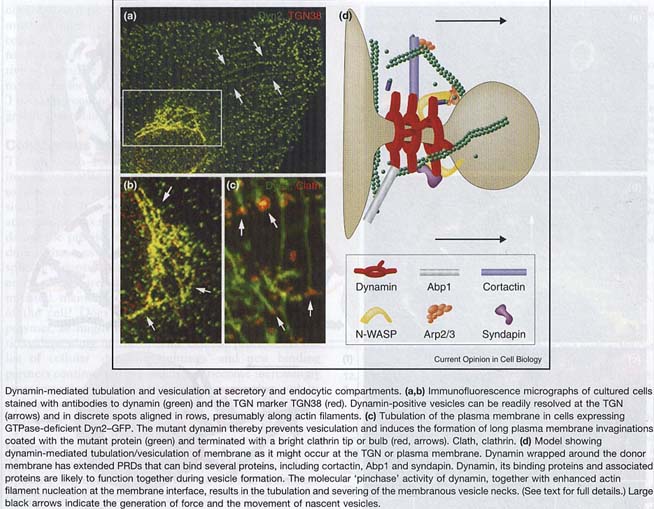 Такое множество целей д. приводить к образованию комплексов, таких динамических, геле-пободных поддержек для дальнейшей деформации бислоя. Тот факт, что GTPase активность динамина м. б. модулирована, а Src-обусловленное фосфорилирование кортактина м. индуцировать изменения в организации актина, делает клетки чуствительной и разностаронней пузырьки продуцирующей машиной.
Такое множество целей д. приводить к образованию комплексов, таких динамических, геле-пободных поддержек для дальнейшей деформации бислоя. Тот факт, что GTPase активность динамина м. б. модулирована, а Src-обусловленное фосфорилирование кортактина м. индуцировать изменения в организации актина, делает клетки чуствительной и разностаронней пузырьки продуцирующей машиной.
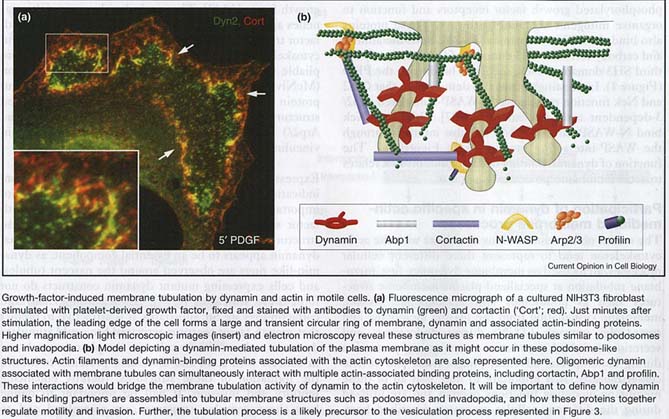
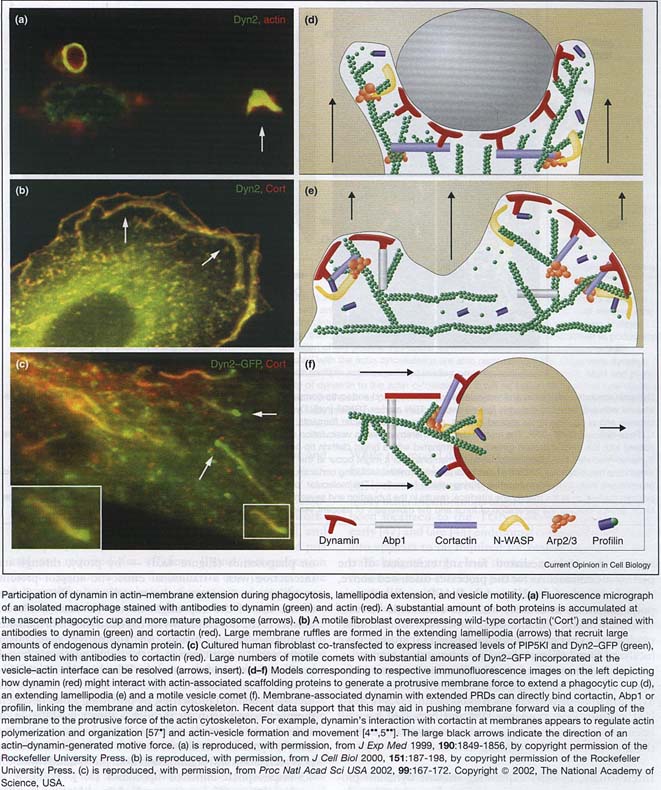 Локализация Dyn2 (Рис. 4а-е) в этих базирующихся на актине структурах демонстрирует, что их функция необходима для их образования и прогресса или обоих. Многие динамин связывающие партнеры, такие как кортактин, Abp1, профилин, синдапин и Nck, локализуются на ведущем крае мигрирующих клеток или в ростовом конусе нейронов.
Локализация Dyn2 (Рис. 4а-е) в этих базирующихся на актине структурах демонстрирует, что их функция необходима для их образования и прогресса или обоих. Многие динамин связывающие партнеры, такие как кортактин, Abp1, профилин, синдапин и Nck, локализуются на ведущем крае мигрирующих клеток или в ростовом конусе нейронов.