FGF2 является важным in vivo регулятором развития и роста скелета. Премежающееся применение FGF2 м. восстанавливать костную массу у крыс после оварийэктомии, модели потери кости в пост-менопаузе. Избыточная экспрессия FGF-2 у трансгенных мышей вызывает преждевременную минерализацию, ахондроплазию и укорочение длинных костей, тогда как разрушение FGF-2 гена ведет к уменьшению костной массы и формирования кости. Более того, активирующие мутации FGF рецепторов ассоциируют с серией краниосиностозных синдромов, характеризующихся ускоренным формированием внутримембранозных костей в швах свода черепа. Т.к. основым путем передачи сигналов от FGF рецепторов является активация ответвления MEK/ERK пути МАРК, то была предпринята серия исследований для проверки, нуждается ли FGF2 индукция гена остеокальцина в активности МАРК и в фосфорилировании Runx 2/Cbfa 1. Сначала было установлено, что FGF2 м. бысто индуцировать фосфорилирование ERK и стимулировать мРНК OCN в клетках МС3Т3-Е1 и в стромальных клетках костного мозга. FGF2 стимулирует также активность трансгенеа в 1.3 т.п.н. OCN промотор-liciferase репортерный ген и эта стимуляция м.б. блокирована с помощью ингибитора MEK/ERK, U0126. Эта стимуляция обнаруживается только в клетках, содержащих дикого типа Runx 2/Cbfa 1 (P/S/T доменовый мутант нечувствителен), и нуждается также в интактном сайте связывания Runx 2/Cbfa 1 в промоторе OCN. Метаболическое мечение показало, что уровень фосфорилирования Runx 2/Cbfa 1 увеличивается при воздействии FGF2 и что эта реакция также предупреждается U0126.
Установлено, что механическая нагрузка играет важную роль в регуляции гомоестаза кости и морфологии скелета во время развития и в постнатальной жизни, когда она увеличивает плотность кости и силу. Напротив отсутствие нагрузки на скелет у людей и крыс, напр. во время космического полета. ассоциирует с потерей кости и снижением механических свойств костей. Путь МАРК является одним из принципиальных сигнал-трансдуцирующих каскадов, ассоциированный механотрансдукцией. Интегрины м. переводить мезанические стимулы в биохимические сигналы. Напр., показано, что механическое натяжение активирует ERK2 и JNK1 , но не р38 в кардиальных фибробластах крыс и что активация нуждается в присутствии двух интегринов α
4β
1 и в не-α
5β
1, интегрине, а также в ВКМ (фибронектине). Сходное приложение механической силы к остеобластам специфически посредством интегринов, содержащих α
2 и β
1, индуцирует активацию МАРК. Два недавних исследования подтвердили важность связи между Runx 2/Cbfa 1 и механиотрансдукцией. В одной работе было показано, что Runx 2/Cbfa 1 м. действовать как мишень для механических сигналов в клетках human peridontal ligament (hPDL)( т.е. в остеобласт-подобных клетках, которые м. диффере6нцироваться в направлении остеобластов в ответ на разнооьобразные внеклеточные стимулы). Низкий уровень постоянных механических нагрузок на hPDL клетки дараматически увеличивает связывание Runx 2/Cbfa 1 с OSE2 ДНК, хотя наблюдалось также легкое увеличение мрНК и белка Runx 2/Cbfa 1. Подобная стимуляция обнаруживается после непродолжительного 30 мин. давления, достигая пика спустя 6 ч и длящаяся, по крайней мере 12 ч. Фосфорилирование ERK1/2 активируется время-зависимым образом в механически растягиваемых hPDL клетках и это хорошо коррелирует с увеличением Runx 2/Cbfa 1 связывающей активности. Более того, индуцируемое растяжением увеличение в Runx 2/Cbfa 1 ДНК связывающей активности полностью устранялось U0126, специфическим ингибитором активации ERK1/2. Особенно интересно то, что активированная растягиванием ERK физически взаимодействует с Runx 2/Cbfa 1 и м. фосфорилировать этот транскрипуионный фактор in vitro. В др. исследовани получены доказательства того .что и активация ERK и фосфорилирование Runx 2/Cbfa 1 нужадются в передаче механических сигналов в стромальных клетках костного мозга мыши и человека. Было показано, что extracorporeal shock wave (ESW) является альтернативным не-инвазивным медодом для стимуляции пролиферации стромальных клеток и дифференцировки остеобластов. Оптимальное воздействие ESW на стромальные клетким костного мозга при 0.16 mJ/nm
2 в 500 импульсов увеличивает включение [
3H]-thymidine в ДНК, активность щелочной фосфатазы, экспрессию гена OCN и образоване костных узелков. Интересно, что ESW драматически стимулиует ERK-зависимое фосфорилирование Runx 2/Cbfa 1, хотя при этом не меняется уровень белка Runx 2/Cbfa 1. Т.о., механические силы м. регулировать пролиферацию и дифференцировку остеобластов, а тажке формирование кости посредством МАРК- зависимого фосфорилирования Runx 2/Cbfa 1.
Итак, остеобластиы д. контактировать с коллаген-содержащим ВКМ, чтобы дифференцироваться. Они связаны с этим матриксом посредством взаимодействий между коллагеном типа I и специфическими β
1 интегринами. Связывание интегринов лигандом активирует МАРК и родственные пути, которые трансдуцируют сигналы в ядро. Runx 2/Cbfa 1 фосфорилируется и активруется с помощью МАРК, это позволяет ему стимулировать дифференцировку остеобластов за счёт повышения транскрипции остеобластных маркерных генов, таких как OCN. Процесс активации до конца непонят, но , по-видимому, он влияет на способность Runx 2/Cbfa 1 взаимодействовать со специфическими сайтами связывания ДНК в генах-мишенях. Кроме того он м. влиять на взаимодействия Runx 2/Cbfa 1 с др. ядерными факторами.
ECM-dependet MAPK Activity is also Necessary for BMP Responsivebess
И остеобласты и сторомльные клетки костного мозга секретируют BMPs. Эти факторы стимвлируют дифференцировку посредством аутокринной петли, которая м. б. блокирована специфическими антогонстами ВМР. Действие BMP на остеобласты также нужадается в матричных сигналах и м.б. блокировано с помощью U0126. В отсутствие синтеза ВКМ BMPs оченть слобо стимулируют экспрессию генов остеобластов, а между BMP и ВКМ сигналами наблдюается строгая синергичность. Это указывает на то. что активация МАРК важна не тольо для чувствиетльности к сигналам ВКМ, но и для стимуляции с помощью этого важного класса факторов дифференцировки.
Conclusion
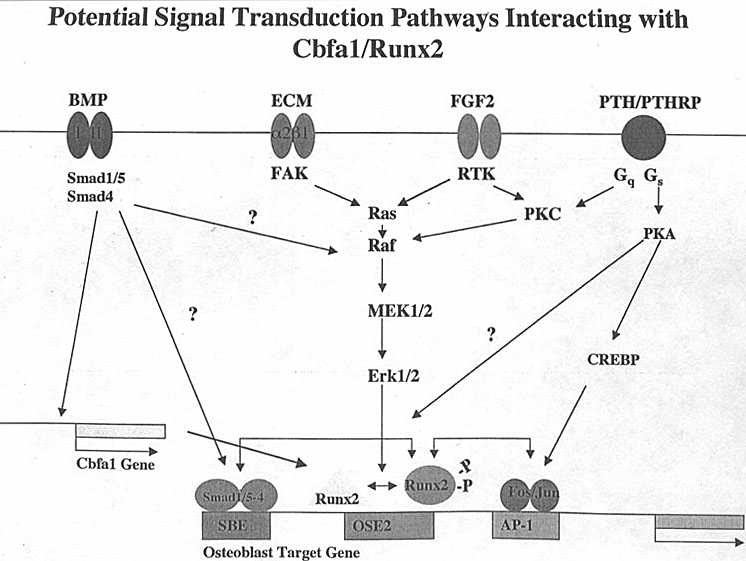
Регуляторные сигналы представлены на Рис. ( т.е. те, что инициируются BMPs, ВКМ, FGF2 и механическими нагрузками. Показана также регуляция с помощью РТН, но это вне рамок статьи. Предполагается, что активация Runx 2/Cbfa 1 посредством фосфорилирования является критическим для этого фактора, чтобы сдалеть его транскрипционно активным. Фосфорилирование м.б. вызвано несколькими способами: 1) ВКМ связывается с интегринами на клеточной поверхности и активирует focal adhesion kinase (FAK) и ветвь MEK/ERK пути МАРК; 2)Активация receptor tyrosine kinase (КЕЛ) в рецепторах FGF2 также активирует MEK/ERK путь; 3) Механические нагрузки активируют путь мАРК; 4) Путь классической protein kinase A (PKA), активируемый с помощью PTH/PTHrP рецепторов также м. стимвлировать фосфорилирование Runx 2/Cbfa 1 в сайтах, отличных от тех, которые используются путём MEK/ERK. Напротив, стимуляция МАРК пути посредством PKC является потенциальным маршрутом для передачи перекрёстных сигналов от PTH/PTHrP рецепторов посредством активирования Gq. Путь РКА также регулируется АР-1 родственными факторами, подобными cFos и cJun путем фосфорилирования cAMP response element binding protein (CREBP). AP-1 факторы регулируют экспрессию генов, связываясь с АР-1 сайтами в генах, связанных с остеобластами, а также взаимодействуя с Runx 2/Cbfa 1. Наконец, путь BMP/Smad контролирует Runx 2/Cbfa 1 экспрессию возможно непосредственно усиливая активность гена Runx 2/Cbfa 1. Кроме того R-Smad-Smad4 гетеродимеры м. прямо взаимодействовать с SBEs в регуляторных областях генов, связанных с остеобластами, а также формировать комплексы с Runx 2.
Fdn/ полагают, ято Runx 2/Cbfa 1 м. рассматриваться как фокальная точка интеграции разнообразных сигналов, затрагивающих активность остеобластов. Эти разнообразные сигналы м. влиять на активность Runx 2/Cbfa 1, изменяя уровни транскрипционного фактора, состояние фосфорилирования или взаимодействия с др. транскрипционными факторами, такими как Smads и АР-1 родственные факторы и Osx.
Сайт создан в системе
uCoz