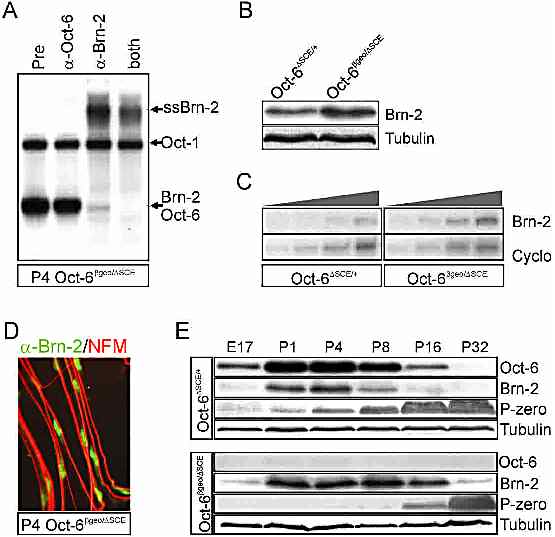
Анализ экспрессии Brn-2 у мутантов Oct-6 и избыточной экспрессии Brn-2 привел к заключению, что количественно боеее высокие уровни белка Brn-2 необходимы для инициации миэлинизации по расписанию. Эти данные вместе с тем фактом, что Brn-2 и Oct-6 имеют очень сходные ДНК-связывающие предпочтения, указывают на то, что различия в биологической функции между Brn-2 и Oct-6 складываются в основном из различий в сродстве с факторами взаимодействия и/или в репертуаре партнеров по взаимодействию.
POU доменовые бклки, как известно, взаимодействуют с членами семейства Sry box (Sox) транскрипционных факторов. Напр., активация энхансера Fgf4 в ES клетках зависит от синергичности взаимодействий между Sox2 и Oct4 белками (Ambrosetti et al.1997). В глиальных клетках было показано, что Sox10 взаимодействует синергично с Oct-6, но не с Brn-1 или Brn-2, чтобы активировать транскрипцию, когда оба белка соединяются с соседними сайтами связывания искусственного энхансера (Kuhlbrodt et al. 1998a). Синергичная активация нуждается в N-терминальной области Oct-6 и Sox10 (Kuhlbrodt et al.1998b). Сходным образом, олигодендроциты, обогащенные Sox11 белком действуют синергично с Brn2 и Brn-1, но не с Oct-6. Все это указывает на то, что существует специфический POU/Sox код и м.б. постулировано, что специфические POU белки необходимы специфическим Sox белкам, чтобы осуществить кооператинвные эффекты (Kuhlbrodt et al.1998a,b). Если в самом деле важные гены-мишени из Oct-6 в глиальных клетках регулируются путем взаимодействия с Sox10, а пара Brn-2/Sox11 эквивалентна Oct-6/Sox10, то онтогенетический дефект в Oct-6-дефицитных Шванновских клетках, но не в олигодендроцитах (Bermingham et al.1996) м.б. объяснен следующим образом: олигодендроциты экспрессируют Brn-2/Sox11 в дополнение к Oct-6/Sox10, тогда как Шванновские клетки экспрессируют Oct-6/Sox10 и Brn-2, но не Sox11.
Полученные данные демонстрируют, что переход promyelin-to-myelinating регулируется с помощью Oct-6/Brn-2 функции, но даже в отсуствие этих POU факторов Шванновские клетки в конечном счете вступают в фазу миэлинизации по мере дифференцировки клеток. Это не связано с накоплением Oct-6 белка, экспрессируемого гипоморфным аллелем Δ;SCE (Fig.2E). Даже когда делеция Brn-2 в клоне Шванновских клеток полная, мозаицизм экспрессии Brn-2 не м.б. объяснен задержкой миэлинизации (Fig.5). Два наблюдения особенно важны для понимания роли Oct-6 и Brn-2 в дифференцировке Шванновских клеток и того, почему даже в их отсутствие миэлинизация происходит. Во-первых, в отсутствие Oct-6, вступление в фазу миэлинизации задержано, а кинетика этого перехода изменена (Fig.6B). В то время как >80% Шванновских клеток дикого типа вступают в фазу миэлинизации на ст. P8, в отстуствие Oct-6 это происходит спустя несколько недель для того же самого количества Шванновских клеток. В отсутствие обоих, и Oct-6 и Brn-2, этот переход задерживается еще больше.
Во-вторых, кинетика этого перехода является зависимой от дозы Oct-6/Brn-2. В терминах регуляции транскрипции это предполагает, что Oct-6 более существенно увеличивает шансы, что его гены-мишени будут активированы. Обнаружение, что отсутствие Oct-6 и Brn-2 эти шансы сводит к нулю, указывает на то, что эти гены-мишени активируются, хотя и с меньшей эффективностью посредством др. транскрипционных факторов, возможно включая и повсеместно распространненный POU фактор Oct-1.